初高中化学衔接知识点及练习
初高化学衔接知识

初高化学衔接知识一、按要求填写下空:1.写出下列酸碱的化学式硝酸硫酸盐酸亚硫酸氢溴酸氢碘酸氢氧化钾氢氧化钠氢氧化钡氢氧化钙氢氧化铁氢氧化亚铁2.书写下列盐的中文名称、化学式、阴、阳离子中文名称例:(CuSO4)硫酸铜Cu2+铜离子SO42-硫酸根离子()氯化钠Na+Cl-()硝酸钾K+ NO3-BaCO3()钡离子CO32-()碳酸氢钠HCO3-NaHSO4()硫酸氢根NaHSO3()亚硫酸氢根3.写出下列阳离子的化学式或名称铵根离子:钙离子:银离子:锌离子:Fe2+:Fe3+:Mg2+:Mn2+:4.写出下列物质的主要成分大理石:苏打、纯碱:小苏打:胆矾:明矾:烧碱:生石灰:熟石灰:二、写出1-36号元素的符合、名称和元素序号写出原子序号为1、6、7、8、9、11、12、26、29、30的相对原子质量三、写出下列化学反应方程式3.1化合反应1.单质或化合物与氧气的反应(1)碳在氧气中充分燃烧:(2)碳在氧气中不充分燃烧:(3)氢气在空气中燃烧:(4)红磷在空气中燃烧:(5)硫粉在空气中燃烧:(6)铁在氧气中燃烧:(7)镁在空气中燃烧:(8)铝在空气中燃烧:(9)铜在空气中加热:2.氧化物与水的反应(1)生石灰与水反应:(2)二氧化碳与水反应:(3)二氧化硫溶于水3.2分解反应1.过氧化氢溶液制氧气:2.加热高锰酸钾:3.加热氯酸钾和二氧化锰:4.水通电分解:5.氧化汞受热分解:6.高温煅烧石灰石(二氧化碳的工业制法):3.3、置换反应1.活泼金属和酸的反应(1)镁和稀盐酸:(2)镁和稀硫酸:(3)铝和稀硫酸:(4)锌和稀硫酸:(5)铁和稀盐酸:2.金属和盐溶液的反应(1)铁和硫酸铜溶液:(2)铜和硝酸银溶液:3.氢气或碳与氧化物的反应(1)氢气还原氧化铜:(2)木炭还原氧化铜:(3)焦炭还原氧化铁:四、复分解反应1.酸+ 碱→盐+ 水(中和反应)(1)稀盐酸和氢氧化钠:(2)稀盐酸和氢氧化钙:(3)氢氧化铝药物治疗胃酸过多:金属氧化物+酸→盐+水(1)氧化铁和稀盐酸:Fe2O3+ 6HCl2FeCl3+ 3H2O (2)氧化铜和稀硫酸:CuO + H2SO4CuSO4+ H2O (3)氧化镁和稀盐酸:MgO + 2HClMgCl2+ H2O 酸+盐→另一种酸+ 另一种盐(1)稀盐酸与大理石:(2)稀盐酸与碳酸钠(纯碱):(3)稀盐酸与碳酸氢钠(小苏打):(4)稀硫酸和碳酸钡:(5)稀盐酸和硝酸银溶液:(6)稀硫酸和氯化钡溶液:4.碱+盐→另一种碱+ 另一种盐(1)氢氧化钠溶液与硫酸铜溶液:(2)氢氧化钠溶液与氯化铁溶液:(3)氢氧化钙溶液与碳酸钠溶液:(4)氢氧化钡溶液与硫酸钠溶液:5.盐+盐→新盐+ 新盐(1)氯化钠溶液和硝酸银溶液:(2)碳酸钠溶液和氯化钡溶液:(4)碳酸钠溶液和硝酸钙溶液:3.5、其他反应1.甲烷燃烧:2.酒精燃烧:3.一氧化碳还原氧化铜:4.一氧化碳还原氧化铁:四、元素常见化合态五、熟背沉淀溶解表。
初升高化学衔接班知识点总结1

初升高化学衔接班知识点总结1
1. 化学基础概念
- 元素:构成物质的基本单位,不可分割
- 化合物:由两种或两种以上的元素通过化学反应形成
- 分子:具有化学性质的最小粒子,由原子通过共价键结合而成
2. 化学式和化合价
- 化学式:用化学元素符号表示化合物的组成
- 化合价:元素在化合物中的化学价值,用于确定化合物中不同元素的相对含量
3. 反应原理
- 反应速率:化学反应发生的快慢程度
- 酸碱中和反应:酸和碱反应生成盐和水
- 氧化还原反应:物质与氧化剂发生电子转移产生氧化和还原的化学反应
4. 反应和方程式
- 化学反应:物质发生变化的过程
- 化学方程式:用化学式表示化学反应的过程
5. 离子和离子化合物
- 离子:带电的原子或原子团
- 离子化合物:由阳离子和阴离子通过电荷平衡结合而成的化合物
6. 酸碱性质和物质
- 酸性物质:能释放出氢离子的物质
- 碱性物质:能释放出羟基离子的物质
以上是初升高化学衔接班的基础知识点总结,希望能帮到你。
如果需要更详细的解释或其他帮助,请告诉我。
2024年初升高化学无忧衔接(通用版)衔接点01物质的分类(解析版)

衔接点01 物质的分类初中要求只是了解物质的简单分类方法高中要求1. 了解分类的方法一树状分类法和交叉分类法;2. 理解氧化物的分类及其各类氧化物的性质、制法;3. 了解正盐、酸式盐、碱式盐的概念和形成原因.• 初高考点对接七初中化学盲点区 高中化学纯净物[-谜-混合物-一溶液_浊液无机物-厂金属单质一单质~\L ■非金属单质1-纯净物-「酸-化欲-碱-盐碱的分类_______■氧化物的分凳L —元酸ng 出一二元酸I 多元酸----、按电菠出电离出 __息。
基氧根高球目 一 一兀例L 多元碱「皿: 按酸碱中和费——稣盐「酸性氧化物A 按氧化物性质——碱性氧化物j 两性氧化物-酸的分类wA 盐的分类 W•••♦,初中知识温故tA-回顾一物质的简单分类1.物质的简单分类表「混合物'金属单质单质,非金属单质、稀有气体物质<纯净物<化合物,厂酸碱无机化合物〈盐氧化物I有机化合物回顾二几组重要概念1.混合物和纯净物混合物纯净物宏观由不同种物质组成由一种物质组成微观由不同种分子构成由同种分子构成性质没有固定的组成,各组分保持各自的化学性质。
没有固定的熔点和沸点具有固定的组成,具有固定的熔点、沸点;具有固定的化学性质例如空气是混合物,由氧气、二氧化碳、氮气等组成,含有N2、。
2、C02、田0等不同种分子水是纯净物,由水(H2。
)分子构成;氧气是纯净物,由氧(。
2)分子构成【易错提醒】(1)不要被“洁净、混合”等字眼迷惑,洁净物不一定是纯净物,例如:洁净的空气、干净的矿泉水就是混合物。
(2)不要被物质的名称迷惑,例如:二氧化碳是物质的名称,“氧”“碳”指组成物质的元素,不是两种物质,二氧化碳是纯净物,不是混合物。
2.单质、化合物和氧化物类别单质化合物氧化物概念由回种元素组成的纯净物由不同种元素组成的纯净物由两种元素组成,且其中一种元素是氧元素的化合物判断方法必须是纯净物;只含一种元素必须是纯净物;含两种或两种以上元素必须是化合物举例氮气(N2)、氢气(田)、氧气(02)、铁(Fe)和碳水(H2。
初升高化学衔接教材高一化学附练习及答案

初高中衔接——化学基本概念和原理【本讲主要内容】化学基本概念和原理【知识掌握】【知识点精析】1. 物质的变化及性质(1)物理变化:没有新物质生成的变化。
①宏观上没有新物质生成,微观上没有新分子生成。
②常指物质状态的变化、形状的改变、位置的移动等。
例如:水的三态变化、汽油挥发、干冰的升华、木材做成桌椅、玻璃碎了等等。
(2)化学变化:有新物质生成的变化,也叫化学反应。
①宏观上有新物质生成,微观上有新分子生成。
②化学变化常常伴随一些反应现象,例如:发光、发热、产生气体、改变颜色、生成沉淀等。
有时可通过反应现象来判断是否发生了化学变化或者产物是什么物质。
(1)混合物和纯净物混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
纯净物:组成中只有一种物质。
①宏观上看有一种成分,微观上看只有一种分子;②纯净物具有固定的组成和特有的化学性质,能用化学式表示;③ 纯净物可以是一种元素组成的(单质),也可以是多种元素组成的(化合物)。
(2)单质和化合物单质:只由一种元素组成的纯净物。
可分为金属单质、非金属单质及稀有气体。
化合物:由两种或两种以上的元素组成的纯净物。
(3)氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
氧化物可分为金属氧化物和非金属氧化物;还可分为酸性氧化物、碱性氧化物和两性氧化物;酸:在溶液中电离出的阳离子全部为氢离子的化合物。
酸可分为强酸和弱酸;一元酸与多元酸;含氧酸与无氧酸等。
碱:在溶液中电离出的阳离子全部是氢氧根离子的化合物。
碱可分为可溶性和难溶性碱。
盐:电离时电离出金属阳离子和酸根阴离子的化合物。
盐可分为正盐、酸式盐和碱式盐。
4. 化学用语⎪⎪⎩⎪⎪⎨⎧反应类型化学方程式化学式元素符号(1)相对原子质量和相对分子质量、分子—原子运动论、核外电子的排布规律(2)元素符号的意义 ① 某一种元素。
② 这种元素的一个原子。
初高中化学衔接知识点

初高中化学衔接知识点初高中化学衔接知识点大全1、我国古代三大化学工艺:造纸,制火药,烧瓷器.2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化.3、构成物质的三种微粒:分子,原子,离子.4、不带电的三种微粒:分子,原子,中子.5、物质组成与构成的三种说法:(1)、二氧化碳是由碳元素和氧元素组成的;(2)、二氧化碳是由二氧化碳分子构成的;(3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的.6、构成原子的三种微粒:质子,中子,电子.7、造成水污染的三种原因:(1)工业“三废”任意排放,(2)生活污水任意排放(3)农药化肥任意施放8、收集气体的三种方法:排水法(不容于水的气体),向上排空气法(密度比空气大的气体),向下排空气法(密度比空气小的气体).9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变.10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低).11、复分解反应能否发生的三个条件:生成水、气体或者沉淀12、三大化学肥料:N、P、K13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物.14、燃烧发白光的物质:镁条,木炭,蜡烛.15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳.16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用).17、CO的三种化学性质:可燃性,还原性,毒性.18、三大矿物燃料:煤,石油,天然气.(全为混合物)19、三种黑色金属:铁,锰,铬.20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁.21、炼铁的三种氧化物:铁矿石,焦炭,石灰石.22、常见的三种强酸:盐酸,硫酸,硝酸.23、浓硫酸的三个特性:吸水性,脱水性,强氧化性.24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠.25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳.26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠.初高中化学衔接知识点考点一.金属活动顺序表口诀(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
初高中化学衔接知识点+配套练习
高一化学初高中知识衔接解析与练习【主要内容】主要通过对物质的组成、分类以及物质之间的关系的总结,对初中所学内容进行整合,又为高中化学的学习打下基础。
使同学们能在直观的层面上较明显的认识物质分类及同类物质间的相似性及其应用。
认识分类这种科学方法对化学研究的作用。
了解物质的组成、结构和性质的关系。
起到初中化学和高中化学衔接的作用。
【知识点精析】化学是研究物质的组成、结构、性质及变化规律的一门自然科学。
在初中我们已经了解了一些物质组成和结构的知识,对元素、分子、原子——等基本概念有了一定的认识。
进入高中的学习我们不仅要能从以前学过的微观、宏观来认识物质,更应该从物质的结构入手以体会结构决定性质。
当然除了了解物质的组成我们还会在今后进一步去学习那些肉眼看不到的微粒是靠什么作用结合在一起的,这些作用会导致物质的性质有什么不同,从而理解物质结构决定性质的道理。
随着人类社会的进步,科学知识的丰富,原来那些只靠经验得到的化学成果已经无法满足人类的需求。
一系列新的问题摆在化学家的面前要求得到圆满的回答。
为什么煤能燃烧而其他的岩石却不能?金属为什么会生锈?为什么柔软的高岭土经过高温的焙烧就变成了晶莹坚固的花瓶?要得到这些问题的谜底,人类就必须对世界上的一切物质进行研究。
可是我们所研究的对象是一个非常庞大的集体,所以为了更好地认识物质,人们常根据物质的组成、状态、性能等对物质进行分类。
“分类”是学习化学非常重要的一个学习方法。
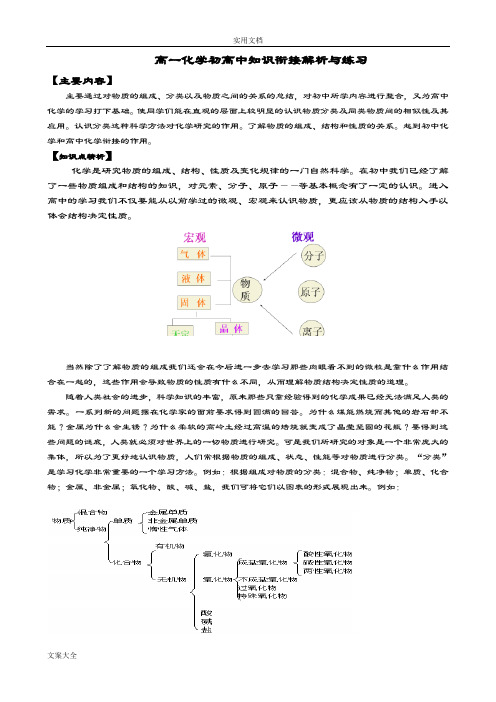
例如:根据组成对物质的分类:混合物、纯净物;单质、化合物;金属、非金属;氧化物、酸、碱、盐,我们可将它们以图表的形式展现出来。
例如:各类物质的概念及代表物在这里要说明的是同一类物质在性质上相似,例如酸性氧化物,它还有一个俗名叫酸酐。
我们中学所学的酸酐中大多数都能溶于水,不溶于水的很少像SiO2。
于是同学们在学习的时候就应该记少的那半儿。
而碱性氧化物中能溶于水的比较少见的有K、Na、Ba、Ca的氧化物。
初高中衔接(高一化学复习初中知识)
非金属单质: 非金属+氧气 ===非金属氧化物 非金属+金属===盐
碱性氧化物: 碱性氧化物+水===碱(碱为可溶性碱) 碱性氧化物+酸性氧化物===盐 碱性氧化物+酸===盐+水
酸性氧化物: 酸性氧化物+水===酸 酸性氧化物+碱性氧化物===盐 酸性氧化物+碱===盐+水
+
+ Na2O ===
+ H2O
(NH4)2SO4 +
===
+
NaCl +
=== NaNO3 +
Zn +
=== Zn(NO3)2 +
NaCl + ===AgCl↓+ .
+ H2O
+ NH3↑ . .
+ CuSO4 ===
+ (NH4)2SO4
预习作业
1、计算(NH4)2SO4、NH4NO3氮元素质量分数。 2、4吨Fe2O3 与多少吨Fe3O4所含铁元素质量相等? 3、硫酸亚铁可用于治疗缺铁性贫血。某贫血患者每天
碱: 使石蕊试液变蓝色,酚酞试液变红色 碱 + 酸性氧化物 === 盐 + 水 碱 + 酸 === 盐 + 水 碱 + 盐 === 新碱 + 新盐
酸: 使石蕊试液变红色,酚酞试液不变色 酸 + 金属 === 盐 + 水 酸 + 碱性氧化物 === 盐 + 水 酸 + 碱 === 盐 + 水 酸 + 盐 === 新酸 + 新盐
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 金属性逐渐减弱
物质溶解性:
钾、钠、铵盐尽皆溶;硝盐遇水影无踪; 氯化物不溶银、亚汞;硫酸不溶钡和铅; 不在上列之正盐,钾、钠、铵溶余沉淀; 溶碱有四位:钾、钠、钙(微溶)钡。
初高中化学衔接复习资料
初高中化学衔接复习资料第一部分 元素及化合物一、水 氢1.水的组成和性质(1)水的物理性质纯净的水是没有颜色、没有气味、没有味道的液体,在101Kpa 时,水的凝固点是0℃,沸点是100℃,4℃时密度最大,为1g/cm 3,水结冰时体积膨胀,所以冰比水轻,能浮在水面上。
(2)水的化学性质①能与可溶性碱性氧化物(Na 2O 、CaO 等)反应生成对应的碱 Na 2O + H 2O ===②能与可溶性酸性氧化物(CO 2、SO 3等)反应生成对应的酸 CO 2 + H 2O ===③能与部分盐反应 CuSO 4 + 5H 2O ===2.氢气的性质、用途和制法 (1)氢气的物理性质和用途在通常情况下,氢气是一种无色、无味的气体,比空气轻,难溶于水,加压降温变成无色液体,再降温变成雪状固体。
氢气能合成氨,能用来制盐酸,可作高能燃料;还可以用来制取单晶硅和制备金属材料。
(2)氢气的化学性质①氢气具有可燃性:纯净的氢气在空气中安静的燃烧,产生淡蓝色的火焰,放出大量的热,用烧杯罩在火焰上方时,在烧杯壁上有水珠生成:H 2+O 2如果氢气不纯,混有空气(或氧气)(且在氢气爆炸极限范围内),点燃时能爆炸。
因此,在使用氢气时,要特别注意安全。
点燃氢气前,一定要检验氢气的纯度。
②氢气具有还原性: H 2+CuO二、碳和碳的化合物1.碳的几种单质以单质形式存在的碳有金刚石、石墨、足球烯和无定形炭(如:活性炭、木炭、焦炭、点燃 △炭黑)。
碳的几种单质在物理性质上有很大的差异,这是因为碳原子排列的方式不同。
注:(1)金刚石和石墨都是由碳元素组成的,像这种由一种元素组成的不同单质互称为同素异形体。
(2)碳和炭的区别:碳是指碳元素、原子;而炭是含有碳元素的天然产物经过碳化而形成的多种碳的单质,如木炭、活性炭等。
2.碳的化学性质常温下,碳的化学性质很稳定,但随着温度的升高,其化学活动性大大增强。
(1)可燃性:充分燃烧:C +O 2 不充分燃烧:C +O 2 (2)还原性:碳和氧化铜:C + CuO碳和二氧化碳:C + CO 2碳和水(水煤气的制取):C + H 2O 3.二氧化碳的性质、制法和用途 (1)物理性质及用途CO 2是无色、密度比空气大的气体,在加压和降温的条件下变成雪状的固体干冰,干冰可以直接变成二氧化碳气体。
初高中化学衔接必备知识(人教版)
初高中化学衔接必备知识整理一.熟记1—20号元素1.默写出1—20号元素2.请画出1-20号元素的原子结构示意图二.常见物质的化学式氧气______ 氮气_______ 氢气 _______ 氨气_______ 氯气______ 二氧化碳_______ 二氧化硫_______ 三氧化硫 _______ 氯化氢_______ 过氧化氢_______ 水_______ 氧化铁_______磁铁矿_______ 氧化亚铁_______ 氧化铜_______ 氧化亚铜_______ 碳酸______ 碳酸钠______ 碳酸氢钠_______ 氢氧化钠_______ 氯化钠_______ 碳酸铵_______ 碳酸氢铵_______ 碳酸钙_________ 碳酸氢钙______ 氧化钙______ 碱式碳酸铜____________盐酸_________氯化钾______ 氢氧化钾________ 氯酸钾_________ 硫酸_______硝酸钡_________ 硝酸铵__________ 硝酸铜_________ 硫酸亚铁_______硝酸银__________ 硫酸铵__________ 硫酸氢铵_________ 硫酸钡__________ 硫酸铝__________ 硫酸铁_________ 硫酸亚铁_________ 磷酸_________磷酸钠_________ 硫磺_______ 氢氧根 _______ 硝酸_________硫酸根 ____ 碳酸根____ 硝酸根____铵根 ___ 碳酸氢根 ______三.常见的俗名纯碱、苏打_______ 小苏打_______ 火碱、烧碱、苛性钠_______生石灰_______ 熟石灰_______ 大理石、石灰石_______赤铁矿_______ 磁铁矿_______ 孔雀石_______四.常见元素的化合价1. 标出下列指定元素的化合价N2、NH3、NH4Cl、NH4+ NO、NO2、N2O4、HNO3;H2S、SO2、SO3、H2SO4、BaSO4;Cl2 、NaCl、HCl、 HClO、 HClO4、 HClO3、 KClO3; CH4、CO、CO2、H2CO3、NaHCO3、CaCO3; KMnO4 K2MnO4 Mg2SiO4 MnO2 FeSO4 Fe2(SO4)3 H2O2 NaAlO2 CuO Cu2O NaH CaH22.在下列化合物中根(原子团)下方划一短线,并标出根的化合价① KOH ②Na2CO3 ③ BaSO4④ NH4Cl ⑤ AgNO3⑥KMnO4 ⑦ NH4NO3⑧Cu2(OH)2CO3⑨ KClO3⑩ KMnO4 五.常见的酸、碱、盐1.常见的酸有:___________________________________2.酸的通性有哪些?A:___________________B:___________________C:___________________D:___________________E:___________________3.常见的碱有:_______________________________________4.碱有哪些通性:A:___________________B:___________________C:___________________D:___________________E:___________________5.常见的盐有(至少写6种)_______________________________________6.盐有哪些化学性质A:___________________B:___________________C:___________________D:___________________六.初中重要化学方程式总结(必记方程式,请注意配平及条件)1.铁在氧气中燃烧___________________________ 反应类型:___________2.硫在空气中燃烧___________________________ 反应类型:___________3.镁在空气中燃烧___________________________ 反应类型:___________4.加热高锰酸钾制氧气___________________________ 反应类型:___________5.过氧化氢分解制氧气___________________________ 反应类型:___________6.氯酸钾分解制氧气___________________________ 反应类型:___________7.木炭和氧化铜反应___________________________ 反应类型:___________8.工业炼铁___________________________ 反应类型:___________9.煅烧石灰石___________________________ 反应类型:___________10.碳高温还原二氧化碳___________________________ 反应类型:___________11.实验室制二氧化碳___________________________ 反应类型:___________12.二氧化碳通入澄清石灰水___________________________ 反应类型:___________13.乙醇的燃烧___________________________ 反应类型:___________14.甲烷的燃烧___________________________ 反应类型:___________15.锌和稀硫酸___________________________ 反应类型:___________16.铁和稀盐酸___________________________ 反应类型:___________17.铁和硫酸铜溶液___________________________ 反应类型:___________18.稀盐酸除铁锈___________________________ 反应类型:___________19.氢氧化钠和盐酸___________________________ 反应类型:___________20.氢氧化钠和硫酸___________________________ 反应类型:___________21.硫酸和氢氧化钙___________________________ 反应类型:___________22.三氧化硫和氢氧化钠溶液___________________________ 反应类型:___________23.二氧化硫与氢氧化钠溶液___________________________ 反应类型:___________24.二氧化碳和氢氧化钠溶液___________________________ 反应类型:___________25.碳酸钠和盐酸___________________________ 反应类型:___________26.碳酸氢钠和盐酸___________________________ 反应类型:___________27.碳酸钠和石灰水___________________________ 反应类型:___________28.硫酸钠和氯化钡溶液___________________________ 反应类型:___________29.氯化镁和氢氧化钠溶液___________________________ 反应类型:___________30.氯化钙和碳酸钠溶液___________________________ 反应类型:___________附化学中的重要口诀:1.盐类物质的溶解性口诀钾钠铵盐皆可溶硝酸盐遇水影无踪氯化物不溶银亚汞硫酸盐不溶钡和铅(钙银微溶)碳酸盐只溶钾钠铵碱溶钾钠钡钙铵(钙微溶)2.元素化合价口诀(1)钾钠氢银正一价,氟氯溴碘负一价,钙镁锌钡正二价,氧是负二价要记清,正三是铝正四硅;下面再把变价归。
初中高一化学衔接知识点
初中高一化学衔接知识点化学是一门研究物质的组成、结构、性质、转化规律以及与能量的关系的科学。
初中化学主要介绍了一些基础的化学概念和实验技巧,为学生打下了化学学习的基础。
而高中化学则进一步深入研究了物质的微观结构和化学反应的规律。
下面我们来具体了解一下初中和高一化学衔接的知识点。
一、物质的组成1. 原子和元素:初中化学主要学习了元素和化合物的概念,以及元素符号和原子质量的表示方法。
高一化学将进一步学习原子结构和元素周期表的相关知识。
2. 分子和化合物:初中学习了分子和化合物的概念,高一化学将学习更多的化学键和化合物的命名规则。
二、物质的性质1. 酸碱中和反应:初中化学学习了一些酸碱性质的基本概念,高一化学会进一步学习酸碱溶液的浓度计算和酸、碱的中和反应。
2. 氧气和氧化还原反应:高一化学会学习氧气的制备、性质以及各种氧化还原反应的特点和规律。
三、化学反应1. 反应类型:初中化学主要学习了酸碱反应、氧化还原反应、置换反应等基本反应类型,高一化学将继续学习这些反应,并深入了解其反应机理。
2. 反应方程式:高一化学会学习更多的化学反应方程式的写法和平衡反应的原理。
四、化学计算1. 相对分子质量和摩尔:高一化学会学习相对分子质量和摩尔的概念,并使用它们进行化学计算。
2. 溶液的浓度计算:高一化学会学习溶液的质量百分比、摩尔浓度和体积浓度的计算方法。
五、化学实验技巧1. 实验仪器和设备:高一化学会进一步学习一些常用的实验仪器和设备,例如容量瓶、量筒等。
2. 实验技巧和安全:高一化学会学习更多的实验技巧和实验室安全知识,掌握正确的实验操作方法和注意事项。
通过初中和高一化学的衔接,学生可以更好地理解和掌握化学的基本概念和原理,为进一步深入学习化学打下坚实的基础。
同时,化学的学习也可以培养学生的观察能力和实验操作技巧,提高他们的科学素养。
希望同学们在学习化学的过程中,能够不断拓展自己的知识边界,培养对化学科学的兴趣和热爱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初高中化学衔接知识点及练习
一.1—20号元素原子结构示意图及其常见化合价
跟踪练习:
1。
写出1—20号元素的原子结构示意图,想想化合价和最外层电子数有什么关系
2。
标出下列指定元素的化合价
N2、NH3、NH4Cl、NO、NO2、N2O4、HNO3;H2S、SO2、SO3、H2SO4、BaSO4;
Cl2、NaCl、HCl、HClO、HClO4、HClO3、KClO3;CH4、CO、CO2、H2CO3、NaHCO3、
CaCO3;
3。
在下列化合物中根(原子团)下方划一短线,并标出根的化合价
① KOH ② Na2CO3 ③ BaSO4 ④ NH4Cl ⑤ AgNO3
⑥ KMnO4 ⑦ NH4NO3 ⑧ Cu2(OH)2CO3 ⑨ KClO3 ⑩ K2MnO4
二.酸碱盐及其相互关系
(1)酸
①定义:
常见的酸有:
②分类:
是否含有氧最多电离出H+的个数
按电离程度按沸点
③性质:
A:酸碱指示剂反应
B:和某些金属反应
C:和某些金属氧化物反应
D:和碱反应
E:和某些盐反应
(2)碱
①定义:
常见的碱有:
②分类:
按溶解性分按电离程度
③性质:
A:酸碱指示剂反应
B: 和某些非金属氧化物反应
C:和某些金属氧化物反应
D:和酸反应
E:和某些盐反应
(3)盐
①定义:
常见的盐有:
②分类
正
盐:
酸式盐:
碱式盐:
复盐:
③性质
A酸碱性
B某些盐和酸反应 C某些盐和碱反应
D盐和盐反应
E特殊盐的不稳定性
(4)氧化物
①定义
②分类
不成盐氧化物:
非金属氧化物:
金属氧化物:
两性氧化物:
复杂氧化物:
跟踪练习、
1.写出下列物质的化学式
碳酸______、碳酸钠______、碱式碳酸铜______________、碳酸氢钠_________、
碳酸钙__________、碳酸氢钙_____________;氯化氢_________、氯气________、
氯化钾___________、二氯化锰___________、氯酸___________、氯酸钾___________、
二氧化氯___________、氧化二氯___________;硝酸___________、硝酸钾___________、硝酸钡___________、硝酸铵___________、硝酸铜___________、硝酸汞___________、
硝酸银___________;硫酸___________、硫酸铵___________、硫酸氢铵___________、
硫酸钡___________、硫酸铝___________、硫酸铁___________、硫酸亚铁___________;磷酸___________、磷酸钠___________、磷酸二氢钠___________、磷酸氢二钠___________、磷酸氢二铵___________、磷酸钙___________、磷酸二氢铵___________;
氮气、硫磺、白磷、金刚石、氦气、二氧化硅、氖气、二氧化氮、氩气、氧化铁、氧化铝;氢氧根离子、硫酸根离子、碳酸根离子、硝酸根离子、铵根离子。
2.写出下列反应的化学方程式
1.三氧化硫和水反应_____________________________
2.氧化钙和水反应_______________________________
3.氧化钠和水反应_______________________________
4.二氧化碳和澄清的石灰水反应_______________________________
5.碳酸钙高温分解_______________________________
6.碳和二氧化碳高温反应_______________________________
7.乙醇在空气中燃烧_______________________________
8.铁和稀硫酸_______________________________
9.氧化铜和碳加热_______________________________
10.氧化铁和CO加热_______________________________
11.四氧化三铁和CO加热_______________________________
12.碱式碳酸铜加热_______________________________
13.氢氧化铁中加入稀硫酸_______________________________
14.氧化铁中加入到稀硝酸中_______________________________
15.铁和硝酸汞溶液反应_______________________________
16.少量的锌加入到FeSO4和稀硫酸的混合液中_______________________________
17.碳酸氢钙溶液中滴加盐酸_______________________________
18.碳酸镁中加入硫酸_______________________________
19.写出有O2生成的三个反应_______________________________
_______________________________、_______________________________
20.写出有水和气体生成的三个反应_______________________________
_______________________________、_______________________________
3。
.写出下列物质在水中的电离方程式
1.碳酸钠2.硫酸
3.硝酸 4.硝酸铜
5.碳酸氢钙 6.硝酸铵
7.硫酸铝 8.高锰酸钾
9.氯酸钾 10.氢氧化钙
11.磷酸钠 12.硝酸钡
13.氯化铁14.氯化铵
三.化学实验
1.启普发生器和氢气的实验室制法
2.Cl_、SO42—检验
Cl_
SO42
3.除杂
原
则:
跟踪练习
1.下列各组物质中,都含有少量的杂质,分别用什么试剂可以将括号内的杂质除去(只要求写所加物质的名称或方法及化学方程式)
(l)CO(CO2) ;
(2)KCl(KClO3) ;
(3)KNO3(KCl) ;
(4)NaCl(Na2CO3) ;
(5)FeSO4(CuSO4) ;
(6)NaOH(Ca(OH)2) ;
(7)Cu(NO3)2(CuSO4) ;
2.只用一种试剂鉴别下列物质,在横线上填所加试剂的化学式或名称
(l)BaCl2、NaCl、K2CO3
(2)NaNO3、MgCl2、(NH4)2SO4
(3)CaCl2、NaNO3、H2SO4
(4)NaCl、H2SO4、Ca(OH)2
3.从玻璃棒、漏斗、100毫升量筒,胶头滴管,试管夹、10毫升量筒,铁架台,药匙等仪器中,选取合适的仪器填入下列横线上:(2%)
(1)取用粉末状药品要用;
(2)量取5毫升液体用;
(3)给试管里的物质加热,必须使用;
4.只有氯化钡溶液和简单的仪器装置,鉴别稀硫酸和碳酸钠溶液(任意编号为甲、乙溶液)。
操作如下:
(1) 分别取少量甲、乙溶液于两支试管中,各滴加氯化钡溶液,两支试管中都产生白色沉淀。
下面还要进行怎样的操作,才能把它们鉴别出来。
将鉴别的步骤、现象及最终结论,填写在相应的横线上。
(2) _______________________________________________________
(3)_______________________________________________________
四:有关溶解度的计算(在物质的量浓度处补讲)。
