植物生理学实验
植物生理学实验

4. 用新的溶液和新鲜的材料重复实验观察几次,直到有确定的结果 为止。在此条件下,细胞的渗透势于上述两个极限溶液浓度之平 均值的渗透势相等的结果记录于下表:
返回
7
蔗糖浓度(1mol/L) 渗透势(MPa)
的渗透势就等于溶液的渗透势。
当用一系列梯度浓度溶液观察细胞质壁分离现象时,细胞的等渗浓度将介 于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离浓度之间的溶液浓 度,将等渗浓度代入公式可以计算出细胞的渗透势。
返回
6
二. 操作步骤
1. 溶液配制:
先配制1mol/L的蔗糖母液,再稀释成0.20、0.25、0.30、0.35、 0.40、0.45、0.50、0.55、0.60 mol/L溶液,备用。
质壁分离的相对浓度 (作图表示)
0.60
0.55
0.50
0.45
0.40
0.35
0.30
0.25
0.20 三. 结果计算
测出引起质壁分离刚开始的蔗糖溶液最低浓度和不能引起质壁分 离的最高浓度平均值(C)后,按实验1中的公式φS =iRCT计算 溶液的渗透势或植物组织的渗透势(或水势)。 四.实验作业 1. 试述细胞渗透作用的原理。
五. 结果结果
1.记录: 蔗糖溶液浓度(mol/L) 小液流移动方向 0.025 0.05 0.10 0.20 0.30
2.计算
根据公式计算溶液的渗透势表示植物组织的水势:
φw=-iRCT
φw--表示植物组织的水势,用Mpa表示
i---为溶液的等渗系数(NaCl等渗系数为1.8)
植物生理学实验测试

植物生理学实验测试植物生理学是研究植物生长和发育等生理过程的科学学科,通过实验测试可以揭示植物对外界环境因素的响应和适应机制。
本文将介绍几种常见的植物生理学实验测试方法,包括植物生长实验、叶绿素测定实验和逆境胁迫实验等。
一、植物生长实验植物生长实验是研究植物对不同环境条件下的生长反应的一种常见方法。
可以通过改变光照、温度、水分等环境因素来观察植物生长的变化。
在实验中,选取相同种子并进行处理,如将一组种子暴露在高温环境下,另一组放置在低温环境中,然后记录植物的生长情况,并进行数据统计和分析。
通过这种实验方法可以了解植物对温度的适应性以及不同温度对植物生长的影响。
二、叶绿素测定实验叶绿素是植物中起着关键作用的色素,其含量可以反映植物光合作用的强弱。
叶绿素测定实验可以通过测量植物叶片中叶绿素的含量来评估光合作用的效率。
实验中,首先需要采集新鲜叶片样品,并将其研磨得到绿色叶汁,然后通过光度计等仪器测定叶绿素的吸光度值,并根据标准曲线计算叶绿素的含量。
通过叶绿素测定实验可以评估植物对不同环境因素(如光照强度、养分浓度)的响应和适应能力。
三、逆境胁迫实验逆境胁迫实验是模拟植物在环境恶劣条件下的生理反应,如盐胁迫、干旱胁迫、冷热胁迫等。
通过逆境胁迫实验,可以研究植物在逆境条件下的生理适应和耐受机制。
实验中,可以使用不同浓度的盐水浇灌植物或让植物在干旱条件下生长,然后观察植物的生长情况、生理指标的变化,并与正常生长的植物进行比较分析。
逆境胁迫实验可以揭示植物对逆境的敏感性和胁迫响应机制,为育种和改良耐逆植物品种提供理论依据。
总结:植物生理学实验测试是研究植物生理过程的重要手段,通过不同的实验方法可以揭示植物对环境因素的响应和适应机制。
植物生长实验、叶绿素测定实验和逆境胁迫实验是常见的植物生理学实验方法,分别用于研究植物生长、光合作用和逆境胁迫的情况。
通过这些实验测试的结果,可以进一步了解植物的适应性和耐受能力,为培育适应不同环境的优良植物品种提供理论基础。
现代植物生理学实验指南

现代植物生理学实验指南植物生理学是一门重要的生物学科,研究植物在生长、发育、代谢和适应环境等方面的生理过程。
为了深入理解植物生理学,我们需要进行各种实验研究,这里为大家提供一份现代植物生理学实验指南,帮助大家系统了解植物生理学实验的基本方法和技巧。
实验一:光合作用实验光合作用是植物体内最重要的生理过程之一,我们可以通过测量植物的氧气释放量和二氧化碳吸收量来评估光合作用效率。
实验步骤如下:1. 将一片绿叶片放入水中,并用环状金属片夹住叶片。
2. 将装有水的容器倒置在金属片上,并使叶片完全浸入水中。
3. 在光亮条件下放置数小时,测量水中溶氧量的变化,记录并计算光合速率。
4. 重复操作若干次,得出稳定的结果。
实验二:水分利用实验水是植物生命的重要组成部分,其缺乏或过多都会对植物生长产生影响。
我们可以通过测量植物根系吸水能力和细胞渗透压来评估植物对水分的利用效率。
实验步骤如下:1. 准备两盆一模一样的植物,其中一盆为对照组,另一盆加盐水。
2. 分别测量两盆植物的根系吸水量和细胞渗透压,记录数据。
3. 将两盆植物进行比较,得出对盐水处理的植物的适应能力。
实验三:激素生理实验植物激素在影响植物生长、发育和适应环境方面发挥了重要作用,我们可以通过测量植物生长的速率和荷尔蒙水平来评估激素的作用。
实验步骤如下:1. 选择一些与生长相关的植物,如小麦或豌豆等。
2. 分别在一组处理中加入不同浓度的激素,另一组作为对照组。
3. 坚持一段时间,测量植物的生长速率和荷尔蒙水平,比较两组的差异。
以上是三个常见的植物生理学实验,希望这份实验指南能对学习植物生理学的同学们有所帮助。
在实验过程中,需要注意实验条件的一致性和数据的准确性,以确保实验的正确性和可靠性。
植物生理学实验报告植物生理学实验基本理论

植物生理学实验报告植物生理学实验基本理论一、植物生理学实验的基本理论1.植物生理学的基本概念:植物生理学是研究植物的生命过程和功能的学科,包括植物的营养、吸收与运输、呼吸、光合作用、生长发育等方面的研究。
2.实验的重要性:实验是科学研究的基础,通过实验可以验证理论,揭示现象背后的机制,推动学科的发展。
3.实验设计的原则:实验设计应具有科学性、可重复性、控制性和操作性。
科学性是指实验要有明确的科学目的和科学问题;可重复性是指实验的方法和结果可以被其他人重复验证;控制性是指实验中要对可能影响结果的因素进行控制;操作性是指实验的方法和步骤应具有可行性和操作性。
二、植物生理学实验的实施步骤1.实验前的准备工作:确定实验的目的和科学问题,收集相关的文献资料,了解实验的背景和已有研究成果。
2.实验器材和试剂准备:选择适当的实验仪器和试剂,确保其质量和可靠性。
3.实验的操作步骤:按照实验设计的方法和步骤进行实验操作,记录下关键的观察和测量数据。
4.实验结果的分析与讨论:将实验数据进行统计和分析,通过统计学方法对结果进行验证,并对实验结果进行解释和讨论。
5.实验结论的总结:根据实验结果和讨论的内容,总结出实验结论,并对下一步的研究方向提出建议。
三、实验示例:光合作用速率与光强的关系实验1.实验目的:探究光合作用速率与光强之间的关系。
2.实验步骤:(1)实验器材准备:太阳光度计、荧光光度计、并联光电度数计、光源、植物叶片。
(2)实验操作:a.在不同的光强条件下,测量光合作用速率和光强的关系。
b.分析测量结果,绘制光合作用速率与光强的曲线图。
c.讨论实验结果,解释光合作用速率与光强之间的关系。
3.实验结果:(1)测量结果表明,光合作用速率与光强之间存在正相关关系。
(2)高光强条件下,光合作用速率较高;低光强条件下,光合作用速率较低。
4.实验结论:光合作用速率与光强呈正相关关系,即光合作用速率随着光强的增加而增加。
通过以上实验示例,我们可以看到植物生理学实验的基本理论和实验设计。
植物生理学实验

3.剪取样品
• 叶柄处理完毕后即可剪取样品,并开始记录时间, 进行光合作用的测定。
• 按编号次序剪下叶片对称的一半,并按顺序夹在 湿润的纱布中,放入培养皿中,用黑色不透光的 塑料袋包好带回室内存于暗处。4h后,再按原 来的顺序依次剪下叶片的另一半,按顺序夹在湿 润的纱布中带回。
4.称干重
• 取6个称量瓶分别标上绿叶光照1、2、3, 绿叶黑暗1、2、3,将各同号叶片照光与暗 中的两半叶叠在一起,用打孔器打取叶圆 片,分别放入相应编号的称量瓶中(光下 和暗中的叶圆片分开)。
1.材料:红色葡萄和青色葡萄; 2.仪器:(1) 721型分光光度计;(2) 打孔器;
(3) 剪子;(4) 10ml刻度试管;(5) 刀片。 3.药品:(1)1%盐酸;(2)5%乙醇溶液。
[方法]
1.样品的提取与测定 2.花青素含量结果计算
1.样品的提取与测定
用直径为0.9cm打孔器(准确测量计算面积), 在葡萄各个不同部位打4圆片,深度以破皮为适, 用刀片取下果肉,否则会延长花青素提取时间。
5.结果计算
光合速率(mgDW·m-2 h-1)= (W2-W1)/(A×t) • W2:照光半叶的叶圆片干重(mg); • W1:暗中半叶的叶圆片干重(mg); • A:叶圆片面积(m2); • t:照光时间(h)。
[实验记录]
1.实验材料: • 植物名称: • 试验处理: • 植物的生长状况: • 取样部位及数量: 2.实验时间: 年 月 日 3.实验数据记录:
取出后待于室温平衡后用来测定外渗电导率。 剩余的15枚绿叶也分为3 组,即3 次重复,
保存在铺有湿纱布的瓷盘中,置于室温下,作 为对照。
4.外渗电导率测定:
(1)样品浸泡:取6个20ml试管,编号。 将处理和对照每个重复的5片叶叠放在一起 用0.5cm直径的洗净打孔器,打取20个小圆 片 (即打4下) ,分别放入不同的试管中。
植物生理学实验
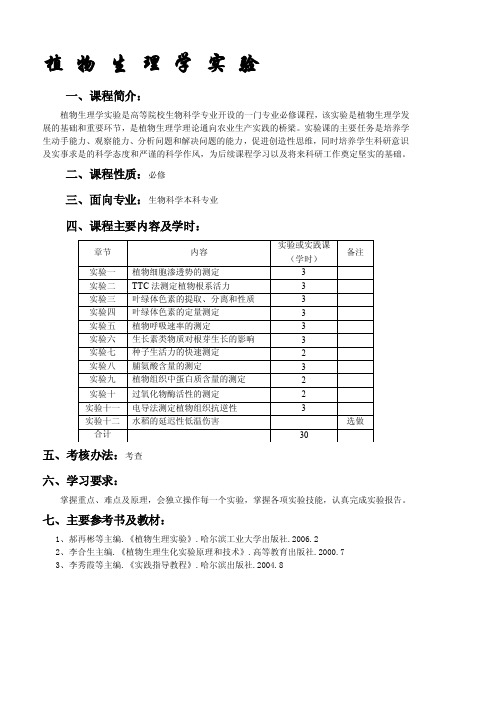
实验一植物细胞渗透势的测定(质壁分离法)一、原理将植物组织放入一系列不同浓度的蔗糖溶液中,经过一段时间后,植物细胞与蔗糖溶液之间将达到平衡状态。
如果在某一溶液中细胞脱水达到平衡时刚好处于临界质壁分离状态,则细胞的压力势ψp将下降为零,此时细胞液的渗透势ψπ等于外液的渗透势ψπ′,即ψπ=ψπ′。
此溶液称为该组织的等渗溶液,其浓度称为该组织的等渗浓度,即可计算出细胞液的渗透势。
实际上临界质壁分离状态镜下很难看到,一般以初始质壁分离作为判断等渗浓度的标准。
(细胞水势=渗+压+衬,其中渗=外渗=-iCRT)(注:内外浓度差不一定质壁分离,因为外高内低才会分离)二、器材、试剂与材料1、器材:显微镜,小培养皿(60mm),载盖玻片,温度计,试剂瓶,吸水纸等。
2、试剂:1mol/L蔗糖溶液,蔗糖系列标准溶液。
3、材料:洋葱。
三、操作步骤1、取干燥、洁净培养皿9套,顺序编号,顺序加入蔗糖系列标准溶液,呈一薄层,盖好皿盖。
(为什么?)2、用镊子撕取材料内表皮(0.5cm见方即可),吸去表面水分,迅速浸入上述培养皿中,每皿4—5片。
3、经20~30min(为什么等这么长时间?因为达渗透平衡)记录室温,同时从高浓度开始依次取出材料放于载片上,滴一滴同浓度的蔗糖溶液,盖上盖片,显微镜下观察。
若所有细胞都发生质壁分离现象,则取相邻低浓度的材料观察,并记录质壁分离的相对程度。
若有50%左右细胞发生初始质壁分离(即原生质体刚从细胞壁的角隅处分离),则该浓度就是等渗浓度。
若两个相邻浓度的材料中,一个未发生质壁分离,另一个发生质壁分离数超过50%,则两浓度平均值即为等渗浓度。
4、由所得的等渗浓度和室温计算细胞液的渗透势:ψπ=ψπ′=-iCRT(MPa),其中:ψπ——细胞的渗透势,MPa;ψπ′——供试溶液的渗透势,MPa;C——供试溶液的浓度,moL/L;R——气体常数,0.008314·L·MPa/(moL·K);T——绝对温度,(273十t℃)K;i——等渗系数,蔗糖为1。
本科课件-植物生理学实验(完整)
放蓝色液流时,不可震动小瓶。
12
根系活力的测定(TTC法)
植物生理生化教研室 曾汉来 2012.03.12
一、实验目的 • 理解植物根系活力的内涵 • 掌握TTC法测根系活力的原理与方法
提供合成所需能量; 合成氨基酸和植物激素 (ABA、CTK、GA等)
H2O 无机盐
硫酸,其他 操作相同。
加入1mol/L硫酸2ml
取出根吸 干水分
与3~4ml乙酸乙酯在研钵 内磨碎
查标准曲线, TTC还原量(mg)
空白试验作参比测 红色提取液移入试管且 485nm下吸光度 用乙酸乙酯定容到10ml
五、实验结果
TTC还原能力 (mg/g(根鲜重)/h)
=
四氮唑还原量(mg) [根重(g)×时间(h)]
(5)手持测糖仪4 分别测定蔗糖原液浓度(C )
四、结果计算 自由水的含量(%)=
植物组织中束缚水的含量(%) = 组织总含水量 - 组织中自由水含量
5
注意事项: 1. 清洗植物组织后应注意用
吸水纸擦干其表面的游离水分。 2. 植物组织与外部溶液之间
达到充分平衡。
6
实验01-2 植物组织水势的测定 (小液流法)
根的生长情况和活力水平直接影响地上部的生长 测定根系活力,为植物生长状况、营养供应研究提供依据。
二、验原理
氯化三苯基四氮唑(TTC)的标准氧化电位为80mV的氧化还 原物质,获得H的能力强。溶于水为无色溶液,还原后即生成 红色而不溶于水的三苯基甲腙 (TTF)。
—
生成的TTF比较稳定,不会被空气中的氧自动氧化,可用 分光光度法定量测定。
实验01-1 植物组织中自由水和束缚水 含量的测定
植物生理学实验指导张志良
植物生理学实验指导引言植物生理学是研究植物内部生物化学和物理活动的科学。
通过实验的方法研究植物的生理过程和生理功能,能够帮助我们更好地了解植物的生长发育、代谢、适应环境等方面的机制。
本实验指导将介绍几个常见的植物生理学实验,并详细说明实验的步骤和注意事项。
实验一:光合作用的测定实验目的通过测定植物光合作用的速率,了解光合作用的基本原理和影响因素。
实验材料和设备•高度光合作用活跃的绿叶片•蒸馏水•滤纸•光合色素提取液•盐酸•詹氏液•光合作用速率测定仪实验步骤1.准备一片新鲜的绿叶片,并使用滤纸将其表面的水分吸干。
2.将绿叶片放入提取瓶中,加入适量的蒸馏水,盖好瓶盖,放置在强光下静置30分钟。
3.将提取瓶中的绿叶片取出,并将其压碎,制成绿叶片提取液。
4.在一次容器中加入10ml绿叶片提取液,同时加入1ml盐酸,用詹氏液调节为酸性条件。
5.将调节好酸性的绿叶片提取液瞬时注入光合作用速率测定仪中。
6.根据测定仪的说明书进行操作,记录每个时间点下的光合作用速率值。
注意事项•实验中所使用的绿叶片应当是光合作用活跃的绿叶片,新鲜度较高。
•测定的过程中应注意光照的稳定性,以免影响光合作用速率的准确性。
•实验过程中应注意安全操作,避免盐酸和其他化学试剂的直接接触。
实验二:渗透压的测定实验目的通过测定植物细胞内外溶液的渗透压差,了解渗透压的基本原理和影响因素。
实验材料和设备•草莓或马铃薯等含有较多汁液的植物组织•单质水•盐水•倒置显微镜•毛细管实验步骤1.取一片新鲜的含有较多汁液的植物组织,如草莓或马铃薯。
2.用刀将该组织剪碎,并将碎片放入一个玻璃杯中。
3.加入适量的单质水,使植物组织完全浸泡其中,静置12小时。
4.取一根毛细管,在一端封闭后,用吸管吸取约5cm 长的盐水,并保持液柱不断。
5.将封闭端的毛细管插入玻璃杯中,并用胶带固定在较深的位置。
6.进行倒置显微镜观察,记录质点的运动情况。
7.根据质点的运动情况,判断渗透压差的大小。
植物生理学 实验
[实验目的]:观察植物组织在不同浓度溶液中细胞质壁分离的产生过程及其用于测定植物组织渗透势的方法。
[实验原理]:当植物组织细胞内的汁液与其周围某种溶液处于渗透平衡状态,植物细胞内的压力势为零时,细胞汁液的渗透势就等于该溶液的渗透势,这种渗透势相等的溶液称为等渗溶液。
该溶液的浓度称为等渗浓度。
当用一系列梯度浓度溶液观察细胞质壁分离时,细胞的等渗浓度将界于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离的浓度之间的溶液浓度。
代入公式即可计算出其渗透势。
[器材与试剂]:实验仪器:显微镜,载玻片及盖玻片,镊子,刀片;实验试剂:100ml 浓度为1mol/L 蔗糖溶液:用蒸馏水配成0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50mol/L 的蔗糖溶液各50mL ;实验材料:洋葱鳞茎[实验步骤]:1.取带有色素的洋葱鳞茎,迅速投入各种浓度的蔗糖溶液中,使其完全浸入,约5—10min 。
2.从0.50mol/L 开始依次取出表皮薄片放在滴有同样溶液的载玻片上,盖上盖玻片,于低倍显微镜下观察,并记录质壁分离的相对程度。
3.在实验中确定一个引起半数以上细胞原生质刚刚从细胞壁的角隅上分离的浓度,和不引起质壁分离的最高浓度。
4.在找到上述浓度极限时,用新的溶液和新鲜的叶片重复进行几次,直到有把握确定为止。
在此条件下,细胞的渗透势与两个极限溶液浓度之平均值的渗透势相等。
将结果记录于表中。
测出引起质壁分离刚开始的蔗糖溶液最低浓度和不能引起质壁分离的最高浓度平均值之后,可按下列各式计算在常压下该组织细胞质液的渗透势。
-Φs=RTiC1式中:-Φs 为细胞渗透势;R 为气体常数=0.083×105L ·Pa/mol ·K ;T 为热力学温度,单位K ;i 为解离常数,蔗糖为1;C 1为等渗溶液的质量摩尔浓度,单位是mol/kg ;则-Φs==0.083×105×(273+t)×1×C由于实验用的蔗糖溶液浓度单位为mol/L ,因此需要按下式对其浓度进行修正。
植物生理学实验
植物生理学实验实验一植物组织中可溶性糖与淀粉的测定植物体内的碳素营养状况以及农产品的品质性状,常以可溶性糖和淀粉的含量作为重要指标,本实验学习几种定量测定可溶性糖和淀粉的方法。
一、苯酚法测定可溶性糖【原理】植物体内的可溶性糖主要是指能溶于水及乙醇的单糖和寡聚糖。
苯酚法测定可溶性糖的原理是:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10~100Mg范围内其颜色深浅与糖的含量成正比,且在485nM波长下有最大吸收峰,故可用比色法在此波长下测定。
苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,灵敏度高,实验时基本不受蛋白质存在的影响,并且产生的颜色稳定时间在160Min以上。
【仪器与用具】分光光度计;电炉;铝锅;20Ml刻度试管;刻度吸管5Ml 1支,1Ml 2支;记号笔;吸水纸适量。
【试剂】90%苯酚溶液:称取90g苯酚(AR),加蒸馏水10Ml溶解,在室温下可保存数月;9%苯酚溶液:取3Ml 90%苯酚溶液,加蒸馏水至30Ml,现配现用;浓硫酸(比重1 84);1%蔗糖标准液:将分析纯蔗糖在80℃下烘至恒重,精确称取1 000g。
加少量水溶解,移入100Ml容量瓶中,加入0 5Ml浓硫酸,用蒸馏水定容至刻度;100μg/L蔗糖标准液:精确吸取1%蔗糖标准液1Ml加入100Ml容量瓶中,加水定容。
【方法】1.标准曲线的制作取20Ml刻度试管11支,从0~10分别编号,按表1-1加入溶液和水,然后按顺序向试管内加入1Ml 9%苯酚溶液,摇匀,再从管液正面以5~20s时间加入5Ml浓硫酸,摇匀。
比色液总体积为8Ml,在恒温下放置30Min,显色。
然后以空白为对照,在485nM 波长下比色测定,以糖含量为横坐标,光密度为纵坐标,绘制标准曲线,求出标准直线方程。
表1-1各试管加入溶液和水的量管号01~23~45~67~89~10100ug/L蔗糖液(ml)00.20.40.60.81.0水(ml)2.01.81.61.41.21.0蔗糖量(μg)0204060801002 可溶性糖的提取取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0 10~0 30g,共3份,分别放入3支刻度试管中,加入5~10Ml蒸馏水,塑料薄膜封口,于沸水中提取30Min(提取2次),提取液过滤入25Ml容量瓶中,反复冲洗试管及残渣,定容至刻度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、实验步骤
1. 取具玻璃塞和橡皮塞的500mL广口瓶各1只,分别编号 1#、2#;
种子
1#
2#
•实验装置图
2. 分别称取10g煮死种子和浸种活种子, 以纱布包裹,悬挂在橡皮塞下方; 3. 向两瓶内各加入Ba(OH)2溶液20mL,立 即封口,室温放置。
种子
1#
2#
•实验装置图
4.
不时轻摇两瓶,1h后,拔 除瓶塞,各加酚酞指示剂 2滴,立即以塑料袋(保 鲜膜)分别封口;
+ 0.5 % TTC →30℃,60 min → 检查
100半粒,煮沸5 min 注意:胚为红色的为具活力种子。 4、作业:计数活种子数,计算活种子的百分率。
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
[实验步骤]
二、红墨水染色法 1、原理 生活细胞的原生质膜对物质吸收有选择性,而死细胞的无此功能,红墨水颗粒可以进入。 2、材料:玉米、小麦(吸胀种子) 3、方法 种子100粒,沿中心线纵切为二,做如下处理: 100半粒
2、测定呼吸速率的常用方法
红外线CO2气体分析仪(IRGA) CO2可以吸收特定波段的红外辐射。当被检 CO2气体通过IRGA的气室时,可使红外辐射减少或 增加,且变化幅度取决于CO2的浓度。这种变化可 被IRGA的检测器所检定,且以电讯号的形式输出, 由记录仪所记录。
•氧电极法
3、小篮子法
4、叶绿素提取液荧光现象观察
取试管3:
从与入射光垂直的方向观 察;
再在透射光方向观察叶绿 体色素溶液的颜色; 记录叶绿素体色素溶液颜 色有何不同 ,分析原因。
5、铜代叶绿素反应
向试管4中逐滴加入浓盐酸,并不断摇匀,至颜色变化, 观察并记录现象;
向变色后的叶绿素溶液中加入少量醋酸铜,并在酒精灯上 缓缓加热,观察并记录颜色的变化。 分析原因。
均不溶于水,而溶于有机溶剂,故可用乙醇、 丙酮等有机溶剂提取。
极性大小: 叶绿素b>叶绿素a>叶黄素>胡萝卜素
根据相似相溶原理,在有机溶液中的溶解度:
叶绿素b<叶绿素a <叶黄素<胡萝卜素
叶绿素的卟啉环
叶绿素分子头部的金属卟啉环中心均为Mg2+。 在弱酸作用下,叶绿素分子中的镁可被H + 取 代而形成褐色的去镁叶绿素,后者遇铜则可形 成绿色的铜代叶绿素。 铜代叶绿素很稳定,在光下不易被破坏,故常 用此法制做植物的原色标本。
[实验目的]
了解种子活力测定生产意义 掌握重要种子活力测定方法和评价标准 理解TTC/染料法测定种子活力的原理
[实验原理]
TTC法
当TTC溶液渗入种胚的活细胞内,并作为氢受体被脱氢辅酶(NADH或NADPH)还原 时,可产生红色的三苯甲腙(TTF),胚染成红色; 如果种胚死亡则不能染色,种胚生 命力衰退或部分丧失生活力则染色较浅或局部被染色。
染料染色法
有生命力种子胚细胞的原生质膜具有半透性,有选择吸收外界物质的能力,一般染料不 能进入细胞内,胚部不染色;而丧失生命力的种子,其胚部细胞原生质膜丧失了选择吸 收能力,染料可以自由进入细胞内,使胚部染色。
实验一 植物种子生活力的快速测定 (TTC法、染料染色法) [实验材料及药品]
BaCO3 +H2O BaC2O4 +2H2O
以酚酞指示滴定终点。
1mL的1/44mol/L草酸溶液中的草酸与1mg的CO2等摩 尔数。
空白和样品二者消耗的草酸溶液的mL数差值 = Ba(OH)2溶液吸收的CO2 mg数 = 种子呼吸作用释放的CO mg数
三、实验材料与试剂
•材料 小麦种子(浸种)和煮死的种子的小麦或 绿豆种子; •试剂 0.05mol/L的Ba(OH)2; 1/44mol/L的草酸; 酚酞指示剂。
(6)浸种催芽法
先将100粒种子用水浸约两小时吸胀,放于湿润草纸上,盖以湿润草纸,置 于氧气充足,室温10-20℃环境中,让种子充分发芽;再以发芽的种子粒数除 以100,乘以100%,求得发芽率。
这种测定方法虽然准确,但需要8天时间。
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
实验二 植物呼吸速率的测定——小篮子法
一、实验目的与要求
掌握小篮子法测定植物种子呼吸速率的原 理与步骤;
比较活种子与死种子的呼吸速率。
二、实验原理
1、植物的呼吸作用 定义:是植物体吸收氧气,将有机物
转化成二氧化碳和水并释放能量的过 程。
葡萄糖+6O2 6CO2 +6H2O+能量 意义: 代谢的中心 有机物转化的枢纽 能量的主要供应渠道
(三)叶绿素的光学性质
叶绿素与类胡萝卜素都具有光学活性,表现出一定 的吸收光谱,可用分光光度计精确测定。
叶绿素的荧光现象
叶绿素溶液在透射光下呈绿色,而反射光下呈红色的现 象。
三、实验材料与试剂
实验材料:
绿色植物叶片 UV-1700分光光度计;天平;剪刀;打孔器 ;研钵;移液管;漏斗;量筒;培养皿;滤 纸;95%乙醇;石英砂;CaCO3;醋酸铜
根系POD活性的测定)------------------------------------12学时
实验五 改良半叶法测定植物光合速率(选做)--------4学时
实验六 谷类种子萌发时淀粉酶活性的测定(选做) --4学时
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
种子生活力:是指种子能够萌发的潜在能力或种胚具有的 生命力。没有生活力的种子是死亡的种子,不能萌发。 种子寿命:种子从发育成熟到丧失生活力所经历的时间。 种子寿命既与植物种类有关,也与贮藏条件(种子含水量、 贮藏温度)有关。
密闭容器中加入一定 量碱液[一般用Ba(OH)2], 并悬挂植物材料,则植 物材料呼吸放出的 CO2 可为容器中Ba(OH)2所吸 收,然后用草酸滴定剩 余的Ba(OH)2,从空白和 样品二者消耗的草酸溶 液之差,可计算出呼吸 释放的CO2量
具体反应式:
Ba(OH)2+CO2 Ba(OH)2+H2C2O4
+5%红墨水→室温, 60 min→检查
100半粒煮沸5 min 注意:胚部着色(红色)很浅或不着色者为生活种子,胚与胚乳着色程度相当者为死种子。 4、作业:计数活种子数,计算活种子的百分率。
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
6 、叶绿素定量测定
稀释叶绿素
取5号试管醇提取液5ml转入50ml容量瓶中(或更大, 视浓度而定),再加入乙醇定容至50ml。
测量光吸收
利用722分光光度计或UV1700分光光度计,分别测定 叶绿素提取液在645nm和663nm下的吸光度。
实验原理
叶绿素提取液中同时含有叶绿素a和叶绿素b, 二者的吸收光谱虽有不同,但又存在着明显的 重叠,在不分离叶绿素a和叶绿素b的情况下同 时测定叶绿素a和叶绿素b的浓度,可分别测定 在663nm和645nm(分别是叶绿素a和叶绿素b 在红光区的吸收峰)的光吸收,然后根据 Lambert-Beer 定律,计算出提取液中叶绿素 a 和叶绿素b的浓度。 A663=82.04Ca+9.27Cb (1) A645=16.75Ca+45.60Cb (2)
一、植物生理学实验的基本要求
重视培养学生的实际操作技能,不片面追求实验数据的准 确性,培养学生实事求是的科学态度。对一些不能开设的 实验,通过演示实验的方式,拓宽学生视野,完善实验内 容。
学生都应参加实验实习环节,选作部分实验,了解植物生 理的主要测试技术,在教师的指导下,独立或团队操作, 完成实验内容并用所学的知识,综合分析,写出实验报告, 解释有关现象并讨论实验结果。实验课程单独考核,单独 记成绩。
植物生理学实验
西南科技大学生命科与工程学院
一、植物生理学实验的基本要求
植物生理是实践性很强的学科,学生必需通过实验、 实习才能加深对理论课的理解,并为后续专业课的学 习打好基础,同时,通过实验、实践可以提高学员观 察问题和解决问题的能力,提高学员的动手能力及独 立思考、分析问题的能力; 在实验课中要通过实例论述论证,让学生认识到实验 的重要性,培养学生对实验课的兴趣;系统介绍植物 生理的一般研究方法和基本技术;
[实验要点]
1、种子要先软化; 2、种子要沿种胚纵切为两半; 3、显色时要使漂浮的种子全部浸入试剂中; 4、TTC见光易分解,需在暗条件下保温染色; 5、结果观察主要是看胚部的颜色变化。
实验一 植物种子生活力的快速测定 (TTC法、染料染色法) [实验结果分析]
比较两种种子活力的高低 比较分析两种方法测定结果的差异 植物种子活力测定的其它方法
正常性种子:水稻、玉米、小麦等种子(1-3年)
短寿命: 柳树种子(12h)
长寿命: 莲子(400年) 贮存条件:低温、低湿,保存时间长
实验一 植物种子生活力的快速测定 (TTC法、染料染色法)
[种子生活力检测评估方法]
(1) 还原力:呼吸→NADH → 还原TTC,胚呈红色。 (2) 原生质着色:活种子不易着色,原生质膜具有选择透性。 (3) 呼吸释放CO2,pH下降,酸碱指示剂显色。 (4) 细胞中的荧光物质:紫外照射发蓝、蓝紫色荧光。 (5) 外观目测法:用肉眼观察玉米种胚形状和色泽。凡种胚凸出或皱缩、 显黑暗无光泽的,则种子新鲜,生活力强,可作生产用种。
