18.杂环化合物解析
【有机化学】杂环化合物【课件PPT】

NN
O + Br2 0 OC
O Br 80%
S
95% H2SO4
25oC
S
SO3H (69~76%)
21
+ Ac2O
N
乙酸酐
H
N H
CH3 O
吡咯和呋喃遇强酸时, 杂原子能质子化, 使芳香大 键破坏, 所以不能用强酸进行硝化和磺化反应, 需选用较温和的非质子性试剂。例如吡咯硝化需 用硝酸乙酰基酯。
1N 6 5
7
N
2
N
3
4
NH9
8
嘌呤
嘌呤是由咪唑和 嘧啶两个杂环稠 合而成。
23
6
1N 5
7
N
2
8
N
3
4
NH9
9H-嘌呤
N Quinoline
6
1N 5
7
NH
2 N4 N 8
39
7H-嘌呤
N Isoquinoline
CH3O
CH3O
N
罂粟碱
OCH3
OCH3
24
水溶度: ∞ 1:1
1:1
微溶
答: 吡啶能与水形成氢键。羟基或氨基取代的 吡啶因分子间氢键的形成而降低了水溶度。
14
2. 碱性:吡啶环 N 原子的孤电子对处于sp2杂化 轨道上,而一般脂肪胺N上的孤电子对处于sp3杂化 轨道。前者碱性较弱 (pKb=8.8) 。
+ HCl N
+ Cl N H
碱性比较:脂肪胺 >>
N N Pyridazine
哒嗪
N
N Pyrimidine
嘧啶
N
N Pyrazine
有机化学基础知识点整理杂环化合物的性质与应用

有机化学基础知识点整理杂环化合物的性质与应用杂环化合物是有机化学中一类具有杂原子(通常是氮、氧、硫等非碳原子)构成的环状分子。
它们具有多种独特的性质和广泛的应用。
本文将整理一些重要的有机化学基础知识点,涵盖杂环化合物的性质和应用。
一、杂环化合物的命名和结构杂环化合物的命名使用通常的有机化学命名法,如官能团命名法、光谱法等。
其结构通常由杂原子和碳原子组成,可以包含一个或多个杂环。
其中,氮杂环化合物如吡嗪、噻吩和咪唑等具有广泛的结构多样性和化学活性。
二、杂环化合物的性质1. 杂环化合物的稳定性:杂环化合物中的杂原子可以增加分子的稳定性,一些杂环化合物比它们的同系物更稳定。
例如,咪唑酮比噻唑酮更稳定,这是由于含氮原子的电子亲和力高于含硫原子的电子亲和力。
2. 杂环化合物的化学反应:杂环化合物中的杂原子可以参与许多重要的化学反应,如亲电取代、亲核取代、氧化还原等。
以氮杂环化合物为例,它们可以发生亲电取代反应,如芳香性亲电取代、加成反应等。
3. 杂环化合物的光学性质:杂环化合物中存在的共轭体系可以产生有趣的光学性质,如荧光、蓝光发射等。
研究人员利用这些性质开发出许多发光材料,应用于有机光电子器件、荧光探针等领域。
三、杂环化合物的应用1. 杂环化合物在药物领域的应用:许多杂环化合物具有药理活性,并被用作药物的活性成分。
例如,噻唑类和咪唑类化合物具有抗菌和抗肿瘤活性,吡唑类和吡唑酮类化合物被广泛应用于抗癌药物研究。
2. 杂环化合物在染料领域的应用:杂环化合物可以用作染料分子的基础结构,赋予染料分子良好的色谱性能和稳定性。
它们在纺织、油墨和染料敏化太阳能电池等领域有广泛应用。
3. 杂环化合物在有机电子器件中的应用:杂环化合物具有优异的载流子传输性能和独特的光学性质,因此被广泛应用于有机发光二极管(OLED)、有机太阳能电池和有机场效应晶体管等器件中。
四、结语本文对有机化学基础知识中的杂环化合物的性质和应用进行了整理和阐述。
第十八章杂环化合物

5 6
4
3 CH3
7 8
H3C
N2
1
N HO
3,8-二甲基喹啉 8-羟基喹啉
如果环内含有不止一种杂原子时,编号的 先后顺序是 O、S、N、C。4-甲基-5-(-羟乙基)噻唑
第二节 五元杂环化合物
代表化合物:呋喃、噻吩、吡咯。
呋喃(furan) 吡咯(pyrrol)
苯噻吩吡咯呋喃
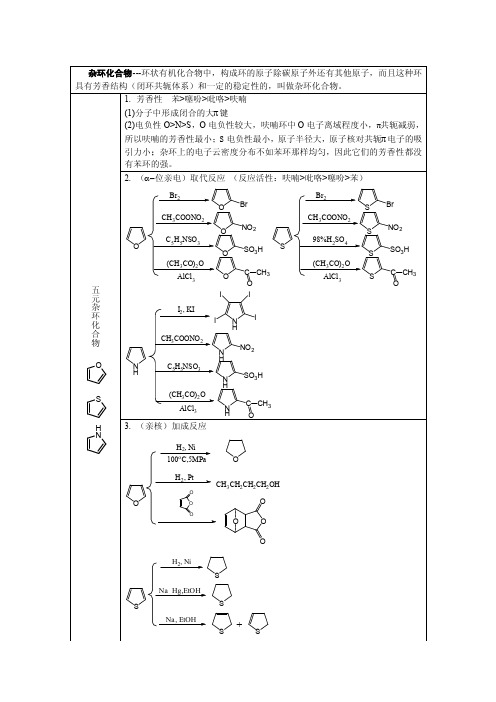
亲电取代反应(α-位取代): 硝化、磺化、卤化、F-C酰基化、F-C烷基化 活性次序:吡咯>呋喃>噻吩>苯
(1)溴代反应:
(2)硝化反应
(3)磺化反应
噻吩因很容易磺化而溶于 H2SO4,比苯 容易磺化,利用这一性质可以除去苯或 汽油中的噻吩.
(4)酰化反应
2、加成反应
3 吡咯的弱碱性和弱酸性(酸性较醇强较 酚弱)
吡啶能发生亲核取代反应,且主要发 生在 2-位。
+ NaNH2 N
N(CH3)2
NH2 N
2-氨基吡啶
4. 吡啶对氧化剂的稳定性 酸性氧化剂中比苯环稳定:
过氧化物氧化:
5. 还原反应 吡啶环对还原剂比苯环活泼:
嘧啶及其衍生物
嘧啶
有三种嘧啶的衍生物存在于核酸的碱基中, 它们是胞嘧啶、胸腺嘧啶、脲嘧啶
光谱数据
呋喃:δ:α-H 7.42 吡咯:δ:α-H 6.68 噻吩:δ:α-H 7.68 偶极矩:呋喃0.70D
噻吩0.51D 吡咯1.81D
β-H 6.37 β-H 6.22 β-H 7.10
三、五元杂环化合物的化学性质
能发生 SE 反应,且反应主要发生在-位。 其反应活性顺序:
吡咯呋喃噻吩苯 化合物的稳定性顺序:
噻吩(thiophene)
杂环化合物总结
NO2
N
SO3H Br
Br2 H2SO4
+
N
N
Br
KNH2 NH3a, EtOH
N
H
S
S
Na, EtOH
+
S
S
Zn, HAc
N
H2, Ni
H
4. 吡咯的酸碱性
+
N
N
H2, Ni 200oC
N
H
H
H
RMgX
CH3I
N
RH
N
MgXI
N
H
MgX
CH3
KOH,
(1)CO2
(2)H2O
N COOH
N
CO2
K
H O
N H
C OK H3O
N COOH H
C6H5COCl
N O C C6H5
5. 鉴别 呋喃蒸汽遇到被盐酸浸湿过的松木片时,即呈现绿色
噻吩在浓硫酸的存在下,与靛红一同加热显示蓝色
吡咯的蒸汽或其醇溶液,能使进过浓盐酸的松木片变成红色
1. 碱性 (CH3)3N>吡啶>苯胺>吡咯
CH3
+ CH3I
N
280 290oC
+
NI CH3
N CH3 HI
N HI
2. 对氧化作用稳定,氧化侧链
CH2CH3 O
COOH
六
N
N
元 杂
3. 亲电取代,在位,不发生酰基化,烷基化反应
环
Br
化
Br2
合 物
N
N SO3H
H2SO4
N
N
NO2
H2SO4 HNO3 N
有机化学 第18章 杂环化合物

有机化学Organic Chemistry 第18章杂环化合物(3’)教材:李景宁主编高等教育出版社原则上,环状机化合物中,构成环的原子,除了碳原子外,还有其他原子的,都称为杂环化合物。
2. 杂环化合物的英文?杂环化合物,heterocyclic compound。
[hetərə'saɪklɪk]By the end of eighteen century,experimenters had well established that each pure substance had its own characteristic set of properties such as density, specific heat,melting point,and boiling point. Organic chemistry is a sub-discipline within chemistry involving the scientific study of the structure,properties,composition,reactions,and preparation(by synthesis or by other means)of carbon-based compounds,hydrocarbons,and their derivatives.一、分类ON S五元 杂环第一节杂环化合物的分类和命名H 六 元 杂环NN N 单杂环稠 杂环NN H1. 母体名称呋喃吡咯噻吩咪唑噻唑82. 编号•从杂原子编起(母体的编号是固定的);•若有不同杂原子时,从O 、S 、N 顺序编号;•杂原子的位次遵循最低系列原则•例:3-1-酸类化合物以酸为母体,杂环为取代基。
N CH3甲基吡咯(β-甲基吡咯)甲基吡咯(N -甲基吡咯)α-呋喃甲酸(2-呋喃甲酸)α-噻吩磺酸N第二节五元杂环化合物OSHfuran pyrrole thiophene 呋喃吡咯噻吩一、呋喃、噻吩、吡咯杂环的结构π电子数满足4n +2,分子是闭合的共轭体系,NMR 谱图δ值为7左右,具有芳香性。
杂环化合物解读

O
N
S
H
呋喃
吡咯
噻吩
一、 呋喃、噻吩、吡咯杂环的结构
物理方法证明:呋喃、噻吩、吡咯都是平面结构,环上所有 原子均以sp2 杂化轨道重叠形成σ键。
碳未杂化的 p 轨道中有一个电子,杂原子的 p 轨道中有一 对电子,p 轨道互相平行重叠,形成闭合的共轭体系。
· ·
·
· ··
N—H
· ·
·
· ·· O ··
O ( 3.5) > N (3.0) > S (2.5)
电负性 , 对外层电子吸引力 , 孤电子离域 , 故芳香性 。
芳香性 与稳定性 :
>
>
>
S
N
H
O
由于呋喃、噻吩、吡咯都是五中心六电子,属于富电子环
p 电子密度: 稳定性 : 芳香性 : 亲电反应活性 :
杂环 > 苯环 杂环 < 苯环 杂环 < 苯环 杂环 > 苯环
H Br
O
顺丁稀二酸酐 双烯合成,30℃
H H
O
O O
内式(90%)
[H] [H]
S
Cl2,-50℃ Cl Cl
S
S
Cl S Cl
ROOCC≡C-COOR
COOR S
COOR
COOR COOR
[H] [H]
N
N
H
H
N H
CHCl3,碱
CCl2
N
H
NH
N CHCl2 H2O
H
N CHO
H
苯炔
3) 吡咯的弱碱性和弱酸性
维生素 B12分子结构
H 2NCOCH 2CH 2
CH 3 CH 3 CH 2CONH 2
有机化学精品课件——杂环化合物
杂环化合物在染料合成中具有重要作用,因为它们可以提供鲜艳的色彩和优良的染色性能。例如,偶氮染料和酞菁染料等杂环染料在纺织品、皮革和纸张等领域广泛应用。
杂环化合物作为染料合成的关键组分,能够提高染料的色牢度和稳定性,同时降低生产成本和对环境的污染。
有机化学精品课件——杂环化合物
汇报人:
2023-12-30
杂环化合物的定义与分类杂环化合物的结构与性质杂环化合物的合成与反应机理杂环化合物的应用杂环化合物的研究进展与展望
目录
杂环化合物的定义与分类
01
总结词
杂环化合物是指分子中至少含有一个杂原子(非碳原子)的环状化合物。
详细描述
杂环化合物是环状有机化合物中的一大类,其分子结构中至少含有一个杂原子(非碳原子),这些杂原子可以是氮、氧、硫等。这些原子与环上的碳原子共同构成一个环状结构。
杂环化合物在材料科学中具有广泛的应用,因为它们可以提供优良的物理和化学性能。例如,聚酰亚胺、聚醚醚酮等杂环高分子材料在航空航天、电子和汽车等领域广泛应用。
杂环化合物作为材料合成的关键组分,能够提高材料的耐热性、耐腐蚀性和机械性能等,同时降低生产成本和提高生产效率。
杂环化合物的研究进展与展望
05
谢谢您的观看
THANKS
在合成过程中,需要注意控制反应条件,如温度、压力、催化剂等,以保证合成效率和产物的纯度。
杂环化合物的合成方法还可以据具体需要采用一些特殊的方法,如分子内的亲核取代反应、分子内的亲电取代反应等。
亲电反应机理是指反应过程中,试剂首先进攻杂环化合物上的电子云密度较低的部位,从而形成正碳离子中间体。然后,正碳离子中间体再与试剂发生反应,形成新的键,最终生成产物。
第十六章杂环化合物PPT
第一节 杂环化合物的分类、命名和结构 第二节 杂环化合物的性质 一、物理性质 二、化学性质
1、五元杂环化合物及其衍生物 ①呋喃 ②吡咯 ③噻吩 ④糠醛
2、六元杂环化合物 ①吡啶 ②喹啉和异喹啉
3、生物碱
第十八章 杂环化合物
第一节 杂环化合物的定义、分类、命名和结构 一、定义:
构成环的原子除碳外还有其它元素原子的一 类环状化合物称为杂环化合物。
B、由于它们的高度活泼性以及呋喃和吡咯对于无机强 酸的敏感性(酸性环境下易发生分解、开环甚至聚 合等),其亲电取代反应必须对试剂及反应条件有 所选择和控制,必须在比较温和的条件下进行。
① 卤代反应:不需要催化剂,要在较低温度进行。
+ Br2 1,4- 二氧六环
O
25oC
75 %
O Br
由于吡咯比呋喃活性大,故吡咯在卤代时常生
二、分类: 1、芳香性
非芳香性杂环化合物 芳香性杂环化合物(4n+2π电子)
2、环数目
单杂环 稠杂环
五元杂环 3、杂环大小
六元杂环
此外,还可 按环中杂原 子的种类和
数目分类
本章重点介绍环较稳定的、具有芳香性的杂 环化合物中的极少数几个环系中的一些与生物关 系密切的杂环化合物。
三、命名: 1. 命名原则:
环中的非碳原子叫做杂原子。常见的杂原子 有O、S、N、P等。
杂环化合物是一大类有机物,占已知有机物 的三分之一。杂环化合物在自然界分布很广、功 用很多,其中许多杂环化合物具有生理活性。例 如,中草药的有效成分生物碱大多是杂环化合物; 动植物体内起重要生理作用的血红素、叶绿素、 核酸的碱基都是含氮杂环;部分维生素,抗菌素; 一些植物色素、植物染料、合成染料都含有杂环。
杂环化合物
杂环化合物杂环化合物杂环化合物是一种含有环的化合物,这个环由一种以上原子所组成。
一般将杂环化合物分为两类:一类是脂肪族杂环化合物,另一类是具有方向性的杂环化合物。
杂环化合物在日常生活中应用广泛。
是合成药物,合成染料,合成材料的重要原料之一。
是一大类有机化合物。
在理论上和实际中都有十分重要意义。
杂环化合物已经成为芳香性杂环化合物的代名词。
杂环化合物数目很多,根据环的大小,杂原子的多少和单环、稠环来分类。
最常见的和最稳定的是五元和六元单杂环及其相应的稠杂环,咋换上的编号一般是从杂原子开始,从阿拉伯数字1、2、3表示顺次,如同环中含有不同杂原子时,按O\S\N先后顺序排列进行编号,若有取代基则要考虑到取代基编号最小。
五元杂环--五元杂环中含有两个杂原子,其中一个必须是N原子(称固定氮原子)的叫做唑,第二个原子为氧原子的叫恶唑;第二个原子为硫原子的叫噻唑,第二个原子为氮原子的叫咪唑或吡唑,命名时还要标出两个杂原子的位置。
即为1,2-唑六元杂环含有两个杂原子的六元环有三种情况:杂原子互为邻位、间位、和对位。
含有两个氮原子的叫二嗪。
如”吡啶“含一个氮原子的吡啶稠杂环稠杂环是两个以上环稠合而成,其中一个是基本环,另一个是附加环,命名时附加环在前,基本环在后。
单环都可以作为基本环,个别稠杂环是基本环,如吲哚(苯并吡咯),喹啉(苯并吡啶),嘌啉(嘧啶并吡唑)由芳环与杂环组成的稠杂环。
杂环优先(即杂环为基本环),如:苯并呋喃、苯并咪唑,由两个杂环组成的稠杂环,大环优先于小环。
环数相同时,N、O、S杂原子顺序确定。
如;吡咯并吡啶,噻吩并吡咯。
环上杂原子数目多的优先,杂原子数目相同时,杂原子种类多的优先例如:吡啶并嘧啶、咪唑并恶唑、咪唑并噻唑。
环上杂原子数目及种类都相同时,同环杂原子编号低的优先。
(2)稠环共用边的标记。
附加环按其杂环的编号顺序编号,并以阿拉伯数字1、2、3.。
将各原子进行标记,苯环上的原子不需要编号,命名时在附加环名称的后面加一个并字。
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-杂环化合物【圣才出品】
(2)物理性质 ①噻唑是无色、有吡啶臭味的液体,沸点 117℃,易与水互溶,有弱碱性。 ②咪唑是无色固体,熔点 90℃,易溶于水。 (3)酸碱性 噻唑具有弱碱性,咪唑同时具有酸碱性,且其碱性较噻唑强。 (4)亲电反应 咪唑环比噻唑环较容易发生亲电取代反应,如卤代、硝化和磺化等。
(2)噻吩的制法 从 C4 馏分制备:丁烷与硫、丁烯与二氧化硫,在高温下反应得噻吩,如:
6 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)吡咯的制法 ①呋喃与氨在高温下反应得吡咯,如:
②吡咯还可从乙炔与甲醛经由丁炔二醇合成,如:
5.噻唑和咪唑 (1)定义 ①噻唑是含有一个硫原子和一个氮原子的五元杂环化合物。
2 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
吡咯、呋喃和噻吩在 3077~3003cm-1 区域出现 C—H 键伸缩振动吸收峰。 b.N—H 键伸缩振动 含有 N—H 基团的杂环在 3500~3200cm-1 区域出现 N-H 键伸缩振动吸收。 吡咯在非极性溶剂的稀溶液中于近 3495cm-1 处出现一条尖锐的峰,而在浓溶液中则于 近 3400cml-1 处出现一条宽峰,在浓和稀的中间浓度时两种峰都有。 c.环伸缩振动(骨架谱带) 环伸缩振动出现于 1600~1300cml-1 区域。 呋喃、吡咯和噻吩在这一区域里出现 2~4 个峰。 ②1HNMR 在吡咯的 1H NMR 中,α-H 的化学位移(δ值)为 6.68,而β-H 为 6.22,约在 8.0 出现 N —H 键的信号。 (4)亲电取代反应 ①亲电取代活性 a.反应速率 呋喃、吡咯、噻吩的反应速率比苯快得多,主要在于环上的五个原子共有 6 个π电子, 其π电子云密度比苯大。 b.反应活性 吡咯和呋喃比较活泼,与苯胺或苯酚相当,而噻吩则是三者中活性最差的。 ②亲电取代的定位原则 呋喃进行亲电取代反应时,亲电基团进入呋喃环的 2 位(即α位)上,若 2、5(即α及α') 两个位置已有基团存在,则进入 3 位。 ③亲电取代的条件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
nC5H10O5
HCl / 脱水
HO HO CHO
O
CHO
戊糖
性质及用途: 无α-H的醛,不饱和的呋喃杂环,重要的工业原料。
a、催化加氢
O + H2 CHO
CuO , Cr2O3 150℃ 10 MPa
O
CH2OH
b、歧化反应
+ NaOH CHO + O
O
O
CH2 OH
COONa
c、安息香缩合
KCN
非芳香杂环:具有脂肪族类化合物相似性质。
杂环
O
N H
芳香杂环:环为平面型,电子数符合4n+2规则, 有一定程度芳香性的较稳定的杂环。
O
S
N H
N
命名:
β` 4 α` 5 3 β
O
1
2 α
S
N H
N
N
呋喃
噻吩
吡咯
N
吡啶
喹啉
N
N H
CH3
S
CH3O
O
吲哚
5-甲基噻唑
6-甲氧基苯并噁唑
编号 从杂原子编起(母体的编号是固定的); 若有不同杂原子时,从O、S、N顺序编号; 杂原子的位次遵循最低系列原则 例:
2-乙酰基噻吩
+ (CH3CO)2O O
BF 3
O O C CH3
+ (CH3 CO)2O N H
150~200℃
O N H C CH3
因呋喃、吡咯、噻吩很活泼,傅氏烷基化往往得到多烷基取代 混合物,甚至产生树脂状物质,因此用处不大。
e、吡咯的特殊反应 类似于苯胺、苯酚,可与重氮盐偶联,呋喃、 噻吩无此反应。
90%
吡咯则先烷基化
O NH + O O N O O O
N ① ClCH2Ph NH ② O O O
CH2Ph
O O O
更强的亲双烯体可反应
H N NH +
噻吩加成产物不稳定,易脱硫。
COOR S + COOR S COOR -S COOR COOR COOR
(3)吡咯的弱碱性、弱酸性 吡咯因未共用电子对参与环的共轭,不能再与酸 结合,碱性比苯胺还弱,只能慢慢溶解在冷稀酸中。
3-甲基吡咯 (β-甲基吡咯) 酸类化合物 以酸为母体, α-呋喃甲酸 杂环为取代 (2-呋喃甲酸) 基。 1-甲基吡咯 (N-甲基吡咯)
α-噻吩磺酸
二、五元杂环化合物
1、呋喃、噻吩、吡咯杂环的结构
sp2
O
o
呋喃
sp2
S
s
噻吩
N H
N
H
吡咯
具有环闭的共轭体系,平面结构,符合4n+2规 则,具有芳香性。核磁共振氢谱δ值在7左右。
H+
+ C6H5 N2+ClN H
N H
N=NC6H5
2-(苯基偶氮)- 吡咯
f、取代呋喃、噻吩、吡咯的定位效应
由环上杂原子的α-定位效应及取代基共同决定。
COOH + S Br + HNO3 S Ac2 O S NO2 Br2
HOAc 25℃
COOH
Br
S
5-溴噻吩-3-甲酸
Br
如α -位有取代基
Br Br Br
N H
C2H5OH 0℃
Br
N H
四溴代吡咯
不活泼的I2在催化剂作用下也可直接取代。
I
I2 / NaOH
I I
N H
I
N H
I2 / HgO
S
S
I
d、傅氏酰基化反应 采用温和催化剂SnCl2、BF3,对活性大的吡咯 可不用催化剂。
+ (CH3CO)2 O S
H3PO4
O S C CH3
O
E
X
第一类定位基
X
第二类定位基
X = N 或 S ,两种产物差别不大
(2)加成反应 催化氢化
N H
H2 / Pt 200~250℃
N H
有机碱,广泛存在于生物碱
H2 / Pt
O
50℃
O
噻吩中含S,易使催化剂中毒,须采用特殊催化剂。
H2 / MoS2
S
S
双烯合成
O O + O O O H O O O H
具有芳香性,易进行亲电取代,其活性都比苯 大,顺序为:
吡咯 ﹥ 呋喃 ﹥ 噻吩 ﹥ 苯 共振能 90.4 71.1 125.5 151 KJ/mol-1
(1)亲电取代反应 呋喃、吡咯稳定性较差,遇酸或氧化剂易开环, 或聚合成高聚物。噻吩较稳定,因C-S键较长,缓解了 环张力的缘故。 为避开开环、聚合、氧化等副产物,常采用较温和 的试剂,避免强酸强氧化剂。
CH3I
N MgBr
N CH3
+ Mg
Br I
(4)糠醛(α -呋喃甲醛) 制法: 由农副产品(甘蔗渣、花生壳、高粱杆、棉子壳) 以热酸处理,因农副产品多为多聚戊醛糖,先水解为戊 糖,然后脱水环化而得。
(C5H8O4)n
HO H CH CH
+ nH2O
CH C OH H
3~5% 稀 H2SO4 水解
OH CH O
O C O
O
CHO
醇溶液
d、珀金反应
O + (CH3CO)2O CHO
NaAc
O
CH=CHCOOH
e、氧化
中性或碱性
O
CHO
KOH , KMnO4
O + CH3C N H
Al2O3
硝酸乙酰基酯 + 乙酸
ONO2
5℃
N H
NO2
83%
O + CH3C S ONO2
Al2O3 -10℃
S
NO2
70%
c、卤代 不需催化剂,为避免多取代物,采用温和条件, 如溶剂稀释和采用低温。
Br2 O O 10℃
O
O
Br
Br2
S
CH3COOH 室温
S Br
Br 2
a、磺化 磺化试剂:吡啶与SO3的加合物
N + SO3-
N H
100℃
N H
SO3 -
N+ H
吡咯-2-磺酸吡啶盐(90%)
HCl
N H
SO3H
+
N H
+
Cl-
+ H2 SO4(95%) S
25℃
S
SO3 H
噻吩-2-磺酸(69-76%)
b、硝化 用硝酸乙酰酯CH3COONO2作硝化剂 乙酐 + 硝酸
第十八章 杂环化合物 (Heterocyclic componds)
构成环的原子除了碳原子外还有其它原子的一类 环状化合物——杂环化合物,其它原子称为杂原子, 常见杂原子为O、S、N等。
杂环在自然界广泛存在。
一、杂环化合物的分类和命名
单杂环:五元环,六元环 杂环化合物 稠杂环:苯环与单杂环或两个以 上单杂环稠合而成。
π 电子几率密度比苯环大。
呋喃、噻吩、吡咯中,诱导效应与共轭效应方向 相反。 在呋喃、噻吩中,由于氧与硫的电负性较大,吸 电子的诱导效应被给电子的共轭效应部分抵消,因而 偶极矩值比相应的饱和化合物小。 而在吡咯中,氮的给电子共轭效应可能大于吸电 子诱导效应,故偶极矩比相应的饱和化合物大。
2、化学性质
吡咯具有弱酸性,其pKa=17.5,比醇强,比酚弱, 可与强碱或金属作用。
固体 KOH K
N K+
N H
N K+
+ H2
可与格氏试剂反应
CH3MgI
N H
乙 醚
N MgI
+ CH4
吡咯钾盐和吡咯卤化镁,可用于合成吡咯衍生物。
N K+
C6H5COCl 甲苯 110℃
O N C C6H5 + KCl
