电位滴定法测定氯、碘离子浓度及AgI和AgCl的Ksp(技术相关)
电位法测定氯和碘

实验5 电位滴定法测定氯、碘离子浓度及AgI和AgCl的K sp一、实验目的1.掌握电位滴定法测量离子浓度的一般原理;2.学会用电位滴定法测定难溶盐的溶度积常数。
二、方法原理当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:如果与一参比电极组成电池可表示为:进一步简化为:式中包括和r(Ag+)常数项。
银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。
例如,卤素离子。
本实验利用卤素阴离子(I-、Cl-)与银离子生成沉淀的溶度积K sp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。
在终点时:其中X-为Cl-、I-,代入终点时的滴定电池方程:用该式即可计算出被滴定物质难溶盐的K sp。
而式中K′和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定K′,斜率确定S。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
三、仪器设备与试剂材料1.pH/mV计,电磁搅拌器。
2.银电极,双液接饱和甘汞电极。
3.硝酸银标准溶液,0.100mol∙L-1:溶解8.5g AgNO3于500mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。
准确称取1.461g基准NaCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL NaCl标准溶液于锥形瓶中,加25mL水,加1mL15% K2CrO4,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点。
根据NaCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
4.Ba(NO3)2(固体)。
5.硝酸,6mol∙L-1。
6.试样溶液(其中含Cl-和I-分别都为0.05mol∙L-1左右)。
自动电位滴定法测定氯化物含量

自动电位滴定法测定氯化物含量一、实验目的1、了解自动电位滴定的原理及实验方法。
2、熟悉和学猩ZD-2型自动电位滴定仪的使用。
二、实验原理若溶液本身具有很深的颜色,影响指示剂的变色,故一般容量滴定不能进行。
虽然可用重量法测定;仍太麻烦。
用电位滴定法测定,其方法方便,快速、被确。
电位电位法测Cl -,通常采用AgNO 3作滴定剂,以银离子选择性电极作为指示电极,饱和甘汞电极为参比电极,滴定反应为:Ag -十Cl -= Ag C l ↓在滴定过程中,随着Cl -的浓度变化E 也在同步变化, 滴定至预定终点时,仪器发出一控制信号,使自动电位滴定仪停止滴定。
最后由用去的AgNO 3体积计算出Cl -含量。
终点电位计算:△E = E e.p -E SCE = 0.276V三、仪器与试剂ZD-2型自动电位滴定仪216型银离子选择性电极232型饱和甘汞电极AgNO 3标准溶液0.0100mo1/L未知试样四、实验步骤1. 调试仪器,预置滴定终点调试好仪器后,将终点预置在276mV 。
2. 未知试样测定取10 mL 未知试样于100 mL 烧杯中,加蒸馏水稀释至50 mL 。
平行测定三次。
3. 自来水样测定取50 mL 自来水于烧杯中,按照上述方法,平行测定三次。
4. 实验后处理用蒸馏水吹洗电极、毛细管。
五、数据处理按下述方法计算Cl -含量10005.35)(312⨯⨯⨯-=-V N V V Cl AgNO其中:V 1滴定前读数; V 2滴定后读数。
V 为水样体积五、问题讨论1、电位滴定与一般容量滴定有何不同?2、试写出该电池的表达式。
3、分析本实验可能的误差。
4、怎样配制0.0100mo1/L AgNO3标准溶液?。
电位滴定法测定氯离子

电位滴定法测定氯离子数据记录和处理一、原始数据记录和计算1、NaCl标准溶液称取氯化钠质量 m=0.2941g,容量瓶体积:100mlC NaCl = m NaClM?V = 0.294158.5?0.1=0.05 mol/L2、手动标定硝酸银溶液(1)原始数据表格1银离子滴定氯离子数据滴定体积/ml电位/mV滴定体积/ml电位/mV滴定体积/ml电位/mV 0172 2.90218 4.204430.30176 3.00221 4.304480.60180 3.10227 4.404500.90182 3.20234 4.504531.20186 3.30239 4.604561.50190 3.40246 4.704581.80185 3.50257 5.004632.101993.60277 5.304672.402053.70354 5.604702.502063.80400 5.904732.602113.90423 6.204752.70213 4.00433 6.504772.80214 4.10438(2)二阶微商法计算滴定终点为方便计算,挑选原始实验数据中的部分数据整理如下:滴定体积/ml电位φ/mVΔV/(V2-V1)Δφ/(φ2-φ1)ΔφΔV Δ2φΔV20.30176————1.201860.901011.11—3.102270.904145.5634.453.202340.1077024.44 3.302390.10550-20 3.402460.1077020 3.502570.101111040 3.602770.102020090 3.703540.1077770570 3.804000.1046460-3103.904230.1023230-2304.004330.1010100-1304.104380.10550-505.30467 1.202924.17-25.836.50477 1.202016.67-7.5去掉一个坏值(3.30,239),找出二阶微商为零的两个数据点(3.70,354)和(3.80,400)。
电位滴定法测定水质中的氯离子

电位滴定法测定水质中的氯离子摘要:建立了自动电位滴定仪测定水质中氯离子的方法。
以Ag Titrode电极作指示电极,选择DET动态等当点滴定模式,用硝酸和氢氧化钠溶液调节PH<4,在乙醇—水溶液中滴定测得结果。
该方法适用于地表水、海水、生活污水和工业废水等氯离子的测定,相对标准偏差0.28~1.23%,回收率为98~102%。
关键词:自动电位滴定仪;水质;氯离子前言1、意义氯离子(Cl-)是水质中一种常见的无机阴离子[1]。
几乎所有的天然水中都有它的存在,含量范围变化很大,河流、湖泊及部分排放水的氯离子含量一般很低,生活污水、工业废水和海水、盐湖及部分地下水的氯离子,含量可高达数千克/升。
水中氯化物含量高时,会损害金属管道和构筑物,并妨碍植物的生长。
2、方法选择测定氯离子的方法很多[2],其中离子色谱法适合于洁净水样中包括氯离子在内的多种阴离子的同时检测,硫氰酸汞分光光度法适合于大气和废气吸收液中氯离子的测定,以上两种方法适合于低含量氯离子的测定。
离子选择电极法适合的测定范围也比较广泛,但测定时间长,操作步骤繁琐。
硝酸银滴定法所需仪器设备简单,适合于清洁水测定,且终点较难判断。
本文采用自动电位滴定仪测定水质中的氯离子[3],以复合银电极作为指示电极,用硝酸银标准滴定液滴定,通过电脑绘制U—V曲线和△U/△V—V曲线,控制滴定速度,电位变化最大时仪器的体积读数即为滴定终点。
3.实验部分3.1主要仪器及试剂3.1.1主要仪器设备:905自动电位滴定仪(瑞士万通);交换单元20mL(瑞士万通);Ag Titrode电极6.0430.100(瑞士万通);电子分析天平(分度值0.1mg)。
3.1.2标液和试剂配制[4]3.1.2.1氯化钠标准溶液(0.0141mol/L):准确称取8.2400g基准氯化钠(预先经500~600℃马弗炉烧40~50min)溶于蒸馏水,定容于1000mL容量瓶中。
稀释10倍,该溶液每毫升含500ug氯离子;3.1.2.2硝酸银标准滴定液(0.0141mol/L):称取2.359g分析纯硝酸银(105℃烘半小时),溶于蒸馏水并稀释至1000mL,储于棕色瓶中,用氯化钠标准溶液标定,详见1.2.3.1;3.1.2.3其他试剂:硝酸溶液(2 mol/L):市售优级纯硝酸按(1+7)体积比配制;氢氧化钠溶液(0.2%):称取0.2克分析纯氢氧化钠,溶于水并稀释至100 mL,储存于聚乙烯试剂瓶中;95%乙醇:分析纯;溴酚蓝指示液:0.1%乙醇溶液;30%过氧化氢;试验所用水为蒸馏水。
采用电位滴定仪测定含氯量方法的探讨

采用电位滴定仪测定含氯量方法的探讨电位滴定仪是一种常用的分析仪器,能够快速准确地测定各种样品的含氯量。
本文将探讨采用电位滴定仪测定含氯量的方法及注意事项。
一、仪器与试剂电位滴定仪:电位滴定仪是一种用于测定液体中特定离子浓度的仪器,其基本原理是利用电位差来测定滴定过程中离子浓度的变化,从而获得样品中特定离子的含量。
氯化钠标准溶液(NaCl):一种常用的含氯量标准溶液,其浓度通常为0.1 mol/L。
石墨电极:一种常用的电位滴定仪电极,可用于测定氯离子的浓度。
二、测定步骤1.准备样品:所要测定的样品中含有的氯离子必须先转化成氯化钠(NaCl)的形式,才能进行测定。
为此,可以将样品溶解于盐酸中,加入草酸钙(CaC2O4)将样品中的钙离子沉淀掉,再加入氯化钠标准溶液将样品中的氯离子转化成氯化钠。
2.进行电位滴定:将电极插入装有样品的容器中,启动电位滴定仪,将氯化钠标准溶液滴入样品中。
随着滴液的加入,氯离子与电极之间的电位差发生变化,电位滴定仪记录下这些变化,并根据标准曲线计算出样品中的氯离子浓度。
3.计算含氯量:根据测得的氯离子浓度,可以推算出样品中的含氯量,公式为Cl-(mg/L)= V×C×35.5/m,其中,V为氯化钠标准溶液滴入样品的体积(mL),C为氯化钠标准溶液的浓度(mol/L),m为样品质量(g)。
三、注意事项1.样品的前处理方法对结果的准确性有很大的影响,必须严格按照标准方法进行;2.氯化钠标准溶液要保持浓度不变,避免影响测定结果;3.电极的清洁与校准必须定期进行,以确保测定结果的准确性;4.在进行滴定时要准确读取和记录氯化钠标准溶液的体积,避免影响测定结果。
通过以上步骤,可以用电位滴定仪准确测定含氯量,为实验室分析工作提供了可靠的手段。
电位滴定法测定氯、碘离子浓度及AgI和AgCl的Ksp

电位滴定法测定氯、碘离子浓度及AgI和AgCl的K sp一、实验目的1.掌握电位滴定法测量离子浓度的一般原理;2.学会用电位滴定法测定难溶盐的溶度积常数。
二、方法原理当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:如果与一参比电极组成电池可表示为:进一步简化为:式中包括和r(Ag+)常数项。
银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。
例如,卤素离子。
本实验利用卤素阴离子(I-、Cl-)与银离子生成沉淀的溶度积K sp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。
在终点时:其中X-为Cl-、I-,代入终点时的滴定电池方程:用该式即可计算出被滴定物质难溶盐的K sp。
而式中和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定,斜率确定S。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
三、仪器设备与试剂材料1.pH/mV计,电磁搅拌器。
2.银电极,双液接饱和甘汞电极。
3.硝酸银标准溶液,0.100mol∙L-1:溶解8.5g AgNO3于500mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。
准确称取1.461g基准NaCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL NaCl标准溶液于锥形瓶中,加25mL水,加1mL15% K2CrO4,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点。
根据NaCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
4.Ba(NO3)2(固体)。
5.硝酸,6mol∙L-1。
6.试样溶液(其中含Cl-和I-分别都为0.05mol∙L-1左右)。
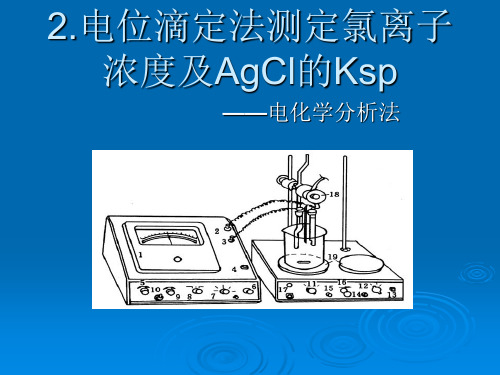
四、实验步骤1.按图示安装仪器。
电位滴定法测定氯离子浓度及AgCl的Ksp(PPS)
E K S ln[ Ag
]
3.终点确定方法(作图法):
三、实验内容
① 2 0 .0 0 m L 水 样 溶 液 ( 100m L烧 杯 )
② 5 0 .0 0 m L 蒸 馏 水 ( 100m L烧 杯 ) 5D 6M HN O 3 0 .5 g B a ( N O 3 ) 2
2 5 .0 0 m L H 2 O
E K RT nF ln a ( Ag
RT nF
RT nF
ln a ( Ag
)
) K
ln[ Ag
]
2.卤化银沉淀溶解平衡
Ag+来自+ X-
AgX
沉淀溶解平衡时:[Ag+]· [X-] =Ksp, 银离子与卤离子完全反应时:[Ag+]=[X-] 所以滴定终点时:[ Ag ] [ X ] 此时:
2.电位滴定法测定氯离子 浓度及AgCl的Ksp
——电化学分析法
一、实验目的
1.掌握电位滴定法测量离子浓度的一般原理; 2.学会用电位滴定法测定难溶盐的溶度积常数。
二、实验原理
1.原电池:
甘汞电极(参比电极)ㄧ待测溶液ㄧ银电极(指示电极)
银电极电极电势: 原电池电动势:
( Ag , Ag ) ( Ag , Ag )
五、思考题
1.与化学分析法中的容量法相比,电位滴定
法有何特点? 2. 如何计算滴定反应的理论电位值?
3D 6M HN O 3 0 .5 g B a ( N O 3 ) 2
搅拌 滴定 记 录 V、 E
搅拌 滴定
记 录 V、 E
电位滴定法测氯离子

电位滴定法
1、方法原理 电位滴定法测定氯化物,是以氯电极为指示电极, 以玻璃电极或双液接参比电极为参比,用硝酸银标准 溶液滴定,用伏特计测定两电极之间的电位变化。在 恒定地加入小量硝酸银的过程中,电位变化最大时仪 器的读数即为滴定终点。
2、干扰及消除 溴化物、碘化物能与银离子形成溶解度很小的物质, 干扰测定;氰化物为电极干扰物质;高铁氰化物会使 结果偏高;高铁的含量如果显著地高于氯化物也引起 干扰;六价铬应预先使还原为三价,或者预先去除。 重金属、钙、镁、铝、二价铁、铬、HPO42-、SO42-等 均不干扰测定。硫化物、硫代硫酸盐和亚硫酸盐等的 干扰可用过氧化氢处理予以消除。Br﹣、I﹣的干扰, 可用加入定量特制的Ag粉末,或者从测得得总卤量中 扣除Br﹣、I﹣的含量的方法消除。
3、氯化物对人和温血动物的危害 水中氯化物浓度超过1500mg/L时,对牛、羊、猪等 家畜和家禽有危害,当浓度超过4000mg/L时,可以使 上述动物死亡。但是当水中阳离子为镁,氯化物浓度 为100mg/L时,即可使人致毒。 4、氯化物对生生物的危害 一般认为氯化物对淡水生物的毒性很小,但当水中 氯化物的浓度较高时,可以致鱼类死亡。氯化物对水 生物的毒性不仅与氯化物的浓度有关,也与水中存在 的阳离子有密切关系。
试剂: ① 氯化钠标准溶液(0.0141 mol/L):称取0.8240g基准氯 化钠(经140℃干燥过),溶于水中,移入1000 ml容量 瓶中,用水稀释至标线,摇匀。此溶液每毫升含500µg 氯离子。 ② 硝酸银标准溶液(0.0141 mol/L):称取2.395g硝酸银, 溶于水中,加2 ml浓硝酸,移入1000 ml容量瓶中,用水 稀释至标线,摇匀。贮存在棕色瓶中,避光保存。用氯 化钠标准溶液进行标定。 ③ 浓硝酸:ρ=1.42 g/ml。 ④ 1+1硫酸。 ⑤ 30%过氧化氢。 ⑥ 1 mol/L氢氧化钠溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电位滴定法测定氯、碘离子浓度及AgI和AgCl的K sp
一、实验目的
1.掌握电位滴定法测量离子浓度的一般原理;
2.学会用电位滴定法测定难溶盐的溶度积常数。
二、方法原理
当银丝电极插入含有Ag+的溶液时,其电极反应的能斯特响应可表示为:
如果与一参比电极组成电池可表示为:
进一步简化为:
式中包括和r(Ag+)常数项。
银电极不仅可指示溶液中Ag+的浓度变化,而且也能指示与Ag+反应的阴离子的浓度变化。
例如,卤素离子。
本实验利用卤素阴离子(I-、Cl-)与银离子生成沉淀的溶度积K sp非常小,在化学计量点附近发生电位突跃,从而通过测量电池电动势的变化来确定滴定终点。
在终点时:
其中X-为Cl-、I-,代入终点时的滴定电池方程:
用该式即可计算出被滴定物质难溶盐的K sp。
而式中和S值可利用第二终点之后过量的[Ag+]与E(电池)关系作图求得,由直线的截距确定,斜率确定S。
通常的电位滴定使用甘汞或AgCl/Ag参比电极,由于它们的盐桥中含有氯离子会渗漏于溶液中,不适合在这个实验中使用,故可选用甘汞双液接硝酸盐盐桥,或硫酸亚汞电极。
三、仪器设备与试剂材料
1.pH/mV计,电磁搅拌器。
2.银电极,双液接饱和甘汞电极。
3.硝酸银标准溶液,0.100mol∙L-1:溶解8.5g AgNO3于500mL去离子水中,将溶液转入棕色试剂瓶中置暗处保存。
准确称取1.461g基准NaCl,置于小烧杯中,用去离子水溶解后转入250mL容量瓶中,加水稀释至刻度,摇匀。
准确移取25.00mL NaCl标准溶液于锥形瓶中,加25mL水,加1mL15% K2CrO4,在不断摇动下,用AgNO3溶液滴定至呈现砖红色即为终点。
根据NaCl标准溶液浓度和滴定中所消耗的AgNO3体积(mL),计算AgNO3的浓度。
4.Ba(NO3)2(固体)。
5.硝酸,6mol∙L-1。
6.试样溶液(其中含Cl-和I-分别都为0.05mol∙L-1左右)。
四、实验步骤
1.按图示安装仪器。
2.用移液管取20.00mL的Cl-、I-混合试样溶液于100mL烧杯中,再加约30mL水,加几滴6mol∙L-1硝酸和约0.5g Ba(NO3)2固体。
将此烧杯放在磁力搅拌器上,放入搅拌磁子,然
后将清洗后的银电极和参比电极插入溶液。
滴定管应装在烧杯上方适当位置,便于滴定操作。
3.开动搅拌器,溶液应稳定而缓慢地转动。
开始每次加入滴定剂1.0mL,待电位稳定后,读取其值和相应滴定剂体积记录在表格里。
随着电位差的增大,减少每次加入滴定剂的量。
当电位差值变化迅速,即接近滴定终点时,每次加入0.1mL滴定剂。
第一终点过后,电位读数变化变缓,就增大每次加入滴定剂量,接近第二终点时,按前述操作进行。
4.重复测定两次。
每次的电极、烧杯及搅拌磁子都要清洗干净。
五、数据处理
1.按下表格式记录和处理数据:
滴入AgNO3
V/mL
电位
E/mV
△E
/mV
△V
/mL
△E/△V
/(mV/m
L)
平均体积
2.作E~V,△E/△V~V,△2E/△V2~V滴定曲线。
3.求算试样溶液中Cl-和I-的质量浓度(mg∙L-1)。
4.从实验数据计算AgI和AgCl的K sp。
六、问题讨论
1.在滴定试液中加入Ba(NO3)2的目的是什么?
2.如果试液中Cl-和I-的浓度相同,当AgCl开始沉淀时,AgI还有百分之几没有沉淀?
3.如果有1.0mol∙L-1氨与Cl-和I-的共存在滴定试液中,将会对上述滴定产生什么样的影响?。
