人教版高中化学必修2课时作业化学能与电能
高中化学 2.2 化学能与电能课时作业1 新人教版必修2

高中化学2.2 化学能与电能课时作业1 新人教版必修2一、选择题(每小题3分,共45分,每小题有1-2个正确选项)1. 下列关于原电池的叙述正确的是()A. 构成原电池的正极和负极必须是两种不同的金属B. 原电池是将化学能转变为电能的装置C. 在原电池中,电子流出的一极是负极,该电极被还原D. 原电池放电时,电流的方向是从负极到正极解析:原电池的电极材料可以是活动性不同的金属,也可以是金属与其他导电的材料(非金属或氧化物)等,故A错;电子流出的一极是负极,该极被氧化,故C错;电流方向是由正极流向负极,故D错。
答案:B2. 由铜、锌片和稀硫酸组成的原电池工作时,电解质溶液的pH()A. 不变B. 先变小后变大C. 逐渐变大D. 逐渐变小解析:根据原电池工作时的总反应:Zn+2H+===Zn2++H2↑只要原电池不断工作,该反应就不断发生,溶液中c(H+)逐渐减小,溶液的pH将不断增大。
答案:C3.(2010·新课标全国卷)根据下图,可判断出下列离子方程式中错误的是()A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)B.Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)解析:本题考查原电池原理及其运用,意在考查考生对原电池装置的判断和总反应方程式的书写。
从两个原电池的电极可以判断出三种金属的活泼性关系为:Cd>Co>Ag,则氧化性关系为:Cd2+<Co2+<Ag+,根据氧化还原反应规律知A项错误。
答案:A4. 如图所示,烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是()解析:A、B、C均形成原电池,D不能构成原电池,其中B、C中Ag、Cu均不与稀H2S O4反应,因此铜电极无法产生气泡。
A中Zn-2e-===Zn2+,2H++2e-===H2↑答案:A5. 某原电池的总反应离子方程式为Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是下列的()解析:原电池的电池反应为Zn+Cu2+===Zn2++Cu,要求Zn作负极,可溶性铜盐作电解质溶液,且能形成闭合回路,只有C项符合。
人教版高中化学必修2化学能与电能第1课时作业
第二节 化学能与电能第1课时 化学能转化为电能基础巩固1.化学与能源开发、环境保护、资源利用等密切相关。
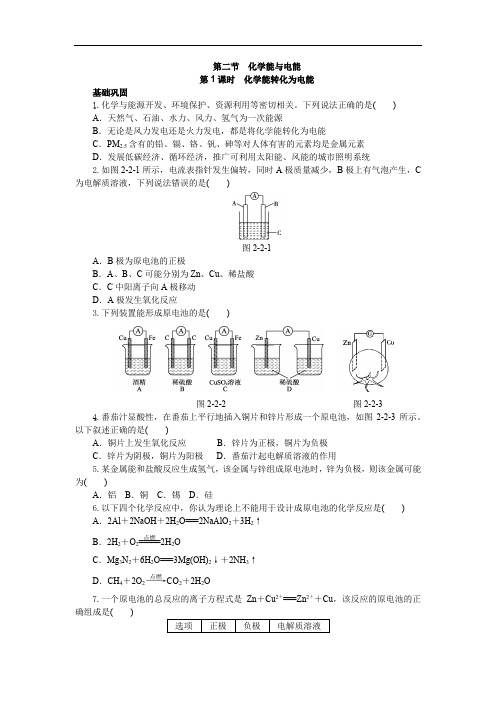
下列说法正确的是( )A .天然气、石油、水力、风力、氢气为一次能源B .无论是风力发电还是火力发电,都是将化学能转化为电能C .PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素D .发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统2.如图221所示,电流表指针发生偏转,同时A 极质量减少,B 极上有气泡产生,C 为电解质溶液,下列说法错误的是( )图221A .B 极为原电池的正极B .A 、B 、C 可能分别为Zn 、Cu 、稀盐酸C .C 中阳离子向A 极移动D .A 极发生氧化反应3.下列装置能形成原电池的是( )图222 图2234.番茄汁显酸性,在番茄上平行地插入铜片和锌片形成一个原电池,如图223所示。
以下叙述正确的是( )A .铜片上发生氧化反应B .锌片为正极,铜片为负极C .锌片为阴极,铜片为阳极D .番茄汁起电解质溶液的作用5.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )A .铝B .铜C .锡D .硅6.以下四个化学反应中,你认为理论上不能用于设计成原电池的化学反应是( )A .2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑B .2H 2+O 2=====点燃2H 2OC .Mg 3N 2+6H 2O===3Mg(OH)2↓+2NH 3↑D .CH 4+2O 2――→点燃CO 2+2H 2O7.一个原电池的总反应的离子方程式是Zn +Cu 2+===Zn 2++Cu ,该反应的原电池的正确组成是( )选项正极 负极 电解质溶液A Zn Cu CuCl2B Zn Cu ZnCl2C Cu Zn CuSO4D Cu Zn ZnSO48.将纯锌片和纯铜片按图224所示方式插入同浓度的稀硫酸中一段时间后,以下叙述正确的是()图224A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两烧杯中溶液的pH均增大D.甲产生气泡的速率比乙慢9.利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。
高中化学 2.2 化学能与电能课时作业1 原电池课件 新人教版必修2

B. 铜棒上产生气泡 C. H+浓度增大 D. 铜棒上不产生气泡
第二十一页,共35页。
解析:由Cu——Zn,稀H2SO4构成的原电池,电极反 应为:
负极:Zn-2e-===Zn2+ 正极:2H++2e-===H2 Zn做负极提供电子,电子由Zn流向Cu并非电流流向, 故A错。Cu棒为正极,H2在上面产生(chǎnshēng),故B正 确D错。由于不断消耗H+所以H+浓度减小。 答案:B
答案:白铁皮和马口铁表面被划破,与表面接触的水 膜形成原电池,白铁皮中锌作负极被腐蚀,铁被保护,不 易生锈,而马口铁中铁作负极首先被腐蚀,易生锈。
第十二页,共35页。
5. 废旧电池为什么必须进行集中处理而不能随意(suíyì) 丢弃?
答案:废旧电池随便丢弃容易造成重金属污染。
第十三页,共35页。
第十四页,共35页。
第二章 化学反应(huàxué fǎnyìng)与
能量
第一页,共35页。
第二节 化学能与电能(diànnéng)
第二页,共35页。
课时(kèshí)作业1——原电池
第三页,共35页。
第四页,共35页。
1. 原电池原理及其应用
(1)原电池的原理
从能量转变看:原电池是将 化学能(h转uà变xu为é) 电能的(d装ià置nnéng)
(zhuāngzhì) 。 从 化 学 反 应 看 , 氧原化电还原池反的应 原 理还原是
中剂
氧化剂
失去的两电个子电极经过导线传递给
,使氧化还原反应
分别在
上进行。
第五页,共35页。
(2)构成原电池的条件
高一化学人教版必修二课时作业:2.2.1化学能转化为电能(有答案)
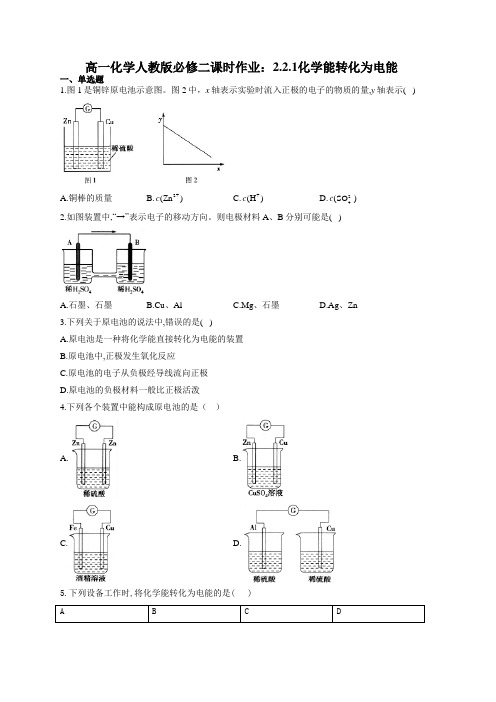
高一化学人教版必修二课时作业:2.2.1化学能转化为电能一、单选题1.图1是铜锌原电池示意图。
图2中,x 轴表示实验时流入正极的电子的物质的量,y 轴表示( )A.铜棒的质量B.2+(Zn )cC.+(H )cD.2-4(SO )c2.如图装置中,“→”表示电子的移动方向。
则电极材料A 、B 分别可能是( )A.石墨、石墨B.Cu 、AlC.Mg 、石墨D.Ag 、Zn3.下列关于原电池的说法中,错误的是( )A.原电池是一种将化学能直接转化为电能的装置B.原电池中,正极发生氧化反应C.原电池的电子从负极经导线流向正极D.原电池的负极材料一般比正极活泼4.下列各个装置中能构成原电池的是( )A. B.C. D.5.下列设备工作时,将化学能转化为电能的是( )铅蓄电池充电锂离子电池放电太阳能集热器燃气灶6.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池。
下列氧化还原反应中,在一定条件下不能构成原电池的是( )A.2FeCl2+Cl2=2FeCl3B.Zn+Ag2O+H2O=Zn(OH)2+2AgC.Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2OD.2H2+O2=2H2O7.下列有关原电池的叙述中不正确...的是( )A.原电池是将化学能转化为电能的装置B.在原电池中,电子流出的一极是负极,发生氧化反应C.原电池中,电解质溶液中的阴离子会移向负极D.构成原电池的两个电极必须是活泼性不同的两种金属8.发生原电池的反应通常是放热反应,在理论上可设计成原电池的是( )A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0B.Ba(OH)2.8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3.H2O(l)+8H2O(l) ΔH>0C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ΔH<0D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<09.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。
高中化学《化学能与电能》课时作业

第二节化学能与电能[基础快练]第1课时化学能转化为电能1.下列装置能形成原电池的是()A.①②③⑦⑧B.①②⑥C.①②③④D.①②③⑥⑦答案 A解析以构成原电池的条件为依据进行分析。
装置④不能形成闭合回路;装置⑤不具有两个活动性不同的电极,只能发生氧化还原反应;装置⑥中酒精不是电解质溶液。
2.下列说法正确的是()A.HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池B.将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转C.在铜-锌-稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌D.原电池中阳离子向正极移动答案 D解析中和反应中无电子转移,不能设计为原电池。
酒精是非电解质,该装置不能组成原电池,不能形成电流。
电子不能通过溶液,原电池中电解质溶液通过离子的移动导电。
由电流方向可知原电池中阳离子向正极移动。
3.下列关于铜-锌-稀硫酸构成的原电池的有关叙述,错误的是()A.锌为负极,锌发生氧化反应B.铜为正极,铜不易失去电子而受到保护C.负极发生还原反应,正极发生氧化反应D.外电路电子流入的一极为正极,电子流出的一极为负极答案 C解析在铜-锌-稀硫酸构成的原电池中,锌是负极,铜是正极,所以锌极发生氧化反应;铜电极上是溶液中的阳离子H+得电子,发生还原反应;外电路电子的流向应该是由负极流向正极。
1.构成原电池的条件(1)具有活泼性不同的两个电极。
(2)两电极必须插入电解质溶液中。
(3)形成闭合回路。
(4)能自发地发生氧化还原反应。
2.原电池中正、负极的确定方法注:原电池正极和负极与电极材料的性质有关,也与电解质溶液有关,即活泼电极不一定作负极例:Mg—Al—NaOH溶液形成的原电池中,铝作负极4.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为()A.Z>Y>X>W B.Z>X>Y>WC.Z>Y>W>X D.Y>Z>X>W答案 A解析甲中Z为负极,活泼性Z>Y;乙中X上有气泡生成,则X为正极,活泼性Y>X;丙中根据电子流向可知,Z为负极,活泼性Z>W;丁中W上发生还原反应,W为正极,活泼性X>W。
高中化学 2.2 化学能与电能课时作业 新人教版必修2

化学能与电能一、选择题(本题包括10小题,每小题5分,共50分)1.(2015·广州高一检测)下列有关电池叙述正确的是( )A.水果电池是高效环保的家用电池B.锌锰干电池是一种常用的二次电池C.锌锰干电池碳棒是负极,锌片是正极D.锌锰干电池工作一段时间后锌外壳逐渐变薄【答案】 D2.(2015·山东潍坊高一检测)有关原电池的下列说法中正确的是( )A.在外电路中电子由正极流向负极B.在原电池中负极发生还原反应C.原电池工作时,阳离子向正极方向移动D.原电池中正极一定是不活泼金属【答案】 C3.(2015·山东莱芜高一检测)X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为原电池的负极。
X、Y、Z三种金属的活动性顺序为( ) A.X>Y>Z B.X>Z>YC.Y>X>Z D.Y>Z>X【答案】 C4.(2015·山东滨州高一检测)下列6个装置中,属于原电池的装置有(F中,盐桥能使离子透过——起导电的作用)( )A.2个 B.3个C.4个 D.5个【解析】A中Fe不与Zn2+反应,B中酒精是非电解质,A、B项不能构成原电池。
其他4个装置均为原电池。
【答案】 C5.(2015·山东济南高一检测)右图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )卡片No.10 Date:2015-3-24实验记录:①导线中电流方向:锌→铜。
②铜极上有气泡产生。
③锌片变薄。
实验结论:④Zn为正极,Cu为负极。
⑤铜比锌活泼。
⑥H+向铜片移动。
A.①②③ B.④⑤⑥C.③④⑤ D.②③⑥【答案】 D6.(2015·试题调研)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极,②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
2024_2025学年高中化学课时分层作业8化学能与电能新人教版必修2

课时分层作业(八) 化学能与电能(建议用时:45分钟)[学业达标练]1.下列有关能源的说法错误的是( )A.风能是人类通过风车等工具获得的能源,但属于一次能源B.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源C.月球土壤中含有丰富的质量数为3的氦,它可作为将来核能的重要原料D.原电池把化学能干脆转化为电能,所以由原电池供应的电能是一次能源D[风能是干脆从自然界中取得的能源,属于一次能源,原电池供应的电能是由化学能转化而得到的,不能干脆获得,属于二次能源,A正确,D错误;随着时代的发展,化石能源渐渐枯竭,所以新能源时代污染小的核能、太阳能、氢能将成为主要能源,B、C正确。
] 2.下列装置中,能构成原电池的是( )A.只有甲B.只有乙C.只有丙D.除乙均可以C[甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精不是电解质溶液,只有丙装置具备原电池的构成条件,故选C。
]3.如图是Zn和Cu形成的原电池,某试验爱好小组做完试验后,记录如下:【导学号:43722094】①Zn为正极,Cu为负极。
②H+向负极移动。
③电子流淌方向,从Zn经外电路流向Cu。
④Cu极上有H2产生。
⑤若有1 mol电子流过导线,则产生H2为0.5 mol。
⑥正极的电极反应式为Zn-2e-===Zn2+。
描述合理的是( )A.①②③B.③④⑤C.④⑤⑥D.②③④B[在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,电子由Zn流出经导线流向Cu,负极反应为Zn-2e-===Zn2+,正极反应为2H++2e-===H2↑,故每转移1 mol电子时,产生H20.5 mol,在溶液中H+向正极移动,SO2-4向负极移动,故①②⑥错误,③④⑤正确。
]4.右图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )A.电池内部含有电解质B.锌是负极,碳棒是正极C.电池用完后可埋入土壤D.锌锰干电池是一次性电池C[锌锰干电池是一次性电池,负极材料是Zn,正极材料是碳棒,电解质是NH4Cl。
2020-2021学年人教版必修2:2.2化学能与电能作业

第二节化学能与电能班级:姓名:1.化学与能源开发、环境保护、资源利用等密切相关。
下列说法正确的是()A.天然气、石油、流水、风力、氢气为一次能源B.无论是风力发电还是火力发电,都是将化学能转化为电能C.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素D.垃圾是放错地方的资源,应分类回收利用答案:D2.如图为原电池构造示意图,下列有关说法正确的是()A.铜上有气泡产生B.锌是原电池的正极C.铜上发生反应Cu-2e-===Cu2+D.该装置将电能转化为化学能答案:A3.某课外活动小组设计的用化学电源使LED灯发光,装置如图。
下列说法错误的是()A.铜片表面有气泡生成B.装置中存在“化学能→电能→光能”的转换C.如果将硫酸换成NaOH溶液,LED灯也会发光D.如果将铝片换成银片,电路中的电流方向相反答案:D4.银锌纽扣电池的构造如图所示。
其电池反应方程式为:Ag2O+Zn+H2O===2Ag+Zn(OH)2。
下列说法正确的是()A.锌粉为正极B.Ag2O发生氧化反应C.电池工作时,电子从锌粉经KOH溶液流向Ag2OD.正极的电极反应式为:Ag2O+2e-+H2O===2Ag+2OH-答案:D5.下列关于原电池的叙述,正确的是()A.构成原电池的正极和负极材料必须是两种活泼性不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,该电极被还原D.原电池放电时,电流的方向是从负极到正极解析:构成原电池的正极和负极材料可以是两种活泼性不同的金属,也可以是导电的非金属(如石墨棒)和金属,A项错误;原电池是将化学能转变为电能的装置,B项正确;在原电池中,负极上发生失去电子的氧化反应,正极上发生得到电子的还原反应,所以电子从负极沿导线流向正极,负极上参与反应的物质被氧化,C项错误;原电池放电时,电子从负极沿导线流向正极,则电流的方向是从正极到负极,D项错误。
答案:B6.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,记录如下,其中正确的是()①Zn为正极,Cu为负极②H+向负极移动③电子是由Zn经外电路流向Cu④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生的H2为1 g⑥正极的电极反应式为Zn-2e-===Zn2+A.①②③B.③④⑤C.④⑤⑥D.②③④解析:Cu-Zn原电池中,Zn为负极,①错误;阳离子移向正极,②错误;电子由Zn 流出,经外电路流向Cu,③正确;Cu极上发生反应2H++2e-===H2↑,④正确;由得失电子守恒可知1 mol电子流过导线可以产生0.5 mol H2,即1 g H2,⑤正确;正极发生还原反应,⑥错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时分层作业(八)(建议用时:40分钟)[合格基础练]1.下列叙述不正确的是( )A .根据一次能源和二次能源的划分,氢气为二次能源B .电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C .火力发电是将燃料中的化学能直接转变为电能的过程D .在火力发电过程中,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化C [氢气不能从自然界中直接取得,是二次能源,电能也是二次能源,且使用方便、污染最小,A 、B 两项正确;以煤为原料,火力发电的能量转化过程:化学能――→燃烧热能――→蒸汽机械能――→发电机电能,C 项错误,D 项正确。
]2.下列装置中,能构成原电池的是( )A .只有甲B .只有乙C .只有丙D .除乙均可以C [甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精不是电解质溶液,只有丙装置具备原电池的构成条件,故选C 。
]3.下列有关电池的说法正确的是 ( )A .铅蓄电池不属于二次电池B .原电池工作时一定有氧化还原反应发生C .废旧电池可埋入土壤,作为肥料D .氢氧燃料电池,通入氢气的电极为电池的正极[答案] B4.如图装置所示,正极发生的反应为( )A.Zn2++2e-===ZnB.2H++2e-===H2↑C.Zn-2e-===Zn2+D.Cu2++2e-===CuB[正极发生还原反应,应该是H+得电子发生还原反应。
]5.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的()A.A是Zn,B是Cu,C是稀硫酸B.A是Cu,B是Zn,C为稀硫酸C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液D[A极逐渐变粗,说明A极为原电池的正极,溶液中的金属阳离子得到电子后在A极上析出;B极逐渐变细,说明B极为原电池的负极,失去电子后变成离子进入溶液中。
A和B中的反应为Zn+H2SO4===ZnSO4+H2↑,则A中A 极变细,B中A极不变。
C和D两项中的反应为Fe+2AgNO3===2Ag+Fe(NO3)2,其中C中A极变细,D中A极变粗。
]6.如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是()A.外电路的电流方向为X→外电路→YB.若两电极分别为Fe和石墨棒,则X为石墨棒,Y为FeC.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极材料都是金属,则它们的活动性顺序为X>YD[外电路的电子流向与电流方向相反,A项错误;由电子流向可知,X极为负极,Y极为正极,则X应为Fe,Y为石墨棒,B项错误;X极发生氧化反应,Y极发生还原反应,C项错误;X极的金属应比Y极的金属活泼,D项正确。
] 7.如图所示,两电极一极为石墨棒,另一极为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是()A.a为负极,是铁片,烧杯中的溶液为稀硫酸B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液C.a为正极,是石墨棒,烧杯中的溶液为稀硫酸D.b为正极,是石墨棒,烧杯中的溶液为硫酸铜溶液C[由题给信息“电流表的指针发生偏转”,可确定该装置构成了原电池。
又因“a极上有大量气泡生成”,可知:a为正极(石墨棒),则b为负极(铁片),即可确定烧杯中的溶液是稀硫酸。
]8.银锌电池用途广泛,可用作各种电子仪器的电源,它的充电和放电过程可以表示为2Ag+Zn(OH)2充电放电Ag2O+Zn+H2O,此电池放电时,负极上发生反应的物质是()A.Ag B.Zn(OH)2C.Ag2O D.ZnD[放电反应为原电池反应,负极发生氧化反应失去电子。
]9.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+Mg===Mg2++2Ag+2Cl-。
有关该电池的说法正确的是() A.Mg为电池的正极B.负极反应为AgCl+e-===Ag+Cl-C.不能被KCl溶液激活D.可用于海上应急照明供电D[由电池反应方程式看出,Mg是还原剂,AgCl是氧化剂,Mg作负极,A错误;Mg作负极,其电极反应式:Mg-2e-===Mg2+,B错误;因为该电池能被海水激活,故KCl溶液也可以激活电池,C错误;电池是一种能被海水激活的一次性贮备电池,电池工作时将化学能转化为电能,电能的产生可用于海上应急照明供电,D正确。
]10.如图是氢氧燃料电池构造示意图。
关于该电池的说法不正确的是()A.a极是负极,反应式为H2-2e-===2H+B.供电时的总反应式为2H2+O2===2H2OC.电子由b通过灯泡流向aD.氢氧燃料电池是环保电池C[a电极发生反应:H2-2e-===2H+,故电子应由a通过灯泡流向b。
] 11.现有如下两个反应:(A)NaOH+HCl===NaCl+H2O(B)Cu+2Ag+===2Ag+Cu2+(1)根据两反应本质,判断能否设计成原电池__________________________。
(2)如果不能,说明其原因___________________________________________________________________________________________________________。
(3)如果可以,则写出正负极材料、电极反应式及反应类型(“氧化反应”或“还原反应”):负极:________,____________________,________。
正极:________,____________________,________。
[解析](1)只有自发的氧化还原反应才能设计成原电池,(B)是氧化还原反应且能自发进行。
(3)根据电池反应式:Cu+2Ag+===2Ag+Cu2+可知,Cu失电子作负极,负极材料是Cu,正极材料应是比铜不活泼的金属或能导电的非金属;Ag+得电子,所以此电解质溶液只能为AgNO3溶液。
[答案](1)(A)不能,(B)可以(2)(A)不是氧化还原反应,没有电子转移(3)Cu Cu-2e-===Cu2+氧化反应碳棒、Ag、铂、金(任选一)2Ag++2e-===2Ag还原反应12.把A、B、C、D四种金属按下表中装置进行实验。
装置现象二价金属A不断溶解C的质量增加A上有气体产生(1)装置甲中负极的电极反应式是___________________________________。
(2)装置乙中正极的电极反应式是___________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_______________________________。
[解析]据图(Ⅰ)知活泼性:A>B,A作负极,电极反应为A-2e-===A2+;据图(Ⅱ)知活泼性:B>C,正极反应为Cu2++2e-===Cu;据图(Ⅲ)知活泼性:D>A,正极反应为2H++2e-===H2↑,故c(H+)减小,pH增大。
据(Ⅰ)、(Ⅱ)、(Ⅲ)知活泼性:D>A>B>C。
[答案](1)A-2e-===A2+(2)Cu2++2e-===Cu(3)变大(4)D>A>B>C[等级过关练]13.如图所示,杠杆A、B两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,若实验过程中不考虑铁丝反应及两边浮力的变化,一段时间后,下列有关杠杆的偏向判断正确的是()A.杠杆为导体和绝缘体时,均为A端高B端低B.杠杆为导体和绝缘体时,均为A端低B端高C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高D[当杠杆为绝缘体时,Fe把Cu2+置换附着在Fe球上,质量增重,下沉,B端低;为导体时,构成原电池,Cu球上有Cu析出增重,Fe球溶解,减轻,B 端升高。
]14.LED产品具有耗电量低、寿命长的特点。
如图是氢氧燃料电池驱动LED 屏发光的装置,下列有关叙述不正确的是()A.a处通入的气体是氢气,电极反应式为H2-2e-+2OH-===2H2OB.装置中电子的流向为a极→N型半导体→P型半导体→b极C.装置中的能量转化至少涉及三种形式的能量D.图中表示来自氢氧燃料电池中的K+的移动方向D[由N型半导体中电子的流向可知,a极是电子流出的一极(负极),a处应通入氢气,碱性条件下氢气失电子结合OH-生成水,A项正确;b极是电子流入的一极(正极),电子只能从a极经半导体流入,B项正确;该装置的能量转化中至少涉及化学能、电能、光能,C项正确;氢氧燃料电池中K+移向b极,但其不能在导线上移动,不能表示K+的移动方向,D项错误。
] 15.普通水泥在固化过程中自由水分子减少并形成碱性溶液。
根据这个特点,科学家发明了测水泥初凝时间的某种方法。
此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是()A.正极电极反应式为Ag2O+2e-+2H+===2Ag+H2OB.测定原理示意图中,Ag2O为负极C.负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2OD.电池工作时,OH-向正极移动C[A项,溶液中含有OH-,正极反应为Ag2O+2e-+H2O===2Ag+2OH-;B项,Ag2O为正极;D项,电池工作时,OH-向负极移动。
] 16.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
甲乙(1)写出甲中正极的电极反应式:___________________________________。
(2)乙中负极为________,总反应的离子方程式:_________________________________________________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出________金属活动性更强,而乙会判断出________金属活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质B.镁的金属性不一定比铝的金属性强C.该实验说明金属活动性顺序表已过时,没有实用价值了D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析[解析]甲同学依据的化学反应原理:Mg+H2SO4===MgSO4+H2↑,乙同学依据的化学反应原理:2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
