材料科学基础-第五章 材料的相结构与相图
合集下载
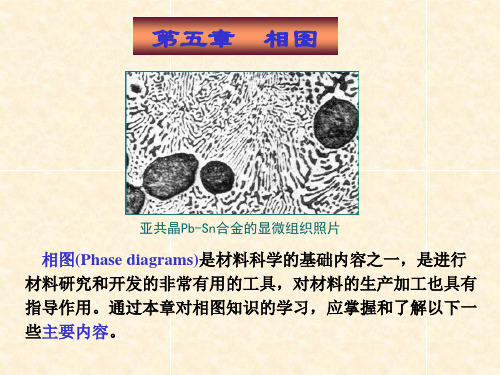
第五章 相图

材料科学基础材料科学基础-石德珂主编
第五章 材料的相结构及相图
电子浓度的定义是合金中各组成元素的价电子数总和与原子总数的比值 电子浓度的定义是合金中各组成元素的价电子数总和与原子总数的比值 ,记 作e/a e/a=VA(1-x)+VBx。 。 元素名称 Cu、Ag、Au 、 、 Be、Mg、Zn、Cd、Hg 、 、 、 、 Al、In、Ga 、 、 Sn、Si、Ge、Pb 、 、 、 As、Sb、Bi、P 、 、 、 Fe、Co、Ni 、 、 每个元素贡献的价电子 +1 +2 +3 +4 +5 0
性能:无论是置换固溶体还是间隙固溶体,均能引起固溶体的硬度、 性能:无论是置换固溶体还是间隙固溶体,均能引起固溶体的硬度、强度 硬度 升高。 升高。 对置换式固溶体,溶质原子与溶剂原子的尺寸差别越大, 对置换式固溶体,溶质原子与溶剂原子的尺寸差别越大,溶质原子的浓度 越高,其强化效果就越大。 越高,其强化效果就越大。这种由于溶质原子的固溶而引起的强化效应 , 称为固溶强化 称为固溶强化 。
材料科学基础材料科学基础-石德珂主编
第五章 材料的相结构及相图
3.陶瓷材料中的固溶方式 .
的方式溶入一些元素而形成固溶体, 无机非金属化合物也可以置换或间隙固溶 的方式溶入一些元素而形成固溶体,有些 甚至可以形成无限固溶体。 甚至可以形成无限固溶体。 如菱镁矿中的Mg 2+可以完全被 Fe 2+置换,形成如下系列矿物: 置换,形成如下系列矿物: 如菱镁矿中的 Mg[CO3]→(Mg, Fe) [CO3]→(Fe, Mg) [CO3 ]→Fe [CO3 ] 菱镁矿 含铁菱镁矿 含镁菱铁矿 菱铁矿
材料科学基础材料科学基础-石德珂主编
大学材料科学基础 第五章材料的相结构和相图(1)

弗兰克尔空位
肖脱基空位
2) 为了保持电中性,离子间数量不等的置换会 在晶体内部形成点缺陷。 如:2Ca2+→Zr4+ ,形成氧离子空缺。 3) 陶瓷化合物中存在变价离子,当其电价改变 时,也会在晶体中产生空位。 如:方铁矿中,部分Fe2+被氧化为Fe3+时, 2FeO+O → Fe2O3中,产生阳离子空缺。 同理,TiO2中,部分Ti4+被还原为Ti3+时,产 生阴离子空缺。 这种由于维持电中性而出现的空位,可以 当作电子空穴。欠缺或多出的电子具有一定的 自由活动性,因而降低了化合物的电阻。这种 现象在材料的电性能方面有重要意义。
3.陶瓷材料中的固溶方式
陶瓷材料——一般不具备金属特性,属无机非金属。 无机非金属化合物可以置换或间隙固溶的方式溶入其 它元素而形成固溶体,甚至无限固溶体,但是一般形 成有限固溶体。 如:Mg[CO3] → (Mg,Fe)[CO3] →(Fe,Mg)[CO3] →Fe[CO3] 菱镁矿 含铁菱镁矿 含镁菱铁矿 菱铁矿 不改变原来的晶格类型,晶格常数略有改变。
(3) 多为金属间或金属与类金属间的化合物, 以金属键为主,具有金属性,所以也称金属 间化合物。 (4) 晶体结构复杂。 (5) 在材料中是少数相,分布在固溶体基体 上,起到改善材料性能、强化基体的作用。 中间相可分为以下几类: 正常价化合物;电子化合物;间隙相;间隙 化合物;拓扑密堆相。
1. 正常价化合物 • 通常是由金属元素与周期表中第Ⅳ、Ⅴ、 Ⅵ族元素形成,它们具有严格的化合比, 成分固定不变,符合化合价规律,常具有 AB、AB2、A2B3分子式。 • 它的结构与相应分子式的离子化合物晶体 结构相同,如分子式具有AB型的正常价化 合物其晶体结构为NaCl型。正常价化合物 常见于陶瓷材料,多为离子化合物。如 Mg2Si、Mg2Pb、MgS、AuAl2等。 • 在合金材料中,起弥散强化的作用。
材料科学基础 第5章 相 图剖析

dG i dni i dni
由于 所以
dni dni
dG (i i )dni
在 相和 相处于平衡时,dG=0 ,故:
i i
即两相平衡的条件是两相中同一组元的化学 位相等。此时,在两相之间转移趋于平衡。 若多元系中有C个组元,P个相,则它们的相 平衡条件可以写成:
由热力学原理可知,当组元在不同相间转 移时,将引起体系自由能的变化。对于一个多 元系,这种自由能变化可用下式表示:
dG Vdp SdT
dn
i
i
在等温等压条件下,可简化为:
dG
dn
i
i
如果体系中只有 和 两相,当极少量(d n i)的 i 组元从 相转移到 相中,则B
Pb
10
20
30
40
50
60
70
80
90
500 400 tA 300 327.5℃ 231.9℃ M α +L 183℃ 19 α +β F Pb 10 20 30 40 50 60 70 80 90 G Sn E 61.9 L+β N β 97.5 L
200 α 100
tB
W W1 W2
2的质量 Wx W1 x1 体系中相 W21 x 体系中相 的质量 体系中物质的总质量 2
t1 t2 M R P Q
L1
L2 L E x x2 20 40 K S N B 100
由上两式可得:
体系中 相1 相 中 B2 组元的含量 B 中 组元的含量 B组元的含量
W1 (x x1 ) W2 (x 2 x)
1083
时间
Cu 0
30
由于 所以
dni dni
dG (i i )dni
在 相和 相处于平衡时,dG=0 ,故:
i i
即两相平衡的条件是两相中同一组元的化学 位相等。此时,在两相之间转移趋于平衡。 若多元系中有C个组元,P个相,则它们的相 平衡条件可以写成:
由热力学原理可知,当组元在不同相间转 移时,将引起体系自由能的变化。对于一个多 元系,这种自由能变化可用下式表示:
dG Vdp SdT
dn
i
i
在等温等压条件下,可简化为:
dG
dn
i
i
如果体系中只有 和 两相,当极少量(d n i)的 i 组元从 相转移到 相中,则B
Pb
10
20
30
40
50
60
70
80
90
500 400 tA 300 327.5℃ 231.9℃ M α +L 183℃ 19 α +β F Pb 10 20 30 40 50 60 70 80 90 G Sn E 61.9 L+β N β 97.5 L
200 α 100
tB
W W1 W2
2的质量 Wx W1 x1 体系中相 W21 x 体系中相 的质量 体系中物质的总质量 2
t1 t2 M R P Q
L1
L2 L E x x2 20 40 K S N B 100
由上两式可得:
体系中 相1 相 中 B2 组元的含量 B 中 组元的含量 B组元的含量
W1 (x x1 ) W2 (x 2 x)
1083
时间
Cu 0
30
材料科学基础第5章 材料的相结构与相图 ppt课件[1]
![材料科学基础第5章 材料的相结构与相图 ppt课件[1]](https://img.taocdn.com/s3/m/534d1746700abb68a882fb0c.png)
一、纯金属特点
1、优良的导电、导热性能; 2、高的化学稳定性; 3、美观的金属光泽; 4、但强度、硬度较低; 5、制取困难;价格高;资源有限
2020/10/28
4
二、合金的基本概念
1、定义
是由两种或两种以上金属元素, 或金属元素与非金属元素,经熔 炼、烧结等方法组合而成并具有 金属特性的物质。
2020/10/28
5
钢:Fe-C合金;
黄铜:Cu-Zn合金; 黄铜 防锈铝:Al-Mg合金。
2、合金的特点 Al-Cu两相合金 强度高、硬度高;性能可大幅 度调节;价格较低、应用广。
2020/10/28
6
3、相
是合金中具有晶体结构相同、 成分相同和性能相同,并以界 面相互分开的组成部分。
2020/10/28
7
纯铁:由α-Fe(铁素体相) 单相构成,为单相合金;
3、作用:为合金的强化相。
2020/10/28
28
(二)金属间化合物
1、定义
合金结晶时,当其溶质浓度大 于溶解度时,将析出结构不同于任 何组元的新相,该相具有一定的金 属特征,称为金属间化合物。
2020/10/28
29
3、分类:
正常价化合物、电子化合物 、 间隙相和间隙化合物 。
1)正常价化合物
P(珠光体)= F + Fe3C Fe3C形状:片状和球状。
2020/10/28
12
❖ 当Fe3C为片状 时,构成P片状
❖ HB≈200 ❖ δ=15% ❖ Ψ=30%
2020/10/28
珠光体
13
当Fe3C为球状 时,构成P球状
HBS≈163 δ=20% Ψ=40%
2020/10/28
《材料科学基础》课件——第五章相平衡与相图第一节第二节第三节第四节

相和相平衡
Байду номын сангаас四、自由度与相律
1、自由度:平衡系统中独立可变的因素
自由度数:独立可变的强度变量的最大数目
(强度变量与广度变量的区别)
2、相律:自然规律
在平衡系统中由于受平衡条件的制约,系统内
存在的相数有一定限制。 组元数 相数P≥1
吉布斯相律:不可为负数
f=c-p+n
外界影 响因素
通常外界影响因素只考虑T、P,所以f=c-p+2
• 掌握匀晶,包晶,共晶相图的特点,进而了解二元合金的一些平衡凝固,固 相转变的规律。
• 重点难点: • 二元系相图的建立,杠杆定律 • 包晶相图,共晶相图,共晶合金 • 相图分析,各种液固,固相转变的判断
材料的性能决定于内部的组织结构,而组织结构
又由基本的相所组成。
相:均匀而具有物理特性的部分,并和体系的其他 部分有明显界面。
晶型转变过程都是在恒温下进行,并伴随有体 积、密度的变化。 2、SiO2系统相图 α-石英与β-石英相变相当慢, β-石英常因冷却过快而被保留 到室温,在常压下,低于573℃
单元系相图
β-石英很稳定,所以自然界或低温时最常见的是 β-石英。晶型转变时,体积效应特别显著。 Al2O3、ZrO2也具有多晶型转变。 3、聚合物相图 (1)状态由分子间作用力决定,分子间约束力弱
共晶相图,平衡凝固,共晶合金,包晶相图,形成化合物的相图,含有双液 共存区的相图,熔晶相图等 ,二元相图的几何规律 ,单相,双相及三相共 存区,相图特征 ,二元系相图的分析,分析的方法与步骤,分析举例。
• 教学目的: • 学习相平衡与相图的基本知识,了解相图在材料科学学习中的重要性,学会
相图的使用。
第五章材料相结构和相图

材料科学基础材料的相结构固溶体中间相置换固溶体间隙固溶体正常价化合物电子化合物尺寸因素化合物间隙化合物置换固溶体间隙固溶体有限固溶体无限固溶体无序固溶体有序固溶体间隙相间隙化合物理解重点理解重点影响置换固溶体溶解度的因素陶瓷与金属固溶体的差别中间相和固溶体的区间隙固溶体间隙相间隙化合物的区别典型材料的相结构的辨别材料科学基础陶瓷与金属固溶体的差别形成弗兰克尔空位的可能性较小形成肖脱基空位时移出的正负离子总电价为零
一般认为热力学上平衡状态的无序固溶体溶质原子 分布在宏观上是均匀的,在微观上是不均匀的。
在一定条件下,溶质原子和溶剂原子在整个晶体中按 一定的顺序排列起来,形成有序固溶体。有序固溶体 中溶质原子和溶剂原子之比是固定的,可以用化学分 子式来表示,因此把有序固溶体结构称为超点阵。
例如:在Cu-Al合金中,Cu:Al原子比是1:1或3:1 时从液态缓冷条件下可形成有序的超点阵结构,用 CuAl或Cu3Al来表示。
HRTEM for Ni precipitate in 8YSZ/Ni Nanocomposites
size of precipitated Ni nanoparticle ~ 20 nm
pore Ni
10 nm
Ni nanoparticle and accompanied nano-pore in 8YSZ/0.6 vol%Ni Nanocomposite
中间相分类:正常价化合物、电子化合物(电子 相)、间隙化合物
材料科学基础
1. 材料的相结构
材料的 相结构
固溶体
置换固溶体 间隙固溶体 正常价化合物
中间相
电子化合物 尺寸因素化合物
间隙化合物 拉弗斯相
2.1 正常价化合物
材料科学基础
一般认为热力学上平衡状态的无序固溶体溶质原子 分布在宏观上是均匀的,在微观上是不均匀的。
在一定条件下,溶质原子和溶剂原子在整个晶体中按 一定的顺序排列起来,形成有序固溶体。有序固溶体 中溶质原子和溶剂原子之比是固定的,可以用化学分 子式来表示,因此把有序固溶体结构称为超点阵。
例如:在Cu-Al合金中,Cu:Al原子比是1:1或3:1 时从液态缓冷条件下可形成有序的超点阵结构,用 CuAl或Cu3Al来表示。
HRTEM for Ni precipitate in 8YSZ/Ni Nanocomposites
size of precipitated Ni nanoparticle ~ 20 nm
pore Ni
10 nm
Ni nanoparticle and accompanied nano-pore in 8YSZ/0.6 vol%Ni Nanocomposite
中间相分类:正常价化合物、电子化合物(电子 相)、间隙化合物
材料科学基础
1. 材料的相结构
材料的 相结构
固溶体
置换固溶体 间隙固溶体 正常价化合物
中间相
电子化合物 尺寸因素化合物
间隙化合物 拉弗斯相
2.1 正常价化合物
材料科学基础
材料科学基础I 第五章 (相图)
F = 0的含义是:在保持系统平衡状态不变的条件下,没有可以 的含义是:在保持系统平衡状态不变的条件下, 的含义是 独立变化的变量。 独立变化的变量。即,任何变量的变化都会造成系统平衡状态 的变化。 的变化。
纯水的PT相图: 纯水的 相图:在a点,水在 相图 点 水在1 大气压、 ℃ 条件下 保持液(水 条件下, 大气压、(0℃)条件下,保持液 水) –固(冰)二相平衡。温度升高,冰 二相平衡。 固 冰 二相平衡 温度升高, 溶化成水;温度降低, 溶化成水;温度降低,水结晶成 也就是说,此时水的液-固平 冰。也就是说,此时水的液 固平 衡转变是在恒温(0℃ 下进行的 下进行的。 衡转变是在恒温 ℃)下进行的。 b点是气 液二相平衡点,意义与 点是气–液二相平衡点 点是气 液二相平衡点,意义与a 点相似。 之间(0℃ 点相似。在a、b之间 ℃~100℃), 、 之间 ℃, 水是单一的液相(P =1),此时F =1, 水是单一的液相 ,此时 , 这说明在此范围内温度的变化不 会引起状态的改变。 会引起状态的改变。
二、相图的建立
建立相图的方法有两种: 建立相图的方法有两种: 利用已有的热力学参数,通过热力学计算和分析建立相图; 利用已有的热力学参数,通过热力学计算和分析建立相图; 依靠实验的方法建立相图。 依靠实验的方法建立相图。 目前计算法还在发展之中,实际使用的相图都是实验法建立的。 目前计算法还在发展之中,实际使用的相图都是实验法建立的。 实验法建立相图的原理和步骤: 实验法建立相图的原理和步骤: 二元合金相图的建立为例。 以A-B二元合金相图的建立为例。 二元合金相图的建立为例 首先, 首先,将A-B二元合金系分成 二元合金系分成 若干种不同成分的合金。 若干种不同成分的合金。 1) 合金成分间隔越小,合金数目 合金成分间隔越小, 越多,测得的相图越精确; 越多,测得的相图越精确; 2) 合金成分间隔不需要相等。 合金成分间隔不需要相等。
材料科学基础-第五章 材料的相结构及相图

相律在相图中的应用
C
2 二元系
P 1 2
3 1
f 2 1 0
3 2 1 0
含义
单相合金,成分和温度都可变 两相平衡,成分、相对量和温度 等因素中只有一个独立变量 三相平衡,三相的成分、相对 量及温度都确定 单相合金其中两个组元的含量 及温度三个因素均可变 两相平衡,两相的成分、数量 及温度中有两个独立变量 三相平衡,所有变量中只有 一个是独立变量 四相平衡所有因素都确定不变
结构简单的具有极高的硬度及熔点,是合金工具钢和硬 质合金的重要组成相。
I. 间隙化合物
间隙化合物和间隙固溶体的异同点
相同点: 非金属原子以间隙的方式进入晶格。
不同点: 间隙化合物:间隙化合物中的金属组元大多与自 身原来的结构类型不同 间隙固溶体:间隙固溶体中的金属组元仍保持自 身的晶格结构
I. 尺寸因素
II. 晶体结构因素 组元间晶体结构相同时,固溶度一般都较大,而且有可 能形成无限固溶体。若不同只能形成有限固溶体。
III. 电负性差因素
两元素间电负性差越小,越易形成固溶体,且形成的 固溶体的溶解度越大;随两元素间电负性差增大,固 溶度减小。
1)电负性差值ΔX<0.4~0.5时,有利于形成固溶体 2)ΔX>0.4~0.5,倾向于形成稳定的化合物
Mg2Si
Mg—Si相图
(2)电子化合物
由ⅠB族或过渡金属元素与ⅡB,ⅢB,ⅣB族元素 形成的金属化合物。 不遵守化合价规律,晶格类型随化合物电子浓度 而变化。 电子浓度为3/2时: 呈体心立方结构(b相); 电子浓度为21/13时:呈复杂立方结构(g相); 电子浓度为21/12时。呈密排六方结构(e相);
NaCl型 CaF2型 闪锌矿型 硫锌矿型 (面心立方) (面心立方) (立方ZnS) (六方ZnS)
