马来酸氯苯那敏注射液
一种马来酸氯苯那敏注射液有关物质的高效液相检测方法[发明专利]
![一种马来酸氯苯那敏注射液有关物质的高效液相检测方法[发明专利]](https://img.taocdn.com/s3/m/c5549a4e26284b73f242336c1eb91a37f11132e0.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011426282.3(22)申请日 2020.12.09(71)申请人 南京斯泰尔医药科技有限公司地址 210000 江苏省南京市栖霞区仙林街道纬地路9号29幢111、113室(72)发明人 唐晶晶 (51)Int.Cl.G01N 30/02(2006.01)G01N 30/06(2006.01)G01N 30/34(2006.01)(54)发明名称一种马来酸氯苯那敏注射液有关物质的高效液相检测方法(57)摘要本发明公开了一种马来酸氯苯那敏注射液有关物质的检测方法,它包括以下步骤:分析溶液的制备、色谱条件、上机检测。
目前关于马来酸氯苯那敏注射液有关物质研究的检测方法不能有效分离杂质。
本方法能够有效的测定马来酸氯苯那敏中各种相关杂质存在,能实现色谱图中氯苯那敏峰与杂质峰的分离。
该检测方法具有高准确度、高灵敏度、节约成本等优点,能确保对产品质量的有效控制。
权利要求书1页 说明书4页CN 112526025 A 2021.03.19C N 112526025A1.一种对马来酸氯苯那敏注射液有关物质进行检测的高效液相色谱法,其特征在于,包括下列步骤:配置分析溶液;色谱条件;上机检测。
2.根据权利要求1所述的高效液相检测方法,其特征在于,步骤①配置样品分析溶液具体方法:用流动相(磷酸盐溶液‑乙腈)溶解样品,制成分析溶液;步骤②色谱条件中,设定高效液相流速为0.9‑1.3ml/min;柱温为25‑40℃,采用检测波长为200‑260nm紫外检测器。
3.根据权利要求1所述的色谱条件,其特征在于,所述色谱柱选自十八烷基硅烷键合硅胶色谱柱。
4.根据权利要求3所述的高效液相检测方法,其特征在于,所述色谱柱的规格为:柱长为150‑250mm,色谱柱内径为1‑10mm,粒径为1‑10µm。
5.根据权利要求4所述的高效液相检测方法,其特征在于,所述色谱柱的规格为:柱长为150mm,色谱柱内径4.6mm,粒径为5µm。
马来酸氯苯那敏BP2015翻译

Chlorphenamine Maleate马来酸氯苯那敏General Notices总体概述(Ph. Eur. monograph 0386)C20H23ClN2O4 390.9 113-92-8Action and use使用及用途Histamine H1 receptor antagonist; antihistamine.组胺H1受体拮抗剂;抗组胺药。
Preparations制剂Chlorphenamine Injection马来酸氯苯那敏注射液Chlorphenamine Oral Solution马来酸氯苯那敏口服溶液Chlorphenamine Tablets马来酸氯苯那敏片Ph EurDEFINITION定义(3RS)-3-(4-Chlorophenyl)-N,N-dimethyl-3-(pyridin-2-yl)propan-1-amine hydrogen (Z)- butenedioate.(3RS)-3-(4-氯苯基)-N,N-二甲基-3 -(2-吡啶基)丙烷-1-胺氢(Z)—butenedioate。
Content含量98.0 per cent to 101.0 per cent (dried substance).98.0~101.0%(按干燥品计算)CHARACTERS性状Appearance外观White or almost white, crystalline powder.白色或类白色结晶性粉末Solubility溶解度Freely soluble in water, soluble in ethanol (96 per cent).易溶于水,溶于乙醇(96.0%)IDENTIFICATION鉴别A. Melting point (2.2.14): 130 °C to 135 °C.熔点(2.2.14)130℃-135℃B. Infrared absorption spectrophotometry (2.2.24).Comparison chlorphenamine maleate CRS. 红外光吸收光谱(2.2.24)与马来酸氯苯那敏的对照品一致C. Optical rotation (see Tests).旋光度(见测试)TESTS测试Solution S溶液澄清度与颜色(溶液S)Dissolve 2.0 g in water R and dilute to 20.0 mL with the same solvent.取供试品2.0g,置于20ml容量瓶中,用水溶解并稀释至刻度。
马来酸氯苯那敏

1、取本品约10mg,加枸椽酸醋酐试液1mL,置水浴上加热,即显红紫色。 2、取本品约20mg,加稀硫酸1mL,滴加高锰酸钾试液,红色即消失。 3、本品的红外光吸收图谱应与对照的图谱(光谱集61图)一致。
酸度 取本品0.1g,加水10mL溶解后,依法测定(附录Ⅵ H),pH值应为4.0 ~5.0。 有关物质 照高效液相色谱法(通则0512)测定。 溶剂:流动相A-乙腈(80:20)。 供试品溶液:取本品,加溶剂溶解并稀释制成每1mL中含1mg的溶液。 对照溶液:精密量取供试品溶液适量,用溶剂定量稀释制成每1mL中含3µg的溶液。 色谱条件:用十八烷基硅烷键合硅胶为填充剂,流动相A为磷酸盐缓冲液(取磷酸二氢铵11.5g,加水适量使 溶解,加磷酸1mL,用水稀释至1000mL),流动相B为乙腈,按下表进行梯度洗脱,流速为每分钟1.2mL,检测波 长为225nm,进样体积10µL。 系统适用性要求:氯苯那敏峰保留时间约为23分钟,氯苯那敏峰与相邻峰之间的分离度应符合要求。 测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
药典信息
基本信息 性状
鉴别 检查
含量测定 类别
贮藏 制剂
本品为2-[对-氯-α-[2-(二甲氨基)乙基]苯基]吡啶马来酸盐,按干燥品计算,含C16H19ClN2·C4H4O4不得 少于98.5%。
本品为白色结晶性粉末,无臭。 本品在水或乙醇或三氯甲烷中易溶,在乙醚中微溶。 熔点 本品的熔点(通则0612)为131.5~135°C。
3、老人对常用剂量的反应较敏感,应注意减量。 4、下列情况应慎用:膀胱颈部梗阻、幽门十二指肠梗阻、消化性溃疡所致幽门狭窄、心血管疾病、青光眼 (或有青光眼倾向者)、高血压、高血压危象、甲状腺功能亢进、前列腺肥大症状明显时。 5、本药不宜与哌乙啶、阿托品等药合用,亦不宜与氨茶碱混合注射。 6、驾驶员、高空作业人员、机械操作者及参赛前的运动员不宜服用该药。 7、肝功能不良者不宜长期使用本药。 8、如服用本品过量或出现严重不良反应请立即就医。抢救中毒病人切忌用组织胺注射解毒。
马来酸氯苯那敏的功能主治

马来酸氯苯那敏的功能主治简介马来酸氯苯那敏是一种广泛使用的抗过敏药物,常用于缓解过敏反应引起的症状。
它属于第一代抗组胺药物,具有镇静和抗胆碱能的作用。
马来酸氯苯那敏可以用于治疗多种不同类型的过敏反应,常见的功能主治包括解痒、抗过敏、止咳止痛等。
功能主治以下是马来酸氯苯那敏的主要功能主治:1. 缓解过敏症状马来酸氯苯那敏对过敏反应引起的症状具有明显的缓解作用。
它能够抑制组胺的释放,减少过敏反应中的组胺介导的症状,如鼻塞、打喷嚏、肌肉痉挛等。
此外,马来酸氯苯那敏也可以减少过敏反应引起的皮肤瘙痒和红肿等症状。
2. 抗过敏作用除了缓解症状外,马来酸氯苯那敏还具有抗过敏作用。
它可以通过阻断组胺受体来减轻过敏反应,降低过敏原对机体的敏感性。
马来酸氯苯那敏还能够抑制肥大细胞释放其他炎症介质,从而减少过敏反应的发生。
3. 止咳止痛马来酸氯苯那敏对咳嗽和疼痛具有一定的镇静作用。
它可以抑制咳嗽中枢,减少咳嗽的频率和强度。
此外,马来酸氯苯那敏还可以减少痛觉过敏,减轻疼痛感。
4. 解痒马来酸氯苯那敏具有良好的抗瘙痒作用。
它可以减少组胺引起的皮肤瘙痒和炎症反应,缓解瘙痒感。
5. 镇静作用马来酸氯苯那敏具有一定的镇静作用。
它能够通过中枢抑制神经系统的兴奋,减少症状对人体的影响,使人感到镇静和放松。
6. 抗呕吐马来酸氯苯那敏还具有一定的抗呕吐作用。
它能够抑制中枢神经系统的呕吐中枢,减少呕吐的发生。
使用注意事项马来酸氯苯那敏虽然具有多种功能主治,但使用时需要注意以下事项:•避免与酒精或镇静剂一起使用,可能增加其镇静作用。
•不推荐用于儿童,特别是年龄小于2岁的儿童。
•长期或大剂量使用可能引起依赖性。
•对驾驶机动车或操作机器的能力有一定影响,使用时需谨慎。
•孕妇、哺乳期妇女和老年人应在医生指导下使用。
总的来说,马来酸氯苯那敏是一种常用的抗过敏药物,具有缓解过敏症状、抗过敏、止咳止痛、解痒、镇静和抗呕吐等多种功能主治。
在使用时需根据医生的建议,注意使用注意事项,以避免不良反应和药物依赖的发生。
马来酸氯苯那敏注射液BP2015翻译

Chlorphenamine Injection马来酸氯苯那敏注射液General Notices总体概述Action and use使用及用途Histamine H1 receptor antagonist; antihistamine.组胺H1受体拮抗剂;抗组胺药。
DEFINITION定义Chlorphenamine Injection is a sterile solution of Chlorphenamine Maleate in Water for Injections free from dissolved air.马来酸氯苯那敏注射液为马来酸氯苯那敏的灭菌水溶液。
The injection complies with the requirements stated under Parenteral Preparations and with the following requirements.此注射液符合注射用制剂通则的规定,并符合以下要求。
Content of chlorphenamine maleate, C16H19ClN2,C4H4O4马来酸氯苯那敏的含量90.0 to 110.0% of the stated amount.标示量的90.0-110.0%CHARACTERISTICS性状A colourless solution.无色溶液IDENTIFICATION鉴别Carry out the method for thin-layer chromatography, Appendix III A, using silica gel GF254 as the coating substance and a mixture of 20 volumes of 1M acetic acid , 30 volumes of methanol and 50 volumes of ethyl acetate as the mobile phase. Heat the plate at 105° for 30 minutes before use. Ap ply separately to the plate 2 μL of each of the following solutions. For solution (1) evaporate an appropriate volume to dryness in a current of nitrogen using the minimum amount of heat, dissolve the residue as completely as possible in sufficient chloroform to produce a solution containing 0.5% w/v of Chlorphenamine Maleate and centrifuge. Solution (2) contains 0.5% w/v of chlorphenamine maleate BPCRS in chloroform. After removal of the plate, allow it to dry in air and examine under ultraviolet light (254 nm). The two principal spots in the chromatogram obtained with solution (1) correspond to those in the chromatogram obtained with solution (2). Spray the plate with dilute potassium iodobismuthate solution. The principal spot in the chromatogram obtained with solution (1) corresponds to that in the chromatogram obtained with solution (2).使用薄层色谱方法,参看附件III A,采用硅胶GF254为涂层物质和1M乙酸-甲醇-乙酸乙酯(20:30:50)的混合物为流动相。
11马来酸氯苯那敏注射液工艺规程分则
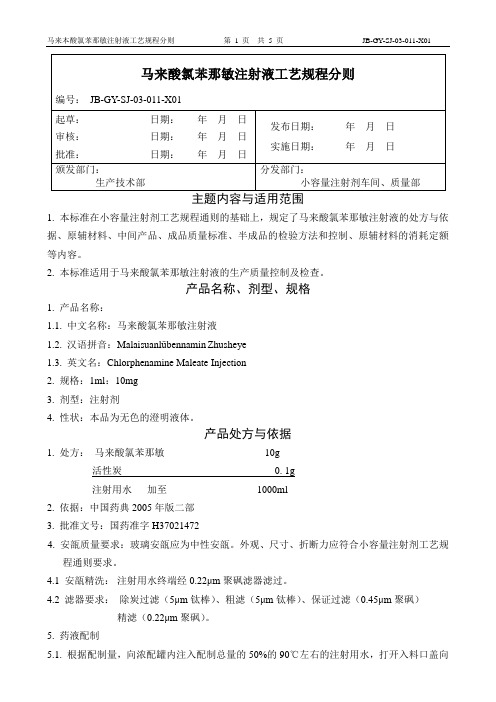
主题内容与适用范围1. 本标准在小容量注射剂工艺规程通则的基础上,规定了马来酸氯苯那敏注射液的处方与依据、原辅材料、中间产品、成品质量标准、半成品的检验方法和控制、原辅材料的消耗定额等内容。
2. 本标准适用于马来酸氯苯那敏注射液的生产质量控制及检查。
产品名称、剂型、规格1. 产品名称:1.1. 中文名称:马来酸氯苯那敏注射液1.2. 汉语拼音:Malaisuanlübennamin Zhusheye1.3. 英文名:Chlorphenamine Maleate Injection2. 规格:1ml:10mg3. 剂型:注射剂4. 性状:本品为无色的澄明液体。
产品处方与依据1. 处方:马来酸氯苯那敏10g活性炭0. 1g注射用水加至1000ml2. 依据:中国药典2005年版二部3. 批准文号:国药准字H370214724. 安瓿质量要求:玻璃安瓿应为中性安瓿。
外观、尺寸、折断力应符合小容量注射剂工艺规程通则要求。
4.1 安瓿精洗:注射用水终端经0.22μm聚砜滤器滤过。
4.2 滤器要求:除炭过滤(5μm钛棒)、粗滤(5μm钛棒)、保证过滤(0.45μm聚砜)精滤(0.22μm聚砜)。
5. 药液配制5.1. 根据配制量,向浓配罐内注入配制总量的50%的90℃左右的注射用水,打开入料口盖向上反放稳妥。
5.2. 启动搅拌电源开关进行搅拌,边搅拌边将称好的马来酸氯苯那敏缓慢加入浓配罐中溶解,加入称量溶解好的活性炭.把盛放原料的不锈钢桶用注射用水冲洗两遍,冲洗水倒入罐内5.3. 投完料关闭机械搅拌,用洁净工具在投料罐之处手工搅拌5分钟(防止浓配罐底原料堆积结块),启动机械搅拌,转入机械自动搅拌。
5.4. 关闭机械搅拌,关紧所需进料的稀配罐底出料口阀门,打开进料口阀门,打开浓配罐底放料口阀门。
5.5. 启动浓配输液泵,将浓配液送入稀配罐中,药液全部进入稀罐时关闭输液泵。
5.6. 向清洗球内通入注射用水冲洗浓配罐内壁的残存药液,关闭冲洗水,再打开输送阀将冲洗水打入稀配罐,关闭输送泵。
马来酸氯苯那敏 - Drug Future药物在线 首页
马来酸氯苯那敏
Malaisuan Lubennamin
Chlorphenamine Maleate
0. l m o l / L 盐 酸 溶 液 5 0 0 m l 为 溶 出 介 质 , 转 速 为 每 分 钟 5 0 转 , 依法操作,经 20 分钟时,取溶液 10ml, 滤过,取续滤液作为供 试品溶液(规格 7. 5 m g ) 或 精 密 量 取 续 滤 液 适 量 , 用 溶 出 介 质 定量稀释制成每lml中含咪达唑仑15fig的溶液,作为供试品 溶 液 ( 规 格 1 5 m g ) ; 照 紫 外 - 可 见 光 光 度 法 ( 附 录 I V A) ,在 258nm 的波长处测定吸光度;另取马来酸咪达唑仑对照品,精 密称定,加溶出介质溶解并定量稀释制成每lml中约含18^g 的溶液,同法测定,计算每片的溶出量,将结果乘以 0.7950 , BP 为C18H,3C1FN3的溶出量。限度为标示量的85%,应符合 规定。 其他应符合片项下有关的各项规定(附录I A)。 【含量测定】照高效液相色谱法(附录V D)测定 色谱条件与系统适用性试验用十八烷基硅烷键合硅胶 为填充剂;以磷酸盐缓冲液(取同体积的 0. l m o l / L 磷 酸 溶 液 与0. 03mol/L三乙胺溶液混合,用0. l m o l / L 氢 氧 化 钠 溶 液 调 节 混 合 液 的 p H 值 至 3 . 5)-甲醇(35 : 65) 为流动相;检测波 长为 220nm; 柱温为 40° (:。取马来酸咪达唑仑对照品与 N- 脱 垸基氟西泮杂质对照品各适量,加流动相溶解并稀释制成每 lml中含咪达唑仑与JV-脱垸基氟西泮各l(Vg的溶液,作为系 统适用性试验溶液,取 lOfxl ,注人液相色谱仪,记录色谱图,咪 达 唑 仑 与 W - 脱 烷 基 氟 西 泮 峰 的 分 离 度 应 大 于 3 . 0。 测定法取本品20片,精密称定,研细,精密称取适量 (约相当于咪达唑仑lOmg),置100ml量瓶中,加流动相超声 处理使马来酸咪达唑仑溶解后,用流动相稀释至刻度,摇匀, 滤过,精密量取续滤液,注人液相色谱仪,记录色谱图;另 精密称取马来酸咪达唑仑对照品,精密称定,加流动相溶解并 定量稀释制成每lml中约含0.12mg的溶液,同法测定。按 外 标 法 以 咪 达 唑 仑 峰 面 积 计 算 , 将 结 果 乘 以 0 . 7950 ,即为 C 18 H13C1FN3的含量。 【类别】同咪达唑仑。 【规格】按C18H】3C1FN3计 【贮藏】 遮光,密封保存。 (1)7. 5mg (2)15mg C 1 6 H 1 9 C1N 2 . C, H 4 0 4 390. 87
反相高效液相色谱法测定马来酸氯苯那敏注射液中马来酸氯苯那敏的含量
反相高效液相色谱法测定马来酸氯苯那敏注射液中马来酸氯苯那敏的含量目的建立反相高效液相色谱法测定马来酸氯苯那敏注射液的含量。
方法选用Xterra RP18色谱柱(4.6mm×250mm,5μm),乙腈-0.02 mol/L磷酸二氢钾(35︰65)为流动相,流速为1.0mL/min,检测波长为225 nm,柱温30℃。
结果马来酸氯苯那敏的浓度在13.16~105.28μg/mL范围内线性关系良好(r=0.9999,n=5),平均回收率为101.0%,RSD值为0.64%(n=6)。
结论本方法操作简便、准确、重复性好,可用于马来酸氯苯那敏注射液的质量控制。
标签:马来酸氯苯那敏注射液;反相高效液相色谱法;含量测定;质量控制马来酸氯苯那敏是抗组胺药,能选择性地阻断H1受体、拮抗组胺的作用而产生抗组胺效应,抗组胺药是治疗过敏性及瘙痒性皮肤疾病中应用最广的药物[1]。
《中华人民共和国药典》2010年版二部中收载有片剂、注射剂和滴丸剂,采用HPLC法测定马来酸氯苯那敏的含量,出峰顺序依次为马来酸与氯苯那敏;魏丽萍等[2]报道马来酸氯苯那敏在流动相中解离为马来酸和氯苯那敏,而马来酸为不饱和烯酸,极性较强,在ODS色谱柱上保留时间较短而先出峰,氯苯那敏为有机碱,极性相对较弱,因此保留时间较长而后出峰[3-4],在反相色谱柱中保留效果不理想。
本文采用改进的含量测定方法,出峰时间较合适,分离效果较好,操作简便、快速,可用于该注射液的含量测定[5-6]。
1仪器与试药美国Waters公司的高效液相色谱仪包括:2487双波长检测器、1525二元高压梯度泵、717自动进样器。
UV-2401PC紫外分光光度计(日本岛津公司);KS-80D 型超声清洗机(产地:宁波海曙科生超声设备有限公司);XW-80A旋涡混合器(产地:上海医科大学仪器厂);FA1004B分析天平(上海精密科学仪器有限公司)。
马来酸氯苯那敏化学对照品(中国药品生物制品检定所,批号:100047-200606,纯度:99.7%);马来酸氯苯那敏注射液(徐州莱恩药业有限公司,批号分别为:1112011、1201282、1202091,规格:1mL:10mg),乙腈(上海展云化工有限公司,色谱纯),所用辅料均为药用辅料,磷酸二氢钾为分析纯,水为纯化水。
马来酸氯苯那敏配合地塞米松治疗眩晕症疗效观察
马来酸氯苯那敏配合地塞米松治疗眩晕症疗效观察作者:甘立森陈北森来源:《中国保健营养·中旬刊》2013年第06期【摘要】目的:观察马来酸氯苯那敏配合地塞米松治疗眩晕症的临床疗效。
方法:将我院住院以及门急诊的60例眩晕症患者随机分为治疗组(30例),采用马来酸氯苯那敏配合地塞米松治疗,对照组(30例)采用甲磺酸倍他司汀片治疗,观察其临床疗效并进行随访。
结果:经过统计两组患者治疗效果,治疗组治疗效果明显优于对照组,P【关键词】马来酸氯苯那敏;地塞米松;眩晕症【中图分类号】R758.23 【文献标识码】A 【文章编号】1004-7484(2013)06-0269-02眩晕症主要的临床症状是视物旋转,并且伴有恶心、呕吐、不能睁眼、不能起床走动的症状,是门急诊以及病房非常常见的病症。
2011年12月至2013年3月本院采用马来酸氯苯那敏配合地塞米松治疗眩晕症,治疗效果满意,现报道如下。
1资料与方法1.1资料所有病例资料来自本院门、急诊以及住院患者,总共60例,按照随机数字表分为治疗组30例,其中治疗男性17例,女性13例;年龄45.2±12.6岁,病程3.6±14.1年。
对照组患者30例,其中男性患者14例,女性患者16例;年龄47.5±11.7岁;病程4.2±10.2年。
治疗组与对照组病例治疗对比(P>0.05),差异无统计学意义,具有可比性。
1.2治疗方法治疗组患者马来酸氯苯那敏注射液10mg,静脉注射,Qd,地塞米松注射液5mg静脉注射,Qd。
对照组口服甲磺酸倍他司汀片6mg,Tid,饭后服用。
1.3疗效判断标准:①治愈:患者眩晕症状完全消失,未发作。
②显效:恶心、呕吐、视物旋转等眩晕症状较治疗前明显减轻,可以睁开眼睛、下床走动。
③好转:恶心、呕吐、视物旋转、等眩晕症状有所减轻,但不能下床走动。
○4无效:眩晕症的各项临床症状无改善或者是症状加重。
马来酸氯苯那敏联合维生素B12穴位注射治疗过敏性皮炎的效果
者使用马来酸氯苯那敏联合维生素 B12 注射液穴位注射进行治疗袁对照组患者使用扑尔敏注射液联合维生素 B12 注射液肌肉注射进行治疗遥 比较两组患者的临床疗效遥 结果 观察组患者用药 1尧3尧7 d 后的病情好转率高于对照
组袁治疗总有效率高于对照组袁且患者出院后 10尧30尧60 d 后的复发率低于对照组袁差异有统计学意义渊P<0.05冤遥 结
LIU Y u-ping1 ZHA NG Ling1 SHEN Jin-di2 1. Department of Pharmacy, Dermatology Prevention in Ruijin City, Jiangxi Province, Ruijin 342500, China; 2. De鄄 partment of Obstetrics and Gynecology, Maternal and Child Health Care Hospital in Ruijin City, Jiangxi Province, Rui鄄 jin 342500, China [Abstract] Objective To analyze the clinical efficacy of Chlorphenamine Maleate combined with acupuncture point in鄄 jection therapy of Vitamin B12 Injection in the treatment of allergic dermatitis. Methods Sixty-two patients with allergic dermatitis who came to our hospital from April 2017 to October 2017 were selected as subjects and divided into two groups according to the treatment method, 31 cases in each group. Patients in the observation group were treated with Chlorpheniramine Maleate combined with acupuncture point injection therapy of Vitamin B12 Injection, the patients in the control group were treated with intramuscular injection therapy of Chlorpheniramine Injection combined with Vita鄄 min B12 Injection. Clinical efficacy was compared between the two groups. Results In the observation group, the im鄄 provement rate of the patients忆 condition were higher than that of the control group after one day, three days, and seven days, the total treatment efficiency were higher than that of the control group, after the patient was discharged from the hospital, the recurrence rate in the observation group were lower than the control group after 10 days, 30 days, and 60 days, the differences were statistically significant (P<0.05). Conclusion The efficacy of Chlorphenamine Maleate com鄄 bined with acupuncture point injection of Vitamin B12 Injection in the treatment of allergic dermatitis is significant, it has a low recurrence rate, is worth promoting and applying. [Key words] Allergic dermatitis; Chlorpheniramine Maleate; Vitamin B12; Acupuncture point injection
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【药品名称】通用名称:马来酸氯苯那敏注射液英文名称:Chlorphenamine Maleate Injection汉语拼音:Malaisuan Lübennamin Zhusheye【成份】本品主要成份为马来酸氯苯那敏,化学名称:2-[对-氯-α-[2-(二甲氨基)乙基]苯基]吡啶马来酸盐。
化学结构式:分子式:C16H19ClN2·C4H4O4分子量:390.87辅料为:注射用水。
【性状】本品为无色的澄明液体。
【适应症】马来酸氯苯那敏可治疗过敏性鼻炎:对过敏性鼻炎和上呼吸道感染引起的鼻充血有效,可用于感冒或鼻窦炎;皮肤粘膜的过敏:对荨麻疹、枯草热、血管运动性鼻炎均有效,并能缓解虫咬所致皮肤瘙痒和水肿;也可用于控制药疹和接触性皮炎,但同时必须停用或避免接触致敏药物。
当症状急、重时可应用注射液。
【规格】1ml:10mg【用法用量】成人:肌内注射,一次5~20mg。
【不良反应】嗜睡、疲劳、乏力、口鼻咽喉干燥、痰液粘稠,可引起注射部位局部刺激和一过性低血压,少见皮肤瘀斑、出血倾向。
【禁忌】尚不明确。
【注意事项】1、对其它抗组胺药或下列药物过敏者,也可能对本药过敏,如麻黄碱、肾上腺素、异丙肾上腺素、间羟异丙肾上腺素(羟喘)、去甲肾上腺素等拟交感神经药。
对碘过敏者对本品可能也过敏。
2、下列情况慎用:膀胱颈部梗阻、幽门十二指肠梗阻、消化性溃疡所致幽门狭窄、心血管疾病、青光眼(或有青光眼倾向者)、高血压、高血压危象、甲状腺机能亢进、前列腺肥大体征明显时。
3、本品不可应用于下呼吸道感染和哮喘发作的患者(因可使痰液变稠而加重疾病)。
4、用药期间,不得驾驶车、船或操作危险的机器。
【孕妇及哺乳期妇女用药】小量氯苯那敏可由乳汁中排出;由于本品的抗M胆碱受体作用,泌乳可能受到抑制,哺乳期妇女不宜使用。
【儿童用药】新生儿、早产儿不宜用。
【老年用药】老年人对常用剂量的反应较敏感,应注意适当减量。
【药物相互作用】1、同时饮酒或服用中枢神经抑制药,可使抗组胺药效增强。
2、本品可增强金刚烷胺、抗胆碱药、氟哌啶醇、吩噻嗪类以及拟交感神经药等的作用。
3、奎尼丁和本品同用,其类似阿托品样的效应加剧。
4、本品和三环类抗抑郁药物同用时,可使后者增效。
【药物过量】可致排尿困难或排尿痛、头晕、头痛、口腔鼻喉部干燥、恶心、腹痛、皮疹;儿童易发生烦燥、焦虑、入睡困难和神经过敏。
【药理毒理】1、抗组胺作用:通过拮抗H1受体而对抗组胺的过敏效应;本品不影响组胺的代谢,也不阻止体内组胺的释放。
2、有抗M胆碱受体作用。
3、本品具有中枢抑制作用。
【药代动力学】肌注后5~10分钟起效。
血浆蛋白结合率约72%。
T1/2为12~15小时,主要经肝代谢,中间代谢产物无药理活性。
代谢产物和未代谢的药物主要经肾排出。
【贮藏】遮光,密闭保存。
【包装】低硼硅玻璃安瓿;每盒10支。
【有效期】24个月【执行标准】《中国药典》2005年版二部【批准文号】国药准字H20054324。
