人工牛黄检验操作规程
商业部关于加强人工牛黄等生化药品质量管理的通知-部发[87]食字第36号
![商业部关于加强人工牛黄等生化药品质量管理的通知-部发[87]食字第36号](https://img.taocdn.com/s3/m/7693efa7c67da26925c52cc58bd63186bceb923c.png)
商业部关于加强人工牛黄等生化药品质量管理的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 商业部关于加强人工牛黄等生化药品质量管理的通知(1987年6月15日部发〔87〕食字第36号)今年四月,山西、河南、河北等地先后揭露了一起“人工牛黄”假药案。
经有关部门和地区一个多月的追查,现已初步查清,假人工牛黄的制造者是河南省郸城县农民李全孝、李全忠、李全职三人。
他们盗用原“河南省商丘地区冷冻厂附属生化制药厂”的厂名,伪造该厂在1983年前使用、现已注销的“环球”商标,非法大量制造和销售假人工牛黄一千零三十五公斤,流入河北省安国县药材市场后,又分别销往山西、河北、河南、辽宁、黑龙江等地。
有的中药厂已将假人工牛黄制成成药出厂,危及人民身体健康。
药品是防病治病的特殊商品。
生产、经营假药、劣药是犯罪行为。
近年来,各地在查处社会上的不法分子制造、销售假药案件的过程中,尚未发现商业部门生化制药厂有这类违法的行为。
人工牛黄是商业部归口管理的生化药品中的重要产品,是二百多种中成药的主要原料之一。
从1978年开始,人工牛黄列为商业部部管产品之一,每年由国家计委、商业部联合下达指导性生产计划,生产有了很大发展。
1986年年产量已达六十余吨,较1978年增长四倍多。
但目前市场供应仍很紧张。
社会上的不法分子乘机制售假药,进行犯罪活动。
为了保护人民的身体健康,维护人工牛黄等生化药品的声誉,各地要采取有力措施,加强生化制药生产和质量管理,切实保证人民用药安全。
一、各地要配合卫生行政部门对人工牛黄生产进行一次普查清理,凡不具备人工牛黄生产条件,质量保障体系不健全,产品质量不过关的单位,要限期进行整顿。
硫黄、制硫磺质量标准及检验操作规程
xxxxxxxxxxxxx有限公司成品质量标准及检验操作规程
1 品名:
1.1 中文名:硫黄制硫磺
1.2 汉语拼音:Liuhuang Zhiliuhuang
2 代码:
3 取样文件编号:
4 检验方法文件编号
5 依据:《中国药典》(2020年版一部)。
6 质量标准:
7 检验操作规程:
7.1 试剂与试药:乙醇、氢氧化钾、盐酸、甲基橙指示液。
7.2 仪器与用具:电子天平、水浴锅。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:本品燃烧时易熔融,火焰为蓝色,并有二氧化硫的刺激性臭气。
7.5 含量测定:取本品细粉约0.2g,精密称定,置锥形瓶中,精密加入乙醇制氢氧化钾滴定液(0.5mol/L)50ml,加水10ml,置水浴中加热使溶解,并挥去乙醇(直至无气泡、无醇臭)。
加水40ml,于瓶颈插入一小漏斗,微沸10分钟,冷却,小心滴加过氧化氢试液5ml,摇匀,置沸水浴中加热10分钟,冷却至室温,用水冲洗漏斗及瓶内壁,加人甲基橙指示液2滴,用盐
酸滴定液(0.5mol/L)滴定,并将滴定结果用空白试验校正。
每lml乙醇制氢氧化钾滴定液(0.5mol/L)相当于8.015mg的硫(S)。
本品含硫(S)不得少于98. 5%。
人工牛黄甲硝唑胶囊微生物限度检查方法验证方案.doc

2015年版中国药典微生物限度检查方法验证方案人工牛黄甲硝卩坐胶囊微生物限度检查方法验证方案下表用于记录修订/变更主要内容及历史。
1.概述2.验证冃的和范I韦I3.组织及职责4.验证进度计划表5.验证所需要的仪器设备及相关文件的确认6.验证所需要的菌种、培养基、检验样品的确认7.验证项冃和验证方法7.1试验菌株7.2需氧菌总数检查、霉菌和酵母菌总数检查方法验证的菌液制备7.3需氧菌总数检查、霉菌和酵母菌总数检查方法验证■■常规倾注平皿法7.4需氧菌总数检查方法验证一离心沉淀■薄膜过滤法7.5控制菌检查方法验证一离心沉淀■薄膜过滤法&偏差与漏项控制9.验证报告会审1.概述我公司生产品种人工牛黄甲硝哇胶囊,产品微生物限度检查项目为需氧菌总数、霉菌和酵母菌总数、以及大肠埃希菌检查和沙门菌检查。
参照《中国药典》2015版四部附录1105:微生物计数法,以及1106:控制菌检查法的规定,本公司对该产品的微生物限度检查方法予以验证。
通过验证以确认所采用的微生物限度检查方法适用。
人工牛黄屮硝卩坐胶囊处方中含有甲硝呼、人工牛黄以及常用辅料成分,文献资料介绍屮硝卩坐对细菌有抑菌特性,对霉菌和酵母菌无抑菌活性。
屮硝畔在水中微溶,可以通过离心沉淀•薄膜过滤法去除其对微生物生长的影响。
本验证方案通过试验菌株的回收率测试,首先确认常规倾注平皿法是否适用于木品的微生物限度检查;如常规倾注平皿法不适用,则进一步验证可去除供试晶抑菌物质的离心沉淀•薄膜过滤法是否适用于本晶的微生物限度检查。
本验证方案根据样晶特性制定微生物限度检查方法和检验条件,按制定的方法进行试验,根据验证结果判断是否符合验证标准。
2.验证目的和范围验证该产品的微生物限度检查方法的适用性,对其有效性进行评价,保证检验结果的可靠性。
本验证方案采用3批按GMP要求组织生产的人工牛黄甲硝呼胶囊,进行微生物限度检查方法的验证。
3.组织及职责3.1验证方案和验证报告的起草、审核、批准验证方案曲质量部QC组负责起草,出质量部审核,最终出质量负责人批准。
种药品检验仪器操作规程

种药品检验仪器操作规程
一、前言
本文档旨在规范药品检验仪器的操作流程,确保检验工作的准确性和有效性。
操作人员应按照本规程的要求进行操作,以确保药品质量和安全。
二、操作人员
1.操作人员必须接受专业培训,熟悉仪器的使用方法。
2.操作人员必须具备一定的药品知识,了解各种药品的检验标准和方法。
三、检验仪器的准备工作
1.确保仪器处于正常工作状态,检查仪器各部件是否完好。
2.根据待检验药品的要求,准备好相应的试剂和标准物质。
四、操作流程
1.开机启动仪器,等待仪器自检完成并进入正常工作状态。
2.选择待检验药品的检验模式,并设置相关参数。
3.将样品按要求放入仪器中进行检测。
4.等待检测结果显示并记录。
5.根据检测结果判断药品的质量是否符合标准,如有异常需
要及时处理。
6.检验结束后,关闭仪器并清洁工作区域。
五、注意事项
1.操作人员必须佩戴防护用品,如手套、口罩等。
2.操作过程中严禁随意更改参数或操作不当。
3.定期对仪器进行维护和保养,保证仪器的稳定性和精确性。
4.报废药品和试剂要按照规定进行分类处理,避免造成污染。
结语
本文档所规定的操作规程应严格执行,任何违反规定的行为都可能导致药品检验结果的不准确,从而影响药品的质量和安全。
希望所有操作人员严格遵守规定,确保药品检验工作的顺利进行。
以上内容为《种药品检验仪器操作规程》的文档,操作人员在使用药品检验仪器时应遵守以上规定,以确保检验工作的准确性。
注意:本文档仅为参考文档,具体操作仍应按照实际情况和实际仪器要求进行。
人工牛黄检验操作规程
目的明确人工牛黄检验方法,规范人工牛黄检验程序,确保检验结果准确。
范围本规程适用于进厂原料人工牛黄的检验。
责任质检处负责制订本规程;质检处原料组和仪器组化验员按本规程操作;质检处监督检查。
内容1 品名:1.1 中文名:人工牛黄1.2 英文名:Bovis Calculus Artifactus1.3 汉语拼音名:Renggong Nuhuang2 引用标准中国药典2010年版(ChP2010)。
3 执行质量标准:《人工牛黄质量标准》4 性状本品为黄色疏松粉末。
味苦,微甘。
6 鉴别6.1 (1) 取胆红素(含量测定)项下溶液,照紫外-可见分光光度法(附录V A)测定,在453nm波长处有最大吸收。
6.2 薄层色谱法:胆酸、去氧胆酸的鉴别6.2.1 供试品溶液的制备:取本品0.1g,置10ml量瓶中,加甲醇适量,超声处理5分钟,加甲醇稀释至刻度,摇匀,静置,取上清液作为供试品溶液。
6.2.2 对照溶液的制备: 取胆酸、猪去氧胆酸对照品,加甲醇制成每1ml各含1mg的混合溶液,作为对照品溶液。
6.2.3 展开剂:正己烷-乙酸乙酯-醋酸-甲醇(20:25:2:3) 上层溶液为展开剂。
6.2.4 薄层板:硅胶G6.2.5 测定方法: 吸取上述供试品溶液4μl, 对照品溶液2μl,分别点于同一硅胶G薄层板上,置于展开剂中展开,取出,晾干,喷以10%磷钼酸乙醇溶液,在105℃加热至斑点显色清晰。
6.2.6 标准规定:供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
6.3 薄层色谱法:牛胆粉对照药材的鉴别6.3.1 对照药材溶液的制备:牛胆粉对照药材10mg,加甲醇适量,超声处理使充分提取,再加甲醇至10ml,摇匀,静置,取上清液作为对照药材溶液。
6.3.2 供试品溶液的制备:鉴别(2)项下的供试品溶液。
6.3.3 展开剂:以甲苯一冰醋酸一水((7.5:10:0.3)为展开剂6.3.4 薄层板:硅胶G6.3.5 测定方法:吸取供试品溶液及上述对照药材溶液各8μl,分别点于同一硅胶G薄层板上展开,取出,晾千,喷以10%磷钼酸乙醇溶液,在105℃加热至斑点显色清晰。
人工牛黄补充检验标准
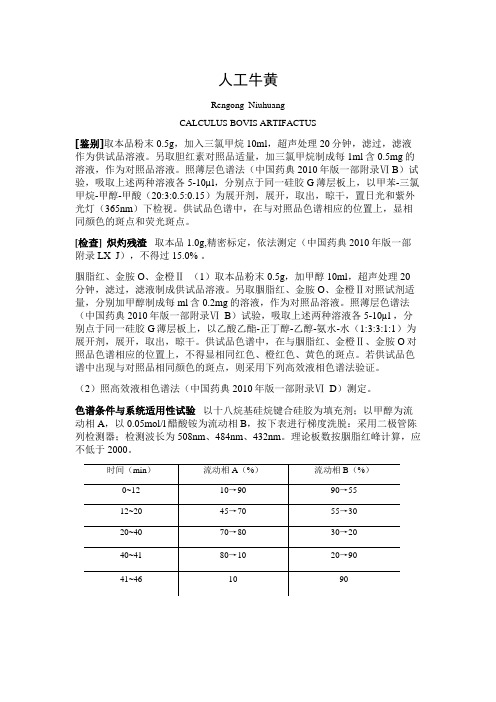
人工牛黄Rengong NiuhuangCALCULUS BOVIS ARTIFACTUS[鉴别]取本品粉末0.5g,加入三氯甲烷10ml,超声处理20分钟,滤过,滤液作为供试品溶液。
另取胆红素对照品适量,加三氯甲烷制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验,吸取上述两种溶液各5-10µl,分别点于同一硅胶G薄层板上,以甲苯-三氯甲烷-甲醇-甲酸(20:3:0.5:0.15)为展开剂,展开,取出,晾干,置日光和紫外光灯(365nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点和荧光斑点。
[检查] 炽灼残渣取本品1.0g,精密标定,依法测定(中国药典2010年版一部附录LX J),不得过15.0% 。
胭脂红、金胺O、金橙Ⅱ(1)取本品粉末0.5g,加甲醇10ml,超声处理20分钟,滤过,滤液制成供试品溶液。
另取胭脂红、金胺O、金橙Ⅱ对照试剂适量,分别加甲醇制成每ml含0.2mg的溶液,作为对照品溶液。
照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验,吸取上述两种溶液各5-10µl ,分别点于同一硅胶G薄层板上,以乙酸乙酯-正丁醇-乙醇-氨水-水(1:3:3:1:1)为展开剂,展开,取出,晾干。
供试品色谱中,在与胭脂红、金橙Ⅱ、金胺O对照品色谱相应的位置上,不得显相同红色、橙红色、黄色的斑点。
若供试品色谱中出现与对照品相同颜色的斑点,则采用下列高效液相色谱法验证。
(2)照高效液相色谱法(中国药典2010年版一部附录Ⅵ D)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇为流动相A,以0.05mol/l醋酸铵为流动相B,按下表进行梯度洗脱:采用二极管陈列检测器;检测波长为508nm、484nm、432nm。
理论板数按胭脂红峰计算,应不低于2000。
对照试剂溶液的制备取胭脂红、金胺O、金橙Ⅱ对照试剂适量,分别加甲醇制成每1ml 含胭脂红0.1mg、金胺O 0.05mg 、金橙Ⅱ0.05mg的溶液,作为对照试剂溶液。
安宫牛黄丸检验操作规程

1.目的建立安宫牛黄丸检验操作规程。
2.范围本规程适用于安宫牛黄丸的全项检验。
3.责任 QC检验员、QC主管、QA主管。
4.标准《安宫牛黄丸质量标准》5.内容:5.1性状本品为黄橙色至红褐色的大蜜丸,或为包金的大蜜丸,除去金衣后显黄橙色至红褐色;气芳香浓郁,味微苦。
5.2 鉴别5.2.1 取本品,置显微镜下观察:不规则碎片灰白色或灰黄色,稍具光泽,表面有灰棕色色素颗粒,并有不规则纵长裂缝(水牛角浓缩粉)。
不规则碎块无色或淡绿色,半透明,有光泽有时可见细密波状纹理(珍珠)。
不规则细小颗粒暗红色,有光泽,边缘暗黑色(朱砂)。
不规则碎块金黄色或橙黄色,有光泽(雄黄)。
纤维束鲜黄色,壁稍厚,纹孔明显;石细胞鲜黄色(黄连)。
韧皮纤维淡黄色,梭形,壁厚,孔沟细(黄芩)。
果皮含晶石细胞类圆形或多角形,直径17~31μm,壁厚,胞腔内含草酸钙方晶(栀子)。
糊化淀粉粒团块几乎无色(郁金)。
5.2.2取本品2g,剪碎,加乙醇20ml,加热回流1 小时,放冷,滤过,滤液作为供试品溶液。
另取胆酸对照品,加乙醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(附录Ⅵ B)试验,吸取上述两种溶液各10μl,分别点于同一硅胶G薄层板上,以乙醚-三氯甲烷—冰醋酸(2:2:1) 为展开剂,展开,取出,晾干,喷以10%磷钼酸乙醇溶液,在105℃加热约10分钟至斑点显色清晰。
供试品色谱中,在与对照品谱相应的位置上,显相同颜色的斑点。
5.2.3取盐酸小檗碱对照品和黄芩苷对照品,分别加乙醇制成每1ml 含盐酸小檗碱的溶液0.2mg和每1ml 含黄芩0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取[鉴别](2) 项下的试品溶液20μl及上述两种对照品溶液各10μl,分别点于同一用4%醋酸钠溶液制备的硅胶G薄层板上,使成条状,以乙酸乙酯-丁酮-甲酸-水(10:7:1:1)为展开剂,展开,取出,晾干。
分别在日光和紫外光灯(365nm )下检视,供试品色谱中,在与黄芩苷对照品色谱相应的位置上,显相同颜色的条斑;在与盐酸小檗碱对照品色谱相应的位置上,紫外光下显相同的黄色荧光条斑。
氨咖黄敏胶囊质量标

氨咖黄敏胶囊质量标准
1. 目的
建立氨咖黄敏胶囊的质量标准,保证产品符合标准规定。
2. 范围
本标准适用于氨咖黄敏胶囊的质量管理和检验。
3. 术语或定义
N/A
4. 职责
质量管理部对本规程的实施负责。
5. 程序
5.1 标准依据:国家食品药品监督管理局国家药品标准WS-10001-(HD-0276)-2002-2006。
5.2 产品名称:氨咖黄敏胶囊。
5.3 产品编码:
5.4 产品规格:每粒含对乙酰氨基酚250mg,咖啡因15mg,马来酸氯苯那敏1mg,人工牛黄10mg。
5.5 包装形式:药品包装用PTP铝箔、聚氯乙烯固体药用PVC硬片泡罩包装(铝塑包装)。
5.6 成品取样操作规程编号:
5.7 氨咖黄敏胶囊检验操作规程编号:
5.8 定性和定量的限度要求
5.9贮存条件:密封,在阴凉干燥处保存。
5.10 类别:抗感冒药。
5.11 有效期:24个月。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目的:为检验人工牛黄规定一个标准的程序,以便获得准确的实验数据。
范围:适用于人工牛黄的检验。
职责:检验室主任、检验员。
规程:
1 性状:本品为黄色疏松的粉末;味苦,微甘。
2 鉴别:
2.1 试剂与仪器
2.1.1 硫酸 2.1.2 硝酸
2.1.3 甲醇 2.2.4 胆酸猪去氧胆酸对照品
2.1.5 异辛烷-正丁醚-冰醋酸(8:5:5) 2.2.6 10%磷钼酸的乙醇溶液
2.1.7 牛胆粉 2.1.8 甲苯-冰醋酸-水(7.5:10:0.3) 2.1.9 硅胶G薄层板 2.1.10 试管
2.1.11 容量瓶(10ml) 2.1.12 微量进样器
2.1.13 层析缸 2.1.14 电子天平(万分之一克)
2.1.15 恒温干燥箱
2.2 项目与步骤
2.2.1 取本品适量,分为二份,一份加硫酸显污绿色;另一份加硝酸显红色为符合规定。
2.2.2 精密称取本品0.1g,置10ml的容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为供试品溶液。
另精密称取胆酸、去氧胆酸对照品各0.01g,置10ml容量瓶中,各加甲醇溶解并稀释至刻度,摇匀,作为对照品溶液。
照薄层色谙法(SOP-QC-304-00)试验,吸取上述供试品溶液4μl,对照品溶液2μl,分别点于同一硅胶G薄层板上,以异辛烷-正丁醚-冰醋酸(8:5:5)为展开剂展开,取出,晾干,喷以10%磷钼酸的乙醇溶液,于105℃烘约5分钟使显色。
供试品色谱中在与对照品色谱相应的位置上,显相同颜色的斑点为符合规定。
2.2.3 精密称取本品0.1g,置10ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为
供试品溶液。
另精密称取牛胆粉对照品0.02g,置10ml容量瓶中,加甲醇溶解,并稀释至刻度,摇匀,作为对照品溶液。
照薄层色谱法(SOP-QC-304-00)试验,吸取上述供试品溶液和对照品溶液各8μl,分别点于同一硅胶板G薄层板上,以甲苯-冰醋酸-水(7.5:10:0.3)为展开剂,展开,取出,晾干,喷以10%磷钼酸的乙醇溶液,于105℃烘烤约15分钟。
供试品色谱中在与对照品色谱相应的位置上应显相同颜色的斑点为符合规定。
3 检查
3.1 试剂与仪器
3.1.1 甲醇 3.1.2 异辛烷-正丁醚-冰醋酸(8:5:5)
3.1.3 层析缸 3.1.4 水分测定仪
3.1.5 硅胶G薄层板 3.1.6 微量进样器
3.2 项目与步骤
3.2.1 水分:精密称取本品约0.1g,按水分测定法(SOP-QC-326-00)测定,本品的水分不得过5.0%为符合规定。
3.2.2 猪去氧胆酸的限量检查:
对照品溶液的配制:精密称取猪去氧胆酸0.01g,置10ml的容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。
供试品溶液的配制:精密称取供试品0.1g,用适量甲醇转移至10ml量瓶中,并稀释至刻度,密塞;振摇使样品溶解,放置,取上清液作为供试品溶液。
检查法:照薄层色谱法(SOP-QC-304-00)试验,精密量取供试品溶液4μl及对照品溶液1.5μl ,分别点于同一硅胶G薄层板上,以异辛烷-正丁醚-冰醋酸(8:5:5)为展开剂,展开,取出,晾干,喷以10%磷钼酸的乙醇溶液,于105℃烘约5分钟。
供试品色谱中,猪去氧胆酸斑点的颜色应深于或等于对照品色谱为符合规定。
4 含量测定
4.1 胆酸
4.1.1 试剂与仪器
4.1.1.1 60%冰醋酸 4.1.1.2 新配制的糠醛水溶液(1-100)4.1.1.3 硫酸溶液 4.1.1.4 带塞试管
4.1.1.5 容量瓶(50ml) 4.1.1.6 滤纸漏斗
4.1.1.7 漏斗架 4.1.1.8 刻度移液管
4.1.1.9 紫外分光光度计
4.2 检验步骤
4.2.1 标准溶液的制备:取在105℃干燥至恒重的胆酸对照品12.5mg,精密称定,置25ml 量瓶中,加60%冰醋酸溶液使溶解,并稀释至刻度,摇匀,即得(每1ml含胆酸0.5mg)。
标准曲线的绘制:精密量取标准溶液0.2、0.4、0.6、0.8与1.0ml,分别置于带塞试管中,均用60%冰醋酸溶液稀释成1.0ml,加新配的糠醛水溶液(1→100)各1.0ml,在冰浴中放置5分钟,加硫酸溶液(取硫酸50ml与蒸馏水65ml混合制成)13ml,混匀,在70℃水浴中加热10分钟,迅速移至冰浴中,放置2分钟,以相应的试剂为空白,照分光光度法(SOP-QC-301-00)测定,在605nm的波长处测定吸收度,以吸收度为纵坐标,绘制标准曲线。
4.2.2 测定法取本品约0.1g,精密称定,加60%冰醋酸溶液数ml,充分研磨,移入50ml 量瓶中,残渣再加60%冰醋酸溶液,研磨后,全部移入量瓶中,再用60%冰醋酸溶液稀释至刻度,摇匀,弃去初滤液,精密吸取续滤液各1ml,分别置于甲、乙两个带塞试管中,于甲管中加新配制的糠醛水溶液1ml,乙管加水1ml作空白,按标准曲线的绘制项下的方法自“在冰浴中放置5分钟”起,依法制定吸收度。
按标准曲线计算含量,即得。
本品胆酸含量按干燥品计,不得少于13.0%为符合规定。
4.3 胆红素
4.3.1 试剂与仪器
4.3.1.1 氯仿、胆红素标准品 4.3.1.2 棕色容量瓶(100ml,50ml)
4.3.1.3 刻度移液管 4.3.1.4 紫外分光光度计
4.4 检验步骤
4.4.1 标准溶液的制备:取胆红素标准品约0.01g,精密称定,置100ml棕色量瓶中,加氯仿30ml使溶解,在60℃水浴中振摇片刻,使充分溶解,取出,用水冷却后,放至室温,加氯仿稀释至刻度,作为标准储备液(0.1mg/ml);精密吸取标准储备液10.0ml,置50ml棕色量瓶中,加氯仿稀释至刻度,即为标准溶液(约20μg/ml)。
4.4.2 标准曲线的绘制:精密吸取胆红素标准溶液4.0、
5.0、
6.0、
7.0、
8.0ml,分别
置于25ml棕色量瓶中,用氯仿稀释至刻度,即得每ml含3.2、4.0、4.8、5.6、6.4μg胆红素的标准液,照分光光度法(SOP-QC-301-00)测定,在453nm处测定吸收度。
4.4.3 测定法取样品0.08g,精密称定,加氯仿30ml转移至100ml棕色量瓶中,置60℃水浴中振摇片刻,使充分溶解,取出,用水冷却后,放置室温,加氯仿稀释至刻度,摇匀,滤过,弃去初滤液,取续滤液,照分光光度法(SOP-QC-301-00)测定,在453nm测定吸收度,按标准曲线计算含量,即得。
本品含胆红素不得少于0.63%为符合规定。
5.类别:清热、解毒、祛痰、定惊药;
6.贮藏:密闭,防潮,避光。
