氧化还原专项练习
氧化还原反应练习及答案

氧化还原反应同步练习一、选择题:1.有关氧化还原反应的叙述正确的是( )A .氧化还原反应的实质是有氧元素的得失B .氧化还原反应的实质是元素化合价的升降C .氧化还原反应的实质是电子的转移(得失或偏移)D .物质所含元素化合价升高的反应是还原反应 2.下列化学反应基本类型中一定是氧化还原反就的是( )A .化合反应B .分解反应C .复分解反应D .置换反应3.下列哪一个反应表示二氧化硫被还原( )4.下列化学方程式中电子转移不正确的是( )5.某元素在化学反应中由化合态变为游离态,则该元素( )A .一定被氧化B .一定被还原C .既可能被氧化又可能被还原D .以上都不是6.下列反应盐酸作还原剂的是( )A.在被氧化B.是氧化剂C.被还原D.是还原剂8.下列变化需要加入还原剂才能实现的是( )A .Na 2SO 3−−→− SO 2B .HCl −−→− Cl 2C .H 2SO 4(浓) −−→− SO 2D .SO 2−−→− S9.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( ) OHA .KClO 3B .KClC .KCl+H 2OD .H 2O量比为( )A .1:1B .5:1C .1:5D .3:112.盐酸能发生下列反应:+H 2O 因此盐酸应当具有的性质是( )A .只有酸性B .只有氧化性C .只有还原性D .有酸性、有氧化性和还原性13.下面三个方法都可以用来制氯气:则三种氧化剂由强到弱的顺序是( )A .O 2 MnO 2 KMnO 4B .KMnO 4 MnO 2 O 2C .MnO 2 KMnO 4 O 2D .O 2 KMnO 4 MnO 2A .+2B .+3C .+4D .+6个数比是( )A .6:5B .5:6C .11:5D .11:6物,③H 2O 是氧化剂,④CaH 2中的H 元素被还原,⑤此反应中的氧化产物和还原产物的分子个数之比为1:1。
高中化学氧化还原反应重点难点专项练习题(附答案)

高中化学氧化还原反应重点难点专项练习题一、单选题1.下列三种说法中,错误的是( ) ①在43NH NO 中氮元素显+5价 ②反应222324FeS +11O 2Fe O +8SO 高温中+2价铁和-2价硫都被氧化③反应22Cu+O 2CuO ∆中Cu 元素化合价降低总数与O 元素化合价升高总数一定相等A.①B.②③C.①③D.①②③2.下列氧化还原反应中,电子转移的方向和数目均正确的是( )A. B.C.D.3.已知:还原性-3HSO >I -,氧化性-3IO >I 2>2-4SO ,在含0.3molNaHSO 3的溶液中逐滴加入KIO 3溶液.加入KIO 3和析出I 2的物质的量的关系曲线如图所示.下列说法不正确的是( )A .0~b 间的反应可用如下离子方程式表示:3-3HSO +-3IO ═32-4SO +I -+3H +B .a 点时消耗NaHSO 3的物质的量为0.12molC .当溶液中的I -为0.04 mol 时,加入的KIO 3只能是0.04mol D .b 点时的还原产物可能是KI 或NaI ,b ~c 间的还原产物是I 24.A 2、B 2、C 2三种单质和它们离子间能发生下列反应2A -+C 2=2C -+A 2,2C -+B 2=2B -+C 2 , 若X -能与C 2发生反应2X -+C 2=2C -+X 2有关说法中不正确的是( ) A .氧化性B 2>C 2>A 2 B .还原性X ->C ->B -C .X 2与B -能发生反应D .X 2与B -不能发生反应5.水热法制备纳米颗粒Y (化合物)的反应为2223262423Fe 2S O O OH S O 2H O a Y -+-+++++﹣=,下列有关说法不正确的是( ) A .a=4B .Y 的化学式为Fe 2O 3C .223S O -是还原剂D .每32g O 2参加反应,转移电子的物质的量为4mol 6.某兴趣小组用莫尔盐[化学式为()()4242Fe SO NH O 6H x ⋅ (Fe 为 +2价)]测定4KMnO 溶液的物质的量浓度的过程如下:①称取19. 6 g 莫尔盐配成100 mL 溶 液,②量取10. 00 mL 4KMnO 溶液,向其中加入足量的24H SO 进行酸化,向酸化后的溶液中逐渐滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液 的体积为20. 00 mL 。
氧化还原反应专项训练(最新整理)

氧化还原反应专项训练1.常温下,往H 2O 2溶液中滴加少量FeSO 4溶液,可发生如下两个反应:2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O ,2Fe 3++H 2O 2=2Fe 2++O 2↑+H +,下列说法正确的是( )A .H 2O 2的氧化性比Fe 3+强,其还原性比Fe 2+弱B .在H 2O 2分解过程中,溶液的pH 逐渐下降C .在H 2O 2分解过程中, Fe 2+和Fe 3+的总量保持不变D .H 2O 2生产过程可以使用铁质容器2.某容器中发生了一个化学反应,反应过程中存在H 2O 、ClO -、CN -、HCO 3-、N 2、Cl -六种粒子,在反应过程中测得ClO -和N 2的物质的量随时间变化的曲线如图所示。
下列判断中正确的是( )A .还原剂是CN -,氧化产物只有N 2B .氧化剂是ClO -,还原产物是HCO 3-C .配平后氧化剂与还原剂的化学计量数之比为5∶2D .标准状况下若生成2.24 L N 2,则转移0.5 mol 电子3.(2014·温州八校联考)新型纳米材料MFe 2O x (3<x <4)中M 表示+2价的金属元素,且在反应中化合价不发生变化。
常温下,MFe 2O x 能使工业废气中的SO 2转化为S ,流程如下:MFe 2O x ――――→常温下SO 2MFe 2O y 则下列有关该反应的判断正确的是 ( )A .MFe 2O x 是氧化剂 B .SO 2被氧化,1 mol SO 2得4 mol 电子C .x <yD .MFe 2O y 是还原产物4.向21.6 g 铁粉和铜粉的混合物中加入1 L 1 mol·L -1硝酸溶液,充分反应,放出NO气体且金属有剩余。
则反应后溶液中c (NO )可能为( )。
-3A .0.45 mol·L -1 B .0.6 mol·L -1 C .0.75 mol·L -1 D .0.9 mol·L -15.为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。
氧化还原反应练习题及答案

氧化还原反应可能用到的相对原子质量:H:1C:12N:14O:16S:32第I卷(选择题共48分)一、选择题(本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1.下列操作过程中一定有氧化还原反应发生的是ABCD2.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是A.3.XA.XC.X4.A.5.6.A.C.7.A.B.C.D.8.已知N元素的最低化合价是–3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是A.NH3B.N2C.NO2D.HNO39.下列各反应中,水作为还原剂的是A.2H2+O22H2OB.SO3+H2O===H2SO4C.2F2+2H2O===4HF+O2D.2Na+2H2O===2NaOH+H210.下列药品置于空气中很容易变质(括号内的物质是变质后的物质),其中不是因为氧化还原反应而变质的是A.Na2SO3(Na2SO4)B.FeCl2(FeCl3)C.KI(I2)D.NaOH(Na2CO3)11.下列反应中,氧化反应与还原反应在同一种元素中进行的是A.Zn+H2SO4===ZnSO4+H2B.2FeCl2+Cl2===2FeCl3C.2KClO32KCL+3O2D.Cl2+H2O===HClO+HCl12.下列关于氧化还原反应的叙述中正确的是A.失去电子的反应为还原反应B.含有氧元素的物质是氧化剂C.氧化剂得到电子的数目和还原剂失去的电子的数目一定相等SB.Na3-Y+H W+O⑶结合I、II实验现象可知,Fe、Cu、Ag的还原性顺序为。
18、(14分)某学生为了验证氢气还原氧化铜的产物,设计了下图所示的实验装置。
⑴写出编号仪器的名称:①;②;⑵浓H2SO4的作用是。
⑶本实验需要加热的装置为(填字母编号)。
⑷写出装置C、D中可观察到的现象:C,D。
⑸D中反应每生成1个水分子,转移的电子数为个。
19、(8分)对于实验室制取O2的反应:2KCLO32KCL+3O2,其电子转移的方向和数目的标法有以下几种,你认为正确的是(填序号)该反应中,是氧化剂,是还原剂,MnO2是剂。
高三氧化还原练习题

高三氧化还原练习题一、选择题(每题3分,共12分)1. 在氧化还原反应中,失去电子的物质被称为:A. 氧化剂B. 还原剂C. 还原物D. 氧化物2. 以下哪个反应不是氧化还原反应?A. 2H2 + O2 → 2H2OB. 2Mg + O2 → 2MgOC. 2H2O → 2H2 + O2D. 2NaOH + H2SO4 → Na2SO4 + 2H2O3. 根据题目1和2的答案,下列哪个选项是氧化剂?A. 氢气(H2)B. 氧气(O2)C. 镁(Mg)D. 硫酸(H2SO4)4. 在下列反应中,哪个元素的氧化态发生了变化?A. 2Na + Cl2 → 2NaClB. 2H2O → 2H2 + O2C. Na2CO3 + 2HCl → 2NaCl + H2O + CO2D. 2H2O2 → 2H2O + O2二、填空题(每空2分,共10分)5. 在氧化还原反应中,氧化数增加的物质是______,氧化数减少的物质是______。
6. 判断下列化合物中各元素的氧化态:- Na2O中的钠(Na)的氧化态是______。
- H2O中的氧(O)的氧化态是______。
- CO2中的碳(C)的氧化态是______。
7. 已知反应:2Fe + 3Cl2 → 2FeCl3,其中铁(Fe)的氧化态从0变化到+3,氯(Cl)的氧化态从0变化到______。
三、计算题(每题5分,共10分)8. 已知反应:2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O。
计算在这个反应中,银(Ag)的氧化态变化了多少?9. 某化学反应的平衡常数Kc = [A][B]/[C][D],如果A和B的初始浓度都是0.1M,C和D的初始浓度都是0.2M,求反应达到平衡时,A的浓度。
四、简答题(每题8分,共8分)10. 解释什么是氧化还原反应,并给出一个日常生活中常见的氧化还原反应的例子。
氧化还原反应专题训练

氧化还原反应专题练习1、亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与氧气结合的能力,误食亚硝酸钠中毒,可服维生素C缓解.下列叙述中表现亚硝酸钠和维生素C的性质正确的是 A.氧化性和还原性B.还原性和氧化性 C.氧化性和酸性D.还原性和碱性2、下列有关氧化还原的叙述正确的是A.氧化还原的本质是元素化合价的升降B.肯定有一种元素被氧化,另一种元素被还原C.反应中不一定所有元素的化合价都发生变化D.作氧化剂的物质不能同时作还原剂3、下列说法中正确的是:A.氧化剂本身发生氧化反应 B.氧化还原反应一定有氧元素参加C.氧化剂在反应中得电子,还原剂失去电子 D.氧化反应一定先于还原反应发生4、下列说法中错误的是A.置换反应一定是氧化还原反应 B.化合反应不可能是氧化还原反应C.分解反应可能是氧化还原反应 D.凡是氧化还原反应,都不可能是复分解反应5、下列有关氧化还原反应的叙述中正确的是A.有单质参加或有单质生成的反应一定是氧化还原反应 B.氧化还原的本质是元素化合价的升降C.失电子的反应物在反应中作氧化剂,反应中被还原 D.金属单质在化学反应中一定作还原剂6、下列叙述正确的是A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原B.有单质参加或生成的反应一定属于氧化还原反应 C.失电子难的原子,获得电子的能力一定强D.元素由化合态变成游离态时,它可能被氧化,也可能被还原7、某实验室由于管理不善,酒精滴漏到某种化学品上而酿成火灾。
该化学品可能是A.KMnO4 B.NaCl C.(NH4)2SO4 D.CH3COOH8、从氧化还原反应的角度看,在实验室制取①H2②CO2③Cl2的三个反应中,盐酸的作用A.互不相同 B.在①和②中相同 C.在②和③中相同 D.在①②③中均相同9、下列反应不属于氧化还原反应的是A. Zn+2HCl=ZnCl2+H2↑B. Ca(ClO)2+2HCl=CaCl2+2HClOC. Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2OD. 3Cl2+6KOH(浓) 5KCl+KClO3+3H2O10、若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是A.Cl2 B.KMnO4 C.FeCl3D.HCl11、根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl③2FeCl2+Cl2=2FeCl3④I2+SO2+2H2O=2HI+H2SO4A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2C.Cl2>Fe3+>I2>SO2D.Cl2>Fe3+>SO2>I212、下列说法正确的是A.难失电子的原子,得电子的能力一定强B.易得电子的原子,失电子的能力一定弱C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大D.任何原子的原子核都是由质子和中子构成的13、已知①Fe + 3Cl2 2FeCl3②Fe + 2FeCl3 3FeCl2③2KMnO4 + 16HCl(浓)2KCl + 2MnCl2 + 5Cl2↑+ 8H2O④ MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O⑤O2 + 4HCl(浓)2Cl2↑+ 2H2O则下列物质氧化性强弱顺序正确的是A.KMnO4﹥MnO2﹥O2﹥Cl2﹥FeCl2 B.KMnO4﹥O2﹥MnO2﹥Cl2﹥FeCl3C.Cl2﹥MnO2﹥O2﹥KMnO4﹥FeCl2 D.O2﹥MnO2﹥KMnO4﹥Cl2﹥FeCl314、在反应KNO2K2O+NO↑+O2↑(未配平)中,当生成(标准状况)时,被氧化的氧原子的物质的量为A.3mol B. C. D.15、已知反应3S+6KOH(浓) 2K2S+K2SO3+3H2O,则反应中氧化剂和还原剂的质量比是A. 3∶1B. 1∶3C. 2∶1 D. 1∶216、已知化学反应3Cl2+8NH3 =6NH4Cl+N2,则氧化剂与还原剂物质的量之比是A.1:8 B.8:1 C.3:2 D.2:117、在3Cl2+6KOH KClO3+5KCl+3H2O中,下列说法不正确的是①Cl2是氧化剂,KOH是还原剂②KCl是还原产物,KClO3是氧化产物③反应中每3个Cl2分子中有5个电子转移④被氧化的氯原子是被还原氯原子物质的量的5倍⑤被还原的氯原子的物质的量是被氧化的氯原子的物质的量的5倍。
高中化学《氧化还原反应》专项训练(附答案)
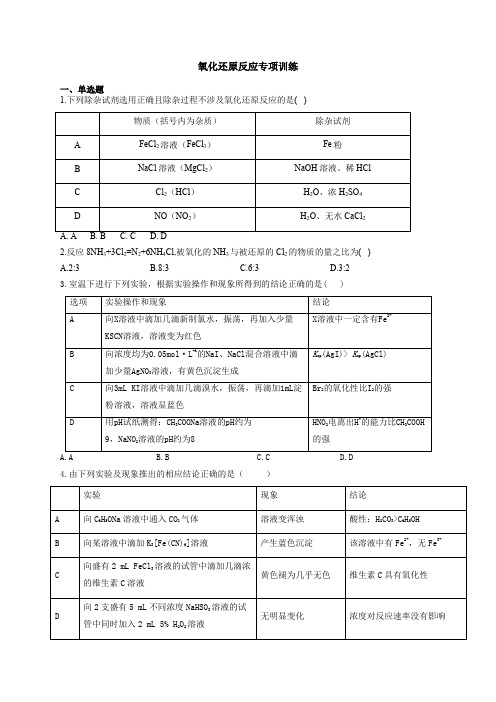
氧化还原反应专项训练一、单选题1.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )2.反应8NH3+3Cl2=N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为( )A.2:3B.8:3C.6:3D.3:23.室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )4.由下列实验及现象推出的相应结论正确的是()A. AB. BC. CD. D5.下列实验中的颜色变化,与氧化还原反应无关..的是 ( )6.某离子反应中涉及H2O、ClO-、4NH 、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示。
下列判断中正确的是( )A.该反应的还原剂是-Cl B.消耗1mol还原剂,转移6mol电子C.氧化剂与还原剂的物质的量之比为2:3D.反应后溶液的酸性明显增强7.含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。
工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)。
下列说法错误的是(其中N A表示阿伏加德罗常数的值)()A.Cl2是氧化剂,CO2和N2是氧化产物B.上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为2:5C.该反应中,若有1mol CN-发生反应,则有5N A电子发生转移D.若将该反应设计成原电池,则CN-在负极区发生反应8.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )A.洗气瓶中产生的沉淀中有碳酸钡B.在Z导管出来的气体中无二氧化碳C.洗气瓶中产生的沉淀是硫酸钡D.洗气瓶中无沉淀产生9.已知2HNO 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH 的关系如下表。
下列有关说法错误的是( )A.碱性条件下, 2NaNO 与NaClO 反应的离子方程式为2NO ClO--+3NO Cl --+B.向冷的2NaNO 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色C.向冷的2NaNO 溶液中加入稀硫酸可得到2HNOD.向冷的2NaNO 溶液中通入2CO 可得到2HNO 10.下列不涉及氧化还原反应的是( )A .补铁剂(有效成分为Fe 2+)与含维生素C 共服效果更佳B .雷雨肥庄稼——自然固氮C .灰肥相混损肥分——灰中含有碳酸钾,肥中含有铵盐D .从沙滩到用户——由二氧化硅制晶体硅11.下列实验现象与氧化还原反应无关的是( ) A. 氨气与氯化氢气体相遇产生白烟 B. 铜遇浓硝酸产生红棕色气体 C. 过氧化钠放置于空气中逐渐变白D. 一氧化氮遇空气变为红棕色参考答案1.答案:B解析:A.FeCl3与Fe反应生成FeCl2,2FeCl3+Fe=2FeCl2,此过程中Fe的化合价发生变化,涉及到了氧化还原法应,故A不符合题意;B.MgCl2与NaOH溶液发生复分解反应MgCl2+2NaOH=Mg(OH)2 +2NaCl,过量的NaOH溶液可用HCl除去HCl+NaOH=NaCl+H2O ,此过程中没有元素化合价发生变化,未涉及氧化还原反应,故B符合题意;C.部分氯气与H2O 发生反应生成氯化氢和次氯酸,反应过程中氯元素化合价变化,涉及到了氧化还原法应,故C不符合题意;D.NO2 与水反应生成硝酸和NO。
高三氧化还原练习题

高三氧化还原练习题一、选择题1. 下列反应正确的是:A. Mg + 2HCl → MgCl2 + H2OB. Ca + 2H2SO4 → CaSO4 + 2H2O + SO2C. Na2CO3 + 2HCl → NaCl + H2O + CO2D. NaOH + HCl → NaCl + H2O2. 氧化剂的特点是:A. 能夺取电子B. 能失去电子C. 在反应中被氢气取代D. 能够促使其他物质氧化3. 还原剂的特点是:A. 能夺取电子B. 能失去电子C. 在反应中被氧气取代D. 能够促使其他物质还原4. 氧化态为+2的金属元素是:A. 铁B. 铜C. 锌D. 铝5. 氧化态为-1的非金属元素是:A. 氯B. 硫C. 氮D. 氧二、填空题1. 在下列反应中,氧化剂是___,还原剂是___。
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag2. 氧化态为-2的元素是___。
3. 氧化态为+1的元素是___。
4. 在还原反应中,氢气的氧化态是___。
5. 化学式H2O2表示的是___。
三、解答题1. 将下列氧化还原反应写成离子方程式:Zn + CuSO4 → ZnSO4 + Cu2. 请结合实例,解释氧化还原反应中氧化剂和还原剂的转化过程。
3. 某次实验中,将锌粉与硫酸反应,观察到氢气的产生。
请写出该反应的化学方程式,并标明反应物、生成物以及反应类型。
四、应用题某实验室中,需要制备氧化锌(ZnO)的实验。
请你根据以下操作步骤,完成实验。
注意,在操作过程中应选择合适的氧化还原反应。
步骤:1. 将锌粉与硫酸反应,得到产物A。
2. 将产物A与氢氧化钠反应,得到产物B。
3. 将产物B进行加热处理,得到氧化锌。
请写出每个步骤中的化学方程式,并解释为什么选择这些反应进行制备氧化锌。
五、综合题1. 用氯化亚铁溶液处理酸性高锰酸钾溶液,观察到产生了氮气和二氧化锰。
请写出该反应的化学方程式,并解释为什么氯化亚铁能氧化高锰酸钾。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原专项练习1.在某强酸性混合稀溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。
完成下列反应的离子方程式:Ce3++H2O2+H2O===Ce(OH)4↓+________2.完成NaClO3氧化酸性FeCl2的离子方程式:ClO-3+Fe2++________===Cl-+Fe3++________3.含氮废水进入水体中对环境造成的污染越来越严重,用金属铝可将水中的NO-3还原成N2,从而消除氮污染,请配平离子反应方程式:NO-3+Al+H2O===N2↑+Al(OH)3+________4.亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:____Na2SO3+____KIO3+____H2SO4===____Na2SO4+____K2SO4+____I2+____H2O(1)配平上面的氧化还原方程式。
(2)若反应中有5mol电子转移,则生成的碘单质是________mol。
5.Mg(ClO3)2加入含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程_____________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________。
6.我国的铜主要取自黄铜矿(CuFeS2),随着矿石质量的降低和环保要求的提高,湿法炼铜的优势日益突出。
氧化浸出法是主要方法之一,氧化浸出法即是在硫酸介质中用双氧水将黄铜矿氧化,测得有SO2-4生成。
(1)该反应的离子方程式_______________________________________________________________________________ _________________________________________________________。
(2)该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因___________________________________________________________________________________________________________________________________________________________。
7.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理如图所示:(1)SCR技术中的氧化剂为__________________。
(2)当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。
该反应的化学方程式为___________________________________________________________________。
当有3mol电子发生转移时,则参与反应的NO的物质的量为____________。
8.近期太阳能利用又有新进展。
利用太阳能由CO2制取C的原理如图所示,若重整系统发生的反应中n(FeO)n(CO2)=4,则重整系统中发生反应的化学方程式:_______________________________________________________________________________ ___________________________。
9.某工厂工业废水中含有甲醛,该厂降解甲醛的反应机理如图所示,则X表示的粒子是_____,总反应的化学方程式为_______________________________________________________________________________ ____________________________________________________________。
10硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。
其生产工艺如下:已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:(1)铁黄(FeOOH)中铁元素的化合价是________。
写出反应①生成铁黄(FeOOH)的离子方程式:_______________________________________________________________________________ _______________________________________________________________________________ 在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”) (2)写出反应③的化学方程式:_______________________________________________________________________________ _____________________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因______________________________________________________________________________________________________________________ ______________________________________________________________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
11、2018年5月15日是我国第25个“防治碘缺乏病日”。
关于“食盐加碘”的问题一直以来被广大医疗专家、沿海居民热议,在社会上引起广泛关注。
某地市场销售的某种食用精制盐配料为食盐、碘酸钾、抗结剂,某学生为了测定其中的碘含量,设计步骤如下:a.准确称取w g食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉溶液为指示剂,逐渐加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):________KIO3+________KI+________H2SO4===________K2SO4+________I2+________H2O(2)向碘的四氯化碳溶液中加入足量Na2SO3稀溶液,将I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是_____________________________________________________________________。
(3)①上述c反应常用于定量测定碘的含量。
I2与Na2S2O3溶液反应的离子方程式是_________________________________________________________。
②判断c中反应恰好完全所依据的现象是____________________________________________________________________。
③b中反应所产生的I2的物质的量是________mol。
12、亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
ClO2易发生爆炸,在生产、使用时可用其他气体进行稀释。
ClO2易与碱反应生成亚氯酸盐和氯酸盐。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为________________________________________________________________________。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO-2存在于中性溶液中):①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。
写出ClO2与碘化钾反应的化学方程式:_________________________________②已知:2Na2S2O3+I2===Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL,判断达到滴定终点的方法是________________________________________________________________________,该水样中ClO2的浓度是________mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:________________________________________________________________________________________________________________________________________________。
将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。
②装置B的作用是___________________________________________________________。
③某同学认为上述装置并不完整,请画出需补充的装置图。
13、为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A 中加热装置已略,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
