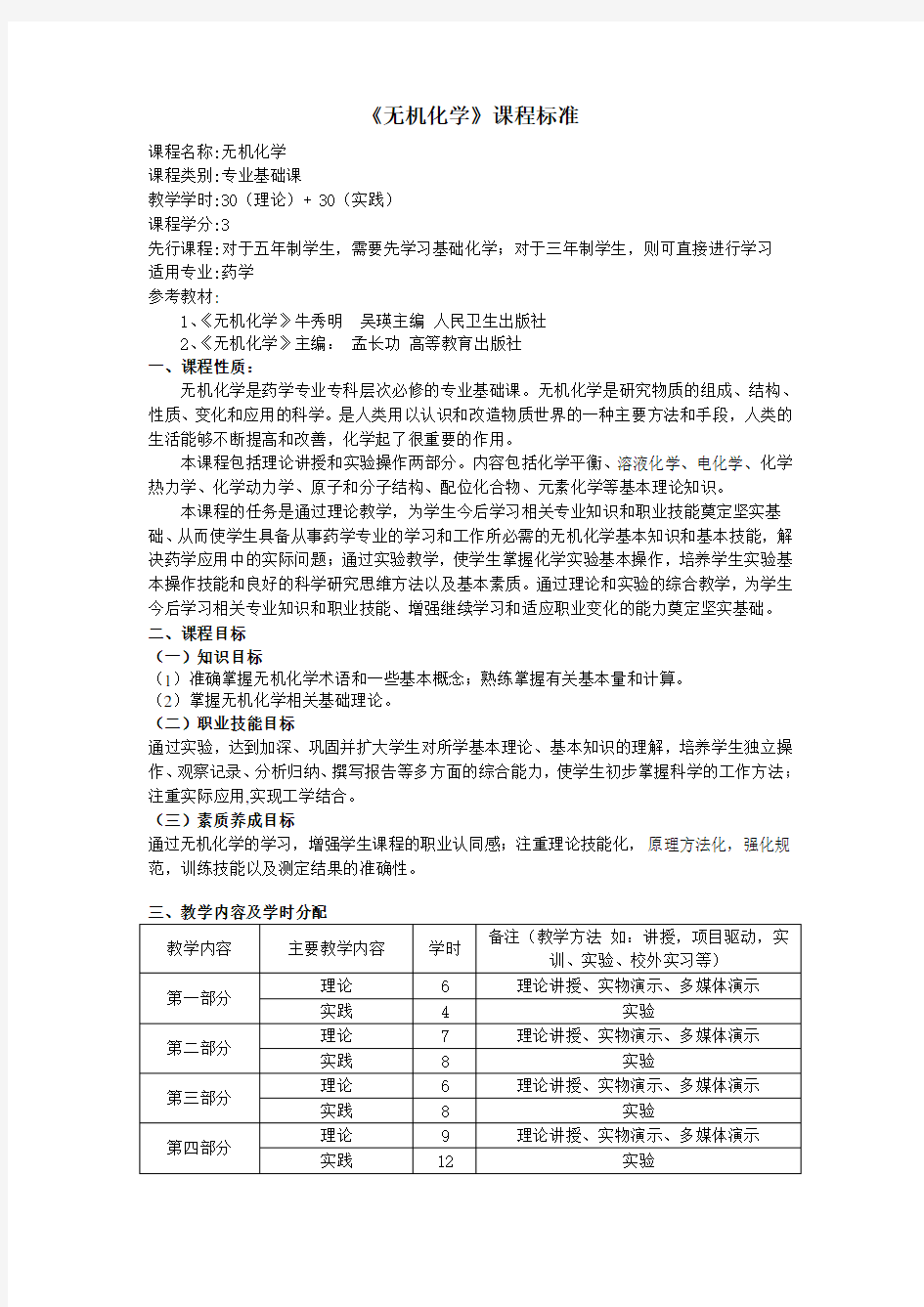
《无机化学》课程标准 高职高专

《无机化学》课程标准
课程名称:无机化学
课程类别:专业基础课
教学学时:30(理论)+ 30(实践)
课程学分:3
先行课程:对于五年制学生,需要先学习基础化学;对于三年制学生,则可直接进行学习
适用专业:药学
参考教材:
1、《无机化学》牛秀明吴瑛主编人民卫生出版社
2、《无机化学》主编:孟长功高等教育出版社
一、课程性质:
无机化学是药学专业专科层次必修的专业基础课。无机化学是研究物质的组成、结构、性质、变化和应用的科学。是人类用以认识和改造物质世界的一种主要方法和手段,人类的生活能够不断提高和改善,化学起了很重要的作用。
本课程包括理论讲授和实验操作两部分。内容包括化学平衡、溶液化学、电化学、化学热力学、化学动力学、原子和分子结构、配位化合物、元素化学等基本理论知识。
本课程的任务是通过理论教学,为学生今后学习相关专业知识和职业技能奠定坚实基础、从而使学生具备从事药学专业的学习和工作所必需的无机化学基本知识和基本技能,解决药学应用中的实际问题;通过实验教学,使学生掌握化学实验基本操作,培养学生实验基本操作技能和良好的科学研究思维方法以及基本素质。通过理论和实验的综合教学,为学生今后学习相关专业知识和职业技能、增强继续学习和适应职业变化的能力奠定坚实基础。二、课程目标
(一)知识目标
(1)准确掌握无机化学术语和一些基本概念;熟练掌握有关基本量和计算。
(2)掌握无机化学相关基础理论。
(二)职业技能目标
通过实验,达到加深、巩固并扩大学生对所学基本理论、基本知识的理解,培养学生独立操作、观察记录、分析归纳、撰写报告等多方面的综合能力,使学生初步掌握科学的工作方法;注重实际应用,实现工学结合。
(三)素质养成目标
通过无机化学的学习,增强学生课程的职业认同感;注重理论技能化,原理方法化,强化规范,训练技能以及测定结果的准确性。
四、教学内容要点:
第一部分原子与分子结构
第一节原子结构(4学时)
一、教学目的及要求
1.掌握用四个量子数描述核外电子运动状态的方法;掌握核外电子的排布及原子结构与元素周期系的关系;掌握元素某些性质的周期性规律.
2.熟悉波函数、电于云的概念;熟悉原子轨道和电子云的角度分布图。
3.了解核外电子运动的特珠性;了解多电子原子产生能级交错的原因。
二、教学重点与难点
(一)教学重点:
1.核外电子的排布及原子结构与元素周期系的关系。
2.波函数、电于云的概念。
3.元素某些性质的周期性规律。
(二)教学难点:
1.用四个量子数描述核外电子运动状态的方法。
2.原子轨道和电子云的角度分布图。
三、主要教学内容
1.核外电子运动的特殊性
①历史回顾
②核外电子运动的特殊性
③波函数与原子轨道
④电子云
⑤四个量子数
2.核外电子排布规律
①多电子原子轨道能级
②核外电子排布原理
3.原子的电子层结构和元素周期律
①原子结构与元素周期律的关系
②元素某些性质的周期性
第二节分子结构(6学时)
一、教学目的及要求
1、掌握离子健、共价键、氢键概念及特点;掌握价键理论。
2、熟悉分子间作用力及杂化轨道理论等内容。
3、了解离子晶体、分子晶体和原子晶体的特点。
二、教学重点与难点
(一)教学重点:
价键理论
(二)教学难点:
杂化轨道理论
三、主要教学内容
1、离子键
①离子键的形成
②离子键的特点
③离子的特征
④离子晶体
⑤离子的极化
2、共价键
①价键理论
②杂化轨道理论
③共价键参数
④分子晶体和原子晶体
3、分子间作用力和氢键
①分子的极性
②分子间作用力
③氢键
四、实践教学内容: 电子天平及分析天平的使用——递减法称量
1、实践教学目的及要求:
(1)了解台秤、电子天平和分析天平的构造。
(2)掌握电子天平和分析天平的使用规则及称量技术。
(3)了解在称量中如何使用有效数字。
2、实践条件要求:
该实验为实操性实验,依据课程标准,课前提出预习要求,实验前讲解实验要点、操作演示,学生实验、教师巡视指导,规范移液管及其它玻璃仪器的使用,实验后讨论、小结。对物质溶解的有关知识进行提问。示范分析天平、电子天平的正确使用。学生两人一组独立完成实验。在实验进行中,教师不断巡视并及时纠正学生操作中存在的问题。
分析天平及电子天平为精密仪器,在使用中要严格按照使用规范进行操作,以免造成损坏。
五、考核知识、技能点
掌握电子天平使用方法
第二部分溶液
第一节溶液和胶体溶液(7学时)
一、教学目的及要求
1.掌握溶液组成标度的表示方法及换算、渗透压的基本概念、溶胶和高分子化合物溶液的组成。
2.熟悉溶胶的形成及胶粒带电的原因、溶胶的稳定性和泉沉、高分子化合物溶液和凝胶的基本性质。
3.了解稀溶液的依数性的基本内容及其计算。
二、教学重点与难点
(一)教学重点:
1.溶液组成标度的表示方法及换算、渗透压的基本概念。
2.溶胶的形成及胶粒带电的原因、溶胶的稳定性。
(二)教学难点:
稀溶液的依数性的基本内容及其计算。
三、主要教学内容
1.溶液
①溶解
②溶液的组成标度
③溶液的组成标度之间的换算关系
2.稀溶液的依数性
①蒸气压下降
②沸点升高
③凝固点下降
④溶液的渗透压
3.胶体溶液
①溶胶的性质和结构
②溶胶的稳定性和聚沉
③高分子化合物溶液和凝胶
四、实践教学内容: 溶液的性质和配制
1、实践教学目的及要求:
(1)掌握饱和溶液和溶液的准确配制。
(2)了解影响溶解度的因素。
(3)了解溶解过程中的热效应及其与物质结构的关系。
2、实践条件要求:
该实验为验证性实验,依据课程标准,课前提出预习要求,实验前讲解实验要点、操作演示,学生实验、教师巡视指导,规范移液管及其它玻璃仪器的使用,实验后讨论、小结。对物质溶解的有关知识进行提问。示范容量瓶、吸管的正确使用。学生两人一组独立完成实验。在实验进行中,教师不断巡视并及时纠正学生操作中存在的问题。
溶液的配置方法及稀溶液依数性
第二节电解质溶液(8学时)
一、教学目的及要求
1.掌握共轭酸碱对的解离常数之间的关系;掌握一元弱酸(碱)、多元弱酸(碱)的有关计算;掌握缓冲溶液的组成、配制及pH的计算;掌握溶渡积规则和难溶电解质溶液中各离子浓度的计算。
2.熟悉酸碱质子理论;熟悉缓冲作用原理;熟悉难溶电解质沉淀溶解平衡的特点。
3.了解活度、活度因子、离子强度的概念;了解酸碱电子理论的概念;了解缓冲溶液和盐类水解在医药上的应用。
二、教学重点与难点
(一)教学重点:
1.共轭酸碱对的解离常数之间的关系。
2.缓冲作用原理。
3.活度、活度因子、离子强度的概念。
(二)教学难点:
1.一元弱酸(碱)、多元弱酸(碱)的有关计算。
2.缓冲溶液的pH的计算。
3.溶渡积规则和难溶电解质溶液中各离子浓度的计算。
三、主要教学内容
1.强电解质溶液理论
①离子相互作用理论
②活度、活度系数和离子强度
2.酸碱理论
①酸碱电离理论
②酸碱质子理论
③酸碱电子理论
3.水溶液中的酸碱解离平衡
①水的质子自递反应
②弱酸、弱碱的解离平衡
③共扼酸碱对K a和K b的关系
④同离子效应和盐效应
4.水溶液中质子转移平衡及有关计算
①一元弱酸(碱)水溶液质子转移平衡及计算
②多元弱酸(碱)水溶液质子转移平衡及计算
③两性物质水溶液质子转移平衡及计算
5.缓冲溶液
①缓冲溶液的基本概念
②缓冲溶液的pH计算
③缓冲容量和缓冲范围
④缓冲溶液的选择和配制
⑤血液中的缓冲系
5.难溶电解质的沉淀溶解平衡
①沉淀溶解的平衡常数——溶度积常数
②溶度积常数和溶解度的关系
③同离子效应和盐效应
④溶度积规则
⑤沉淀的生成与溶解
四、教学内容: 电解质溶液性质
1、实践教学目的及要求:
(1)了解强弱电解质电离差别及同离子效应。
(2)学习缓冲溶液的配置方法及其性质
(3)学习离心机、酸度计、pH试纸的使用等基本操作。
2、实践条件要求:
该实验为验证性实验,依据课程标准,课前提出预习要求,实验前讲解实验要点、操作演示,学生实验、教师巡视指导,规范移液管及其它玻璃仪器的使用,实验后讨论、小结。对物质溶解的有关知识进行提问。示范酸度计、离心机的正确使用。学生两人一组独立完成实验。在实验进行中,教师不断巡视并及时纠正学生操作中存在的问题。
3、实践教学设备、场地要求
醋酸解离常数的原理及方法;甘汞电极、玻璃电极及酸度计的使用。
第三部分化学反应速率
第一节化学反应速率和化学平衡(7学时)
一、教学目的及要求
1.掌握浓度、温度、压强、催化剂等外界条件对化学反应速率的影响;掌握化学平衡的概念、特点、意义及相关计算;掌握化学平衡移动的原理及应用;
2.熟悉化学反应速率的概念及表示方法;
3.了解化学反应机理及反应速率理论。
二、教学重点与难点
(一)教学重点:
1.外界条件对化学反应速率的影响
2.化学平衡移动的原理及应用
(二)教学难点:
1.化学平衡的特点及相关计算。
2.化学反应机理及反应速率理论。
三、主要教学内容
1.化学反应速率及影响因素
①浓度随时间变化曲线
②平均速率和瞬时速率
③基元反应和复杂反应
④速率方程—浓度对反应速率的影响
⑤反应机制与限速步骤
⑥阿仑尼乌斯方程—温度对反应速率的影响
2.反应速率理论简介
①碰撞理论
②过渡状态理论
③催化剂与酶
3.化学平衡和标准平衡常数
①可逆反应
②化学平衡
③标准平衡常数
④多重平衡
4.影响化学平衡的因素
①浓度对化学平衡的影响
②压力对化学平衡的影响
③温度对化学平衡的影响
四、教学内容:平衡常数的测定——滴定操作
1、实践教学目的及要求:
(1)测定I3-=I-+I2 平衡常数,加强对化学平衡,平衡常数的了解并了解平衡移动的原理。(2)巩固滴定操作。
2、实践条件要求:
该实验为验证性实验,依据课程标准,课前提出预习要求,实验前讲解实验要点、操作演示,学生实验、教师巡视指导,规范移液管及其它玻璃仪器的使用,实验后讨论、小结。对物质溶解的有关知识进行提问。学生两人一组独立完成实验。在实验进行中,教师不断巡视并及时纠正学生操作中存在的问题。
五、考核知识、技能点
影响平衡常数的因素
第二节氧化还原与电极电势(7学时)
一、教学目的及要求
1.掌握氧化还原反应的基本概念、标准电极电势及其应用;掌握能斯特方程、影响电极电势的因素及其应用。
2.熟悉利用离子电子法配平氧化还原方程式的方法。
3.了解标准氢电极结构和电极电势产生的原因。
二、教学重点与难点
(一)教学重点:
利用离子电子法配平氧化还原方程式。
(二)教学难点:
1.氧化还原反应的实质、标准电极电势及其应用。
2.能斯特方程、影响电极电势的因素及其应用。
三、主要教学内容
1.基本概念
①氧化数
②氧化还原反应的实质
③氧化还原反应式的配平
1.电极电势
①原电池
②电极电势
③标准电极电势
2.影响电极电势的因素
①能斯特方程式
②能斯特方程式的应用
3.电极电势的应用
①比较氧化剂与还原剂的强弱
②判断氧化还原反应进行的方向
③计算原电池的电动势
④元素电势图及应用
4.电势法应用举例
①离子选择性电极
②电势法测定溶液pH
四、教学内容: 葡萄糖酸锌的的制备及锌含量测定
1、实践教学目的及要求:
(1)掌握锌盐的含量测定方法
(2)了解葡萄糖酸锌的制备方法和原理
2、实践条件要求:
该实验为综合性实验,实验教学首先由任课教师简要讲解实验目的、原理、内容及操作要点,再结合现场演示,帮助学生理解和掌握实验过程中的一些要点和注意事项。学生二人一组独立完成实验。在实验进行中,教师不断巡视,并及时纠正学生操作中存在的问题。学生针对预习过程中出现的问题,在教师的讲解过程中应重点关注。对于教师要求的实验操作要点,懂得原理。实验操作过程中要仔细记录实验现象,并利用理论知识进行解释,最后,规范撰写实验报告,认真分析实验数据。
3、实践教学设备、场地要求
锌盐的含量测定方法
第四部分常见化合物
第一节配位化合物(7学时)
一、教学目的及要求
1.掌握配位化合物的基本概念、组成、命名;掌握配位平衡和稳定常数的意义,掌握配位平衡的有关计算。
2.熟悉配位化合物的类型;熟悉配位化合物价健理论的基本内容。
3.了解配位化合物的异构现象,了解配位化合物在医药上的应用。
二、教学重点与难点
(一)教学重点:
1.配位化合物的组成、命名。
2.配位化合物的异构现象。
(二)教学难点:
1.配位平衡和稳定常数的意义及配位平衡的有关计算。
2.配位化合物的类型及配位化合物价健理论的基本内容。
三、主要教学内容
1.配合物的基本概念
①配合物的组成
②配合物的命名
③配合物的异构现象
④鳌合物和鳌合效应
2.配合物的价键理论
①价键理论基本要点
②内轨型配合物与外轨型配合物
③配合物的磁性
高职高专_新职业英语(课程标准)
江西现代职业技术学院 《新职业英语·职业综合英语》课程标准 课程名称:新职业英语·职业综合英语 英文名称: English for Careers 课程类型: 必修课、公共基础课 总学时: 48 讲课学时: 36 实验学时:12 学分: 3.5 适用对象: 商务学院、旅游经贸学院非英语专业大学一年级学生 一、课程定位 该课程为高职高专公共基础课,也是非英语专业的必修课。教学目的是使英语服务于专业,学生掌握一定的英语基础知识和技能,具有一定的听、说、读、写、译的能力,从而能借助词典阅读和翻译有关英语业务资料,在涉外交际的日常商务活动中进行简单的口语及书面交流,并为今后进一步提高英语职场交际能力打下基础。 二、主要任务 根据国家教育部高等教育司颁发的《高职高专教育英语课程教学基本要求》(以下简称《基本要求》)。 1.词汇 认知3400个英语单词(包括入学时要求掌握的1600个词)以及由这些词构成的常用词组,对其中2000个左右的单词能正确拼写,英汉互译。学生还应结合专业英语学习,认知400个专业英语词汇。 2.语法 掌握基本的英语语法规则,在听、说、读、写、译中能正确运用所学语法知识。3.阅读能力 能了解英语国家的一些风俗人情,在阅读中等难度的一般题材的简短英文资料能理解正确。能读懂通用的简短实用文字材料,如信函、技术说明书、合同等,理解正确。 4.写的能力 能就一般性题材,在30分钟内写出80-100词的命题作文;能填写和模拟套写简短的英语应用文,如填写表格与单证,套写简历、通知、信函等,词句基本正确,无重大语法错误,格式恰当,表达清楚。
三、课程目标 本课程的教学目标为:通过学习使学生的人文素质修养得到提高,掌握一定的英语基础知识和技能,具有一定的听、说、读、写的能力。 1、知识目标 (1)扩大学生的词汇量(要求学生掌握单词的读音、用法及拼写),使之达到《基本要求》中规定的3400个单词,为英语学习打下坚实的基础 (2)通过学习掌握一定的语法知识,能够分析复杂句子结构 (3)学习掌握应用文(即:表格填写、商务贺卡、商务信函、信封、传真、备忘录、邀请函、简历以及海报)的写作格式 (4)学习掌握阅读技巧与方法,如:根据定义与复述、比较与对比、举例子等方法猜词义 2、技能目标 (1)听:能听懂基本的日常对话及简短的篇章 (2)说:能进行基本的口语交流 (3)读:在阅读生词不超过总词数3%的英文资料时,阅读速度能不低于每分钟70词 (4)写:在30分钟之内能写出80—100字的应用文,制作英文MINI-PROJECT 的作业。 3、态度目标 (1)培养学生的人文素质,增强学生的团队意识,能够准确把握学生人文素质教育方向。 (2)培养学生养成良好的学习习惯及掌握有效的学习英语的方法 (3)通过举办英语演讲比赛、英语特色班、英文话剧、英文歌曲、播放英文电影等形式增强学生对国外的了解,提高学习英语的兴趣 四、教学内容与能力要求 1.知识点和教学要求 《新职业英语》系列教材共三册,前两册为《职业综合英语》,第三册为《新职业英语·行业篇》,每册共有8个单元,每个单元由以下几个项目组成: (1)Warming-up 本部分围绕单元主体设计一些简单有趣的活动,既能引起学生的兴趣,导入主题的学习,又能让学生就此话题交流自身的经验,展示已有的语言知识与技能,为后面的学习做好准备。 (2)Reading A 本部分围绕一篇阅读材料展开一系列的活动,是各单元的核心部分。每单元根据不同职业涉外活动中典型的英语交际场景进行选材,提供主题背景或商务文化方面的信息,侧重语言信息的输入。 (3)Reading B 本部分根据单元主题选取了与之相关的职场工作中的实用文体,例如公司简介、公司内部简报、酒店菜单等,培养学生把握真实工作语料的能力。 (4)Listening ﹠Speaking 本部分围绕单元主题涉及到的典型职业活动场景,
初中化学课标解读
初中化学课标解读、教材分析———酸碱盐 沁阳六中胡小霞 今天我说课的题目是九年级化学课标解读、教材分析———酸碱盐,人教版九年级化学的特点是从初中学生的思维发展水平出发,结合他们已有的知识和日常生活经验,以广阔的自然和社会为背景,贴近生活,联系社会实际建构学习情景,引入化学知识,重视化学、技术与社会相互联系。设置许多的活动与探究内容,体现学生自主学习的过程,提倡以科学探究为主的多样化学习方法,培养学生理论联系实际,善于解决简单化学问题的能力。体现初中化学课程的基础性、普及性和启蒙性。 下面我准备从课程标准的要求,内容标准,教材的编写原则,知识结构和内在逻辑关系,教材分析,建议内容等六个方面进行研说。 一.总体课程目标 义务教育阶段的化学课程以提高学生的科学素养为主旨,激发学生学习化学的兴趣,帮助学生了解科学探究的基本过程和方法,培养学生的科学探究能力,使学生获得进一步学习和发展所需要的化学基础知识和基本技能;引导学生认识化学在促进社会发展和提高人类生活质量方面的重要作用,通过化学学习培养学生的合作精神和创新意识,提高未来公民适应现代社会生活的能力。 通过义务教育阶段酸碱盐的学习,学生主要在以下三个方面得到发展。 知识与技能方面: 要求认识物质的多样性, 了解酸碱盐的组成.结构和命名, 掌握常见酸碱盐的性质和用途, 学会粗盐的提纯.碳酸钠的检验等. 过程与方法方面: 通过动手实验锻炼实验技能, 通过观察分析比较归纳,从而进行信息加工。 情感态度与价值观方面: 通过激发兴趣,培养科学精神,强化环保意识. 二..内容标准 内容标准是《课程标准》的重要组成部分,人教版九年级化学包括5个一级主题,每个一级主题由若干个二级主题(单元)构成,这5个一级主题分别是科学探究,身边的化学物质,物质构成的奥秘, 物质的化学变化,化学与社会发展. 内容标准对酸碱盐的要求:通过学习知道常见酸碱盐的主要性质和用途, 初步学会稀释常见的酸碱溶液, 会用酸碱指剂和pH试纸检验溶液的酸碱性,(例如:会用酚酞咝试剂鉴别酸碱盐) 知道酸碱性对生命活动和农作物生长的影响,了解食盐、纯碱、小苏打、碳酸钙等盐在日常生活中的用途,知道一些常用化肥的名称和作用,初步认识复分解反应并能解释与日常生活相关的一些现象.
(精选)大一无机化学期末考试试题精选
(√) 1. 电子云是描述核外某空间电子出现的几率密度的概念。 (√)2. 同种原子之间的化学键的键长越短,其键能越大,化学键也越稳定。 (√)3.系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和焓的变化量均为零。(√)4. AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。 (×)5. 原子轨道的形状由量子数m决定,轨道的空间伸展方向由l决定。 (1)某元素原子基态的电子构型为1s22s22p63s23p5,它在周期表中的位置是:a a.p区ⅦA族 b.s区ⅡA族 c.ds区ⅡB族 d.p区Ⅵ族 (2)下列物质中,哪个是非极性分子:b a.H2O b.CO2 c.HCl d.NH3 (3)极性共价化合物的实例是:b a.KCl b.HCl c.CCl4 d.BF3 (4)下列物质凝固时可以形成原子晶体的是:c a. O2 b. Pt, c. SiO2 d. KCl (5)在298K,100kPa下,反应 2H2(g)+O2(g)=2H2O(1) Δr H mΘ= -572 kJ·mol-1 则H2O(l)的Δf H mΘ为:d a.572 kJ·mol-1 b.-572 kJ·mol-1 c.286 kJ·mol-1 d.-286 kJ·mol-1 (6)定温定压下,已知反应B=A的反应热为Δr H m1Θ,反应B=C的反应热为Δr H m2Θ,则反应A=C的反应热Δr H m3Θ为:d a.Δr H m1Θ+Δr H m2Θ b.Δr H m1Θ-Δr H m2Θ c.Δr H m1Θ+2Δr H m2Θ d.Δr H m2Θ-Δr H m1Θ (7)已知HF(g)的标准生成热Δf H mΘ= -565 kJ·mol-1,则反应H2(g)+F2(g)=2HF(g)的Δr H mΘ为:d a.565 kJ·mol-1 b.-565 kJ·mol-1 c.1130 kJ·mol-1 d.-1130 kJ·mol-1 (8)在氨水溶液中加入固体NH4Cl后,氨水的离解度:d a.没变化 b.微有上升 c.剧烈上升 d.下降 (9)N的氢化物(NH3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH3:c
高职英语课程标准
《高职英语》课程标准 一、课程概述 (一)制定依据 本标准根据国家教育部高等教育司颁发的《高职高专教育英语课程教学基本要求》中对《高职英语》课程培养目标的要求制定。 (二)课程性质与作用 高职英语是高职教育中一门重要的公共必修课程。本课程意在经过120学时的教学,使学生掌握一定的英语基础知识和基本技能,具有一定的英语语言综合应用能力,即一定的听、说、读、写、译的能力,从而能借助词典阅读和翻译有关英语业务资料,在涉外交际的日常活动和业务活动中进行简单的口头和书面交流,并为进一步提高英语水平打下较好的基础。通过学习,学生应能够具备通过高等学校应用能力考试A级或B级的水平。 高职英语为高职院校学生后续专业课程打下基础。高职英语是一门公共基础课程,是一门综合性的英语课程,它涵盖各行业的基本专业词汇、日常生活的交际用语以及科技用语等,为学生以后学习会计英语、商务英语、计算机英语等专业英语打下基础,也为学生学习专业课中的英文术语打下基础。 (三)课程设计思路 本课程的教学强调其实践性:一是课堂内的实践,注重引导学生将所学的理论用于
完成某项交际任务的实践;二是通过开展语音语调大赛、语音语调模仿、"演讲"、"情景对话"等旨在通过比赛改善学生的英语发音,提高学生英语的口头表达能力,为学生们提供一个学以致用的机会,一个展现个人才能的舞台,在学生中营造一个多听,多说,多练英语的活泼的学习气氛,更好地满足不同层次学生的需要,同时通过实践培养学生分析问题和解决问题的能力,从而使课程达到最佳的教学效果。 (四)课程内容选取依据 本校高职英语教学使用教材为《现代实用职业英语综合教程》(ModernPracticalVocationalEnglish)是由“北京师范大学出版集团”编写的普通高等教育“十一五”国家级规范教材。本教材坚持《高职高专教育英语课程教学基本要求》的正确方向,体现了高职高专教育“以应用为目的,实用为主,够用为度”的原则,突出了高职高专培养实用性人才的目的。 《新编实用英语综合教程》共分为4册(本校大部分专业学习2册书的内容),每册8个单元,每个单元都由听说(ListeningandSpeaking)、读(ReadingandSkillDeveloping)、写(GrammarStudyingandWriting)三部分组成,另有一个“达人英语”(ExpertEnglish)部分。各部分具体内容如下: 包括:热身训练、回答问题、语音练习、句子或短对话、短文听力、等。其选取材料形式多样,并以丰富与主题相关的各种信息,增加语音输入,强化语言技能,学生边学边练。 本部分注重“阅读与技能培养”,由围绕同一主题的两篇文章组成。题材、体裁丰富多彩,原汁原味,涉猎面广博,体现了多元化、多方位文化的只是输入。学生在学习语言文化的,同时也能增加自己的应用性知识。 本部分结合中国学生典型错误进行分析讲解,力图使学生从认识错误到改正错误再到有意识地避免错误,逐步提高写作水平。 二、课程目标 培养学生具有较强的阅读能力和一定的听、说、写、译能力,使他们能用英语交流信息,打下扎实的语言基础,掌握良好的语言学习方法,提高文化素养,以适应社会发展和经济建设的需要。鉴于目前高职学生入学时英语的水平差异较大,本课程的教学要求分为A、B两级,A级是标准要求,B级是过渡要求。入学水平较高的学生应达到A级要求,入学水平较低的学生至少应达到B级要求。 本课程在加强英语语言基础知识和基本技能训练的同时,重视培养学生实际运用英语进行交际的能力。通过本课程的学习,学生应该达到下列要求: (1)词汇
《无机化学》课程标准
中山职业技术学院 课程标准 课程名称:无机化学 适用专业:工业分析与检验、精细化学品生产技术 学时数:72 学分:3 @ 2010年 4 月
《无机化学》课程标准 一、课程的性质 《无机化学》课程是工业分析与检验专业、精细化学品生产技术专业的职业能力核心课程之一。本课程通过研究单质和化合物的组成、结构、性质及反应,使学生理解和掌握周期律、分子结构、氧化还原、配合物、化学热力学等初步知识,并在原理的指导下,理解化学变化中物质结构与性质的关系,初步从宏观和微观不同的角度理解化学变化的基本特征,使学生掌握常见元素及化合物的酸碱性、氧化还原性、溶解性、热稳定性、配位能力及典型反应,熟知元素周期表中各类物质的性质及其变化规律。本课程为职业能力课,后续课程有《有机化学》《分析化学》《分析化学技术》《化工安全技术》等课程。 二、设计思路 . 本课程的构建以“化工专业工作任务与职业能力分析表”中的教学工作项目设置为指导,并结合了中山市及珠三角地区化工从业人员的能力要求和学院专业教学标准。它基于职业教育工学结合的特点,密切结合专业生产的需要,精选学生必须掌握的基础理论、基本知识和基本技能,既保证了基本内容的深广度及科学性,又培养和提高了学生的独立工作能力。本着宽基础、多方向的就业思路,根据专业岗位群技能要求,从而确定教学内容、教学时数和教学方法。本门课程内容包括理论知识和实践教学两大模块,其中,理论知识模块包括化学反应速率和化学平衡、电解质溶液和离子平衡、氧化和还原、原子结构和元素周期律、分子结构和晶体结构、配位化学和元素、单质及化合物的性质等几个部分,实践教学模块包括化学实验中的基础知识和基本操作、数据表达与处理、玻璃管加工及塞子的打孔、台秤与分析天平的使用、酒精灯的使用、电导率仪的使用、酸度计的使用、醋酸电离常数的测定、水合硫酸铜结晶水的测定、二氧化碳相对分子质量的测定等。 无机化学作为化学专业最基础的一门专业课程,它涉及到的知识面很广,学生在掌握基础理论的同时,也要注重实验操作技能的训练。 三、课程教学目标 《无机化学》课程是培养学生化学基础知识、化学思维方法和实验动手能力的一门课程。通过本课程的学习,学生从整体上认识化工相关工作所需要的知识与技能,为后续课程学习作前期准备,为学生顶岗就业夯实基础。同时,培养学生实事求是、勇于创新的职业道德情操,使学生具备较强的工作方法能力和社会能力。主要实现以下目标:专业知识目标:
无机化学专业的专业英语词汇
无机化学专业英语词汇 1.化学原理chemical principles 2.气体,液体和溶液的性质the behaviors of gas ,liquid and solution 3.理想气体定律ideal gas law 4.道尔顿分压定律Dalton’s Law of Partial pressures 5.液体的蒸汽压vapor pressure of liquid 6.液体的凝固点freezing point of liquid 7.体系和环境system and surrounding 8.状态和状态函数states and state functions 9.化学热力学基础the basis of chemical thermodynamics 10.化学平衡chemical equilibrium 11.体系与状态system and state 12.热力学定理law of thermodynamics 13.热化学thermochemistry 14.焓enthalpy 15.混乱度disorder 16.熵entropy 17.吉布斯自由能Gibbs free energy 18.化学平衡chemical equilibrium 19.标准平衡常数standard equilibrium constant 20.同离子效应the common ion effect 21.缓冲溶液buffered solution 22.酸碱理论与电离平衡the theories of acids &bases and ionization equilibrium 23.盐的水解the hydrolysis of salts 24.沉淀反应the precipitation reactions 25.溶度积solubility product 26.沉淀溶解平衡的移动 equilibrium shift between precipitation and dissolution 27.分步沉淀stepwise precipitation 28.盐效应salt effect 29.氧化还原反应oxidation and reduction reactions 30.还原剂reducing agent or reducer or reductant 31.氧化剂oxidazing agent or oxidizer or oxidant 32.原电池galvanic cell 33.负极,正极negative pole, positive pole 34.阳极,阴极anode ,cathode 35.燃料电池fuel cell 36.电化学electrochemistry 37.电极电势electrode potential 38.歧化反应disproportionation reaction 39.化学动力学基础the basis of chemical dynamics 40.化学反应速率the rate of chemical reaction 41.化学反应机理reaction mechanism 42.化学反应活化能activation energy of chemical reaction 43.动能kinetic energy 44.基元反应elementary reaction 45.一级反应first-order reaction 46.零级反应zero-order reaction 47.化学理论chemical theories 48.原子结构the atomics structure 49.元素周期律periodic system of elements 50.原子内部structure in atom 51.氢原子光谱the spectrum of atomic hydrogen 52.等电子原理isoelectronic principle 53.电子构型electronic structure of atom 54.价电子构型valance electronic configuration 55.主量子数principal quantum number
英语国家概况课程标准
英语国家概况课程标准 课程代码: 适用专业:商务英语 一、课程概述 1.课程性质 语言是文化的载体,文化是语言的基础。英语语言学习和英国国家文化相互依存、密不可分。一个优秀的英语语言学习者,若不了解该语言背后所承载的民族文化,其交际能力也会受到限制。该课程能使学生了解和掌握英美两国政治,历史,经济,社会,文化和教育等基本知识,了解英美国家社会发展、现状和影响这两个国家社会发展的因素,拓展学生的知识面,培养学生文化意识,启发学生了解西方社会,了解交际规则,增强学生的英语语言学习能力,为后续专业课程的学习打下一定的基础,进而为培养高技能应用型复合人才打下基础。 2.课程设计思路 本课程在设计上围绕合作学习法—任务型教学法、比较教学法、线索梳理法、启发式等教学法。 合作学习法—任务型教学法 合作学习法又称协作学习,是以合作学习小组为基本形式,系统利用教学中动态因素之间的互动,促进学生的学习,以团体成绩作为评价标准,共同完成教学活动。任务型教学法是一种以任务或活动为核心单位计划组织语言教学的途径,一种强调“在做中学”的语言教学方法。合作学习法与任务型教学法结合是指教师设计学习任务,指导并帮助学生以小组为单位通过合作、协商完成学习任务的教学过程。主要采用组织演示、演讲、讨论等形式。 2)比较教学法 比较教学法是在教学过程中,利用教学内容的相互联系和区别,促进学生掌握和巩固教学内容、达到教学目标的一种逻辑思维方法。例如,在学习美国的政体时,我们可以和英国政体、甚至是我国的政体进行比较,异中求同,同中求异。从而对“Parliament”、“Congress”和我国的NPC (The National People’s Congress)形成更深刻的理解。运用这种教学法不仅有利于学生掌握基本知识与技能,而且有利于提高学生的创造性思维能力。3)线索梳理法 线索梳理法,尤其是历史年代轴线表示法是表达历史线索最清晰的一种方式,这种方式的特点是易于梳理,可操作性强,非常直接,便于记忆。比如说,英国历史很长,如果不进行梳理,很难记忆,如果整理成一条线索,效果却不能同日而语: Early settlers——Roman invasions——Anglo-Saxons——the Viking and Danish Invasions——the Norman Conquest——William’s Rule——the Great Charter——the Hundred Year’s War——the English Reformation——the English Renaissance——the Civil War——the Glorious Revolution——the Industrial Revolution——the two World Wars 同样,美国历史部分可整理成这样一条线索: The war of Independence——the War of 1812——territorial expansion and Westward Movement——the Civil War——the two World Wars——the Cold War——the Berlin Blockade——the Civil Rights Movement in the 1950s——the Vietnam War 二、课程培养目标 1.知识目标 了解主要英语国家的地理,历史,经济和政治等方面的概况;了解主要英语国家的文化传统,风俗习惯和社会生活的其他有关情况。 2.技能目标 扩大知识面,有效弥补英语专业学生知识面窄的不足;提高英语阅读的能力和语言应用能力。 3.素质目标
《有机化学》课程标准
《有机化学》课程标准 课程代码:0299057B1 建议课时数:54 适用专业:药品经营与管理专业 先修课程:无机化学 一、前言 (一)课程的性质 《有机化学》是研究有机化合物及其变化规律的一门科学。它是药品经营与管理专业的一门专业基础课,与专业课密切相关。《有机化学》的主要任务是阐明有机化合物的结构、性质、应用及其合成的基础理论和基本知识,重点和难点深入浅出,训练基本操作技能,使学生获得从事药品经营与管理各个岗位工作必需的有机化学基本理论、基础知识,注重培养学生的基本技能,应用所学的知识分析和解决实际问题,为学习专业课和毕业后从事本专业相关岗位工作打下坚实的基础。 (二)设计思路 《有机化学》课程是药品经营与管理专业的职业基础课。是一门以实验为基础的理论性和实践性并重的课程。《有机化学》课程改革一直体现着“基础课服务于专业课”的精神。该课程的总体设计思路是:淡化学科意识强化专业意识,强调“必须、够用”原则。紧紧依附专业,提炼、收集本学科的知识点、能力点,以它们为主线整合优化教学内容。注重职业素养教育,加强与后续课程的横向联系,内容的选取上着眼于专业需求,以“需用为准、够用为度、实用为先”的原则服务于药物化学、药物分析、生物化学等后续课程。例如,《有机化学》设置有与药物化学关系密切的杂环化合物、萜类和甾体化合物等;在实验技能训练中,遵循“加强基本训练、体现职业特色、建立环保意识”的原则,以药学研究中所需的有机化学基本技术为主线,组织实验教学内容,循序渐进,着重培养了学生的基本操作能力,如回流、蒸馏、
分馏等实验操作练习均为培养学生后期对药物提取、分析的能力打下了扎实的基础。 依据我院专业办学定位、人才培养方案要求,该门课程总学时设为54学时。理论:40学时;实验:14学时。 二、课程目标 知识目标 (1)掌握主要类型有机化合物的结构特点、命名。 (2)掌握各有机化合物官能团的典型性质,熟悉典型有机反应类型和实例。 (3)掌握简单的有机化学结构理论,能通过有机化学的结构特点分析各类有机化合物的性质。(4)掌握各类有机化合物的异构现象。熟悉有机化合物的构型、构象等立体化学基本知识。(5)熟悉各类有机化合物的鉴别方法。 (6)了解与医药有关的典型的有机化合物的性质、来源及用途。 (7)能够运用所学有机化学知识对有关化学问题具有进行分析与评价能力。 (8)能够运用所学有机化学知识理解和分析药物化学和药物分析的理论和相关问题。 技能目标 (1)学会有机化学实训常用仪器的使用,掌握有机化学实训的基本操作技能。 (2)学会蒸馏、回流、分离、萃取等有机化学基本单元操作。 (3)掌握各类常见有机化合物的定性鉴定方法。 (3)掌握实验数据的处理和分析方法,掌握实验报告的书写方式。 职业素质和态度目标 (1)树立安全意识和环保意识、初步建立绿色化学理念。 (2)培养综合分析问题和解决问题的能力,养成严肃认真、实事求是的科学态度和严谨的工作作风。
大一无机化学期末考试试题精选
(√ ) 1. 电子云是描述核外某空间电子出现的几率密度的概念。(√)2. 同种原子之间的化学键的键长越短,其键能越大,化学键也越稳定。 (√)3.系统经历一个循环,无论多少步骤,只要回到初始状态,其热力学能和焓的变化量均为零。 (√)4. AgCl在NaCl溶液中的溶解度比在纯水中的溶解度小。(×)5. 原子轨道的形状由量子数m决定,轨道的空间伸展方向由l决定。 (1)某元素原子基态的电子构型为1s22s22p63s23p5,它在周期表中的位置是:a a.p区ⅦA族 b.s区ⅡA族 c.ds区ⅡB族 d.p区Ⅵ族 (2)下列物质中,哪个是非极性分子:b a.H2O b.CO2 c.HCl d.NH3 (3)极性共价化合物的实例是:b a.KCl b.HCl c.CCl4 d.BF3
(4)下列物质凝固时可以形成原子晶体的是:c a. O2 b. Pt, c. SiO2 d. KCl (5)在298K,100kPa下,反应 2H2(g)+O2(g)=2H2O(1) Δr H mΘ= -572 kJ·mol-1 则H2O(l)的Δf H mΘ为:d a.572 kJ·mol-1 b.-572 kJ·mol-1 c.286 kJ·mol-1 d.-286 kJ·mol-1 (6)定温定压下,已知反应B=A的反应热为Δr H m1Θ,反应B=C的反应热为Δr H m2Θ,则反应A=C的反应热Δr H m3Θ为:d a.Δr H m1Θ+Δr H m2Θ b.Δr H m1Θ-Δr H m2Θ c.Δr H m1Θ+2Δr H m2Θ d.Δr H m2Θ-Δr H m1Θ(7)已知HF(g)的标准生成热Δf H mΘ= -565 kJ·mol-1,则反应H2(g)+F2(g)=2HF(g)的Δr H mΘ为:d a.565 kJ·mol-1 b.-565 kJ·mol-1 c.1130 kJ·mol-1 d.-1130 kJ·mol-1 (8)在氨水溶液中加入固体NH4Cl后,氨水的离解度:d
《无机化学》专科辅导资料考试资料答案北京中医药大学远程教育学院
1 《无机化学》专科辅导资料 A 型题: 1. NaAc 固体加到HAc 溶液中去,将使HAc 的 D.电离度减小 2. 强电解质溶液的表观电离度总是小于100%,原因 是 B.正负离子互相吸引 3. 一种酸的强弱可用下列哪一种数据来衡量 C.电离常数 4. 已知NH 3·H 2O 的θb K = 10—4.75,将0.2 mol ·L —1 的NH 3·H 2O 和0.2 mol ·L —1的NH 4Cl 等体积混合, 溶液的pH 值为 A .9.25 5. 计算无机多元弱酸的酸度时 D .θ1a K /θ2a K ≥104时,可以按一元弱酸处理 6. 有一难溶电解质AB,在水溶液中达到溶解平衡,设平衡时[A] = X ·mol ·L —1,[B] = Y ·mol ·L —1,则θSP K 可表达为 B .θSP K = X ·Y 7. 在下列分子中元素氧化值为+7的是 D .(NH 4)2S 2O 8 8. 已知:BrO 4— +0.93 BrO 3— +0.54 BrO — +0.54 Br 2 +1.07 Br — 能发生歧化反应的是 C .Br 2 9. 电子运动具有波动性B .电子衍射实验可以证实 10.下列各组量子数哪组是正确的 D .n =4 l =3 m =0 m s =+1/2 11. 中心原子采取sp 2 杂化,空间构型为平面三角形的是 C .BF 3 12. 泡里原理(pauli )指的是 B .在同一原子里,不 能有四个量子数完全相同的电子 13.ψ2的物理意义是D 代表原子在该点(r 、θ、?)出现的概率密度,即单位微体积中电子出现的概率 14.水分子间产生的作用力是哪一种 E. 取向力+色散力+诱导力+氢键 15.当n = 3时,?则该电子层最多可容纳的电子数 B. 18个电子 16.在 HAc 溶液中加入 NaCl 固体振荡后 B. 溶液 的 pH 值降低 17.铁的原子序数是26,Fe(Ⅲ)离子的电子层结构在基态时是下列哪种构型 D. [Ar] ↑ ↑ ↑ ↑ ↑ 18.在下列哪一种物质中,氧的氧化值与水的氧的氧化 值不同 D. H 2O 2 19、在饱和H 2S(θ1a K =1.32×10-7,θ2 a K = 7.08×10- 15)水溶液中,何者浓度最小 C. S 2- 20.难溶物 AgCl 的溶解度为 s (mol·L - 1),其 θSP K 等于E. s 2 21.下列配体中,何种配体是螯合剂 D. NH 2CH 2CH 2NH 2 22.实际浓度为0.1 mol·L -1 的NaCl 溶液,其有效浓度为0.078 mol·L -1 ,对此现象最恰当的解释是:C .离子间的相互牵制 23.原电池中负极发生的是A .氧化反应 24.氨分子间产生的作用力是E. 取向力+色散力+诱导力+氢键 25.HAc 溶液中,加少量固体NaAc 后,则B. 溶液酸度 下降 26.0.1mol·L -1的H 2S(θ1a K =9.1×10- 8,θ2a K =1.1×10- 12)水溶液中,浓度最大的是:A. H 2S 27.温度一定时,决定某弱酸及其盐缓冲溶液pH 值的 主要因素是:D.弱酸和其盐的浓度比 28.π键的特征是 D.原子轨道以平行方式重叠,重 叠部分通过一个键轴平面,具有镜面反对称 29.下列有关分步沉淀叙述中正确的是A.J θ先达到溶 度积者先沉淀出来。 30.下列分子中,中心原子以sp 2 杂化轨道成键,且具有π键的是D. BF 3 31.具有极性共价键的非极性分子是E 、BF 3 33.下列五组量子数中,不合理的是E 、n =4,l =4,m =3,m s =+1/2 34.根据质子论,下列物质中,哪一种既具有酸又具有碱的性质C .HS - 35.难溶物 Mg(OH)2 的溶解度为 s (mol·L - 1),其 θSP K 等于B. 4s 3 13.电子云是指C .核外电子概率密度分布的形象化 表示 37.NH 3·H 2O 溶液中,加少量固体NH 4Cl 后,则B.溶液中OH -浓度下降 38.在0.1mol ?L -1H 2S (θ1a K =1.32×107,θ2a K =7.08×10-15)水溶液中,浓度最小的是 C. S 2- 40. 在含有Cl —、Br —、I — 离子的溶液中,逐滴加入 AgNO 3溶液,则E .离子的J 先达到θSP K 值者先沉淀出来 41.BaSO 4的溶解度为1×10—5 mol ·L —1,它的溶度积是D .1 ×10—10 42在Na 2S 4O 6中硫的氧化值是:D .+5/2 43.在反应方程式MnO 4—+8H +( ) Mn 2++4 H 2O,中 括号应填入B .+5e 44.原电池中正极发生的是B .还原反应 45.E θ值越大,则该氧化还原反应B .反应进行的越完全 46.下列五组量子数中,合理的是 A 、n =4,l =3,m =2,m s =+1/2 47.原子轨道是描述C .核外电子概率(几率)出现 最多的地方 48.σ键的特征是 C 、原子轨道沿键轴方向重叠,重叠部分沿键轴呈圆柱形对称 49.下列分子中,中心原子以sp 2杂化轨道成键的是B. C 2H 4 15.具有极性共价键的极性分子是 C. NH 3 50.氯分子与水分子间产生的作用力是哪一种 E. 取向力+色散力+诱导力+氢键 51.根据价键理论, 空间构型为正四面体形的是以下 哪种类型杂化的A. sp 3 52.下列物质中,加入HCl 后酸效应不明显的是 C. [Fe(SCN)6]3- 53. 由实验测得电解质的电离度小于100%,对此互吸理论的解释是 B .由于“离子氛”的存在,离子不能自由运动 54.HCN 溶液中,加少量固体NaCN 后,则B. 酸度下降 55. 在0.1mol .L -1的H 2S (θ1a K =1.32×10-7,θ2 a K =7.08×10- 15)水溶液中,[S 2-]浓度(mol .L -1)为 D. 7.08×10- 15 59. 反应NH 3 + H 2O NH 4+ + OH — 属下列哪一类反应 A .酸碱反应 60.在反应方程式Cr 2O 72— +14H +( )2Cr 3+ + 7H 2O, 中括号应填入:C .+6e 61.电池反应是C .氧化还原反应 63.下列五组量子数中,不合理的是 E. n =3,l =3,m =2,m s =-1/2 66.下列分子中,中心原子以sp 杂化轨道成键的是A. BeCl 2 67. 下列分子中为极性分子的是 C. NH 3 68. CCl 4与H 2O 产生的作用力是哪一种 C. 色散力 +诱导力 69. 根据价键理论, 空间构型为平面正方形的是以下列哪种类型杂化的E. dsp 2 70. 右图 y 为 D .p y 电子云角度 分布剖面图 X 型题 71.对于H 2O 分子来说,下列说法正确的是A .空间构型为V 型C .偶极矩不等于零 D .以不等性sp 3 杂化E .有两对未成键电子 72.下列物质具有还原性的是B. Na 2SO 3 C. H 2O 2 E. H 2S 73根据原子电子层结构的特点,可将周期表中的元素 分为A .s 区 B .ds 区C .d 区、D .f 区 E 、p 区 74.下列物质中,属于简单配合物的是B. [Ag(CN)2]- D. [Cu(SCN)4]2- E. [Cu(H 2O)4]2+ 75.下列各对能组成缓冲对的是: A. NH 3·H 2O —NH 4Cl B. HAc —NaAc C. HCO 3-—CO 32- 76.下列分子或离子中,中心原子以sp 3不等性杂化轨道成键的是A .NH 3 C .H 2O E .PH 3 77. 根据质子论,下列分子或离子中可作为酸的是B .H 3PO 4 C .HPO 42— E .H 3O + 78.分子间存在氢键的有C .H 2O D .NH 3 E .H F 79.下列每组四个量子数(n ,l ,m ,m s )合理的是 A .4,1,0, +1/2 C .3,2,2,-1/2 80.ψ2的物理意义是B .电子在核点(r 、θ、φ)出现的概率密度 D .单位微体积中电子出现的概率 81.对于H 2O 分子来说,下列说法正确的是A .空间构型为V 型 D .以不等性sp 3杂化 E .有两对未成键电子 82.已知在酸性溶液中,氯的元素电势图如下ClO 4- +0.36 ClO 3- +0.33 ClO 2- +0.66 ClO - +0.40 Cl 2 +1.36 Cl - 下列物质不能发生歧化反应的是A .ClO 4- B .ClO 3- D .ClO - 83.下列物质中,不属于螯合物的是B. CuCl 3- D. Cu(SCN)42- E. Cu(H 2O)42+ 84.在酸性条件下,能将Mn 2+氧化为MnO 4-的是A .PbO 2 B .(NH 4)2S 2O 8 85.下列物质具有剧毒,需要特殊保管的是D .As 2O 3 E .HgCl 2 86.下列酸中,可以固体形式存在的是A .HIO 3 B .纯H 3PO 4 C .H 4SiO 4 D .HBO 3 87.对d 区元素,下列说法正确的是A .在水中大多显颜色 C .均为金属元素 D .含多种氧化值 E .易形成配合物 88.对于NH 3分子来说,下列说法正确的是B .为极性分子 D .以等性sp 3 杂化 E .有一对未成键电子 89.下列物质具有还原性的是B. Na 2SO 3 E. H 2S 91.下列物质中,属于简单配合物的是B. [Ag(CN)2]- D. [Cu(SCN)4]2- E. [Cu(H 2O)4]2+ 93.下列分子或离子中,中心原子以sp 3不等性杂化轨道成键的是A .NH 3 C .H 2O E .H 2S 94.ψ2的物理意义是B .电子在核点(r 、θ、?)出现的概率密度 D .单位微体积中电子出现的概率 96.已知在酸性溶液中,锰的元素电势图如下MnO 4— +0.564 MnO 42— +2.26 MnO 2 +0.95 Mn 3+ +1.5 Mn 2+ -1.182 Mn 能发生歧化反应的物质是 B. MnO 42— D. Mn 3+ 97.︱ψ︱2的物理意义是D .单位微体积中电子出现的概率(几率)E .电子在某点(r 、θ、?)出现的概率(几率)密度 99.下列分子或离子中,中心原子以sp 3不等性杂化轨道成键的是A .NH 3 C .H 2O 100.对于H 2S 分子来说,下列说法正确的是A .空间构型为V 型 C .H —S 键有极性D .以等性sp 3杂化 E .有两对未成键电子对 101.下列物质中,属于简单配合物的是 B. [Ag(CN)2]- D. [Cu(SCN)4]2- 107下列物质具有剧毒,需要特殊保管的是 D .As 2O 3 E .HgCl 2 108.对d 区元素,下列说法正确的是 A .在水中大多显颜色C .均为金属元素D .含多种 氧化值E .易形成配合物 二、填空题: 1.弱电解质的溶液越稀,电离度越大。 3.离子—电子法配平氧化还原反应的原则是氧化剂 得到的电子总数与还原剂失去的电子总数必须相等。 4.元素原子序数为17,它的核外电子排布式1S 22S 22P 63S 23P 5,该元素在 3周期 卤 族,属于 P 区。 5.核外电子运动状态的特征是量子化特性和波粒二象性。 6.鲍林电负性指定元素F 的电负性为最大。 7.离子键的特征是 没有饱和性 和 无方向性 。 8.中心离子与配位体之间的化学键是配位键。 9.配合物化学式为K 3[Fe(CN)6],其命名为高铁氰化钾, 10.写出下列矿物药的主要化学成份:生石膏 CaSO 4?2H 2O 自然铜 FeS 2 密陀僧PbO 砒霜As 2O 3 。
职业英语课程标准-2017new
《职业英语C》课程标准 一、课程基本信息 【课程名称】职业英语C 【课程代码】(此项可以暂不填写) 【开课时间】第 6 学期 【学时/学分数】68学时/4学分 【课程类型】公共必修课 【授课对象】所有专业 二、课程定位 《职业英语C》是一门公共必修课,中职学生在学完《中职英语》的基础上学习《职业英语C》。其中,《中职英语》旨在帮助刚进入学校时英语程度尚待提高的学生,使他们在相对较短的时间内,较为系统而概括地学习并掌握必要的英语知识和技能,从而能顺利地开始使用《职业英语》教材。在此基础上,《职业英语C》进一步巩固基本的语言知识和技能,并使学生的语言水平接近《高职高专教育英语课程教学基本要求》中的B级要求,为学生进入高职阶段的英语学习和B级考试做准备。 三、课程培养目标 本课程的教学目标是:根据“以实用为主,以应用为目的”的要求,培养学生的英语综合应用能力,特别是听、说技能,使学生在今后工作和社会交往中能用英语进行简单的口头和书面信息交流,同时增强其自主学习能力,掌握良好的语言学习方法,提高综合文化素质,以适应我国社会发展和国际交流的需要。本课程的教学在帮助学生打下良好的语言基础的同时,也为衔接后续的英语学习准备好条件。 本课程以课堂面授为主,学生课后广泛阅读与听力训练为辅,面授时鼓励学生积极参与课堂讨论。在教学过程中,教师还可向学生介绍我国的相关文化知识,让学生对我国与英美两国的传统文化差异有一个较为清醒的认识。同时,该课程的设计与实施要有利于学生自主学习能力的发展。为培养学生积极主动的学习方法和形成有效的学习策略,要采用课堂教学和自主学习相结合的方式,营造个性化学习的环境,努力向学生提供自主学习的资源。课程教学中还要充分运用先进的现代化教育技术,引入计算机与语音设备等多媒体教学手段,全方位、立体化得提高教学效率和教学质量。 《职业英语C》课程在帮助学生继续打好语言基础的同时,要特别重视培养学生的应用交际能力,尤其要加大对听、说技能的训练。经过三学年的学习,学生的语言应用能力及词汇
化学基础课程标准
《化学基础》课程标准 一、课程性质 《化学基础》是生物工程系专业的一门基础辅助课程。是对无机化学、分析化学、有机化学课程的基本理论、基本技能进行优化组合、有机组合而形成的一门课程。主要讲授化学基础的基本概念、原理和技术,包括溶液浓度的计算、配制及通性,化学反应速率和化学平衡,电解质溶液和离解平衡,滴定分析法和酸碱中和滴定,分光光度法,有机化学基本知识和基本理论。 二、参考学时及学分 该课程总学时60,其中理论38学时,实验22学时。 三、课程目标 通过本课程讲授和实训的学习,使学生熟悉化学基础课程在本专业中所必需的化学基本概念和化学理论相关知识,掌握化学实验基本操作和实验仪器的组装及使用技能。同时培养学生具有良好的职业道德、行为规范和认真细致的工作态度,树立高度责任意识,为学生在本专业学习和职业岗位奠定必需的化学基础。 (一)能熟练掌握溶液浓度的若干表示方法和换算以及各种不同浓度溶液的配制 (二)了解化学反应速率和化学平衡相关知识,并能应用于溶液中的平衡分析 (三)掌握酸碱中和滴定的有关计算和滴定方法
(四)会进行数据处理和分析 (五)掌握分光光度法的基本原理,会熟练使用分光光度计 (六)掌握常见有机物的组成、结构、性质、分类、命名。 四、设计思路 本着为专业服务的指导思想,本课程力求突出应用性、实践性和针对性的原则。基础理论以应用为目的,以必要、够用为度;尽量体现新知识、新方法、新技能,以利于学生综合素质的形成和科学思维方式与创新能力的培养。实训操作充分体现理论与实践相结合的原则,在实训中穿插介绍各种仪器的使用,各种常用的滴定方式,各种实验手段和生产技术。让学生在教中学、学中做、做中学,“教、学、做”相结合,强化对学生能力的培养。 五、教学项目任务 (1)理论课程(共38学时) 序号项目学 时 任务学时 1 溶液 6 溶液浓度表示方法及换 算 溶液配制 稀溶液的依数性2 2 2 2 化学反应速率和化学 平衡2 化学反应速率和化学平 衡 2 3 电解质溶液和离解平 4 水的离解和溶液的PH 2
