昆虫sf9细胞培养
杆状病毒——昆虫细胞表达系统

实验材料:1. 重组杆状病毒质粒:Bacmid/nsp-6及阳性对照Bacmid/CAT,已构建成功。
2. 昆虫细胞Sf9、High Five及其相关培养基、转染试剂均购自Invitrogen公司。
抗His单克隆抗体购自Oncogene公司,CAT-ELISA试剂盒购自Roche。
实验步骤:一、昆虫细胞转染:1. Sf9细胞计数,取6孔板中的两孔,每孔加入9×10 5个细胞(其中一孔设为正常对照),并以全培培养至少1小时,使细胞贴壁。
2.准备重组质粒和细胞转染试剂的混合物:a. 溶解1μg纯化重组杆状病毒重组质粒于100μl 无添加成分的Grace’s Medium。
b. 转染试剂充分摇匀后取6μl加入100μl 无添加成分的Grace’s Medium,混匀。
c. 将上述稀释好的质粒及稀释好的转染剂混匀,室温孵育20min。
3.重组质粒与转染剂混合液孵育的同时,以2ml无添加成分的Grace’s Medium洗涤待转染的一孔细胞并弃去洗液。
4.取0.8ml无添加成分的Grace’s Medium加入质粒与转染剂的混合液中,轻轻混匀后,总体积约为1ml。
加入上步洗涤后的细胞孔中,27℃继续培养5h。
5.移除质粒、转染剂混合物,加入2ml全培。
27℃湿盒孵育,直到病变现象产生。
二、病毒贮液的制备:1. 病毒感染晚期(正常24-72h)可见细胞停止生长、黏附,呈颗粒状外观。
即收集含病毒的培养上清,500g离心5min,去除细胞和碎片。
2. 上清即为P1病毒贮液,移入新的离心管中4℃避光保存。
长期保存分装冻存于-80℃。
3. 病毒贮液的扩增,按以下公式进行所需病毒P1贮液的量:感染所需病毒贮液量(ml)=[MOI(pfu/cell) ×细胞数÷病毒贮液效价(pfu/ml)]注:若不进行病毒空斑测定,P1贮液效价按照1×10 6到1×10 7计。
4. 扩增P1液制备P2病毒贮液方法如下:a. 转染当天,取2×106个细胞/孔加入六孔板中,贴壁生长至少1h。
sf9细胞冻存方法

sf9细胞冻存方法
SF9细胞是一种昆虫表达系统中常用的细胞系。
下面是一种常
见的SF9细胞冻存方法:
1. 在培养皿中培养SF9细胞至高密度(通常为培养皿80-90%
的细胞覆盖度)。
2. 用DPBS(无钙无镁的磷酸盐缓冲液)洗涤细胞一次,以去
除培养基和细胞碎片。
3. 使用酶解液(例如Trypsin-EDTA)将细胞从培养皿中解离。
根据细胞的密度,可以使用适当的溶菌酶/胰酶酶解细胞。
4. 加入同等体积的冻存培养基(通常为细胞培养基中含有20-50%的人血清、10%的二甲基亚砜(DMSO)和1-2%的低浓度抗生素的培养基)。
5. 轻轻混合并将混合液转移到冻存管中。
6. 使用-80℃冰箱或液氮罐冷却细胞冻存过程。
最好将细胞冻
存在气相中且不接触液氮。
7. 冻存细胞超过12小时后,将冻存管从液氮中转移到-150℃
以上的长期液氮储存罐中。
使用这种冻存方法,SF9细胞可以在-70℃至-80℃下保存6个
月至1年以上。
为了确保细胞质量,建议每6个月检查一次细胞的生长和表达能力。
请注意,在冻存细胞前,确保培养细
胞没有被细菌、真菌等污染,以避免污染的细胞冻存在长期储存中。
sf-9细胞培养2

血清中含有: 血清中含有: 多种蛋白质(白蛋白,球蛋白,铁蛋白等) ①多种蛋白质(白蛋白,球蛋白,铁蛋白等) ②多种金属离子 激素; ③激素; 促贴附物质,如纤粘蛋白,冷析球蛋白, ④促贴附物质,如纤粘蛋白,冷析球蛋白,胶 原等. 原等. ⑤各种生长因子 ⑥转移蛋白 ⑦不明成分
血清质量好坏是实验成败的关键. 血清质量好坏是实验成败的关键. 常用血清有胎牛血清,新生牛血清,小牛血清, 常用血清有胎牛血清,新生牛血清,小牛血清, 兔血清,马血清等,其中以胎牛血清质量最好. 兔血清,马血清等,其中以胎牛血清质量最好. 优质血清的标准:透明,淡黄色,无沉淀物, 优质血清的标准:透明,淡黄色,无沉淀物, 无细菌,支原体,病毒污染. 无细菌,支原体,病毒污染. 血清的灭活(消除补体活性): ):56 血清的灭活(消除补体活性):56 ℃ ,30 min 血清的消毒: 血清的消毒:过滤除菌
实验要求: 实验要求:
进实验室先洗手,签到.进细胞培养室要换鞋. 进实验室先洗手,签到.进细胞培养室要换鞋. 洗手 必须保持显微镜,试验桌,超净台以及其它用具 的清洁和整齐,各种药品,试剂按照规定的用量 进行使用.用完后要恢复摆放位置 进行使用.用完后要恢复摆放位置. 恢复摆放位置. 严格遵守显微镜使用的注意事项,否则损坏物镜, 同时也影响试验的进行. 离开实验室前,必须检查水龙头和电开关,避免 发生事故.
培养皿和培养板等表面消毒
超净台
超净工作台的工作原 理是利用鼓风机驱动 空气遁过高效滤器除 去空气中的尘埃粒, 使空气得到净化. 净化空气徐徐通过工 作台面,使工作台内 构成无菌环境.
生化培养箱
生化培养箱设定的条件为28 ℃ . 使用生化培养箱培养细胞时应注 意的问题: 1)保持培养箱内空气干净.定 期消毒 (90 ℃ ,14 h). 2)箱内灭菌蒸馏水3000ml蒸馏 水槽中以保持箱内湿度,避免培 养液蒸发.
昆虫细胞培养手册
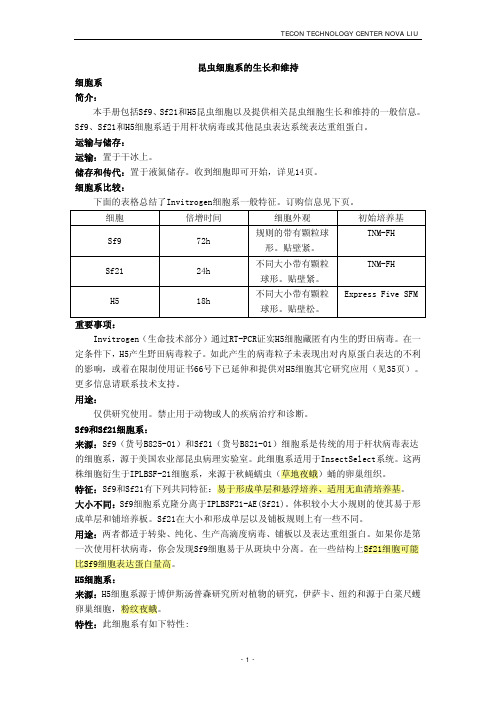
昆虫细胞系的生长和维持细胞系简介:本手册包括Sf9、Sf21和H5昆虫细胞以及提供相关昆虫细胞生长和维持的一般信息。
Sf9、Sf21和H5细胞系适于用杆状病毒或其他昆虫表达系统表达重组蛋白。
运输与储存:运输:置于干冰上。
储存和传代:置于液氮储存。
收到细胞即可开始,详见14页。
细胞系比较:下面的表格总结了Invitrogen细胞系一般特征。
订购信息见下页。
细胞 倍增时间 细胞外观 初始培养基Sf9 72h 规则的带有颗粒球形。
贴壁紧。
TNM-FHSf21 24h 不同大小带有颗粒球形。
贴壁紧。
TNM-FHH5 18h 不同大小带有颗粒球形。
贴壁松。
Express Five SFM重要事项:Invitrogen(生命技术部分)通过RT-PCR证实H5细胞藏匿有内生的野田病毒。
在一定条件下,H5产生野田病毒粒子。
如此产生的病毒粒子未表现出对内原蛋白表达的不利的影响,或着在限制使用证书66号下已延伸和提供对H5细胞其它研究应用(见35页)。
更多信息请联系技术支持。
用途:仅供研究使用。
禁止用于动物或人的疾病治疗和诊断。
Sf9和Sf21细胞系:来源:Sf9(货号B825-01)和Sf21(货号B821-01)细胞系是传统的用于杆状病毒表达的细胞系,源于美国农业部昆虫病理实验室。
此细胞系适用于InsectSelect系统。
这两株细胞衍生于IPLBSF-21细胞系,来源于秋蝇蠕虫(草地夜蛾)蛹的卵巢组织。
特征:Sf9和Sf21有下列共同特征:易于形成单层和悬浮培养、适用无血清培养基。
大小不同:Sf9细胞系克隆分离于IPLBSF21-AE(Sf21)。
体积较小大小规则的使其易于形成单层和铺培养板。
Sf21在大小和形成单层以及铺板规则上有一些不同。
用途:两者都适于转染、纯化、生产高滴度病毒、铺板以及表达重组蛋白。
如果你是第一次使用杆状病毒,你会发现Sf9细胞易于从斑块中分离。
在一些结构上Sf21细胞可能比Sf9细胞表达蛋白量高。
SF9细胞的建立及生物学特性的鉴定

2020年第8期 吉林畜牧兽医97·经验交流·JingYan JiaoLiuSF9细胞的建立及生物学特性的鉴定李来旭1,刘鑫莹1、潘添博2,李 睿31.重庆永健生物制品有限公司,重庆市 400000;2.重庆市合川区合阳城街道办事处畜牧兽医站,重庆市 400000;3.东北农业大学,黑龙江哈尔滨 150000摘 要:自菌种保藏中心引进1株SF9细胞系,扩大培养,保存于液氮,建立SF9细胞基础细胞库。
对细胞进行形态、生长曲线、纯净性、染色体分析及致瘤性等特性进行研究。
结果表明,细胞呈圆球形;细胞呈S 型生长曲线;无细菌、支原体及外源病毒污染;细胞的染色体数目主要分布在170~190之间;无致瘤性。
关键词:SF9细胞系;基础细胞库;生物学特性杆状病毒表达系统(BEVS)被广泛用于疫苗开发及外源蛋白表达。
BEVS 因其操作简便、安全性及适用于大规模生产等优势, 具有极大的应用前景。
杆状病毒表达的受体为昆虫细胞,目前应用较广的细胞系为SF9细胞。
目前兽用疫苗领域针对猪圆环病毒、禽流感病毒、猪瘟病毒及鸡新城疫病毒等多疫苗在SF9 细胞中表达,极大程度上缓解了畜牧业的养殖风险和生产成本。
本研究自菌种保藏中心引进SF9细胞系,进行细胞生物学特性研究,为开展SF9细胞系及及传染性法氏囊VP2疫苗的研究与开发提供细胞资源和理论依据。
1 材料和方法1.1 材料1.1.1 细胞SF9细胞,购自美国菌种保藏中心ATCC。
1.1.2 试验试剂:SF9无血清培养基,胎牛血清,DMSO 购自美国gibco 公司;无菌培养基,重庆永健生物制品有限公司制备。
1.2 方法1.2.1 细胞传代:取对数生长期的SF9细胞,以900 r/min 离心5 min,弃去上清,用SF9无血清培养基稀释细胞密度为0.8×106个/mL 分装到三角培养瓶中。
培养转速为150 r/min,置27 ℃培养箱中培养。
1.2.2 基础细胞库的建立 取生长状况良的好SF9细胞进行离心,加入冻存液,吹打混匀细,调节细胞密度为1.2×107个/m L ,每只冻存管分装1 mL。
Sf9细胞的培养及转染解析

超净台
超净工作台的工作原 理是利用鼓风机驱动 空气遁过高效滤器除 去空气中的尘埃粒, 使空气得到净化。
净化空气徐徐通过工 作台面,使工作台内 构成无菌环境。
生化培养箱
• 生化培养箱设定的条件为28℃ 。 • 使用生化培养箱培养细胞时应注
意的问题:
• 1)保持培养箱内空气干净。定 期消毒(90 ℃ ,14 h)。
转染基本步骤
• 1、接种细胞并使其贴壁 • 2、制备重组Bacmid与Cellfectin Reagent
( )复合物 Invitrogen公司转染试剂 • 3、加入复合物 • 4、去掉复合物混合液,加入完全培养基,
培养细胞直到细胞出现病毒感染迹象 • 5、取上清液分离纯化得目的蛋白
• 4)送入培养箱中继续培养。
细胞培养-换液
• 对于像Sf9这样的半贴壁的培养物,可按如 下步骤操作:
• 吸去或倾出(部分或全部)旧培养液。 • 加入新鲜的培养液。加入的量与换液前的
量相同。 • 放回原来的培养箱中继续培养。
转染
• 转染(transfection)指真核细胞由于外源DNA 掺入而获得新的遗传标志的过程。
病毒重组,获得重组病毒(酶切酶连转化) 2、将重组的病毒纯化 3、感染昆虫细胞或虫体(转染) 4、外源基因随着病毒的复制而获得表达
*《人细小病毒B19- XA株VP1蛋 白在Bac- to-Bac系 统中的表达及其反应原性》 *《Bac-toBac® Baculovirus Expression System 实验流程》
• (2)5分钟内用培养液稀释至原体积的10 倍以上。
• (3)低速离心10分钟。 (4)去上清,加新鲜培养液培养刚复苏的 细胞。
Sf9细胞的培养工艺

第19卷第3期1998年8月化 工 冶 金Engineering Chem istry &M etallu rgy V o l 119N o 13A ug 11998收稿日期:1997206209,修回日期:1997210216王晓迟:女,25岁,硕士,生物化学工程专业・研究简报・Sf 9细胞的培养工艺王晓迟 戚艺华 欧阳藩中国科学院化工冶金研究所生化工程国家重点实验室 北京 100080)细胞进行环境pH 值由低到高的值为710的培养液中即不能其次进行了培养液血清浓度由高到低2◊时细胞仍可,104个 m l 数量级是其生长的临界接种密度.关键词 Sf 9细胞,培养工艺,pH 值,血清浓度,接种密度中图分类号 Q 281 前 言80年代以来,Sf 9昆虫细胞—杆状病毒系统被广泛用于各种重组蛋白的表达.该细胞有许多优点,如非贴壁依赖性、培养温度低、可在无血清体系中繁殖等,很适合高密度、大规模培养.与之相关的各种发酵设备也在不断被开发.对Sf 9细胞的研究既能为动物细胞大规模培养找到一个新的对象,又可使推广多种以该细胞为表达系统的基因工程产品成为可能.要利用这株细胞,首先要对其培养工艺有全面、深入的了解,然而目前Sf 9细胞培养工艺方面的研究成果大部分属于商业机密,文献报道很少.本文从静止培养入手,对几项关键性的工艺条件进行了研究.2 材料和方法211 细胞系Sf 9昆虫细胞,来自美国A TCC (160~220代).212 细胞培养液21211 pH 梯度实验培养液用二次蒸馏水溶解IPL 241昆虫细胞培养基干粉(G I BCO ,Inc .),加0135g LN aHCO 3,用215m o l LN aOH 调pH 至设定值,以0122Λm 滤膜过滤除菌,向滤后液中加入2◊胰蛋白肉汤(G I BCO ,Inc .),1◊制霉菌素,50单位 m l 庆大霉素以及10◊的热灭活小牛血清.21212 血清梯度实验培养液先将有血清培养液的pH 调至612,然后加入设定浓度的热灭活血清,除血清条件外其余同上;无血清培养液Sf 2900II SFM (G I BCO ,Inc .)中加入2◊胰蛋白肉汤.872化 工 冶 金19 卷21213 密度梯度实验培养液将pH调至612,加10◊血清,其余同21211.213 实验方法21311 pH梯度实验将在初始pH=612的培养液中生长到对数期的细胞传至pH=615的培养液中,适应生长1代;待细胞密度达到105个 m l以后稳定传代2次;然后依次传至初始pH=618和pH=710的培养液中驯化.观察细胞在每种条件下的生长规律.21312条件下生长到对数期的细胞传至含8◊血清的培养液中,适应生长1周,2次;然后依次传至含5◊和2◊血清的培养液中驯化观察细胞在每种条件下的生长规律.21313密度梯度实验分别以较高密度(5×105和1×105个 m l)、中等密度(5×104和1×104个 m l)及低密度(5×103和1×103个 m l)接种Sf9细胞进行培养,观察细胞在每种条件下的生长规律.3 结果与讨论311 pH梯度实验Sf9细胞在pH=615的环境中适应很快,1代以后就能良好生长,适应pH=618的环境比较困难,连续传代3次才得以稳定生长,在pH=710的环境中始终难以存活.Sf9细胞在不同pH环境中的生长状况如图1所示,以pH=612的培养液中的细胞为对照组.由图可知,Sf9细胞在初始pH=615的培养液中生长良好,与对照组相比差别不大,延迟期24h,最大细胞密度由接种时的104个 m l数量级增加到105个 m l数量级;培养液初始pH=618时,细胞的生长开始受到影响,生长速率缓慢,延迟期增加至48h,最大细胞密度远小于对照组;培养液初始pH值提高到710时,细胞已不能存活.Sf9细胞生长过程中,各组培养液pH值的变化情况见图2.Sf9细胞在初始pH值为612,615和618的3种培养液中生长时,培养液的pH值总体上均呈升高趋势,其pH增加值不超过0131在pH=710条件下细胞已不能正常生长,其培养液pH值的检测也随细胞的死亡而终止.Sf9细胞的最适pH值为612,略偏酸性,而中性条件更利于工业化生产和多种基因工程产品的稳定,因此进行了该细胞对高pH值环境的适应性实验.结果发现,培养液的pH值随着细胞的生长会略有增加,这可能是由于Sf9细胞在生长过程中产生乳酸的量较少,并且在乳酸积累时还会反过来利用它作为碳源;同时培养液中的许多酸性成份如精氨酸等在细胞生长旺盛时被大量消耗,所以引起了培养液pH值升高,但这种升高仍然是缓慢的和不显著的.初始pH=710时培养液pH值的上升可能是由于细胞死亡裂解,释放出胞内碱性成份的缘故.培养液初始pH值提高到615对细胞生长的影响不大,但继续升高至618时细胞的生长状况已明显不如对照组,在初始pH值为710的培养液中Sf9细胞已不能存活,说明此时的pH值已超出了该细胞的适应范围.因此,较大幅度地提高培养液的pH值在Sf9细胞的培养过程中极为困难.图1 Sf 9细胞在各种pH 值条件下的生长曲线F ig 11 Sf 9cell grow th at vari ouspH 图2 各组实验中培养液的pH 值变化曲线F ig 12 V ariati on of pH of culture w ith different initial pH 图3 Sf 9细胞在不同血清浓度的培养液中的生长曲线F ig 13 Sf 9cell grow th in culture w ith different concentra 2ti on of serum312 血清梯度实验Sf 9细胞对于含8◊血清的培养液适应很快,1代之后即可良好生长;适应5◊的血清需传代2次,共12d ;适应2◊的血清较慢,共需3代18d ;由2◊的血清到无血清培养液适应较快,需2代10d .Sf 9细胞在不同血清浓度下的生长状况如图3所示.Sf 9细胞在含8◊血清的培养液中生长良好,延迟期24h ,最大细胞密度由接种时的104个 m l 数量级增加到105个 m l 数量级,与常用浓度10◊条件下基本相同;细胞在含5◊血清的培养液中延迟期增加至48h ,生长速度减慢,但仍属于正常生长状态;当血清浓度降至2◊时细胞仍可生长,出现72h 的延迟期,最大细胞密度值较低;该细胞在无血清培养液中生长良好,各项指标均接近在10◊常用浓度下的情况.因此该细胞具有较强的低血清适应性.同时,Sf 9细胞在已经过优化的市售无血清培养液中生长良好,如需尽可能地消除血清对实验造成的影响,可以考虑采用无血清培养系统.313 密度梯度实验不同接种密度时Sf 9细胞的生长状况如图4~6所示.105个 m l 数量级接种时,Sf 9细胞的生长十分迅速,不出现延迟期而直接进入对数生长阶段,最大细胞密度增加至106个 m l 数量级;104个 m l 数量级接种时,细胞处于正常生长状态,有24h 的延迟期,倍增迅速,最大细胞密度值增加至105个 m l 数量级;103个 m l 数量级接种时,细胞有4d 的延迟期,生长过于缓慢,已失去实际操作意义.当以较高密度接种时,细胞的启动生长极为迅速,这可能是由于细胞密度较高时,与之相关的各种激素、生长因子、酶及其它细胞因子的浓度也较高,同时细胞间的频繁接触有利于多种因子的分泌,从而增强了细胞活力的缘故;当以低密度接种时,细胞生长过于缓慢,说明此接种量限制了细胞的正常生长,因此初始接种密度对Sf 9细胞的生长影响很大,直接关系其延迟期的长短和最大细胞密度值的大小.9723期王晓迟等:Sf 9细胞的培养工艺图4 Sf 9细胞在较高密度接种时的生长曲线F ig 14 Sf 9cell grow th in culturew ith h igh density of inoc 2ulati on 图5 Sf 9细胞在中等密度接种时的生长曲线F ig 15 Sf 9cell grow th in culture w ith m edium density of inoculati on 图6 Sf 9细胞在低密度接种时的生长曲线F ig 16 Sf 9cell grow th in culture w ith low density of inocu 2lati on 另一方面,由图6可知,103个 m l 数量级接种时,细胞生长已不正常,所以104个 m l 数量级是Sf 9细胞的临界接种密度,低于这一密度会出现超长延迟甚至不生长.4 结 论根据上面的实验结果可以得出以下结论:(1)Sf 9细胞对于环境pH 值的适应能力十分有限;在生长过程中,培养液的pH 值是逐渐升高的,但总的变化幅度不大.(2)Sf 9细胞对于低血清环境的适应性很强.(3)初始接种密度对Sf 9细胞的生长影响很大,该细胞的临界密度约为104个 m l 数量级.本文对Sf 9细胞静止培养的几项关键性工艺条件进行了初步研究,其结果可作为进一步放大培养的理论依据.参考文献 1Caro l J .M arcus -Sekura et al .Confo r m ati on -dependent recogniti on of Baculovirus -exp ressed Ep stein -barr V irus gp 350by a Panel of M onoclonal A ntibody .Journal of General V iro logy ,1993,74:2171 2Summ ers M .D .,Sm ith G .E .Baculovirus Structural Po lypep tides .A M anual of M ethods fo r Baculovirus V ecto rs andInsect Cell Culture P rocedures .T exas ,U SA ,T exas A gricultural Experi m ent Stati on and T exas A &M U niversity Co l 2lege Stati on ,1987.10 3王国政等.动物细胞大量培养.生物工程进展,1988,8(4):11 4卢锦汉等.医学生物制品学.北京:人民卫生出版社,1995.528 5W ong et al ,R elati onsh i p betw een O xygen U p take R ate and T i m e of Infecti on of Sf 9Insect Cells Infected w ith a R ecom 2binant Baculovirus.Cyto techno logy ,1994,15:157 6Bertheussen K .Grow th of Cells in a N ew D efined P ro tein -free M edium .Cyto techno logy ,1993,11:219082化 工 冶 金19 卷THE CUL TURE TECHNOLOG Y OF Sf 9CELL SW AN G X iaoch i Q I Y ihua OU YAN G Fan(Inst .Che m .M eta ll .,Ch inese A cad e m y of S ciences ,B eij ing 100080,Ch ina )ABSTRACT Sf 9cells are cultured staticly w ith different pH ,serum concentrati on and inoculati on densi 2ty .It is found that the cell culture is sensitive to pH change and cells hardly grow in the m edium w ith an ini 2tial pH of 7.0,pH of the culture m edium increases sligh tly during the culture and Sf 9cells can grow w ell in the m edium w ith serum concentrati on as low as 2◊.A critical inoculati on density of 104cells m l is foundnecessary fo r the grow th of Sf 9cells.KEY WOR D S Sf 9cells ,Culture techno logy ,pH ,Serum concentrati on ,Inoculating density 化工冶金研究所学位论文简介有机硫代磷酸2有机铵协萃体系萃取分离镉锌的研究 选择有机硫代磷酸作为萃取剂,合成与提纯了二2(22乙基己基)二硫代磷酸(D 2EHD T PA ,简称二硫代磷酸)和二2(22乙基己基)单硫代磷酸(D 2EHM T PA ,简称单硫代磷酸).在分别考察了其萃取效果后,进一步系统研究了这两种有机硫代磷酸与3种有机胺(伯胺N 1923、仲胺DOA 和叔胺TOA )协同萃取体系的性能与机理.总的来说,二硫代磷酸2有机胺协萃体系的萃取能力较优.对各体系,一般萃镉的能力大于萃锌的能力.硫酸盐溶液中,镉、锌分离的综合性能的优良顺序如下:D 2EHD T PA -TOA >D 2EHD T PA -DOA >D 2EHM T PA -TOA >D 2EHD T PA -N 1923,D 2EHM T PA -DOA ,D 2EHM T PA -N 1923用恒界面池法对D 2EHD T PA 2TOA 萃取镉体系进行了动力学研究,该萃取过程属于界面反应模式,表观活化能为4412kJ m o l ,反应历程为BHA i =BH +i +A -i(1)BH i +=B i +H i +(2)Cd i 2++A -i k 1k -1CdA +i (3)CdA +i +A -i k 1k -2CdA 2i (4)CdA 2(O )+BHA (O )=CdA 2 BHA (O )(5)其中式(3)与(4)为速率控制步骤,CdA +为反应活性中间产物,下标i 表示在界面上,下标(O )表示有机相,B 为有机胺,BH +为胺阳离子,A -为有机硫代磷酸根阴离子.最后,用实际的含镉、铜和锌的浸出液进行新协萃体系检验,取得了较好的分离效果,从而提出了萃取分离无渣新工艺建议流程.(摘自化工冶金研究所1997年张大力的博士学位论文,导师:柯家骏,卢立柱)1823期王晓迟等:Sf 9细胞的培养工艺。
Sf9细胞的培养及转染

Bacmid
? 能快速、高效产生的重组AcMNPV 病毒。 取杆状病毒( baculovirus) 和质粒( plasmid) 的英文字头字尾命名为Bacmid,即杆状病 毒质粒之意。该载体可像质粒一样在大肠 杆菌中生长,又对鳞翅目昆虫细胞具有感 染性。
昆虫杆状病毒表达系统的构成
表达过程: 1、将外源目的基因插入到启动子下游与杆状
Sf-9细胞的培养及转染
Sf-9细胞
? Sf-9细胞是由G.E. Smith 和 C.L. Cherry 在1983年从细胞株IPLB-SF 21 AE得来的一 个克隆。IPLB-SF 21 AE是1977年由Vaughn 等从草地夜蛾蛹的卵巢组织得到的。
? Sf-9是半贴壁的细胞,贴壁性不强,可贴 壁培养也可悬浮培养。
? (2)5分钟内用培养液稀释至原体积的10 倍以上。
? (3)低速离心10分钟。 (4)去上清,加新鲜培养液培养刚复苏的 细胞。
Sf9细胞的传代
? 判断分离(散)细胞培养物是否需要传代 的主要指标就是观察培养物是否已基本长 满培养瓶皿的底壁。
? 一般来说,原代培养物未达到生长基质的 80%表面面积,不要急于传代,对于拟行 首次传代的培养物更如此。
? 2)箱内灭菌蒸馏水3000ml蒸馏 水槽中以保持箱内湿度,避免培 养液蒸发。
培养瓶
拿培养瓶的正确姿势:拇指和食指夹住培养瓶, 瓶口向外,中指托住瓶底。保持瓶子的水平, 防止培养液倒向瓶口。
血球计数板
细胞冻存和复苏
? 冻存和复苏的原则:慢冻快融
– 当细胞冷到零度以下,可以产生以下变化:细 胞器脱水,细胞中可溶性物质浓度升高,并在 细胞内形成冰晶。
? 4)送入培养箱中继续培养。
细胞培养-换液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Sf9培养要点:
温度:27-28摄氏度
pH:,sf9最适的pH6.2,随培养时间的延长,Ph值会增加
传代时间:72h(三天左右)
细胞来源:Sf9(货号B825-01)和Sf21(货号B821-01)细胞系是传统的用于杆状病毒表达的细胞系,源于美国农业部昆虫病理实验室。
此细胞系适用于InsectSelect系统。
这两株细胞衍生于IPLBSF-21细胞系,来源于秋蝇蠕虫(草地夜蛾)蛹的卵巢组织。
(以上来自invitrogen)细胞特点:规则的带有颗粒球形。
贴壁紧。
标准条件的定义:
培养最低密度:0.6×106/ml(健康对数生长期细胞活率至少应不低于90%。
活率低于90%细胞不是在最佳条件下培养不能用于实验)1×106/mL将出现对数生长状态
传代培养:传代培养需将细胞调整到维持对数生长状态和最大活率。
贴壁培养: 贴壁细胞传代需在细胞长成单层(如下定义)然后1:5(细胞体积:最后培养基体积)稀释维持对数生长。
形成单层细胞可以传代培养
悬浮培养:在细胞密度达到2.0×106-2.5×106细胞/mL后将密度调整至0.7×106-1.0×106细胞/mL进行悬浮传代。
确保传代细胞密度不高于4×106个/mL或保持密度高于1×106个/mL以达到对数生长状态。
Sf9悬浮培养所需要的细胞数
培养基:sf-900 ⅢSFM(添加2%的血清减小感染过程中蛋白水解量)
培养瓶与培养体积:
冻存:一旦细胞系建立且倍增规律则可以进行冻存。
细胞需达到90%活率和80-90%融合的要求(如:低代次)推荐冻存几管。
当融解细胞,它将会达到最佳使用状态。
1. 用细胞计数板计数细胞。
需要足够的如上表所示密度的细胞冻存2-4管。
细胞可是悬浮或贴壁培养;
2. 将无菌冻存管立于冰上,做好标记;
3. 室温400-600×g离心10min。
移除上清。
4. 以给定的密度在冻存液中重悬细胞;
5. 移取1mL细胞悬液置于无菌冻存管中;
6. 置于-20℃1h,然后移至-80℃24-48h;
7. 储存于液氮中。
转染的细胞:需要的是对数期的细胞>95%发育能力,可以完成成功的转染。
载氧:对于最优生长条件和蛋白的表达,昆虫细胞要求被动的通氧。
积极的通氧系统要求溶氧饱和在10%-50%
Sf900II和sf900Ⅲ的区别:一般推荐Sf900II来大量表达蛋白
Sf900II含有表面活性剂(剪切力保护剂(保护细胞在转瓶中培养时不会受到剪切力伤害))
当设计纯化多聚组氨酸标签蛋白的计划时,注意无血清培养基不能直接用于螯合树脂,因为培养基的成分会除去树脂中的镍离子。
细胞培养的一般顺序:复苏——传代——传代稳定——冻存
应当遵循的一般过程:复苏——贴壁培养——悬浮——悬浮扩大培养(产生目标蛋白)(也可不经过贴壁培养,直接悬浮培养)
贴壁时间:45min
悬浮的转速:80rpm
附:离心机rcf与g的换算:
无血清培养基可以选择性加入一定的抑菌剂防止细菌或者真菌污染:
培养基:GIBCO-SFM900
加青霉素链霉素抑制细菌生长两性霉素B抑制真菌生长。
