棕榈酸帕利哌酮注射液说明书
棕榈酸帕利哌酮注射液治疗急性期精神分裂症36例

棕榈酸帕利哌酮注射液治疗急性期精神分裂症36例许秋霞;孙菊水;王世锴;靳西龙;郭卫刚;戴熊凯【摘要】目的:观察棕榈酸帕利哌酮长效针剂在急性期精神分裂症治疗中的疗效及安全性。
方法将72例急性期精神分裂症患者随机分为治疗组和对照组,各36例。
治疗组给予棕榈酸帕利哌酮注射液,对照组给予利培酮,观察时间13周。
于治疗前,治疗第1,2,5,9,13周末分别评定阳性与阴性症状量表( PANSS),于治疗前,治疗第5,9,13周末分别评定个人和社会功能量表(PSP)。
以不良反应症状量表(TESS)评定治疗时出现药物不良反应,并检测各观察点血常规、生化、性激素、心电图的变化,以药物满意度问卷(MSQ)评定患者主观满意度。
结果治疗组有效率69.44%,与对照组63.89%比较,差异无统计学意义(P>0.05),但治疗组起效更快,治疗第1周末时PANSS总分即明显下降(P<0.05)。
两组患者治疗后PSP评分均较治疗前明显改善( P<0.01),组间差异无统计学意义。
治疗组药物不良反应发生率较对照组低( P<0.05),且药物治疗满意度更好( P<0.05)。
结论棕榈酸帕利哌酮治疗急性期精神症疗效较好,起效较快,社会功能改善明显,且使用方便,患者满意度高。
【期刊名称】《医药导报》【年(卷),期】2015(000)010【总页数】4页(P1304-1307)【关键词】帕利哌酮,棕榈酸;精神分裂症,急性期;注射剂,长效【作者】许秋霞;孙菊水;王世锴;靳西龙;郭卫刚;戴熊凯【作者单位】浙江省湖州市第三人民医院精神科,湖州 313000;浙江省湖州市第三人民医院精神科,湖州 313000;浙江省湖州市第三人民医院精神科,湖州313000;浙江省湖州市第三人民医院精神科,湖州 313000;浙江省湖州市第三人民医院精神科,湖州 313000;浙江省湖州市第三人民医院精神科,湖州 313000【正文语种】中文【中图分类】R971.4;R749.3精神分裂症是一组反复发作的常见慢性精神疾病,患者常有严重的精神症状、认知功能损害及自制力缺损,其社会功能损害较明显,致残率较高。
棕榈酸帕利酮长效针剂治疗大学生精神分裂症患者的疗效

棕榈酸帕利酮长效针剂治疗大学生精神分裂症患者的疗效张文静;李晶【摘要】目的:探讨棕榈酸帕利哌酮长效针剂对大学生精神分裂症患者的疗效和安全性.方法:大学生精神分裂症患者73例,给予注射棕榈酸帕利哌酮针剂治疗.于治疗前后评估大学生患者的阳性与阴性症状量表(PANSS)、临床总体印象-严重程度分量表(CGI-S)、副反应量表(TESS),观察特异性症状的变化.结果:完成治疗62例,治疗后4、8、12、24周的CGI-S评分、PANSS总评分和阳性分量表、阴性分量表评分随着治疗时间的延长而逐渐下降,与治疗前比较差异均具有统计学意义(P<0.05).患者在治疗期间的不良反应较轻,特异性症状均得到明显改善(P<0.05).结论:棕榈酸帕利哌酮长效针剂治疗大学生精神分裂症使用便利、安全有效,能明显改善大学生精神分裂症患者的特异性症状.【期刊名称】《神经损伤与功能重建》【年(卷),期】2016(011)005【总页数】3页(P421-423)【关键词】棕榈酸帕利哌酮;长效针剂;精神分裂症;大学生;临床疗效【作者】张文静;李晶【作者单位】内蒙古精神卫生中心呼和浩特010050;昆明医科大学第一附属医院精神科昆明650031【正文语种】中文【中图分类】R741;R749.053;R749.3精神分裂症是一种常见的易反复发作的精神疾病,会给患者造成严重的自制力缺损、认知功能损害和社会功能损害。
患者在使用口服抗精神病药物时会经常出现依从性差、容易中断、治疗效果欠佳等问题。
研究发现使用长效针剂治疗精神病在预防复发和提高依从性方面优于口服药物[1]。
棕榈酸帕利哌酮长效针剂是一种非典型性抗精神病药物,每月只需注射一次,单药治疗精神分裂症具有起效迅速、维持疗效时间长、有效预防复发等优点[2]。
本研究采用棕榈酸帕利哌酮针剂治疗73例精神分类症患者,分析其疗效及安全性。
1.1 一般资料选择2013年1月至2015年6月在呼和浩特市4所医院门诊或住院治疗的大学生精神分裂症患者73例,男41例,女32例;年龄18~26岁,平均(21.6±3.8)岁,均符合美国制定的《精神疾病诊断和统计手册》,阳性与阴性症状量表(Positive and Negative Syndrome Scale,PANSS)总分为60~120分,患者或其监护人签署知情同意书。
善思达的全球及中国数据介绍

7
基本信息
起始给药模式确保快速起效,更稳定血药浓度
棕榈酸帕利哌酮使用推荐的起始给药模式后5周内,中位血药浓度与口 服6mg或12mg帕利哌酮缓释片的比较
棕榈酸帕利哌酮的临床研究小结
10
临床数据及意义
3007棕榈酸帕利哌酮第8天即显著改善精神分裂症症状
0 -2 较基线的平均变化 (± SE) -4 -6 -8 -10 -12
治疗第8天就观察到 棕榈酸帕利哌酮治疗 组的疗效显著优于安 慰剂组
不同剂量组在终点时较安慰 剂组相比的最小二乘法变化分别 为-5.1分( 25 mg eq. 组),8.7(100 mg eq组)和-9.8( 1 50 mg eq. 组) *.第8天开始棕榈酸帕利哌酮 25 和150 mg eq.剂量组vs安慰剂组 的所有未调整 p<0.05,第22天 开始棕榈酸帕利哌酮 100 mg eq . 组vs安 慰剂组的未调整 p<0.05 。 第8天的结果反应了第1天使用15 0mg eq剂量治疗的结果
16
临床数据及意义
研究中发生率5% 的不良事件
棕榈酸帕利哌酮 (N=229) N (%) RLAI (N=223) N (%) 167 (74.9) 30 (13.5)
有不良事件患者总数 失眠
168 (73.4) 41 (17.9)
静坐不能
震颤 上呼吸道感染
30 (13.1)
24 (10.5) 18 (7.9)
善思达采用独特纳米晶体®技术
酯链反应 帕利哌酮
颗粒大小缩减过程
配方
JXHL0900401_棕榈酸帕利哌酮注射液进口标准

国家食品药品监督管理局进口药品注册标准标准号:JX20100263棕榈酸帕利哌酮注射液Zonglvsuan Palipaitong ZhusheyePaliperidone Palmitate Injection本品含棕榈酸帕利哌酮按帕利哌酮(C23H27FN4O4)计算,应为标示量90.0%~110.0%。
【性状】本品为白色至灰白色的混悬液。
【鉴别】(1)取本品1支,摇匀,取1滴至溴化钾片的表面。
照红外分光光度法(中国药典2010年版二部附录IV C)测定,其红外光吸收图谱在3200-2600cm-1,1800-1500cm-1和1200-750cm-1范围内应与对照品的红外光吸收图谱一致。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】重混悬性与抽针试验取本品3支,在10秒钟内振摇30次,振摇幅度约为25cm,振摇后溶液应均匀,不得检出可见异物或团块物。
用23号针头(蓝色针座)的注射器抽取,应顺利通过,不得阻塞。
pH值应为6.5~7.5(中国药典2010年版二部附录VI H)。
粒度分布取本品1支,加水稀释至250ml(1.5ml规格稀释至500ml),混匀后测试。
应用Malvern Mastersizer 2000 激光粒度仪,红光检测,泵速为1250转/分,颗粒折射率为1.56,颗粒吸收率为0.01,遮光度在6.8%-7.2%之间稳定1分钟后测试,测试时间为30秒。
d(0.1)应为0.3-0.6μm,d(0.5)应为0.9-1.4μm,d(0.9)应为2.0-4.4μm。
有关物质照含量测定项下的色谱条件,精密量取含量测定项下供试品溶液和对照品溶液各10μl注入液相色谱仪,记录色谱图。
供试品溶液色谱图中如有杂质峰,加校对因子校正后,按外标法以对照品溶液中主峰面积计算各杂质的含量,单个杂质峰面积不得过0.2%,各杂质的总和不得过0.4%。
单个杂质含量计算公式如下:式中G 为注射液的密度,1.037g/mlq s为供试品称样量,gP r为对照品纯度F r为棕榈酸帕利哌酮与帕利哌酮的换算因子1.56RRF为校正因子,杂质R130696为0.933(相对保留时间为0.70),其他杂质均为1.0 r i为供试品溶液中单个杂质色谱峰的峰面积Q th为标示含量,100mg/mlr r为对照品溶液色谱图中主峰的峰面积q r为对照品溶液中对照品的称样量,mg释放度取本品,照溶出度测定法(美国药典32版<711> 第二法),以0.489%聚山梨醇酯20的0.001mol/L盐酸溶液900ml为释放介质,介质温度为25 ︒C±0.5︒C,转速为每分钟50 转,依法操作,向每个溶出杯中加入相当于0.5ml±0.025ml的均匀混悬液样品【加样方式:取本品足够支数,摇匀,预先混合,量取0.5ml±0.025ml,置样品杯(规格为高14mm,内径14mm,壁厚1mm)中,精密称定,使样品杯悬于释放介质正上方,接近溶出杯的边沿,在桨转动时将样品投入;或将预先混合注射液约0.5ml±0.025ml,置1ml规格的带针头注射器内,精密称定,当桨转动时,将上述混悬液加入每个溶出杯中,精密称定带有针头的空注射器】。
棕榈酸帕利哌酮注射液善思达中文说明书

棕桐酸帕利哌酮注射液(善思达)中文说明书警示语增加患有痴呆相关精神病的老年患者的死亡率与安慰剂相比,使用非典型抗精神病药治疗患有痴呆相关精神病的老年患者时,死亡的风险会增加。
对在患有痴呆相关精神病的老年患者中进行的17项安慰剂对照临床试验(平均众数治疗时间为10周)的分析发现,药物治疗组患者死亡的危险性为安慰剂对照组的1.6-1.7倍。
在一项10周对照临床试验中,药物治疗组的死亡率为4.5%,安慰剂对照组为2.6%o虽然死亡原因各异,但是大多数死于心血管病(如心衰、猝死)或感染(如肺炎)。
研究显示,与非典型抗精神病药物相似,采用传统抗精神病药物治疗可能增加死亡率。
观察研究中死亡率的增加归因于抗精神病药物还是患者本身的某些特性造成的,目前尚不清楚。
本品未被批准用于治疗痴呆相关的精神病患者(参见【注意事项】)。
【通用名称】棕桐酸帕利哌酮注射液【商品名称】善思达®InvegaSustenna【英文名称】Pa1iperidonePa1mitateInjection【汉语拼音】Zong1vsuanPa1ipaitongZhusheye【成份】主要成份:棕相酸帕利哌酮化学名称:(±)-3-[2-[4-(6-氟-1,2-苯并异嘿嗖-3■基)-I-哌名]乙基]-6,7,8,9-四氢-2-甲基-4-氧-4H-口比咤[1,2-a]嗜咤-9-基棕桐酸酯化学结构式:分子式:C39H57FN4O4分子量:664.89辅料:聚山梨醇20、聚乙二醇4000、枸檬酸、无水磷酸氢二钠、磷酸二氢钠一水合物、氢氧化钠和注射用水。
【性状】本品为白色至灰白色的混悬液。
【适应症】本品用于精神分裂症急性期和维持期的治疗。
【规格】(1)0.75m1:75mg(2)1.0m1:IOOmg(3)1.5m1:150mg(按帕利哌酮计)【用法用量】给药方式每次注射都必须由专业医护人员操作。
只要产品和包装容器许可,注射制剂在使用前都应目视检查有无异物和变色。
棕榈酸帕利哌酮注射液维持治疗显著延迟精神分裂症患者的复发时间
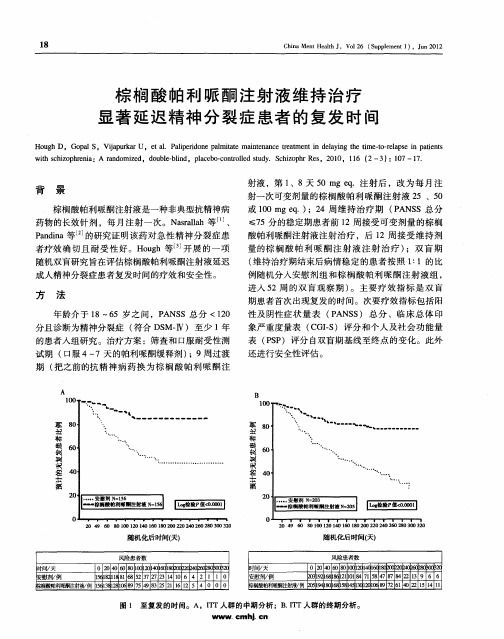
图 1 至复发的时间。A,I r人群的中期分析 ;B I r人群的终期分析。 1 T .1 T n w. mh. n Ⅳ c jc
中国心理卫生杂志
21 0 2年 6月
第2 6卷 ( 增刊 1 )
1 9
结 果
H u h等 _ 的研 究结 果发 现 ,8 9例 患者 人组 og 3 4
背 景
棕榈 酸帕利 哌 酮注射 液是 一种非 典 型抗 精 神病 药 物 的长 效针 剂 ,每 月 注 射 一次 。Narlh等 … 、 s l aa
P n ia等 的研 究证 明该 药对 急性 精 神分 裂 症 患 adn
射液 ,第 1 、8天 5 ge.注射后 ,改为每月注 0m q 射 一次 可变剂 量 的棕 榈 酸 帕利 哌 酮 注射 液 2 、5 5 0
出现 复 发 的 比 例 也 显 著 低 于 安 慰 剂 组 ( 0 1%
V.4 ) T S3 % 。I T人 群 的终 期分 析 结果 显 示 ,棕榈 酸 帕利 哌酮 注射 液治疗 组也 显著 延迟 患者 的复发 时 间
研究,其 中40例患者进入双盲期 ,32例完成双 1 5
盲 期研究 。两 组患 者基线 时 的人 口学特 征相 当 。6 8
用 剂量 相 当 (2 6V.8 . q ) 8 . S 2 8mge . 。棕榈 酸 帕利 哌酮注 射液 在过 渡期 和维持 治疗期 的总体 中位暴 露 时问为 2 9天 ,在双盲 期为 1 1天 ,而安慰 剂组 双 2 7
盲期 的 中位 暴露 时 间为 15天 。 0 意 向 性 治 疗 (T IT) 人 群 的 中期 分 析 结 果 显 示 ,相 对 于安慰 剂组 ,棕榈 酸 帕利 哌酮注射 液治 疗
1% ( 1 n=9 ) 6 。双 盲 期 安 慰 剂 组 和棕 榈 酸 帕利 哌 酮 注射 液组 出现 T AE E s或 T A s加重 的 比例 相 当 EE (5 V.4 ) 4 % S4 % ,严 重 T A s的 发 生 率 分 别 为 EE
棕榈酸帕利哌酮注射液治疗急性精神分裂症的疗效及安全性研究
棕榈酸帕利哌酮注射液治疗急性精神分裂症的疗效及安全性研究目的探讨棕榈酸帕利哌酮注射液治疗急性精神分裂症的疗效及安全性。
方法对42例急性精神分裂症患者使用棕榈酸帕利哌酮注射液(75~150mg)。
在治疗前及治疗后第1、2、4、8w末分别评定阳性与阴性症状量表(PANSS),用副反应量表(TESS)评定不良反应,并进行前后对比分析。
结果有40例患者完成8w的临床研究,临床治愈率33%,有效率80%;在第1w末PANSS总分及各分量表评分均较基线明显降低(阴性症状分P<0.05,其余均P<0.01);治疗中无严重不良反应。
结论棕榈酸帕利哌酮注射液对急性精神分裂症效果良好,起效快,且具有良好的安全性和耐受性。
标签:棕榈酸帕利哌酮;精神分裂症抗精神病药物长效针剂的出现,为患者及其照料者简化了治疗过程,并且提高了患者的依从性[1,2]。
棕榈酸帕利哌酮是一种已被批准用于成人精神分裂症治疗的长效注射液,是首个每月注射1次的非典型长效针剂,在首次肌注后的第1d,帕利哌酮即释放入血循环中,并持续释放126d,达峰时间平均为13d[3],其使用方法可以使药物快速达到治疗浓度,控制精神分裂症急性期患者的病情[4]。
本研究应用棕榈酸帕利哌酮治疗急性精神分裂症,以探讨其疗效及安全性。
1资料与方法1.1一般资料为我院2013年1月~8月的住院患者。
纳入标准:①年龄在18~60岁;②符合国际疾病分类(ICD-10)精神分裂症诊断标准;③受试者处于精神分裂症急性发作阶段,基线期的PANSS总分≥70分;④所有受试者均经其本人或法定监护人签署了知情同意书。
1.2排除标准①筛选前3个月使用了长效注射类抗精神病药或氯氮平;②既往规范使用利培酮、帕利哌酮治疗无效或不能耐受者;③足量足疗程应用两种以上抗精神病药治疗效果不佳者;④有重大或不稳定的躯体疾病,包括目前存在有临床意义的实验室检查异常(血、尿常规及血生化);⑤有酒精、物质滥用或依赖者;⑥曾经或目前存在迟发性运动障碍症状的患者;⑦曾有抗精神病药所致恶性综合征病史的患者;⑧存在暴力或者自伤行为或倾向者;⑨妊娠或哺乳期的女性;⑩代谢或其他因素可能影响帕利哌酮活性的患者。
棕榈酸帕利哌酮结构式_概述说明
棕榈酸帕利哌酮结构式概述说明1. 引言1.1 概述棕榈酸帕利哌酮(Paliperidone palmitate)是一种常用的抗精神病药物,属于非典型抗精神病药(atypical antipsychotic)。
作为一种长效注射剂,它能够提供持久而稳定的治疗效果,减轻患者每日服药的负担。
由于其强大的治疗效果和方便的使用方式,棕榈酸帕利哌酮在临床上得到广泛应用。
1.2 文章结构本文将分为四个主要部分进行介绍。
首先,在引言部分将对棕榈酸帕利哌酮进行总体概述并阐明文章的目的。
然后,在"2. 棕榈酸帕利哌酮结构式"部分,我们会详细地探讨其定义、特点以及分子结构解析,并介绍其化学性质和各种用途。
接着,在"3. 正文"部分,我们将回顾棕榈酸帕利哌酮的历史与发现背景,并深入探讨其合成方法与工艺流程,以及生物活性和医药应用研究。
最后,在"4. 结论"部分,我们将总结主要的研究发现和成果,并展望未来的研究方向和建议。
1.3 目的本文旨在全面介绍棕榈酸帕利哌酮的结构式以及其相关内容。
通过对棕榈酸帕利哌酮的分析和探讨,我们希望读者能够更好地了解这一药物的定义、特点、化学性质等方面信息,并加深对其历史背景、合成方法、生物活性以及医药应用研究等方面内容的理解。
最终,我们也希望通过本文所提供的内容,为今后关于棕榈酸帕利哌酮的研究和进一步发展提供一定的参考依据。
2. 棕榈酸帕利哌酮结构式2.1 定义与特点棕榈酸帕利哌酮(Paliperidone palmitate)是一种药物,属于抗精神病类药物。
它是帕利哌酮的植物脂肪酸衍生物,通过与棕榈酸发生酯化反应制得。
棕榈酸帕利哌酮具有改善精神症状和控制兴奋状态的作用。
2.2 分子结构解析在棕榈酸帕利哌酮的分子中,帕利哌酮部分与普通的帕利哌酮相同,而其巯基(thiol group)则与棕榈酸发生化学反应形成脂肪酰基链(palmitoyl chain)。
棕榈酸帕利哌酮注射液治疗老年精神分裂症的有效性及安全性分析
棕榈酸帕利哌酮注射液治疗老年精神分裂症的有效性及安全性分析顾培;仇玉莹;靳秀;毛富强【摘要】目的:探讨棕榈酸帕利哌酮注射液治疗老年精神分裂症患者的疗效、耐受性、安全性及社会功能的恢复.方法:将天津市安定医院2014年8月-2016年3月老年科收治的80例老年精神分裂症患者随机分为研究组和对照组,每组40例患者.研究组用棕榈酸帕利哌酮注射液治疗,第1日注射75 mg,第8日注射75 mg,此后每隔1个月左右注射50~75 mg;对照组用利培酮片剂治疗,第1日口服0.5 mg,在2周内逐步增量至最佳给药剂量,最大给药剂量不超过2 mg/d,疗程24周.治疗前及治疗后4、8、16和24周采用阳性和阴性症状量表(PANSS)、依从性评定量表(MARS)、副反应量表(TESS)来评估疗效及安全性,用个人和社会功能量表(PSP)来评估社会功能.结果:72例患者完成24周临床治疗,有8例患者脱落.①两组PANSS 评分在治疗第4、8、16和24周时均低于基线水平,差异均有统计学意义(P均<0.01);两组间同一时点PANSS评分比较,差异均无统计学意义(P均>0.05).②研究组MARS评分在治疗第4、8、16和24周均高于基线水平,差异均有统计学意义(P均<0.01);对照组MARS评分在治疗第4、8周均有显著统计学意义(P均<0.05);两组间除基线外同一时点MARS评分比较,差异均有统计学意义(P均<0.01).③研究组同一治疗时点PSP评分均高于对照组,且差异均有统计学意义(P均<0.01);对照组PSP评分在治疗第4、8、16和24周均高于基线水平,差异有统计学意义(P 均<0.05);两组间除基线外同一时点PSP评分均高于对照组,差异均有统计学意义(P 均<0.05).④两组患者均无严重不良反应发生,组间不良反应发生率比较差异无统计学意义(P均>0.05).结论:老年精神分裂症患者采用棕榈酸帕利哌酮注射液治疗疗效与利培酮片剂相当,但服药依从性好,社会功能明显恢复,无明显不良反应.【期刊名称】《天津药学》【年(卷),期】2017(029)003【总页数】4页(P42-45)【关键词】棕榈酸帕利哌酮注射液;老年精神分裂症;疗效;安全性;社会功能【作者】顾培;仇玉莹;靳秀;毛富强【作者单位】天津市安定医院,天津 300222;天津医科大学 300070;天津市安定医院,天津 300222;天津医科大学 300070;天津医科大学 300070【正文语种】中文【中图分类】R971+.41精神分裂症的治疗目标随着精神医学的发展而不断变化,已由原来的单一注重疗效,逐渐发展成为更强调患者服药的安全性、耐受性及社会功能的恢复。
帕利哌酮说明书
【通用名】帕利哌酮控释片【适应症】适用于精神分裂症的所有症状,思维形式障碍,妄想,直觉/情感障碍,意志和行为障碍,自知力差等【规格】6mg/片,7片/盒【批准文号】【生产企业】西安杨森【英文名】Paliperidone【汉语拼音】Palipaitong Huanshipian【主要成分】帕利哌酮【性状】【药理作用】本药是通过阻断5-HT2A受体和多巴胺D2受体发挥抗精神病作用【药代动力学】【用法用量】一次一片,一日一次。
【不良反应】副作用小,多数会引起体重增加。
【禁忌】【储存】通风,阴凉,干燥储存。
【包装】【有效期】暂定二年产品说明:目前应用到临床上的抗精神分裂症药物非常多,大部分都存在药效不够稳定、副作用较大、改善患者社会功能的作用不明显等问题,而且传统抗精神病药由于受剂量滴定的影响,起效缓慢,难以在短时间内控制病情。
但是也有一些药物患者反响不错,比如说帕利哌酮缓释片,它给药方式简单,起效快,对于改善社会功能这一方面有显著效果。
这得益于药物采用了缓释技术,应用这种独特技术之后,药物中的有效化学成分能够比较持久和稳定地释放,使患者病情保持稳定,像正常人一样,这对精神分裂症患者回到工作岗位回归社会是很重要的。
第一个非典型抗精神病药物利培酮在上世纪90年代初期问世,其独特的5羟色胺和多巴胺平衡抑制作用,对精神分裂症患者阳性和阴性症状认知功能的改善,以及其良好的安全性,使得非典型抗精神病药物成为治疗精神分裂症的主流药物。
传统的抗精神病药物缓解了精神分裂症患者阳性症状,使得患者冲动、伤人、毁物的行为得到了控制。
非典型抗精神病药物能缓解患者的阳性和阴性症状,使患者的认知功能提高,多数患者得以临床缓解,回归社会。
新一代非典型抗精神病药——帕利哌酮控释片芮达(Paliperidone-ER)是强生-杨森公司最新研制的新型抗精神病药,2006年12月20日由美国食品与药物管理局(FDA)批准上市。
芮达通过阻断5羟色胺2A受体和多巴胺D2受体发挥抗精神病的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核准日期:2011年12月19日修改日期:2012年10月15日2013年01月28日棕榈酸帕利哌酮注射液说明书请仔细阅读说明书并在医师指导下使用警示语非典型性抗精神病药物会增高痴呆相关性精神病老年患者的死亡率使用非典型性抗精神病药物治疗痴呆相关性精神病的老年患者时,死亡的风险会增加。
对在患有痴呆相关性精神病的老年患者中进行的17项安慰剂对照临床试验(平均众数治疗时间为10周)的分析显示,药物治疗组患者死亡的风险为安慰剂对照组的1.6~ 1.7倍。
在一项典型的10周对照试验中,药物治疗组的死亡率为4.5%,安慰剂对照组为2.6%。
虽然死亡原因各异,但大多数死于心血管病(如心衰、猝死)或感染(如肺炎)。
观察性研究提示,与非典型性抗精神病药物相似,传统抗精神病药物也可能会增高死亡率。
在观察性研究中见到的增加死亡的机会有多少是抗精神病药物的原因而不是病人躯体疾患所致目前尚不清楚。
棕榈酸帕利哌酮注射液未被批准用于治疗痴呆相关性精神病患者(参见【注意事项】) 。
【药品名称】通用名称:棕榈酸帕利哌酮注射液商品名称:善思达® Invega Sustenna英文名称:Paliperidone Palmitate Injection汉语拼音:Zonglvsuan Palipaitong Zhusheye【成份】主要成份:棕榈酸帕利哌酮化学名称:(±)-3-[2-[4-(6-氟-1,2-苯并异噁唑-3-基)-1-哌啶]乙基]-6,7,8,9-四氢-2-甲基-4-氧-4H-吡啶[1,2-a]嘧啶-9-基棕榈酸酯化学结构式:分子式:C39H57FN4O4分子量:664.8辅料:聚山梨醇20、聚乙二醇4000、一水柠檬酸、磷酸氢二钠(无水)、一水磷酸二氢钠、氢氧化钠和注射用水。
【性状】本品为白色至灰白色的混悬液。
【适应症】本品用于精神分裂症急性期和维持期的治疗。
【规格】(1) 0.25ml:25mg,(2)0.5ml:50mg ,(3)0.75ml:75mg,(4)1.0ml:100mg,(5)1.5ml:150mg(按帕利哌酮计)【用法用量】推荐剂量对于从未使用过帕利哌酮口服制剂、利培酮口服制剂或利培酮注射剂的患者,建议在开始本品治疗前,先通过口服帕利哌酮缓释片或口服利培酮确定患者对帕利哌酮的耐受性。
建议患者在起始治疗首日注射本品 150 mg,一周后再次注射100mg,前2剂起始治疗药物的注射部位均为三角肌。
建议维持治疗剂量为每月75mg,根据患者的耐受情况和/或疗效,可在25~150 mg的范围内增加或降低每月的注射剂量。
第2剂药物之后,每月1次注射的部位可以为三角肌或臀肌。
每个月都可以调整维持治疗的剂量。
调整剂量时,需考虑到本品的长效释放特点【见药理毒理】,剂量调整所产生的全部效应可能需要几个月的时间才能体现出来。
药物漏用应避免药物漏用。
建议在给予首剂药物1周后注射第2剂本品。
为了避免药物漏用,可以在预定的时间点(首次给药后1周)之前或之后2天内给予第2剂药物。
同样,建议从第3剂药物开始每月给药1次。
为了避免药物漏用,患者可以在每月计划的给药时间之前或之后7天内给药。
药物漏用(1个月至6周)。
起始治疗之后,推荐的本品给药周期为1个月。
如果距离前一次给药的时间不到6周,则应该尽快按照原来的稳定剂量进行注射,之后继续按照每月1次的间隔注射给药。
药物漏用(>6周至6个月)。
如果距离前一次给药时间已经超过了6周,那么应当按照下面的方式以患者之前注射的稳定剂量重新开始治疗(但是,当患者之前的稳定剂量为150mg时,前两剂的注射剂量均应为100mg):1)尽可能快地在三角肌进行一次注射;2)一周以后进行另一次三角肌注射(与前一次的剂量相同);3)继续按照每月1次的间隔时间在三角肌或臀肌部位注射。
药物漏用(>6个月)。
如果距离前一次给药的时间已经超过了6个月,则应按照首次给药的方法【见用法用量】,重新开始本品治疗。
给药方式本品仅供肌肉注射使用。
注射时,应缓慢地注入肌肉深部。
注意不要将药物注射入血管中。
每次注射都必须由专业的卫生技术人员操作。
每剂药物都应一次性注射完毕,不能分次注射。
不要将药物注射到血管内或皮下。
在将本品注入三角肌时,应根据患者的体重情况确定所用的针头型号。
体重大于和等于90kg (≥200 lb)的患者应使用1.5英寸的22号针头进行注射。
体重小于90kg(<200 lb)的患者应使用1英寸的23号针头进行注射。
应交替使用两侧的三角肌。
在臀肌部位注射本品时,建议使用1.5英寸的22号针头。
应将药物注射到臀肌的外上象限。
应交替使用两侧的臀肌。
与口服利培酮或帕利哌酮联用目前尚未进行本品与帕利哌酮口服制剂、利培酮口服制剂或利培酮注射剂联用的研究。
由于帕利哌酮是利培酮的主要活性代谢物,因此本品与这些药物中的任何一种联用时,都会增加帕利哌酮的暴露量。
特殊人群的用药剂量肾脏损伤患者尚未在肾脏损伤患者中对本品进行系统的研究【见药理毒理】。
对于轻度肾脏损伤的患者(肌酐清除率≥50 mL/min至<80 mL/min),推荐本品的起始用药剂量为:第1天给予100mg,1周后给予75 mg,这两剂药物均采用三角肌注射给药。
之后每月注射50 mg,可以选择三角肌或臀肌部位给药。
不推荐本品用于中度或重度肾脏损伤患者(肌酐清除率<50 mL/min)。
肝损伤患者尚未在肝损伤患者中进行本品的研究。
根据一项帕利哌酮口服制剂的临床研究结果推测,轻度或中度肝损伤患者使用本品时无需调整剂量。
尚未在重度肝损伤患者中进行帕利哌酮的研究【见药理毒理】。
老年人一般情况下,推荐肾功能正常的老年患者使用本品的剂量和肾功能正常的成年患者相同。
由于老年患者有时会伴随肾功能下降,所以还应参考上述肾脏损伤患者的推荐剂量。
维持期治疗本品在长期治疗中可以有效延长精神分裂症症状未复发的时间。
治疗有效的患者推荐以所需最低剂量继续治疗。
患者应该定期进行重新评估以判定是否需要继续治疗。
从其它抗精神药物转用本品尚未系统性地收集以前接受其他抗精神病药物治疗的精神分裂症患者转为接受本品治疗的数据,或者本品与其他抗精神病药物合用的数据。
从口服抗精神药物转用本品对于那些从未服用过口服帕利哌酮或口服/注射用利培酮的患者,在给予本品之前要通过口服帕利哌酮缓释片或口服利培酮明确其耐受性。
在开始使用本品治疗后可以停止服用之前的口服抗精神药物。
按照【用法用量】的描述使用本品。
之前服用不同剂量的帕利哌酮缓释片稳定的患者在每月使用本品进行维持期治疗时可以获得如下相似的帕利哌酮稳态暴露,剂量见表1表1 稳态下可以达到相似暴露的帕利哌酮缓释片和本品的剂量剂型帕利哌酮缓释片本品服药周期每日一次每4周一次剂量(mg)1263150 75 25~50从长效注射用抗精神药物转用本品对于从未使用过帕利哌酮口服制剂、利培酮口服制剂或利培酮注射剂的患者,建议在开始本品治疗前,先通过口服帕利哌酮缓释片或口服利培酮明确其耐受性。
对于从长效注射用抗精神药物转用本品的患者,应该在下一次预计的注射日使用本品。
本品应该按月继续治疗。
用法用量中所描述的第一周起始治疗是不需要的。
如果中断本品,其长效的特点必须要考虑。
像其他口服抗精神药物推荐的一样,需定期重新进行评估决定是否需要继续使用抗锥体外系症状的药物。
【不良反应】以下内容在说明书其他部分会详细讨论:•增高痴呆相关性精神病老年患者的死亡率【见注意事项】•痴呆相关性精神病老年患者的脑血管不良事件(包括中风)【见注意事项】•抗精神病药物恶性综合征【见注意事项】•QT间期延长【见注意事项】•迟发性运动障碍【见注意事项】•高血糖和糖尿病【见注意事项】•体重增加【见注意事项】•高催乳素血症【见注意事项】•体位性低血压和晕厥【见注意事项】•白细胞减少,嗜中性粒细胞减少和粒细胞缺乏症【见注意事项】•潜在的认知和运动功能障碍【见注意事项】•癫痫【见注意事项】•吞咽困难【见注意事项】•自杀【见注意事项】•阴茎异常勃起【见注意事项】•血栓性血小板减少性紫癜【见注意事项】•体温调节紊乱【见注意事项】•避免疏忽导致注射入血管中【见注意事项】•止吐作用【见注意事项】•增加帕金森综合症或路易小体性痴呆患者的敏感性【见注意事项】•疾病或疾病状态可以影响代谢或血液动力学反应【见注意事项】在本节中对不良事件和不良反应加以区别。
不良事件是由临床研究者报告的事件,不对其与研究药物的因果关系作出结论。
不良反应是根据预先确定的评价方法(例如,对药物组和安慰剂组的不良事件的发生率进行比较)判断与使用本品有合理相关性的不良事件(不良药物反应)。
通过接受药物治疗的患者的个体不良事件报告无法正确地判断因果关系。
因此,本节总体上讲述的是不良反应,但单个小节中讲述的是不良反应还是不良事件,则取决于该节的内容。
由于临床试验是在广泛变化的条件下进行的,因此在一种药物的临床试验中观察到的不良反应率不能直接与在另一种药物的临床试验中观察到的不良反应率比较,而且也无法反映出在临床实践中观察到的不良反应率。
在双盲、安慰剂对照试验中最常见的(在任何一个使用本品治疗组中的发生率至少为5%)药物相关(与药物有关的不良事件率至少为安慰剂的两倍)不良反应是注射部位反应、嗜睡/镇静、头晕、静坐不能和锥体外系症状。
本部分中的数据来源于临床试验数据库,此数据库中包含3817例按照推荐的剂量范围(25~150 mg)接受了至少1剂本品治疗的精神分裂症受试者,以及共计510例接受安慰剂治疗的精神分裂症受试者。
在3817例接受了本品治疗的受试者中,1293例受试者在4项固定剂量、双盲、安慰剂对照试验(其中1项试验的疗程为9周,另外3项试验的疗程为13周)中接受了本品治疗,849例受试者在预防复发的长期试验中接受了本品治疗(其中的205例受试者在此项研究的双盲安慰剂对照阶段继续接受了本品治疗),1675例受试者在5项非安慰剂对照的试验中(其中3项为活性药物对照的非劣效试验,1项为长期开放药代动力学和安全性,另外1项为注射部位[三角肌-臀肌]交叉试验)接受了本品治疗。
在一项为期13周的临床试验中,本品的起始剂量为150 mg,随后每隔4周给予25 mg、100 mg或150 mg剂量的药物。
接受研究治疗期间的不良事件通过一般询问调查获得并由临床研究者采用其自己的术语记录。
因此,要对个体发生的不良事件的比例进行有意义的估计,需采用国际医学词典(MedDRA)术语将这些事件划分到标准化的类别中。
大部分不良反应的严重程度为轻度至中度。
双盲、安慰剂对照临床试验中的常见不良事件表2列出了在四项固定剂量、双盲、安慰剂对照试验中接受本品治疗的精神分裂症受试者中有2%或以上受试者报告的不良事件。
表2. 四项固定剂量、双盲、安慰剂对照试验中, 2%或以上接受本品治疗的精神分裂症受试者报告的治疗期间出现的不良事件发生率系统器官分类安慰剂a25 mg 50 mg 100 mg 150/25 mg b150/100 mg b150/150 mg b不良事件(N=510) (N=130)(N=302)(N=312)(N=160) (N=165) (N=163)发生不良事件的受试者的总百分率70 75 68 69 63 60 63胃肠道症状腹部不适/上腹疼痛2 2 4 4 1 2 4便秘 5 3 5 5 2 4 1 腹泻 2 0 3 2 1 2 2 口干 1 3 1 0 1 1 1 恶心 3 4 4 3 2 2 2 牙痛 1 1 1 3 1 2 3 呕吐 4 5 4 2 3 2 2 一般性疾病和用药部位症状虚弱0 2 1 <1 0 1 1 疲乏 1 1 2 2 1 2 1 注射部位反应2 0 4 6 9 7 10感染与传染鼻咽炎 2 0 2 2 4 2 2 上呼吸道感染2 2 2 2 1 2 4尿道感染 1 0 1 <1 1 1 2 受伤、中毒和手术并发症皮肤损伤<1 2 <1 0 1 0 0 研究检查丙氨酸氨基转移酶升高2 0 2 1 1 1 1体重增加 1 4 4 1 1 1 2 肌肉骨骼和结缔组织疾病背痛 2 2 1 3 1 1 11 1 <1 <1 1 1 2肌肉骨骼僵硬肌痛 1 2 1 <1 1 0 2肢体疼痛 1 0 2 2 2 3 0神经系统症状静坐不能 3 2 2 3 1 5 6头晕 1 6 2 4 1 4 2锥体外系症1 523 1 0 0状头痛12 11 11 15 11 7 6嗜睡/镇静 3 5 7 4 1 5 5精神性症状激越7 10 5 9 8 5 4焦虑7 8 5 3 5 6 6失眠15 15 15 13 12 10 13梦魇<1 2 0 0 0 0 0自杀倾向 2 0 1 2 2 2 1呼吸、胸和纵隔症状咳嗽 1 2 3 1 0 1 1血管疾病高血压 1 2 1 1 1 1 0百分率四舍五入为整数。
