1,3-二羰基化合物的碳-氢键活化反应
高等有机第二章-溶剂化效应
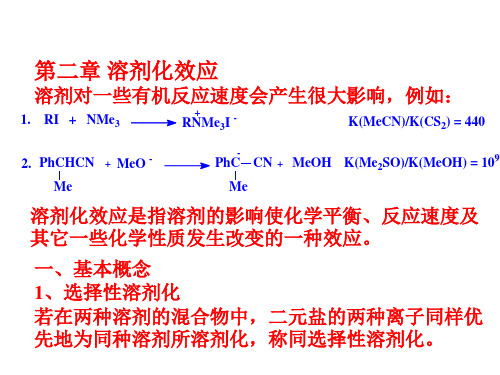
C、偶极-诱导偶极力 具有永久偶极矩的分子或离子能诱导邻近分子,产 生诱导偶极矩,分子在被诱导的瞬间总是处于诱导 偶极的方向,两者之间有吸引力。非极性分子可极 化率越大,诱导偶极矩也越大。这对偶极分子和离 子在非极性溶剂中的体系最重要。
D、瞬间偶极-诱导偶极力(色散力〕 非极性分子由于电子不断运动,会瞬间产生小的偶极 矩,它使邻近分子产生脉冲性极化,从而产生分子间 的相互吸引力,这称为色散力。
环烷-1,3-二酮与反式烯醇结构存在平衡,由于不存在 分子内氢键,溶剂极性对平衡的影响与前面顺式烯醇 时相反。如,5,5-二甲基-1,3-环己二酮在水中95%烯醇 化,在环己烷稀溶液中烯醇化含量<2%.
O
O
HO
O
四、溶剂对均相化学反应速度的影响
溶剂 V
(C2H5)3N + C2H5I 己烷 乙醚 1 4
2、溶剂和溶质分子间的相互作用 第一类包括定向诱导力和色散力,这些力是非特异性 的,不可能完全饱和。 第二类包括氢键力和电荷转移力,或称电子对授受力。 这类作用有方向并且可以饱和生成化学计量的分子化 合物。
(1)定向诱导和色散力 A、离子-偶极力 中性偶极分子具有永久偶极矩。当偶极分子处于离子 产生的电场中时,将进行定向排列,带有和离子电荷 相反电荷的一端指向离子,这种作用称离子-偶极力, 这种作用对离子化合物在极性溶剂种最重要。作用能 可用下式表述:E= - Z u Cos a/r2 Z 离子电荷。 u永久偶极矩, r 离子到偶极分子中心距 离, a= 0 o 时,偶极分子和离子在一条直线上。 B、偶极-偶极力 两个偶极分子在一定距离内相互吸引时,可按下列二 种方式排列。 -
例:
1. (CH3)3CCl 溶剂 K相对 C2H5OH 1 CH3OH 9
8 碳氧双键化合物(2)

O
工业上乙烯酮可由乙酸或丙酮热解制备。
CH3 C OH CH3 C CH3 O O
700℃ AlPO4
CH2 C
O
+ H2O
800℃ Fe
CH2 C
O
+ CH4
较好的制备方法是由 CO 和 H2 合成乙烯酮。
2
ZnO
3 CO + H2
250℃,压力
CH2 C
O
+ CO2
在α,β-不饱和羰基化合物中,C=C 双键与羰基共轭,所以它们除了具有与烯烃和简 单羰基化合物相类似的化学性质外,还有一些特殊的化学性能。 1、 1,2- 和 1,4- 加成反应 α,β-不饱和羰基化合物与亲核试剂 NuH 能发生 1,2- 加成和 1,4- 加成反应。
9
O
O
室温
OH CH3C
O CHCOC2H5
7%
CH3CCH2COC2H5
93%
烯醇式乙酰乙酸乙酯
烯醇式中存在顺反异构,占多数的是 Z-式构型。这是由于 Z-式构型有利于形成分子 内六员环氢键。 酮的结构对烯醇含量影响很大。若烯醇式中共轭体系越大,则烯醇式含量越高。
O O C CH2 C CH3 OH C CH
O CH3 CH3 + CH3 CH3MgBr
1) CuCl 2) H /H2O
O CH3 CH3 CH3 CH3
Michael 加成中,常用的共轭体系有:
O C C C , C C O C OR , C C C N , C C C N O 等
产生碳负离子的体系有: CH2(COOEt)2, CH3COCH2COOR , CH 3NO2 , NCCH2COOR , PhCH 2CN , RMgX , R 2CuLi Michael 加成产物的结构为:
教学课件:第十四章-1-3-二羰基化合物

要点二
详细描述
二羰基化合物可以通过一系列的反应,如氧化、还原、取 代等,合成出多种药物,如抗生素、抗癌药物、抗病毒药 物等。这些药物在医疗领域中发挥着重要的作用,对于治 疗各种疾病、保障人类健康具有重要意义。
在香料合成中的应用
总结词
二羰基化合物在香料合成中也有着广泛的应用,能够 合成出多种具有特殊香味的化合物。
究。
新应用探索
鼓励寻找二羰基化合物的新用 途,特别是在绿色化学和可持 续发展方面的应用。
教学改进
提出了一些关于如何改进二羰基 化合物教学的建议,以帮助学生 更好地理解和掌握这一主题。
跨学科整合
提倡将二羰基化合物与其他化 学主题进行跨学科整合,以提
供一个更全面的学习视角。
THANKS
感谢观看
羧酸酯的脱羧
总结词
羧酸酯的脱羧是制备二羰基化合物的另一种常用方法,通过加热或使用催化剂可以将羧酸酯脱羧生成 二羰基化合物。
详细描述
在加热或催化剂的作用下,羧酸酯中的酯基会发生脱羧反应,生成一个碳碳双键和二氧化碳,再通过 氧化等手段将碳碳双键转化为羰基,从而得到二羰基化合物。该方法条件温和,适用于大多数羧酸酯 的转化,但反应过程中可能伴随有副反应的发生。
详细描述
香料工业中,二羰基化合物可以通过一系列的反应, 如酯化、取代等,合成出各种香料,如香豆素、香兰 素等。这些香料在食品、化妆品等领域中广泛应用, 能够为人们的生活带来美好的体验。
在染料合成中的应用
总结词
二羰基化合物在染料合成中也有着重要的应用,能够合 成出多种具有优良性能的染料。
详细描述
染料工业中,二羰基化合物可以通过一系列的反应,如 偶联、氧化等,合成出各种染料,如偶氮染料、蒽醌染 料等。这些染料在纺织、皮革等领域中广泛应用,能够 为纺织品和皮革制品带来鲜艳的色彩和优良的性能。
第十三章-+羧酸衍生物

Ac2O
H2N CH3
KMnO4 / H+ AcHN CH3
AcHN
COOH
H+ / H2O
H2N
COOH
降低反应活性,制备酚、芳胺的单卤代化合物
OH
Ac2O
OAc
Br2 / Fe
OAc
H+ / H2O
OH
Br
Br
23
五、格氏反应
O Ph C Cl CH3MgBr Et2O OMgBr Ph C Cl CH3 -MgBrCl O Ph C CH3 CH3MgBr OMgBr Ph C CH3 CH3 H3O+ OH Ph C CH3 CH3
R CO2C2H5 O NaOC2H5 C2H5OH
R CO2C2H5 O
R R' R'X CO2C2H5 O 1) NaOH 2) H3O O R R' 双烷基化
乙酰乙酸乙酯制备甲基酮衍生物
甲酸己酯:苹果香味 甲酸苄酯:香蕉香气 乙酸苯乙酯:玫瑰清甜蜜香 苯乙酸苄酯:茉莉香气
11
二、化学性质:亲核取代反应
1.水解反应(hydrolysis)
O R C O R C O R C O R C NH2(R') OR' O X H 2O HX O C R' O O R H2 O HOR' H+ or OH H2 O H+ or OH HNH2 (HNHR') C OH + HO C R'
苯甲酰溴
4
2、酸酐的命名
以酐为母体,前面加酸的名称
CH3CH2CO-O-OCCH3
O O H C O C H
《有机化学中的氢键问题》笔记

有机化学中的氢键问题●氢键的饱和性:氢原子小,而A和B原子较大,A—H的氢原子只能和一个B原子形成氢键。
同时负离子之间相互排斥,另个电负性较大的B1原子就更难接近氢原子。
●氢键键能由静电作用能、离位能、诱导能和色散能构成。
○1静电作用能:A—H键的偶极矩和B的未共用的成对电子之间的能量。
○2离位能:B原子和氢原子之间的距离小于范德华半径,存在斥力;B原子使得氢原子电子云密度增大,削弱了A—H键键能;B原子的未共用电子对和A—H的成键电子云共用化后(实际上三个轨道共同形成三个分子轨道),A—H…B获得额外的键能。
上述三种变化能量总和称为离位能。
○3诱导能和色散能:(1)诱导能:永久偶极矩(极性分子)诱导临近分子,使其出现诱导偶极矩。
永久偶极矩和诱导偶极矩的之间存在吸引,此相互作用的能量为诱导能。
(2)色散能:瞬时偶极矩(非极性分子)诱导临近分子,使其出现诱导偶极矩。
瞬时偶极矩和诱导偶极矩的之间存在吸引,此相互作用的能量为色散能。
●形成分子内氢键的驱动力主要是熵增,其生成能不大。
●通过氢键形成的螯形环内如果不含双键或一个双键,则五元环最稳定;含两个双键,六元环最稳定。
●一般的分子内氢键,六元环比五元环更稳定,因为张力更小(标准氢键为180°)●在晶体内形成氢键,则晶体变硬;在液体内形成氢键,使液体粘度和表面张力增加。
●湿熔点法:测量化合物干燥时的熔点和沾有水的熔点,二者作差。
若差值较大,则形成分子间氢键;若差值较小,形成分子内氢键。
(1915年N.V.sidgwick首创) ●乙酰丙酮可以形成分子内氢键。
●羧酸通常是以两分子之间形成分子间氢键;过氧酸通常是单分子形成分子内氢键(五元环较稳定)●不能互溶的实质:同种分子之间的力大于不同种分子之间的力。
●亲核试剂容不容易被溶剂化,取决于溶剂化前后电荷是否会更加分散。
若像F-、OH-体积小电荷密度大的,溶剂化后负电荷更加分散,故容易溶剂化;若像SCN-、I-体积大电荷密度小,就不容易被溶剂化。
高等有机化学第6章羰基化合物的反应精品PPT课件

R
H
C2H 5
+
H
OH
Ph
OH
H
C2H 5
H
R
Ph
Ph
H
C 2H 5
HO
H
R
主要产物
Ph
H
C 2H 5
H
OH
R
次要产物35oC源自R主次CH3
2.5 : 1
C6H5
>4 : 1
(CH3)2CH 5 : 1
(CH3)3C
49 : 1
-70oC
R (CH3)3C CH3
主
次
499 : 1
5.6 : 1
Cram规则二:当醛或酮的α-碳原子上连有羟基或氨基 等可以和羰基氧原子形成氢键的基团时,试剂将从含氢 键环的空间阻碍较小的一边对羰基进行加成。
Cram规则一:如果醛或酮的α-碳原子上连有三个大
小不同的基团(L、M、S分别代表大、中、小三个
基团)时,其优势构象为羰基键处在两个较小基团
之间的构象,试剂优先从空间阻碍较小的一边进攻
羰基。
O
次要产物
Nu-
M
S
M O S 主要产物
LR LR
Ph
O
H
H
C 2 H 5
H
O
P hH
C 2H 5 1 RMgX 2 H2O
——羰基C=O的吸电子作用使得a-H具有明显的酸性,在碱
性条件下可以离解,生成烯醇负离子,从而成为亲核试剂, 进攻羰基碳或卤代烃,发生亲核加成反应、亲核取代反应。
O CC H
BH2
O CC
O CC
烯 醇 负 离 子
烯醇负离子由于羰基的共轭作用得以稳定
有机化学II14二羰基化合物

OO CH3C C- H C OC2H5
电子的分布不同
CH3 C CH2COOC2H5 O 互变异构
CH3 C CHCOOC2H5 OH
质子的转移
共振杂化体与互变异构本质区别!
酯缩合反应 Claisen 酯缩合
-酮酸酯
2 CH3COOCH2CH3
NaOC2H5
CH3COCH2COOC2H5 + C2H5OH
C CH2
C
O
O CH3 C
H O
C CH2 O
H O
O
CH3 C CH2 C O
CH3COCH3
(乙)酸式分解
O
O
CH3C CH2COOC2H5
40%NaOH
Δ
2CH3CONa + C2H5OH
酸式分解的机理:
O
O
CH3 C CH2 C OC2H5
OH
O-
O
CH3 C CH2 C OC2H5
OH
CO2C2H5
CO2C2H5
+
CO2C2H5 +
O NaOC2H5
OO C CO2C2H5
O C CH3
NaOC2H5
O
O
C CH2 C
O CH3CH2CO2C2H5 + H3C C CH3
NaOC2H5
O
O
H3C C CH2 C CH2CH3
β-二羰基化合物碳负离子的反应
1、与卤烷反应
OO CH3CCH2COC2H5
CH3COCHCOOC2H5 (CH2)nCOOC2H5
1)稀OH -,2)H+,3)Δ
酮 式 ·分 解
第 六章羰基化合物的反应(共137张PPT)

与亚硫酸氢钠的加成
O CH3 + NaHSO3
O CH3 SO3Na
O
O
应用:a 鉴别化合物(2-戊酮和3-戊酮) b 分离和提纯醛、酮
分离3-戊酮和2-戊酮的混合物
=
= =
=
= =
O
C H3 C H2 C C H2 C H3
b p :102℃
O
NaHSO3
C H3 C H2 C H2 C C H3
O 2 N
O 2 N
CO + H 2 N NHN 2O H 2 O CN NHN 2O 2,4-二硝基苯腙
O
O
CO + H 2 NNC H N 2H H 2 O
缩氨脲
CNNC H N 2H
应用:鉴别醛酮
与格氏试剂的加成
加成产物水解后生成醇,用于制备各种醇。
δ- δ+
δ+δ-
R M g X+ CO
RCO M g XH 2O
Nu
R CO
R'
sp2杂化 平面三角型
键角:120° 109°28 ′
产物中基团拥挤程度增大。
R 越大,妨碍Nu:进攻C原子。
R
O
C Nu
R'
sp3杂化 四面体
缓解角张力
OH C N
O H C NK = 1 0 0 0 0
O + H C N
C O N HK = 1 0 0 0
角张力缓解程度不大
醛、酮羰基碳原子所连的基团空间位阻或空间张力愈大, 则羰基的反应活性愈小。这一方面是由于大的位阻会阻 碍亲核试剂的进攻;另一方面醛、酮羰基碳原子为sp2杂 化,键角为1200,而加成产物原羰基碳原子变成了sp3杂化, 键角接近109028’,基团体积大,加成后必然张力增加 也大,使亲核加成难以发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1,3-二羰基化合物的碳-氢键活化反应1,3-二羰基化合物是一种应用广泛的化学物质。
香料工业用于制造食用香精,医药工业用于制造钙抗结剂、降压剂等,也是很多结构复杂的化合物和天然产物的中间体。
二羰基化合物由于其独特的结构特性从而具备了多种特殊的化学性质例如作为重要的有机合成中间体用于合成杂环类化合物同时它具有高效的抗菌活性,因而在医学上有着广泛的应用。
许多不同的二羰基化合物及其衍生物可以作为合成活性氨基酸的原料因此该结构单元被看成是最基本的医学分子之一,另外,二羰基化合物亚甲基可以与有机硼化物的螯合物相结合以及与许多不同的金属配体相络合因此在合成化学和配位化学中吸引了很多化学家的注意。
最近几年,关于碳-氢键的活化一直受到人们的关注,碳氢键是构成有机化合物的最基本化学键之一。
通过过渡金属催化剂实现的简单碳氢化合物与碳碳、碳氮和碳氧等多重键的直接碳氢键活化及加成反应是实现相关碳-碳键和碳-杂键构建的最经济、最高效的方法之一。
而直接利用碳氢键选择性地官能团化是有机化学家们长期以来追求的目标。
由于碳氢键具有较高的键能相对稳定且极性很小等基本结构特征,直接地官能团化遇到的第一个问题就是反应活性很低。
另外,同一个有机化合物分子内通常有很多种化学性质不同的碳氢键,如何实现其中的某一类碳氢键的转化而不影响分子中其它的碳氢键和官能团,这就涉及到碳氢键活化过程中的选择性问题!碳氢键活化,就是在一定的条件下,对一种有机化合物中的某一碳氢键反应性增强或切断实现定向化学转化!因此,有机化学家面临的最大挑战是如何活化非活性的碳氢键以及解决其化学转化的选择性问题!如果能够选择性切断非活性的碳氢键,并开发出实用的合成化学新方法、新反应必将为传统的有机合成工业带来一场巨大的变革。
1. 1,3二羰基化合物与烯烃的反应2005年,李朝军课题组报道过1,3-二羰基化合物与苯乙烯分子间加成反应,在该反应中,以金和银作为催化剂,收率为76%。
反应效果良好[1]。
之后,三氟甲基磺酸铋,氯化铁[2],氯化铟,三氟甲磺酸镓等这些Lewis 酸和布朗斯特酸等也被应用到这类反应中。
十二磷钨酸(PW A),十二磷钼酸(PMA)这类杂多酸(HPAs),经常作为绿色催化剂使用,因其具有工业作用,稳定性,可循环再利用,简单干净的反应过程等优点。
此外,近年来,无溶剂反应体系简单,产率高,在现代有机合成化学中越来越受到人们的关注。
2008年,有人报道以十二磷钨酸(PW A)为催化剂的无溶剂合成方法[3].由于单质碘便宜易得,在有机合成中的应用越来越广泛,温和的Lewis 酸与单质碘共同作用使得单质碘用量更少,作用效果更优异[4]。
2010年,有人报道了在单质碘存在下,1,3-二羰基化合物与苯乙烯的反应,收率为92%,当不断变换烯烃的取代基,此反应的收率依然很好,当原料变为1H-茚时,此反应效果仍然很好,因此,可以说这种烯烃与1,3-二羰基化合物分子间作用的合成方法简便有效,产率高,原子利用充分,操作简便,应用前景良好[5]。
R R'OO O O FeCl 3,30mol o /o DCE,80o C+RR'O O Ph O PhOAgOTf ,CH 3NO 2100o C +O O O O PWA100o C,4h+Ph Ph2. 1,3二羰基化合物与苄醇的反应具有条件温和,合成简便,产率高等特点的合成方法一直以来都是人们关注和不懈追求的。
苄位和烯丙位的碳-氢键断裂能 ( BDE) 较低,且相邻Π-体系的分子轨道与过渡金属有较强的相互作用,使碳-氢键活化变得相对容易。
Li 等利用Fe, Cu 作为催化剂发展了一系列构建碳-碳键的方法,并提出了直接高效的交叉脱氢偶联(CDC )的概念[6a]。
2008年,报道过以碘单质作为条件的1,3-二羰基化合物和苄醇的反应,在该反应中,仅用了催化量的单质碘,就达到了很高的收率[6b]。
2010年,刘等人报道了用布朗斯特酸催化反应,在这个反应中,仅仅使用了1mmol %的HClO 4, 反应温度为70℃,以甲苯为溶剂,得到了88%的收率[7];此外,在“绿色化学”概念的不断引领下,催化剂固定液越来越得到人们的关注,因为多相催化剂的使用,使得反应的后续处理,产物的分离纯化变得更简单,同时,也加强了催化剂的回收再利用[8],近年来,关于硅胶负载含氯酸模式的催化剂的研究越来越多[9,10],刘等人试图将这种方法引入到1,3-二羰基化合物与苯乙烯或者醇类的反应中,并惊喜地发现,与单纯的使用酸做催化剂相比,这种方法效果更好,反应条件温和,以甲苯为溶剂时,得到94%的产率,而在不使用溶剂的情况下,产率可达96%[7]。
OH 5mol o /o I 2,CH 2Cl 2r.t,2.5h +O O OO曾有人认为H 2SO 4是不能催化乙酰丙酮和苯乙醇这个反应的发生[11]。
然而,2012年,刘等人报道了H 2SO 4可以催化使其发生反应,并且在1,2-二氯乙烷做溶剂时是一个高效催化剂,回流时5min 即可反应完全,产率为67%,再进一步对溶剂进行筛选过程中,发现当CH 3NO 2为溶剂时,反应产率高达98%[12]。
在过去的几年里,双官能团有机催化剂作为新型高效的有机催化剂合成不对称化合物而出现在世人面前[13]。
2012年,有人报道了以硫脲作为催化剂,催化该类反应的发生,产率为94%[14]。
O 10mol o /o A,-40o C,10h+CH 3(E)O Ph O Ph O NO 2这为我们提供了一种新思路,在选择催化剂时,不仅仅局限于金属催化剂,Lewis 酸或者布朗斯特酸,有些天然产物亦可为我所用,也许就会有意外之喜。
3. 1,3-二羰基化合物与苯胺的反应2008年, Peter Langer 等人报道了1,3-二羰基化合物与苯胺作用形成环状化合物的反应,环化产物的生成需要依赖于芳香化合物的空间结构和C-C 键的形成[15]。
O 5mol o /o H 2SO 4,CH 3NO 2101o C,5min +OH OPh OPh O N H SN H R NA2011年,Chhanda Mukhopadhyay 等人将1,3-二羰基化合物与苯胺及其衍生物通过一锅法合成氮杂环化合物,反应条件温和,收率良好[16]。
Grob 和 Camenisch 首先发现吡咯环可以由二羰基化合物和硝基烯通过分子间环化制得。
2013年,Claudio C. Silveira 等人希望为此OEt O O NH 25mol o /o FeCl 3,DCM25-30o C,stirring+HCHO +OEtO O N N反应寻找一个新的反应体系简单的方法。
化学方法中用于电子转移的氧化包括使用高价态的金属盐,Mn(III)、Cu(II)、Ag(I)、Co(in)、V(V)和Fo(m)。
在这些盐中,Mn(III)运用最广。
这个时候,Ce试剂作为一种合适的单电子氧化剂承担了重要的角色。
在此反应中,作者在微波条件下以Ce盐作为催化剂,产率为75%[17]。
4.结论无论是1,3-二羰基化合物还是碳-氢键的活化在有机合成反应中的意义不可小觑。
一般,利用过渡金属,Lewis酸,布朗斯特酸等对碳-氢键进行活化,加之,微波,催化剂固定,无溶剂反应等的运用,使得1,3-二羰基化合物碳-氢键活化的研究已经取得了非常重大的进展。
但从以上的介绍来看,大多数反应都只局限于一些特定的体系,离普遍意义上的碳-氢键活化尚有很远距离!这也为我们留下了很大的发展空间开展新反应,而且有很多经验值得我们借鉴!可以预料,碳-氢键活化还会受到化学家们的广泛关注,仍然是有机化学中的热点研究领域。
【参考文献】[1]Yao, X. ; Li, C.-J. J. Org. Chem. 2005, 70, 5752[2]Duan, Z.; Xuan, X. J. ; Wu, Y. J . Tetrahedron Lett. 2007, 48, 5157.[3]X.-L. Wu; G.-W. Wang. Tetrahedron Letters 2008, 49, 5090-5093.[4]Zhou, Y.; Yan, P. F.; Li, G. M.; Chen, Z. J.Chin. J. Org. Chem.2009, 29, 1719;[5]J. S. Yadav. Tetrahedron Letters 2010. 51. 2622-2624.[6](a)Lin Cao; Zhiping Li; Chao-Jun Li. Angew. Chem. Int. Ed. 2007, 46, 6505.(b)W. Rao; Philip W. H. Chan. Tetrahedron Letters. 2008. 49. 122-126.[7] Yu Jie Ren; Pei Nian Liu. J. Org. Chem.2010, 75, 15;[8] Gu, Y.; Li, G. Adv. Synth. Catal. 2009,351, 817.[9] Kumar, R.; Kumar, D.; Chakraborti, A. K. Synthesis. 2007, 299.[10]Shaterian, H. R.; Yarahmadi, H.; Ghashang, M. Tetrahedron. 2008,64, 1263.[11] Liu, P. N.; Dang, L.; Wang, Q. W.; Zhao, S. L.; Xia, F.; Ren, Y. J.; Gong, X. Q.; Chen, J. Q. J. Org. Chem. 2010, 75, 5017–5030.[12]F. X.; Z-L Zhao; P-N Liu. Tetrahedron Letters. 2012. 53. 2828-2832.[13] Connon, S. J. Chem. Commun.2008, 44, 2499–2510[14]Z. Ma; Jing-chao Tao. Tetrahedron:Asymmetry . 2012 . 23. 443-448.[15]J. Hefner; Peter Langer. Tetrahedron Letters. 2008. 49. 2262-2264.[16]Sunil Rana; Ray J. Butcher; C. Mukhopadhyay. Tetrahedron Letters. 2011. 52 4153–4157.[17]C.C. Silveira. Tetrahedron. 2013. 69. 9076-9085.。
