【精品】陕西省西安市2017-2018学年高二《化学》上学期第一次月考试题及答案
陕西省西安市远东一中2017-2018学年高二(上)月考化学试卷(10月份) Word版含解析

2017-2018学年陕西省西安市远东一中高二(上)月考化学试卷(10月份)一、单项选择题(20×3分=60分)1.(3分)(2014秋•小店区校级期中)在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是()①增大反应物的浓度②升高温度③增大压强④移去生成物4.(3分)(2008秋•锦州期末)若以N A代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+O2(g)→2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法中,正确的是()OO6.(3分)(2014秋•福建校级期末)单斜硫和正交硫是硫的两种同素异形体.已知:①S (s ,单斜)+O 2(g )═SO 2 (g )△H 1=﹣297.16kJ •mol ﹣1﹣17.(3分)(2005•乐山一模)已知在25℃,101kPa 下,1g C 8H 18(辛烷)燃烧生成二氧化碳8.(3分)(2014春•房山区期末)已知2H 2(g )+O 2(g )═2H 2O (l );△H=﹣569.6kJ •mol ﹣1,2H 2O (g )═2H 2(g )+O 2(g );△H=+482.1kJ •mol ﹣1.现有1g 液态H 2O ,蒸发时吸收9.(3分)(2007秋•郑州期末)反应A (g )+3B (g )⇌2C (g )+2D (g ),在不同情况下测得10.(3分)(2012•杭州一模)一定条件下,体积为10L 的密闭容器中,1mol X 和1mol Y 进) 的平衡浓度变为原来的11.(3分)(2014•泾阳县校级模拟)在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A (g )+2B (g )⇌C (g )+D (g )已达到平衡状态( ) ①混合气体的压强 ②混合气体的密度 ③B 的物质的量浓度 ④混合气体总物质的量⑤混合气体的平均相对分子质量 ⑥v (C )与v (D )的比值⑦混合气体总质量12.(3分)(2014秋•宁城县期末)体积相同的甲.乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化13.(3分)(2013秋•新田县校级期末)某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z (g);△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是()14.(3分)(2012秋•下陆区校级期中)在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡时测得CO2为0.6mol,再通15.(3分)(2012秋•莲湖区校级月考)在一定的温度和压强下,合成氨反应3H2+N2⇌2NH316.(3分)(2012•南京模拟)对于任何一个平衡体系,采用以下措施,一定会使平衡移动的17.(3分)(2013秋•富平县校级期中)在密封容器中,一定条件下进行反应:mA(g)+nB (g)⇌pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,V正’、V逆’变化过程均如图所示,则对该反应叙述正确的是()18.(3分)(2012秋•莲湖区校级月考)A(g)+B(g)⇌C(g);△H<0平衡后,若使温度C19.(3分)(2014秋•华龙区校级期中)有如下反应2SO2(g)+O2(g)⇌2SO3(g),△H=﹣197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2、1molSO3,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确20.(3分)(2013秋•尖山区校级期中)在一密闭容器中有如下反应:aX(g)+bY(g)⇌n W (g).某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下二、填空题(20分)21.(2分)(2011秋•碑林区校级期中)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol﹣1Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H1=+473.63kJ•mol﹣1写出Na2CO3•H2O脱水反应的热化学方程式.22.(4分)(2011秋•陕西校级期末)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H﹣H键能为436kJ/mol,氧气分子中O=O键能为498kJ/mol,则水分子中O﹣H键的键能为kJ/mol.若1g水蒸气转化成液态水时放热2.5kJ,则反应H2(g)+1/2O2(g)═H2O(l)的△H=kJ/mol.23.(6分)(2010秋•宿州校级期中)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO (g)⇌Fe(s)+CO2(g)△H>0(1)此反应的平衡常数表达式为:K=(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比(填“增大”、“减小”或“不变”).(3)已知1100℃时,K=0.263.某时刻测得高炉中c(CO2)=0.025mol•L﹣1,c(CO)=0.1mol•L ﹣1,在这种情况下,该反应(填“是”或“不是”)处于化学平衡状态.如果“不是”,此时化学反应向方向进行(填“正反应”或“逆反应”).如果“是”,此空不填.24.(8分)(2011秋•碑林区校级期中)已知A(g)+B(g)═C(g)+D(g)反应过程中的能量变化如图所示,回答下列问题.(1)该反应是反应(填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”或“不变”),(2)在反应体系中加入催化剂,反应速率增大,E的变化是,(填“增大”、“减小”或“不变”)理由是E的大小对该反应的反应热有无影响?.三、实验题(12分)25.(12分)(2012秋•莲湖区校级月考)中和热的测定是高中重要的定量实验.取0.55mol/L 的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是,除此之外,装置中的一个明显错误是.(2)若改用60mL 0.25mol•L﹣1H2SO4和50mL 0.55mol•L﹣1NaOH溶液进行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热填“相等”“不相等”).(3)实验数据如下表:的比热容c=4.18J/(g•℃).则中和热△H=(取小数点后一位).四、计算题:(8分)26.(8分)(2013秋•响水县校级期中)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)⇌2NH3(g);在2min时达到平衡状态,此时c(N2)=5.00mol•L﹣1,c(H2)=10.00mol•L﹣1,c(NH3)=5.00mol•L﹣1.试求:(1)该温度下反应的平衡常数(2)H2的起始浓度(3)用N2表示该反应的平均反应速率(4)N2的转化率.2012-2013学年陕西省西安市远东一中高二(上)月考化学试卷(10月份)参考答案与试题解析一、单项选择题(20×3分=60分)1.(3分)(2014秋•小店区校级期中)在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是()①增大反应物的浓度②升高温度③增大压强④移去生成物4.(3分)(2008秋•锦州期末)若以N A代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+O2(g)→2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法中,正确的是()+OO6.(3分)(2014秋•福建校级期末)单斜硫和正交硫是硫的两种同素异形体.已知:①S(s,单斜)+O2(g)═SO2(g)△H1=﹣297.16kJ•mol﹣1﹣1)7.(3分)(2005•乐山一模)已知在25℃,101kPa 下,1g C 8H 18(辛烷)燃烧生成二氧化碳O 8.(3分)(2014春•房山区期末)已知2H 2(g )+O 2(g )═2H 2O (l );△H=﹣569.6kJ •mol ﹣1,2H 2O (g )═2H 2(g )+O 2(g );△H=+482.1kJ •mol ﹣1.现有1g 液态H 2O ,蒸发时吸收Q=×9.(3分)(2007秋•郑州期末)反应A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得10.(3分)(2012•杭州一模)一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是()的平衡浓度变为原来的=0.0005mol/,故11.(3分)(2014•泾阳县校级模拟)在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)⇌C(g)+D(g)已达到平衡状态()①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体总质量12.(3分)(2014秋•宁城县期末)体积相同的甲.乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化13.(3分)(2013秋•新田县校级期末)某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z (g);△H<0.下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是()14.(3分)(2012秋•下陆区校级期中)在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡时测得CO2为0.6mol,再通15.(3分)(2012秋•莲湖区校级月考)在一定的温度和压强下,合成氨反应3H2+N2⇌2NH316.(3分)(2012•南京模拟)对于任何一个平衡体系,采用以下措施,一定会使平衡移动的17.(3分)(2013秋•富平县校级期中)在密封容器中,一定条件下进行反应:mA(g)+nB (g)⇌pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,V正’、V逆’变化过程均如图所示,则对该反应叙述正确的是()18.(3分)(2012秋•莲湖区校级月考)A(g)+B(g)⇌C(g);△H<0平衡后,若使温度C19.(3分)(2014秋•华龙区校级期中)有如下反应2SO2(g)+O2(g)⇌2SO3(g),△H=﹣197KJ/mol,同温下,往体积相同的密闭容器A、B中分别充入2molSO2、1mol O2和1mol SO2、0.5mol O2、1molSO3,当它们分别达到平衡时放出的热量为Q1KJ和Q2 KJ,则下列比较正确20.(3分)(2013秋•尖山区校级期中)在一密闭容器中有如下反应:aX(g)+bY(g)⇌n W (g).某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下二、填空题(20分)21.(2分)(2011秋•碑林区校级期中)已知:Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol﹣1Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H1=+473.63kJ•mol﹣1写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)═Na2CO3(s)+H2O(g)△H1=+58.73kJ•mol﹣1.22.(4分)(2011秋•陕西校级期末)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H﹣H键能为436kJ/mol,氧气分子中O=O键能为498kJ/mol,则水分子中O﹣H键的键能为463.4kJ/mol.若1g水蒸气转化成液态水时放热2.5kJ,则反应H2(g)+1/2O2(g)═H2O(l)的△H=﹣286.8kJ/mol.+O436kJ/mol+××23.(6分)(2010秋•宿州校级期中)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO (g)⇌Fe(s)+CO2(g)△H>0(1)此反应的平衡常数表达式为:K=(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比增大(填“增大”、“减小”或“不变”).(3)已知1100℃时,K=0.263.某时刻测得高炉中c(CO2)=0.025mol•L﹣1,c(CO)=0.1mol•L ﹣1,在这种情况下,该反应不是(填“是”或“不是”)处于化学平衡状态.如果“不是”,此时化学反应向正反应方向进行(填“正反应”或“逆反应”).如果“是”,此空不填.k=故答案为:Qc==0.2524.(8分)(2011秋•碑林区校级期中)已知A(g)+B(g)═C(g)+D(g)反应过程中的能量变化如图所示,回答下列问题.(1)该反应是放热反应(填“吸热”、“放热”).当反应达到平衡时,升高温度,A的转化率减小(填“增大”、“减小”或“不变”),(2)在反应体系中加入催化剂,反应速率增大,E的变化是减小,(填“增大”、“减小”或“不变”)理由是催化剂改变了反应的途径,降低了反应所需的活化能E的大小对该反应的反应热有无影响?无影响.三、实验题(12分)25.(12分)(2012秋•莲湖区校级月考)中和热的测定是高中重要的定量实验.取0.55mol/L 的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌器,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.(2)若改用60mL 0.25mol•L﹣1H2SO4和50mL 0.55mol•L﹣1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”).(3)实验数据如下表:②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=﹣56.8 kJ/mol(取小数点后一位).kJ/mol温度差平均值为=3.4﹣=四、计算题:(8分)26.(8分)(2013秋•响水县校级期中)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)⇌2NH3(g);在2min时达到平衡状态,此时c(N2)=5.00mol•L﹣1,c(H2)=10.00mol•L﹣1,c(NH3)=5.00mol•L﹣1.试求:(1)该温度下反应的平衡常数(2)H2的起始浓度(3)用N2表示该反应的平均反应速率(4)N2的转化率.K=计算=K=×=7.5mol/L×=2.5mol/L ==。
西安市高二上学期化学第一次月考试卷

西安市高二上学期化学第一次月考试卷姓名:________ 班级:________ 成绩:________一、单选题 (共20题;共40分)1. (2分)按下图装置实验,若x轴表示负极流出的电子的物质的量,则y轴应表示()①c(Ag+) ②c(NO3-) ③a棒的质量④b棒的质量⑤溶液的质量A . ①③B . ③④C . ①②④D . ②2. (2分)溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.010 mol·L-1。
向该溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是[已知:Ksp(AgCl)=1.8×10-10Ksp(AgBr)=5.0×10-13Ksp(AgI)=8.3×10-17]()A . AgBr和AgIB . AgI和AgClC . AgBr和AgClD . 一起沉淀3. (2分) (2018高二上·武汉期末) 下列说法不正确的是()A . Ksp只与难溶电解质的性质和温度有关B . 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀C . 其他条件不变,离子浓度改变时,Ksp不变D . 两种难溶电解质作比较时,Ksp小的,溶解度一定小4. (2分)为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是()A . 实验①、②说明锌能与稀硫酸反应而铜不能B . 实验③说明发生原电池反应时会加快化学反应速率C . 实验③说明在该条件下铜可以与稀硫酸反应生成氢气D . 实验④说明该原电池中铜为正极、锌为负极5. (2分) (2019高二上·哈尔滨期末) 下列说法错误的是()A . 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因B . 人们常采用牺牲阳极的阴极保护法防止金属腐蚀C . 在电镀槽中,一般镀件做阴极,阳极选用镀层金属D . 用惰性电极电解某硫酸铜溶液一段时间后,加入一定量的氧化铜可能会恢复原溶液的成分和浓度6. (2分) (2016高二上·沈阳期中) Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2 (s)⇌Cu2+(aq)+2OH﹣(aq),在常温下Ksp[Cu(OH)2]=2×10﹣20 .某CuSO4溶液中,c(Cu2+)=0.02mol•L﹣1 ,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于()A . 2B . 3C . 4D . 57. (2分) (2016高二上·福州期中) 用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是()A . CuCl2[CuCl2溶液]B . AgNO3[Ag2O]C . NaCl[HCl溶液]D . CuSO4[CuSO4]8. (2分) (2019高一下·浙江期中) 金属-空气电池是以金属为燃料,与空气中的氧气发生氧化还原反应产生电能的一种特殊燃料电池。
陕西省西安市第一中学2017-2018学年高二上学期第一次(10月)月考化学试题 Word版含答案

西安市第一中学2017-2018学年度第一学期月考试题高二化学可能用到的原子量:H:1 O:16 C:12 N:14一、选择题:(每小题只有一个选项符合题意,每小题2分,共 50分)1.下列对化学反应的认识错误的是( )A .会引起化学键的变化B .会产生新的物质C .必然引起物质状态的变化D .必然伴随着能量的变化2.已知Zn(s)+H 2SO 4(aq)===ZnSO 4(aq)+H 2(g) ΔH <0,则下列关于该反应的叙述不正确的是( )A .该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以总能量不变B .上述热化学方程式中的ΔH 的值与实验测定中反应物的用量无关C .该反应的化学能可以转化为电能D .反应物的总能量高于生成物的总能量3. 反应 A +B ―→C(ΔH <0)分两步进行:①A +B ―→X (ΔH >0),②X ―→C(ΔH <0)。
下列示意图中,能正确表示总反应过程中能量变化的是( )4. C(s)+12O 2(g)===CO(g) ΔH =―126.4 kJ/mol,这个热化学方程式表示( )A .1 g 碳燃烧生成一氧化碳时放出126.4 kJ 的热量B .12 g 碳燃烧生成一氧化碳时吸收126.4 kJ 的热量C .1 mol 固体碳在氧气中燃烧生成一氧化碳气体时放出126.4 kJ 的热量D .碳的燃烧热为126.4 kJ/mol5.下列关于热化学反应的描述中正确的是( )A .HCl 和NaOH 反应的中和热ΔH =-57.3 kJ/mol ,则H 2SO 4和Ca(OH)2反应的反应热ΔH =2×(-57.3) kJ/molB .CO(g)的燃烧热是283.0 kJ/mol ,则2CO 2(g)===2CO(g)+O 2(g)反应的ΔH =+566.0 kJ/molC .需要加热才能发生的反应一定是吸热反应D.1 mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷的燃烧热6. 已知H2SO4(aq)与Ba(OH)2(aq)反应的ΔH=-1 584.2 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。
西安市高二上学期化学第一次月考试卷D卷

西安市高二上学期化学第一次月考试卷D卷姓名:________ 班级:________ 成绩:________一、单选题 (共18题;共36分)1. (2分)(2018·丰台模拟) 清代《本草纲目拾遗》中关于“鼻冲水(氨水)”的记载明确指出:“鼻冲水,……贮以玻璃瓶,紧塞其口,勿使泄气,则药方不减……唯以此水瓶口对鼻吸其气,即遍身麻颤出汗而愈,虚弱者忌之。
宜外用,勿服。
”下列有关“鼻冲水”的推断错误的是()A . 鼻冲水是弱电解质B . 鼻冲水滴入酚酞溶液中,溶液变红色C . 鼻冲水中含有分子和离子的种类为6种D . 存在平衡:NH3 + H2O NH3·H2O NH4+ + OH-2. (2分)为了加快漂白粉的作用,最好的方法是()A . 加入苛性钠溶液B . 用水湿润C . 加少量盐酸D . 加干燥剂使用3. (2分) (2018高三上·张家口期末) 实验室检验SO2中混有CO2的装置如图所示。
下列说法正确的是()A . ①、②、③中可依次盛放饱和NaHCO3溶液、品红溶液、澄清石灰水B . ②的主要作用是除去SO2C . ③中观察到的现象是先有白色沉淀,当沉淀最多后再不断溶解D . 该装置也可用于检验NO2中混有NO4. (2分) (2016高二上·大连开学考) 依据下列甲、乙、丙三图,判断下列叙述不正确的是()A . 甲是原电池,乙是电镀装置B . 甲、乙装置中,锌极上均发生氧化反应C . 乙、丙装置中,阳极均发生氧化反应而溶解D . 丙装置中,铜电极的质量有增有减5. (2分) (2016高三上·洛阳期中) 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是()A . 该装置将化学能转化为光能和电能B . 该装置工作时,H+从b极区向a极区迁移C . 每生成1mol O2 ,有44g CO2被还原D . a电极的反应为:3CO2+18H+﹣18e﹣=C3H8O+5H2O6. (2分)(2018·遵义模拟) 类比是重要的学习方法,类比pH的定义可定义pOH和pKW。
西安市高二上学期化学第一次月考试卷(I)卷

西安市高二上学期化学第一次月考试卷(I)卷姓名:________ 班级:________ 成绩:________一、选择题(每小题3分,共42分。
) (共14题;共42分)1. (3分) (2019高二上·南宁期末) 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是()A . 反应物的键能总和大于生成物的键能总和B . 升高温度,利于A的转化率增大C . 加入催化剂时,可以降低反应热D . 增大压强,能够缩短反应达到平衡状态的时间2. (3分)(2018·红桥模拟) 常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。
下列有关说法正确的是()A . 常温下,PbI的Ksp为2×10-6B . 温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小C . 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大D . 常温下,Ksp(PbS)=8×10-28 ,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq) PbS(s)+2I-(aq)的化学平衡常数为5×10183. (3分) (2015高二上·中原期末) 下列有关实验的说法正确的是()A . 用干燥的pH试纸测定新制氯水的pHB . 中和滴定实验中,洗净后的锥形瓶不需要干燥C . 用Na2S溶液与AlCl3溶液混合制取Al2S3D . 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)4. (3分) (2016高二上·广州期中) 下列变化不能用勒夏特列原理解释的是()A . 实验室中常用饱和食盐水除去Cl2中混有的HClB . 银器长期放置,表面变暗C . 红棕色的NO2加压后颜色先变深再变浅D . 氨水中加酸,NH4+的浓度增大5. (3分)(2017·浙江模拟) 一定条件下,反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是()A . 10s内,NH3的平均反应速率为0.008mol•L﹣1•s﹣1B . 该反应达到平衡时6v(O2)正=5v(H2O)逆C . 10s内,反应放出的热量为0.1akJD . 10s时,H2O的反应速率为0.012mol•L﹣1•s﹣16. (3分) (2018高二上·江苏期末) 下列各图示与对应的描述相符合的是()A . 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100B . 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂C . 图丙表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化D . 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化7. (3分) (2020高二下·泸县月考) 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是()A . c(OH-)B . pHC . KbD . n(H+)·n(OH-)8. (3分) pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。
陕西省高二上学期化学1月月考试卷
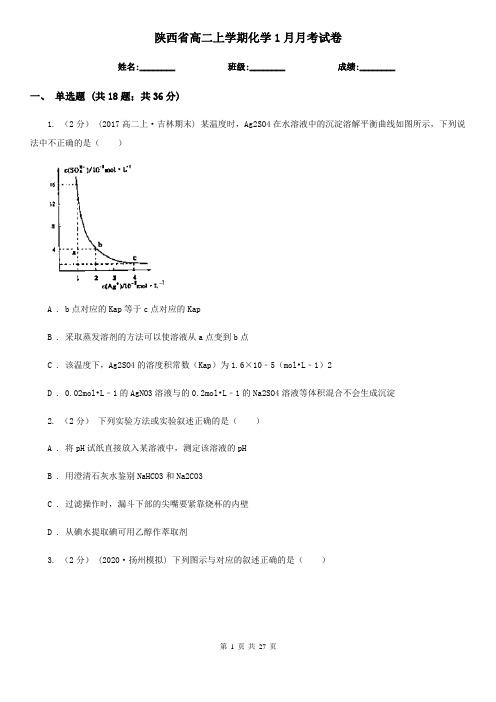
陕西省高二上学期化学1月月考试卷姓名:________ 班级:________ 成绩:________一、单选题 (共18题;共36分)1. (2分) (2017高二上·吉林期末) 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是()A . b点对应的Kap等于c点对应的KapB . 采取蒸发溶剂的方法可以使溶液从a点变到b点C . 该温度下,Ag2SO4的溶度积常数(Kap)为1.6×10﹣5(mol•L﹣1)2D . 0.02mol•L﹣1的AgNO3溶液与的0.2mol•L﹣1的Na2SO4溶液等体积混合不会生成沉淀2. (2分)下列实验方法或实验叙述正确的是()A . 将pH试纸直接放入某溶液中,测定该溶液的pHB . 用澄清石灰水鉴别NaHCO3和Na2CO3C . 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁D . 从碘水提取碘可用乙醇作萃取剂3. (2分)(2020·扬州模拟) 下列图示与对应的叙述正确的是()A . 图甲表示一定条件下反应2SO2(g) + O2(g) 2SO3(g)中各物质的物质的量浓度随时间的变化,说明t2时刻仅缩小了容器的容积B . 图乙表示反应CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明KⅠ>KⅡC . 图丙表示用0.01 mol·L−1 AgNO3溶液滴定浓度均为0.01 mol·L−1的NaX、NaY混合溶液时,-lgc随AgNO3溶液体积的变化,说明Ksp(AgY) >Ksp(AgX)D . 图丁表示25℃时,加水稀释10 mL pH均为5的HF与HCN溶液时,溶液的pH随溶液体积的变化,说明Ka(HCN) >Ka(HF)4. (2分) (2015高二上·海南期末) 埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是()A . 在潮湿疏松透气的土壤中B . 在干燥致密不透气的土壤中C . 在含铁元素较多的酸性土壤中D . 在含碳粒较多,潮湿透气的土壤中5. (2分) (2018高二上·台州月考) 25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
陕西省高二上学期第一次月考化学试卷A卷
陕西省高二上学期第一次月考化学试卷A卷姓名:________ 班级:________ 成绩:________一、选择题 (共16题;共32分)1. (2分) (2018高二上·红桥期中) 甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。
下列说法正确的是()A . 平衡时各容器内c(NO2)的大小顺序为乙>甲>丙B . 平衡时N2O4的百分含量:乙>甲=丙C . 平衡时甲中NO2与丙中N2O4的转化率相同D . 平衡时混合物的平均相对分子质量:甲>乙>丙2. (2分) (2016高一下·淮安期中) 下列做法,不能使CaCO3+2HCl═CaCl2+CO2↑+H2O的反应速率增大的是()A . 增大盐酸的浓度B . 碾碎碳酸钙C . 适当加热D . 把盐酸换成同浓度硫酸3. (2分)一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g)⇌4C(g),下列叙述能作为该反应达到平衡状态的标志的是()①混合气体平均摩尔质量不再变化②v(A):v(B):v(C)=1:3:4③A、B、C 的浓度不再变化④C 的体积分数不再变化⑤A、B、C 的分子数之比为 1:3:4⑥混合气体的密度不再变化⑦单位时间内消耗 amolA,同时生成 3amolB.A . ③④⑦B . ③④⑤⑥⑦C . ②③④⑦D . ①③⑤⑥⑦4. (2分) (2017高二上·西安期末) 造成西安雾霾的重要原因之一是汽车尾气,已知汽车尾气无害化处理的反应之一为 2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0,下列说法正确的是()A . 升高温度可以提高NO和CO的转化率B . 使用高效催化剂可以提高NO和CO的转化率C . 反应达到平衡后,NO 的生成速率和消耗速率相等D . 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响5. (2分)图为一带可移动隔板的密闭容器,某温度下,左、右两侧反应均达平衡,此时隔板处于容器中央。
陕西省西安市高二化学上学期第一次月考试题(1)
2017-2018学年度第一学期高二年级第一次月考化学试题可能用到的原子量:H:1 C:12 N:14 O:16 Al:27 Fe:56 Zn:65第I部分选择题(共52分)一、选择题(每小题只有一个选项符合题意,每小题2分,共 52分)1.下列变化属于吸热反应的是①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥ Ba(OH)2·8H2O与NH4Cl晶体混合A.①④⑤ B.①②④ C.②③ D.②④⑥2.下列各组物质的燃烧热相等的是A.C2H4和C3H6 B.1mol碳和3mol碳 C.白磷和红磷 D.淀粉和纤维素3.下列反应在任意温度下一定能自发进行的是( )A.X2Y2(g)=X2(g)+Y2(g) ΔH<0B.NH3(g)+HCl(g)=NH4Cl(s) ΔH<0C.CaCO3(s)=CaO(s)+CO2(g) ΔH>0D.2NaCl+2H2O =2NaOH+Cl2↑+H2↑4.根据以下3个热化学方程式:2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) △H=―Q1 kJ/mol2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol判断Q1、Q2、Q3三者关系正确的是A. Q3>Q2>Q1 B. Q1>Q3>Q2 C.Q1>Q2>Q3 D. Q2>Q1>Q35.下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/molB.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)错误!未找到引用源。
2CO(g)+O2(g) △H =+566kJ/molC.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热6.下列反应中生成物总能量高于反应物总能量的是A.氧化钙溶于水 B.乙醇燃烧C.铝粉与氧化铁粉末反应 D.碳酸钙受热分解7.已知25℃、101kPa条件下:① 4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9kJ•mol-1② 4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1kJ•mol-1由此得出的正确结论是A.O3比O2稳定,由O2变O3为放热反应B.由反应①可确定铝的燃烧热是708.7KJC.等质量的O2比O3能量低,O2变O3为吸热反应D.由反应②可确定铝的燃烧热是779.78 kJ•mol-18. 甲烷是一种高效清洁的新能源,4g甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中表示甲烷燃烧热的热化学方程式是A.1/2CH4(g) + O2(g) == 1/2CO2(g) + H2O(l) ΔH= +445 kJ·mol-1B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1C.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1D.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -1780 kJ·mol-19.由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。
陕西省西安市长安区2017-2018学年高二化学上学期第一次月考试题(重点、平行班)
陕西省西安市长安区2017-2018学年高二化学上学期第一次月考试题(重点、平行班)可能用到的相对原子质量H-1 O-16 Na-23第 I 卷 (选择题 共40分)一、选择题(本题包括20小题,每小题2分,共40分。
每小题只有一个....选项符合题意) 1.下列说法不正确的是( )A .增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大B .有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大单位体积内活化分子数,从而使反应速率增大C .升高温度使化学反应速率增大,主要因为增加了反应物分子中活化分子的百分数D .催化剂不影响活化能,但能增大单位体积内活化分子百分数,从而增大反应速率2.下列与化学反应能量变化相关的叙述正确的是 ( )A .需要加热的化学反应一定是吸热反应B .应用盖斯定律,可计算某些难以直接测量的反应焓变C .放热反应的反应速率总是大于吸热反应的反应速率D .同温同压下,H 2(g)+Cl 2(g)===2HCl(g)在光照和点燃条件下的ΔH 不同3.下列有关热化学方程式的叙述正确的是( )A .若2H 2(g)+O 2(g) =2H 2O(l) △H=-571.6 kJ/mol 则氢气的燃烧热为285.8 kJ/molB .已知C(石墨,s) =C(金刚石,s) △H >0,则金刚石比石墨稳定C .含20.0g NaOH 的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则该反应的热化学方程式为:NaOH(a q)+HCl(a q) =NaCl(a q)+H 2O(l) △H=-28.7kJ/molD .已知2C(s)+2O 2(g)=2CO 2(g) △H 1 ;2C(s)+O 2(g)=2CO(g) △H 2 则△H 1>△H 24.用50 mL 0.50 mol·L -1盐酸和50 mL 0.55 mol·L -1NaOH 溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g -1·℃-1,盐酸和NaOH 溶液的密度都近似认为是1 g·cm -3,则中和反应生成1 mol 水时放热( )A.55.2 kJB.57.4 kJC.50.2 kJD.1.38 kJ 5.已知“凡气体分子总数增多的反应一定是熵增大的反应”。
陕西省2017-2018学年高二化学12月月考试题(含解析)
陕西省2017-2018学年高二化学月考试题(含解析)注意事项:1.本试卷分第Ⅰ卷和第Ⅱ卷两部分,将答案答在答题卡上,在本试卷上答题无效2.本试卷总分100分,答题时间90分钟。
3.可能用到的相对原子质量:H-1 C-12 O-16 S-32 N-14 Mn-55第I卷(选择题共48分)一、选择题(每小题只有一个选项正确,每小题3分,共48分)1.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
下列符合来来新能源标准的是①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能A.①②③④ B.⑤⑥⑦⑧C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧【答案】B考点:考查新能源2.下列说法正确的是A.凡要加热才能发生的反应都是非自发进行的B.凡是放热反应都自发的C.自发反应都是熵增大的反应D.吸热反应可能属于自发反应【答案】D【解析】试题分析:A.需要加热的反应也可能是自发进行的,如可燃物的燃烧,故A错误;B.反应能否自发进行取决于焓变和熵变的综合判据,放热反应不一定能自发进行,如铝热反应应在高温下进行,故B错误;C.自发进行的反应熵不一定增大,如氨气和HCl反应生成氯化铵,故C错误;D.有些吸热反应也能自发进行,比如:氯化铵和氢氧化钡晶体之间的反应是吸热反应,能自发进行,故D正确;答案为D。
考点:考查化学反应与焓变3.下列说法正确的是A.活化分子间的碰撞一定发生化学反应 B.吸热反应只有加热才能发生C.有能量变化的一定是化学反应 D.有化学键断裂不一定发生化学反应【答案】D【解析】试题分析:A.只有活化分子发生有效碰撞才发生化学反应,故A错误;B.吸热反应不加热也能发生,如氯化铵和氢氧化钡晶体之间的反应,故B错误;C.有能量变化的不一定是化学反应,如物态变化,故C错误;D.化学变化有化学键断裂和形成,只有化学键断裂不一定发生化学反应,故D正确,答案为D。
考点:考查反应的自发进行与能量变化、化学键的断裂与形成等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017-2018学年度第一学期高二年级第一次月考化学试题可能用到的原子量:H:1 C:12 N:14 O:16 Al:27 Fe:56 Zn:65第I部分选择题(共52分)一、选择题(每小题只有一个选项符合题意,每小题2分,共 52分)1.下列变化属于吸热反应的是①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰⑥ Ba(OH)2·8H2O与NH4Cl晶体混合A.①④⑤ B.①②④ C.②③ D.②④⑥2.下列各组物质的燃烧热相等的是A.C2H4和C3H6 B.1mol碳和3mol碳 C.白磷和红磷 D.淀粉和纤维素3.下列反应在任意温度下一定能自发进行的是( )A.X2Y2(g)=X2(g)+Y2(g) ΔH<0B.NH3(g)+HCl(g)=NH4Cl(s) ΔH<0C.CaCO3(s)=CaO(s)+CO2(g) ΔH>0D.2NaCl+2H2O =2NaOH+Cl2↑+H2↑4.根据以下3个热化学方程式:2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) △H=―Q1 kJ/mol2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol判断Q1、Q2、Q3三者关系正确的是A. Q3>Q2>Q1 B. Q1>Q3>Q2 C.Q1>Q2>Q3 D. Q2>Q1>Q35.下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/molB.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)错误!未找到引用源。
2CO(g)+O2(g) △H =+566kJ/molC.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热6.下列反应中生成物总能量高于反应物总能量的是A.氧化钙溶于水 B.乙醇燃烧C.铝粉与氧化铁粉末反应 D.碳酸钙受热分解7.已知25℃、101kPa条件下:① 4Al(s)+3O2(g)==2Al2O3(s);△H=-2834.9kJ•mol-1② 4Al(s)+2O3(g)==2Al2O3(s);△H=-3119.1kJ•mol-1由此得出的正确结论是A.O3比O2稳定,由O2变O3为放热反应B.由反应①可确定铝的燃烧热是708.7KJC.等质量的O2比O3能量低,O2变O3为吸热反应D.由反应②可确定铝的燃烧热是779.78 kJ•mol-18. 甲烷是一种高效清洁的新能源,4g甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中表示甲烷燃烧热的热化学方程式是A.1/2CH4(g) + O2(g) == 1/2CO2(g) + H2O(l) ΔH= +445 kJ·mol-1B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1C.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1D.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -1780 kJ·mol-19.由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。
从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是A.391.6 kJ/mol B.541.4kJ/mol C.700.2kJ/mol D.1174.7kJ/mol 10.完全燃烧一定量的无水C2H5OH,放出的热量为Q,用6mol/L的NaOH溶液吸收燃烧放出的CO2,消耗50mL时,生成等物质的量的Na2CO3和NaHCO3。
则燃烧1mol无水C2H5OH时放出的热量为A.10QB. 5QC.0.1QD. 0.2Q11.Zn与SiCl4的反应如下:SiCl4(g)+2Zn(l)⇌Si(s)+2ZnCl2(g)△H1SiCl4(g)+2Zn(g)⇌Si(s)+2ZnCl2(g)△H2下列说法正确的是()A.Zn(l)=Zn(g)△H=(△H1-△H2)B.用硅制作的太阳能电池是将化学能转化为电能C.增加 Zn(g)的量,△H2变大D.上述反应的△H2一定小于△H112.下列说法不正确的是A.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多B.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多C.升高温度,活化分子百分数增加,分子运动速度加快,有效碰撞次数增多D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多13.在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.200 mol·L-1时的反应速率为C.0.0760 mol·L-1·s-1 D.0.038 0 mol·L-1·s-114.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) x C(g) + 2D(g)。
2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。
下列判断错误的是A.x=1 B.B的转化率为50%C. 2min内A的反应速率为0.3mol·L-1·min-1D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态15.对于反应N2O4(g)2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是()A.A、C两点的正反应速率的关系为v(A)<v(C)B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态EC.维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<yD.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p14 5 3 2 1 0 v6 16.某温度下,在恒容密闭容器中充入NO 2,发生反应2NO 2(g)N 2O 4(g) ΔH <0,达到平衡后,下列说法不正确的是A .再充入少量NO 2,达平衡后NO 2的转化率升高B .再充入少量NO 2,达平衡后NO 2的体积分数增大C .再充入少量N 2O 4,达平衡后NO 2的体积分数减小D .升高温度,体系的颜色加深17.在固定的密闭容器内,一定温度下,可逆反应A 2(g)+3B 2(g)2AB 3(g)达到平衡的标志是A .容器内每减少1mol A 2,同时生成2mol AB 3B .容器内每减少1mol A 2,同时生成1mol B 2C .容器内A 2、B 2、AB 3的物质的量之比为1:3:2D .容器内总压强保持不变18.某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH <0。
下图表示该反应的速率(v )随时间(t )变化的关系,t 2、t 3、t 5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
下列说法中正确的是A .t 2时加入了催化剂B .t 3时降低了温度C .t 5时增大了压强D .t 4~t 5时间内转化率一定最低19.某密闭容器中进行如下反应:X(g)+2Y(g)2Z(g),要使平衡时反应物总物质的量与生成物的物质的量相等。
若最初时只加入X 、Y 两种物质,则X 、Y 的初始物质的量之比的范围应满足A. B.C. D.20.已知某可逆反应aA (g )+bB (g )⇌cC (g )+dD (g ).反应过程中,当其它条件不变时,C 的体积分数与温度(T )和压强(P )的关系如图.下列叙述正确的( )A.正反应为吸热反应 B.降低温度,正反应速率增大C.a+b<c+d D.增大压强,B转化率增大21.对于反应A(s)+2B(g)3C(g) ΔH>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是A.Y表示温度,X表示压强,且Y3>Y2>Y1B.Y表示压强,X表示温度,且Y3>Y2>Y1C.X表示压强,Y表示温度,且Y1>Y2>Y3D.X表示温度,Y表示压强,且Y1>Y2>Y322.在一定条件下,将1molN 2和3molH2混合,发生反应N2(g)+3H2(g)2NH3(g),平衡后测得混合气体的密度是相同条件下氢气密度的5倍,则N2的转化率为A.10% B.30% C.50% D.60%23.容积完全相同的两个容器甲和乙,已知甲中装有SO2、O2各1mol,乙中装有SO2、O2各2mol,在同一温度下反应,2SO 2(g)+O2(g)2SO3(g)达平衡时,下列比较不正确的是()A.反应速率:甲<乙 B.O2浓度:甲<乙C.O2的转化率:甲<乙 D.SO2的百分含量:甲<乙24.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是()A.2mol C B.2mol A、1mol B和1mol He(不参加反应)C.1mol B和1mol C D.2mol A、2mol B和3mol C25.在恒容的密闭容器中充入2molA和1molB的气体后发生反应2A(g)+B(g)xC(g),达到平衡后,C的体积分数为m%。
若维持容器容积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质的量,达到平衡后,C的体积分数仍为m%。
则x的值可能为A.1 或2 B.2 或3 C.3 或4 D.无法确定26.在某温度下将2molA和3molB充入一密闭容器中发生反应:aA(g)+B(g)⇌C(g)+D(g ),5分钟后达到平衡,各物质的平衡浓度关系为:[c (A )]a•c (B )=c (C )•c (D ).若在此温度下,将容器的体积扩大为原来的10倍,A 的转化率不变,则此时B 的转化率为( )A .4%B .24%C .40%D .60%第Ⅱ部分 非选择题 (共48分)二、简答题:(3小题,共48分)27.(15分)(1)盖斯定律在生产和科学研究中有很重要的意义。
