极性分子和分子的极性
高中化学:分子极性
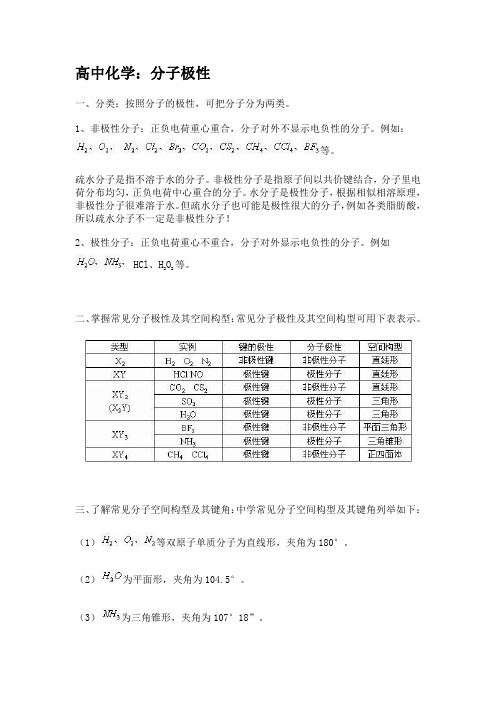
高中化学:分子极性一、分类:按照分子的极性,可把分子分为两类。
1、非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。
例如:等。
疏水分子是指不溶于水的分子。
非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
水分子是极性分子,根据相似相溶原理,非极性分子很难溶于水。
但疏水分子也可能是极性很大的分子,例如各类脂肪酸,所以疏水分子不一定是非极性分子!2、极性分子:正负电荷重心不重合,分子对外显示电负性的分子。
例如HCl、H2O2等。
二、掌握常见分子极性及其空间构型:常见分子极性及其空间构型可用下表表示。
三、了解常见分子空间构型及其键角:中学常见分子空间构型及其键角列举如下:(1)等双原子单质分子为直线形,夹角为180°。
(2)为平面形,夹角为104.5°。
(3)为三角锥形,夹角为107°18”。
(4)S为平面形,夹角为92°。
(5)为正四面体形,夹角为109°28”。
(6)为四面体形,夹角不确定。
(7)为直线形,夹角为180°。
(8)为平面形,夹角为120°。
(9)为平面形,夹角为60°。
(10)为正四面体形,夹角为109°28”。
(11)为直线形,夹角为180°。
(12)为平面形,夹角为120°。
②③④⑤注意:中学常见的四面体物质有①CH4⑥⑦⑧⑨等。
其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
四、分子极性判断规律。
①双原子单质分子都是非极性分子。
如等。
②双原子化合物分子都是极性分子。
如HCl、HBr、HI等。
③多原子分子极性要看空间构型是否对称,对称的是非极性分子,否则是极性分O、等是极性分子;子。
如H2等是非极性分子。
④形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。
如等。
若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。
键的极性和分子的极性

键的极性是形成分子的基础:键的极性是形成分子的基础分子的极性是由键的极性决定的。
分子的极性是键的极性的体现:分子的极性是键的极性的体现分子的极性是由键的极性决定的。
键的极性和分子的极性的相互影响
键的极性:键的极性是指分子中不同原子或原子团之间的电荷分布不均匀导致分子具有正负电荷中心
,
键的极性和分子的极性
汇报人:
目录
添加目录项标题
01
键的极性
02
分子的极性
03
极性分子和非极性分子
04
键的极性和分子的极性的关系
05
Prt One
单击添加章节标题
Prt Two
键的极性
什么是键的极性
键的极性是指分子中不同原子或原子团之间的电荷分布不均匀导致分子具有正负电荷中心。
键的极性是由分子中的共价键和离子键共同决定的。
添加标题
预测分子性质:分子的极性会影响分子的物理和化学性质如溶解度、熔点、沸点等。研究键的极性和分子的极性的关系有助于预测分子的性质。
添加标题
指导合成反应:分子的极性会影响化学反应的进行如酸碱反应、亲核反应等。研究键的极性和分子的极性的关系有助于指导合成反应。
添加标题
解释生物活性:许多生物大分子具有特定的极性研究键的极性和分子的极性的关系有助于解释生物活性。
非极性分子:在化工、材料、能源等领域有广泛应用如石油化工、高分子材料、太阳能电池等
极性分子和非极性分子:在环境科学、食品科学等领域有广泛应用如污水处理、食品添加剂等
极性分子和非极性分子:在电子、信息等领域有广泛应用如半导体、液晶显示等
Prt Five
键的极性和分子的极性的关系
极性分子和非极性分子课件

1
溶解性测试
将分子置于极性溶剂中观察其溶解性。
2
化学反应测试
与其他物质进行反应,观察化学反应是否发生。
3
电荷分布测试
使用分子模型分析分子中正负电荷的分布情况。
总结和回顾
极性分子
两个或更多不同元素组成,电荷不均匀分布。
非极性分子
相同元素组成,电荷均匀分布或不存在电荷。
极性分子的性质
1 溶解性
极性分子可以溶解在其他 极性溶剂中,如水。
2 静电作用
极性分子之间的正负电荷 吸引力较强,容易发生静 电强,其沸点通常 较高。
非极性分子的性质
1 溶解性
非极性分子通常不溶解在 极性溶剂中,如水。
2 惰性
非极性分子具有较低的反 应性,不容易与其他物质 发生化学反应。
3 低沸点
由于非极性分子之间的相 互作用力较弱,其沸点通 常较低。
极性分子和非极性分子的例子
极性分子
水分子 (H2O)
非极性分子
氧气分子 (O2)
极性分子和非极性分子的应用
极性分子
被广泛用于溶剂、草药提取和医药领域。
非极性分子
被用于润滑剂、绝缘材料和塑料制品等方面。
如何区分极性分子和非极性分子
极性分子和非极性分子
本课件将介绍分子的极性和非极性,包括其定义、性质、例子和应用。我们 还会分享如何区分极性分子和非极性分子。让我们开始探索这个有趣的话题 吧!
分子的极性和非极性定义
1 极性分子
极性分子是由两个或更多不同元素组成的分子,其中正负电荷在分子内分布不均匀。
2 非极性分子
非极性分子是由相同元素组成的分子,其中正负电荷在分子内分布均匀,或者不存在正 负电荷。
化学键的极性与性质极性对物质性质的影响

化学键的极性与性质极性对物质性质的影响化学键的极性是指电子在化学结合中的相对分布和性质。
化学键极性的不同会对物质的性质产生重要的影响。
本文将探讨化学键的极性与性质极性对物质性质的影响,并分析其在实际应用中的重要性。
一、化学键的极性化学键的极性是指化合物中所形成的化学键在电子分布上的不均匀性。
根据电子云的分布,化学键可以分为极性化学键和非极性化学键。
1. 极性化学键:当两个原子之间的电负性不同,即一个原子相对另一个原子具有更强的电子亲和力时,就会形成极性化学键。
在极性化学键中,电子会更倾向于围绕电负性较大的原子,导致电子云在空间上不均匀分布。
2. 非极性化学键:当两个原子之间的电负性差异较小或相等时,就会形成非极性化学键。
在非极性化学键中,电子会均匀地分布在化学键的两侧。
二、性质极性对物质性质的影响化学键极性与物质的性质密切相关。
不同的化学键极性会导致物质在化学反应和物理性质方面表现出不同的特性。
1. 溶解性:极性物质更容易溶解于极性溶剂。
这是因为在极性物质中,化学键中电子的极性会和溶剂相互作用,从而更容易被溶解。
2. 沸点和熔点:极性物质通常具有较高的沸点和熔点。
由于极性化学键中存在强烈的相互作用力,需要相对较高的能量才能打破这些化学键,因此具有较高的沸点和熔点。
3. 导电性:在溶液中,极性物质可以导电。
这是因为极性溶剂可以在溶解过程中分离极性化学键(例如离子键),导致带电离子的产生。
4. 分子极性:具有极性化学键的分子通常是极性分子。
这导致分子在电子分布上不均匀,产生极性分子间相互作用。
极性分子间的相互作用可以影响物质的热力学性质,如溶解度、沸点和熔点。
三、化学键极性的应用化学键的极性在实际应用中非常重要,特别是在化学合成、药物设计和材料科学等领域。
1. 化学合成:根据化学键的极性,可以预测化学反应的速率和方向。
极性化学键通常会促进化学反应的进行,为有机合成提供了一种重要的反应选择方法。
2. 药物设计:药物分子通常需要与目标分子发生特定的相互作用,以产生治疗效果。
浅谈共价键的极性和分子的极性判断

浅谈共价键的极性和分子的极性判断共价键是化学中一种常见的化学键类型,常见于非金属元素之间的化合物中。
在共价键中,两个原子共享一对电子以形成化学键。
由于原子中的电子在不同程度上被吸引到原子核,因此共价键并非总是非极性的。
有些共价键是非极性的,有些是极性的。
而分子的极性则与其中的原子之间的共价键的极性密切相关。
在本篇文章中,我们将就共价键的极性和分子的极性进行一番浅谈。
让我们回顾一下共价键的极性。
共价键的极性取决于相互作用的原子的电负性差异。
电负性是原子倾向于吸引共享电子对的能力,根据元素周期表的位置来确定。
通常来说,原子的电负性与位置的靠近程度成正比。
在化学键中,如果两个原子的电负性差异较小,那么它们共享的电子对就会均匀地分布在两个原子之间,形成非极性共价键。
如果两个原子的电负性差异较大,那么共享的电子对就会更多地偏向电负性较高的原子,形成极性共价键。
以氢氟化氢(HF)为例,氢原子的电负性为2.20,氟原子的电负性为3.98,二者的电负性差异较大。
在HF分子中,由氢和氟原子形成的共价键是极性的。
氢原子的电子密度会更多地偏向氟原子,形成部分正电荷和部分负电荷,从而使得整个分子具有极性。
极性共价键的极性程度还可以通过测量分子中键的偶极矩大小来了解。
偶极矩是用来描述分子极性程度的物理量,它是由分子中所有极性共价键的偶极矩矢量之和得到的。
偶极矩的方向指向带有部分负电荷的原子。
通过测量偶极矩的大小和方向,可以判断分子的极性程度。
接下来,让我们谈一谈如何通过共价键的极性来判断分子的极性。
在一个分子中,如果存在一个或多个极性共价键,那么就需要考虑这些极性共价键对整个分子的影响。
在大部分情况下,分子的极性可以从其构成的共价键的极性推断出来。
如果一个分子中所有的共价键都是非极性的,那么这个分子就是非极性的。
二氧化碳(CO2)分子中,碳和氧之间形成的是非极性共价键。
整个二氧化碳分子是非极性的。
另外一个例子是甲烷(CH4)分子,其中碳与氢之间形成的也是非极性共价键,因此整个甲烷分子也是非极性的。
分子的极性和分子间作用力

B.极性键
C. 氢键
D. 范德华力
30
下列关于范德华力影响物质性质的 叙述中,正确的是( D )
A.范德华力是决定由分子构成物质熔、沸 点高低的唯一因素 B.范德华力与物质的性质没有必然的联系 C.范德华力能够影响物质的化学性质和物 理性质 D.范德华力仅是影响物质部分物理性质的 一种因素
31
根据中心原子最外层电子是否全部成键判断
A.干冰 B.NaCl
C.NaOH
D.I2
E.H2SO4
14
2 判断:(1) 范德华力与相对分子质量的关系
分子 相对分子质量 范德华力(kJ/mol) 熔点/℃
沸点/℃
HCl 36.5 21.14 -114.8
-84.9
单质
相对分子质量
F2
38
Cl2
71
Br2
160
I2
254
HBr HI
Ar
81
128
9
巩固练习: 下列叙述正确的是( 2 ): 1. 凡是含有极性键的分子一定是极性分子。 2. 极性分子中一定含有极性键。 3. 非极性分子中一定含有非极性键。 4. 非极性分子中一定不含有极性键。 5. 极性分子中一定不含有非极性键。 6. 凡是含有极性键的一定是极性分子。 7. 非金属元素之间一定形成共价键。 8. 离子化合物中一定不含有共价键。
非极性分子:
电荷分布均匀对 称的分子
正电荷重心和负电荷重心相重合的分子
3
H Cl
δ+
δ-
H Cl
共HC用l分电子子中对,共用电子对偏向Cl原子, ∴Cl原子一端相对地显负电性,H原子 一端相对地显正电性,整个分子的电荷 分布不均匀,∴为极性分子
浅谈共价键的极性和分子的极性判断

浅谈共价键的极性和分子的极性判断【摘要】本文主要讨论了共价键的极性和分子的极性判断。
在介绍了共价键的概念、极性共价键的定义以及分子极性的影响因素。
在正文中,详细探讨了共价键极性的判断方法、如何判断分子的极性、共价键极性和分子的极性关系,列举了常见的极性分子和非极性分子的特点。
在结论中,强调了共价键极性和分子极性的重要性,并通过实际例子分析了极性和非极性分子的性质,提出了极性分子在化学反应和生物过程中的作用。
通过本文的探讨,读者可以更好地理解共价键的极性和分子的极性判断方法,加深对化学领域中极性和非极性分子的认识。
【关键词】共价键、极性、分子、判断方法、影响因素、关系、极性分子、非极性分子、重要性、性质、化学反应、生物过程、实际例子。
1. 引言1.1 共价键的概念共价键是指两个原子之间通过共享电子对而形成的化学键。
在形成共价键的过程中,原子之间会共享电子以使得它们的原子层电子填满,从而达到稳定状态。
共价键是一种常见的化学键类型,它通常由非金属原子之间形成。
共价键的形成是由原子之间的电负性差异所决定的。
电负性是原子吸引和保持共享电子对的能力的度量,原子的电负性差异越大,则共价键中电子对的偏移性越强,这种共价键称为极性共价键。
在极性共价键中,由于原子之间的电负性不同,电子对会倾向于偏向电负性较强的原子。
相对而言,电负性相近的原子形成的共价键则是非极性的。
共价键的概念在化学中具有重要意义,它不仅决定了分子的性质,还影响了化学反应的进行。
了解共价键的概念有助于我们更好地理解化学物质之间的相互作用,为我们进一步探讨分子极性和相关性质奠定基础。
1.2 极性共价键的定义极性共价键是指其中一个原子吸引共享电子对的能力强于另一个原子的情况下形成的共价键。
在极性共价键中,电子对会偏向性地靠近较电负的原子,导致共价键两端带有一定电荷分布不均匀的性质。
极性共价键的特点包括电负性差异较大的原子结合形成、极性键中间会存在电子云的移动、极性键两端形成部分正负电荷分布等。
极性分子非极性

极性分子非极性极性分子指的是拥有极性的分子,它们具有一个或多个不同电荷的原子组成,而非极性分子则指的是没有极性的分子,这些分子具有相同电荷的原子组成。
极性分子通常拥有不对称的结构,它们有一个或多个极性中心,各自有一个或多个不同的电荷。
这种不对称的结构使得这些分子能够以两种不同的方向被电磁场滑入一起,从而形成复杂的化学结构。
例如,水分子中有两个氧原子,其中一个原子拥有负电荷,另一个原子拥有正电荷,这被认为是极性分子的极性中心,产生了电磁相互作用,使得它们能够结合在一起。
非极性分子具有平衡的结构,它们不具有极性中心。
它们由相同电荷的原子组成,不会产生电磁力。
此外,由于它们没有电磁相互作用,因此它们也不会结合成复杂的化学结构。
例如,氢气分子是非极性分子的一个典型例子,它由两个氢原子组成,每个原子都有一个负电荷,由于它们没有极性中心,因此不存在电磁相互作用产生。
极性分子和非极性分子有着本质的区别,这些不同之处在于它们气体的极性结构以及极性中心的存在与否。
极性分子具有极性中心,而非极性分子则没有极性中心,因而它们不具有电磁相互作用。
而且,极性分子可以形成更复杂的结构,而非极性分子则不会形成复杂的结构。
极性分子和非极性分子的另一个主要区别在于它们的溶解性。
极性分子具有良好的溶解性,通常能够被水溶解,而非极性分子则很难被水溶解。
极性分子可以通过电荷的相互作用,与水分子形成可溶解的络合物,而非极性分子则无法与水分子形成可溶解的络合物,因此其被溶解的能力很低。
极性分子和非极性分子的最终结果也有很大的不同,极性分子可以与其他极性分子形成络合物,从而产生新的物质,而非极性分子则无法形成复杂的结构,所以它们也无法形成新的物质。
总之,极性分子和非极性分子都有不同的特性,这些不同的特性使得它们在化学领域有着不同的应用,这是很有意义的。
因此,在化学实验中,极性分子和非极性分子都需要特别识别,以确保实验结果的可靠性和准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子的极性怎样左右物质的行为?
分子的极性源于键 的极性;键的极性决 定于成键原子间电子 云的分布。
正、负电荷中心重合的分子是非极性分子; 正、负电荷中心不重合的分子是极性分子。
回
非极性键构成的分子,必是非极性分子。放
极性键构成的分子:
双原子分子—分子和键的极性相一致;
多原子分子— 分子空间结构对称,非极性分子; 分子空间结构不对称,极性分子。
另一面,纸的纤维是 极性分子构成的。
C2H6 / H2O
溶液里发生了如下的反应:
2KBr+Cl2→Br2+2KCl 虽然水溶液里还有KBr:
Br–+Br2→Br3– Br2还是进入了CCl4。这 表明Br2在CCl4中溶解度 比Br–大得多。
ClCCl4
某些物质的表面活性
有一类物质,结构上由不对称的两部分 (极性和非极性)组成(又称双亲化合 物):
常表示为:
极性基 非极性基 (亲水基 ) (亲油基)
如:十二烷基磺酸钠
这类物质称表面活性剂,具有广泛用途。
表面活性剂的最重要作用是能降低表 面张力。
两根火柴被表面张力拉在一起,又于表 面张力的降低而分开。
什么是表面张力?
润滑油(润滑脂)的防锈作用
防锈剂是一种表面活性剂。 它的极性基吸附于金属件上,而油性基 则在在摩擦件中间形成油膜。把固体摩擦 变为液体摩擦,起到减磨作用。
黏结剂的作用也有类似的模型 黏结剂也是依据分子的极性产生作用的。 极性材料要使用极性黏结剂,非极性材 料要使用非极性黏结剂。
黏结剂多是高分子材料。
“分子的极性”是分子层次上最 基本的结构特征之一,也是普通化 学中最重要的基本概念。依此可以 说明物质的许多性质:电性能、溶 解性、表面活性、减磨性、黏结性、 机械性能等等。
此处我们把它作为一个独立的话 题讨论,意在提倡一种融会贯通的 学习方法。
⑵ 表面活性剂的亲水性,即HLB值。
双亲分子极性基团极性越强,HLB值越 大。
HLB值可以表示表面活性剂的特性及 使用范围。
一些表面活性剂的HLB值
十二烷基苯磺酸钠(LAS)
1.7
失水山梨醇单油酸酯(span80)
4.3
烷基酚聚氧乙烯醚(OP—10)
14.5
脂肪醇聚氧乙烯醚(平平加O—20)
16.5
表面活性剂的性质
⑴ 临界胶束浓度(CMC): 当浓度增加到液面形成表
面活性剂的单分子膜时(103-10-5),表面张力降到最 低点。
表面活性剂的浓度只有稍大于CMC时才 能发挥最大作用。
当表面活性剂的浓度超过CMC时,它 们的亲油基受水分子的排斥而相互聚在一 起,形成团状结构,称胶束。
胶束内部是亲油的,可提高非水熔性的 物质溶解度——胶束增熔。
11--13 14
10--17 8 4
表面活性剂的基本作用
① 润湿 渗透作用; 不同的界面间表面张力不同。表面活
性剂降低表面张力便可以提高润湿作用。
由于润湿作用的增强,使渗透作用也 得以提高。
② 乳化 分散作用: 在不互溶的油-水间,由于表面活性剂的
加入,可以使系统成
为乳状分散系。
乳液有两种:
W/O O/W
物体表面层分子 便受到一种向内的 力。欲使表面积增 大,就必须做功。 此功即表面张力。
符号:σ, 单位:N·m-1。
当溶液中溶有双亲分 子时,其极性基指向 水,非极性基指向气。
由于水与亲油基的 排斥使表面活性剂在表面形成单分子膜。 这种斥力降低了水的收缩力,即降低了 表面张力。
表面活性剂具有降低表面张力的功能, 这种性质称表面活性。
高聚物分子中的极性基团
高聚物分子的极性是指链节中存在着 极性基团,使整个分子呈极性。
如,聚乙烯和聚氯乙烯 : (—CH2—CH2—)n (—CH—CH—)n Cl Cl
在尼龙6中有氨基和羰基:
ABS: 涤纶: 尼龙66:
高分子的极性基团对高聚物性质的影响
机械性能:分子间力大,机械强度就大。 大分子的极性基团可以增强 分子间力。
电性能:高聚物无电子、离子,多是绝 缘体。但极性基团在电场中会 周期性取向,产生位移电流, 使其具有导电性。
溶解性:符合“相似相溶”原理。但不 同
于低分子,其溶解过程可分为 溶胀:溶溶胀剂、分溶子解进两入步高:分子链中,使高
分子链间距增大,体积膨胀; 溶解:高分子链间距离继续扩大,直至
高分子链彼此分离而进入溶剂。 极性基团的数量对溶解性有大影响。
聚氧乙烯失水山梨醇单月桂酸酯(Tween—20)16.7
工业用表面活性剂的HLB值
防水乳剂 湿润剂 家庭洗涤剂 雪花膏 水性乳胶漆 磺胺软膏 切削油
9--11 12--15
13 3--7 14—16
5 10
抗静电剂 干洗剂 金属净洗剂 液体手用皂 维生素油 青霉素软膏 防锈剂
20--30 3--4
油包水(W/O)—水是分散质; 水包油(O/W)—油是分散质。
把固体微粒分散于溶剂中的作用称分散 作用。表面活性剂的分散作用与乳化作用 相似。
③ 起泡 消泡作用: 不溶性气体分散于液体或固体中形成的
分散系—气泡。 表面活性剂可以使气泡稳定存在。如果
能把起泡剂替换出来,就可以消泡。
④ 洗涤作用。
表面活性剂的洗涤作 用是润湿、渗透、 乳 化、分散的综合结果。
O-C-O
H2O
CH4
物质的电性
分子的极性就是分子 的电性。因此,可用电 学实验予以验证:
水分子的极性使其能 在微波作用下震荡。微 波炉以此烹饪食品。
物质的溶解性
物质的溶解性遵循“相似相溶”的规
律在。溶液中,极性相似的物质相趋向。
这张纸片之所以如
此“倔犟”,是因为:
铅笔把石墨涂在纸上,
而石墨是非极性的;
