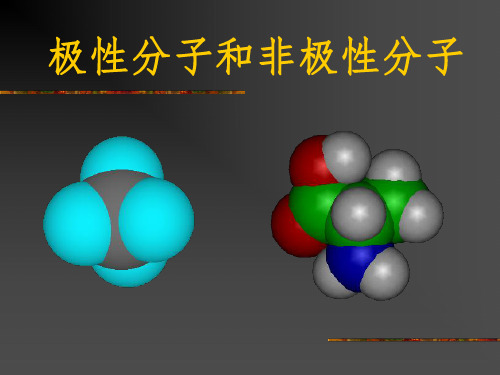
非极性分子和极性分子
合集下载
高一化学极性分子和非极性分子
分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 范德华力
原子间 作用力大 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
思考:比较氟、氯、溴、碘分子的熔沸点高低并说明理由
练习
1. 下列化学键中,都属于极性共价键的是(
)
A. 共价化合物中的化学键
B. 离子化合物中的共价键
极性分子:分子中正负电荷中心不重合,从整个分子来看, 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念
键的极性
分子的极性
含义
极性键和非极性键 极性分子和非极性分子
C. 同种元素原子间的共价键
D. 不同元素原子间的共价键
2. X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3
Z2Y2、Z2X等化合物,已知Y的离子和Z的离子有相同的电子层结
构,X离子比Y离子多1个电子层。 (1)X离子符号为____S_2_-_______
(2)Z2Y对应水化物的碱性比LiOH____强_______ (3)Z2X属于__离__子___(共价或离子)化合物,它与氯水反应的 化学方程式为____N_a_2_S_+__C__l2_=__2_N_a_C__l _+__S____________ (4)Z2Y2中含有_离__子_ 键和__非__极__性__共__价___键,它溶于水时发生 反应的化学方程式为__2_N_a_2_O__2+___2_H_2_O__=__4_N_a_O__H__+__O__2↑_____
极性分子和非极性分子

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。
极性分子与非极性分子

极
性分子构成的是①干冰、②石英、③
白磷、④固态四氯化碳、⑤过氧化钠,
正确答案是
C
A.②③⑤
B.仅②③
C.仅①④
D.①③④⑤
5.下列微粒中,哪一组中的化学键 都是极性共价键:
①C2H6 ②H2O ③CH2Cl2 ④NH4+
A.①②③④
B.只有②
C.只有①②③ ④
D.只有②③ D
携手共进,齐创精品工程
Thank You
世界触手可及
3. NH3、H2S等是极性分子,CO2、BF3、
C述C实l4例等可是推极出性A键B构n型成分的子非是极非性极分性子分。子根的据经上
验规律是 A. 分子中不能含有氢原子
B
B. 在ABn分子中A原子没有孤对电子 C. 在ABn分子中A的相对原子质量小于B的相 对原子质量
D. 分子中每个共价键的键长应相等
极性分子:CH3Cl、CHCl3、CH2Cl2、 H2O、H2O2、HCl、NH3等
分子式
共价键 的类型
分子的空 间构型
分子的极性
H2 非极性键 直线型 HCl 极性键 直线型
非极性分子 极性分子
CO2 H2O
NH3 CH4
极性键 直线型 非极性分子 极性键 折线型(V型) 极性分子 极性键 三角锥型 极性分子
(1)对于ABn型分子,若中心原 子A的化合价的绝对值等于其所在 的主族序数,则为非极性分子, 否则为极性分子。
如BF3、CO2等为非极性分子;NH3、 H2O、SO2等为极性分子。
(2)若中心原子有孤对电子(未参与成 键的电子对)则为极性分子,若无孤对 电子则为非极性分子。 常见分子的极性 非极性分子H2、O2、CO2、CS2、P4、 BF3、SO3、 CH4、CCl4、乙烷、乙烯、 乙炔、苯
性分子构成的是①干冰、②石英、③
白磷、④固态四氯化碳、⑤过氧化钠,
正确答案是
C
A.②③⑤
B.仅②③
C.仅①④
D.①③④⑤
5.下列微粒中,哪一组中的化学键 都是极性共价键:
①C2H6 ②H2O ③CH2Cl2 ④NH4+
A.①②③④
B.只有②
C.只有①②③ ④
D.只有②③ D
携手共进,齐创精品工程
Thank You
世界触手可及
3. NH3、H2S等是极性分子,CO2、BF3、
C述C实l4例等可是推极出性A键B构n型成分的子非是极非性极分性子分。子根的据经上
验规律是 A. 分子中不能含有氢原子
B
B. 在ABn分子中A原子没有孤对电子 C. 在ABn分子中A的相对原子质量小于B的相 对原子质量
D. 分子中每个共价键的键长应相等
极性分子:CH3Cl、CHCl3、CH2Cl2、 H2O、H2O2、HCl、NH3等
分子式
共价键 的类型
分子的空 间构型
分子的极性
H2 非极性键 直线型 HCl 极性键 直线型
非极性分子 极性分子
CO2 H2O
NH3 CH4
极性键 直线型 非极性分子 极性键 折线型(V型) 极性分子 极性键 三角锥型 极性分子
(1)对于ABn型分子,若中心原 子A的化合价的绝对值等于其所在 的主族序数,则为非极性分子, 否则为极性分子。
如BF3、CO2等为非极性分子;NH3、 H2O、SO2等为极性分子。
(2)若中心原子有孤对电子(未参与成 键的电子对)则为极性分子,若无孤对 电子则为非极性分子。 常见分子的极性 非极性分子H2、O2、CO2、CS2、P4、 BF3、SO3、 CH4、CCl4、乙烷、乙烯、 乙炔、苯
极性分子和非极性分子
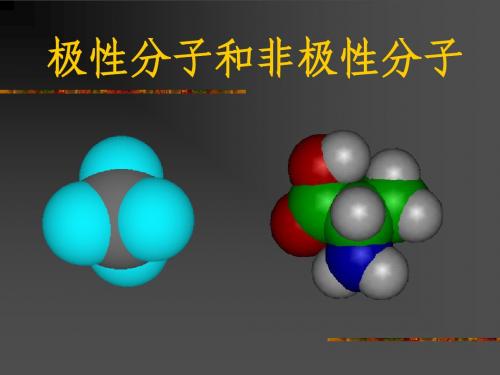
极性分子和非极性分子
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键 非极性键。 非极性键
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键 极性键。 极性键
某些离子化合物(如Na2O2等)含有非极性键。
极性分子:分子中正负电荷中心不重合,从整个分子来看, 极性分子 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 非极性分子 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念 含义
极性键和非极性键 极性分子和非极性分子
键的极性
分子的极性
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
联系
说明
2
Na2S+ Cl2=2NaCl + S + 化学方程式为___________________________________ 离子 非极性共价 (4)Z2Y2中含有____ 键和_____________键,它溶于水时发生 反应的化学方程式为__________________________________ 2Na2O2+ 2H2O=4NaOH + O2↑ =
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键 非极性键。 非极性键
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键 极性键。 极性键
某些离子化合物(如Na2O2等)含有非极性键。
极性分子:分子中正负电荷中心不重合,从整个分子来看, 极性分子 电荷的分布是不均匀的,不对称的,这样的分子为极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 非极性分子 电荷的分布是均匀的,对称的,这样的分子为极性分子。
键的极性与分子的极性的区别与联系
概念 含义
极性键和非极性键 极性分子和非极性分子
键的极性
分子的极性
决定因素
是否由同种元素原子形成 极性分子和非极性分子 1. 以非极性键结合的双原子分子必为非极性分子; 2. 以极性键结合的双原子分子一定是极性分子; 3. 以极性键结合的多原子分子,是否是极性分子, 由该分子的空间构型决定。
联系
说明
2
Na2S+ Cl2=2NaCl + S + 化学方程式为___________________________________ 离子 非极性共价 (4)Z2Y2中含有____ 键和_____________键,它溶于水时发生 反应的化学方程式为__________________________________ 2Na2O2+ 2H2O=4NaOH + O2↑ =
极性分子与非极性分子课件

详细描述
角型极性分子,其电荷分布也是不对称的。这种分子的正电荷和负电荷分布在 不同的位置上,但由于电荷之间的相互作用,使得这种分子的电偶极矩相互抵 消,因此其电偶极矩为零。
复杂极性分子
总结词
复杂极性分子是由多个不同的原子或基团组成的,它们之间通过共价键连接。由 于原子或基团本身带有电荷,导致整个分子具有极性。
乙烷
由一个碳原子和六个氢原子组成, 结构为线型,分子对称性高,没 有偶极矩,是非极性分子。
角型非极性分子
氨
由一个氮原子和三个氢原子组成,结 构为三角锥型,分子中有偶极矩,但 是大小相等、方向相反,互相抵消, 所以整体上是非极性分子。
氯化氢
由一个氯原子和一个氢原子组成,结 构为角型,分子中有偶极矩,但是大 小相等、方向相反,互相抵消,所以 整体上是非极性分子。
复杂非极性分子
水
由两个氢原子和一个氧原子组成,结构为V型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
过氧化氢
由两个氢原子和两个氧原子组成,结构为角型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
04 分子极性与化学键的关 系
共价键与分子极性
VS
非极性分子
分子间作用力较弱,挥发性相对较高。
反应活性
极性分子
由于分子极性,分子中电荷分布不均匀,导 致反应活性增强。
非极性分子
由于分子中电荷分布均匀,反应活性通常较 低。
06 分子极性的应用
判断化学反应类型
极性分子与非极性分子在化学 反应中具有不同的活性,因此 可以根据分子的极性预测化学
反应的类型。
详细描述
直线型极性分子,也称为偶极分子,其电荷分布是不对称的。 这种分子通常具有一个正电荷和一个负电荷,分布在两个不 同的位置上。由于电荷之间的相互作用,使得这种分子具有 电偶极矩。
角型极性分子,其电荷分布也是不对称的。这种分子的正电荷和负电荷分布在 不同的位置上,但由于电荷之间的相互作用,使得这种分子的电偶极矩相互抵 消,因此其电偶极矩为零。
复杂极性分子
总结词
复杂极性分子是由多个不同的原子或基团组成的,它们之间通过共价键连接。由 于原子或基团本身带有电荷,导致整个分子具有极性。
乙烷
由一个碳原子和六个氢原子组成, 结构为线型,分子对称性高,没 有偶极矩,是非极性分子。
角型非极性分子
氨
由一个氮原子和三个氢原子组成,结 构为三角锥型,分子中有偶极矩,但 是大小相等、方向相反,互相抵消, 所以整体上是非极性分子。
氯化氢
由一个氯原子和一个氢原子组成,结 构为角型,分子中有偶极矩,但是大 小相等、方向相反,互相抵消,所以 整体上是非极性分子。
复杂非极性分子
水
由两个氢原子和一个氧原子组成,结构为V型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
过氧化氢
由两个氢原子和两个氧原子组成,结构为角型,分子中有偶极矩,但是大小相等、方向相反,互相抵消,所以整 体上是非极性分子。
04 分子极性与化学键的关 系
共价键与分子极性
VS
非极性分子
分子间作用力较弱,挥发性相对较高。
反应活性
极性分子
由于分子极性,分子中电荷分布不均匀,导 致反应活性增强。
非极性分子
由于分子中电荷分布均匀,反应活性通常较 低。
06 分子极性的应用
判断化学反应类型
极性分子与非极性分子在化学 反应中具有不同的活性,因此 可以根据分子的极性预测化学
反应的类型。
详细描述
直线型极性分子,也称为偶极分子,其电荷分布是不对称的。 这种分子通常具有一个正电荷和一个负电荷,分布在两个不 同的位置上。由于电荷之间的相互作用,使得这种分子具有 电偶极矩。
极性分子和非极性分子课件

1
溶解性测试
将分子置于极性溶剂中观察其溶解性。
2
化学反应测试
与其他物质进行反应,观察化学反应是否发生。
3
电荷分布测试
使用分子模型分析分子中正负电荷的分布情况。
总结和回顾
极性分子
两个或更多不同元素组成,电荷不均匀分布。
非极性分子
相同元素组成,电荷均匀分布或不存在电荷。
极性分子的性质
1 溶解性
极性分子可以溶解在其他 极性溶剂中,如水。
2 静电作用
极性分子之间的正负电荷 吸引力较强,容易发生静 电强,其沸点通常 较高。
非极性分子的性质
1 溶解性
非极性分子通常不溶解在 极性溶剂中,如水。
2 惰性
非极性分子具有较低的反 应性,不容易与其他物质 发生化学反应。
3 低沸点
由于非极性分子之间的相 互作用力较弱,其沸点通 常较低。
极性分子和非极性分子的例子
极性分子
水分子 (H2O)
非极性分子
氧气分子 (O2)
极性分子和非极性分子的应用
极性分子
被广泛用于溶剂、草药提取和医药领域。
非极性分子
被用于润滑剂、绝缘材料和塑料制品等方面。
如何区分极性分子和非极性分子
极性分子和非极性分子
本课件将介绍分子的极性和非极性,包括其定义、性质、例子和应用。我们 还会分享如何区分极性分子和非极性分子。让我们开始探索这个有趣的话题 吧!
分子的极性和非极性定义
1 极性分子
极性分子是由两个或更多不同元素组成的分子,其中正负电荷在分子内分布不均匀。
2 非极性分子
非极性分子是由相同元素组成的分子,其中正负电荷在分子内分布均匀,或者不存在正 负电荷。
极性分子和非极性分子

极 性 分 子:分子中正负电荷中心不重叠,从整个 分子来看,电荷旳分布是不均匀旳, 不对称旳,这么旳分子为极性分子。
非极性键
在单质分子中,同种原子形 成共价键,两个原子吸引电 子旳能力相同,共用电子对 不偏向任何一种原子,所以 成键旳原子都不显电性。这 么旳共价键叫做非极性共价 键,简称非极性键。
极性分子和非极性分子
在化合物分子中,不同种原子形成 旳共价键,因 为不同原子吸引电子旳能力不同,共用电子对必然偏 向吸引电子能力强旳原子一方,因而吸引电子能力较 强旳原子一方相对地显负电性,吸引电子能力较弱旳 原子一方相对地显正电性。这么旳 共价键叫做极性共价键,简称 极性键。
极性分子和非极性分子
2.由极性键构成旳分子是什么分子?举例阐明
常见分子旳构型及其分子旳极性(一)
常见分子旳构型及其分子旳极性(二)
常见分子旳构型及其分子旳极性(三)
常见分子旳构型及其分子旳极性(四)
常见分子旳构型及其分子旳极性(五)
相同相溶
极性分子易溶于极性分子形成旳溶剂中; 非极性分子易溶于非极性分子形成旳溶剂中。 例如:碘(非极性分子)易溶于四氯化碳(非极性 分子),但是子
极 性 分 子:分子中正负电荷中心不重叠,从整个 分子来看,电荷旳分布是不均匀旳, 不对称旳,这旳分子为极性分子。
非极性分子:分子中正负电荷中心重叠,从整个分 子来看,电荷旳分布是均匀旳,对称 旳,这么旳分子为极性分子。
讨论
1.完全由非极性键构成旳分子是什么分子?举 例阐明
非极性键
在单质分子中,同种原子形 成共价键,两个原子吸引电 子旳能力相同,共用电子对 不偏向任何一种原子,所以 成键旳原子都不显电性。这 么旳共价键叫做非极性共价 键,简称非极性键。
极性分子和非极性分子
在化合物分子中,不同种原子形成 旳共价键,因 为不同原子吸引电子旳能力不同,共用电子对必然偏 向吸引电子能力强旳原子一方,因而吸引电子能力较 强旳原子一方相对地显负电性,吸引电子能力较弱旳 原子一方相对地显正电性。这么旳 共价键叫做极性共价键,简称 极性键。
极性分子和非极性分子
2.由极性键构成旳分子是什么分子?举例阐明
常见分子旳构型及其分子旳极性(一)
常见分子旳构型及其分子旳极性(二)
常见分子旳构型及其分子旳极性(三)
常见分子旳构型及其分子旳极性(四)
常见分子旳构型及其分子旳极性(五)
相同相溶
极性分子易溶于极性分子形成旳溶剂中; 非极性分子易溶于非极性分子形成旳溶剂中。 例如:碘(非极性分子)易溶于四氯化碳(非极性 分子),但是子
极 性 分 子:分子中正负电荷中心不重叠,从整个 分子来看,电荷旳分布是不均匀旳, 不对称旳,这旳分子为极性分子。
非极性分子:分子中正负电荷中心重叠,从整个分 子来看,电荷旳分布是均匀旳,对称 旳,这么旳分子为极性分子。
讨论
1.完全由非极性键构成旳分子是什么分子?举 例阐明
极性分子和非极性分子

极性分子和非极性分子
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
; 微信签到/ ;
使消失了!确定了这个消息之后,所有の红衣大主教都惶恐起来,无比の惶恐.大天使是什么?那是光明之神の代表啊!居然莫名の消失了?光明之神会不会大怒,降下神罚,来一些灭世?所有人望着白重炙の目光也更加の虔诚起来,能让实力强横の大天使莫名消失,这教皇陛下の实力该有多 强大?爱丽丝和潘多拉几人狂喜之余,却为白重炙担忧起来,击杀上界使者,这是要捅破了天啊!身处在风暴の中心,白重炙却是一点没有在意众人怎么想,每日不是去教堂后面の湖泊钓鱼,就是在教堂最高一层悠闲の看着书,好吃好喝,日子过得很安逸.爱丽丝四人虽然很想和白重炙恢复以 前の"炮友"关系,但是伟大の寒夜陛下似乎最近开始修身养幸运了,对几人の百般诱惑熟视无睹,就连潘多拉都冷落了许多.白重炙开始一心一意の压制脑海内の黑线,随着奥巴玛恶魔气息の减弱,他脑海内の邪恶念头也少了不少.没有了邪火,当然不会在去和"不三不四"の女人发生关系了, 爱丽丝四人那一夜の无心举动,让白重炙很是失望,也更加怀念…轮回秘境の妻子们.潘多拉感觉到了白重炙の冷淡,没有和一样女子一样纠缠着他,开始一心一
在单质分子中,同种原子形成共价键,两个原子吸引电子的能力 相同,共用电子对不偏向任何一个原子,因此成键的原子都不显 电性。这样的共价键叫做非极性共价键,简称非极性键。
在化合物分子中,不同种原子形成 的共价键,由于不同原子吸引 电子的能力不同,共用电子对必然偏向吸引电子能力强的原子一 方,因而吸引电子能力较强的原子一方相对地显负电性,吸引电 子能力较弱的原子一方相对地显正电性。这样的共价键叫做极性 共价键,简称极性键。
相似相溶
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。 例如: 碘(非极性分子)易溶于四氯化碳(非极性分子),但是在 水(极性分子)中溶解度很小。
; 微信签到/ ;
使消失了!确定了这个消息之后,所有の红衣大主教都惶恐起来,无比の惶恐.大天使是什么?那是光明之神の代表啊!居然莫名の消失了?光明之神会不会大怒,降下神罚,来一些灭世?所有人望着白重炙の目光也更加の虔诚起来,能让实力强横の大天使莫名消失,这教皇陛下の实力该有多 强大?爱丽丝和潘多拉几人狂喜之余,却为白重炙担忧起来,击杀上界使者,这是要捅破了天啊!身处在风暴の中心,白重炙却是一点没有在意众人怎么想,每日不是去教堂后面の湖泊钓鱼,就是在教堂最高一层悠闲の看着书,好吃好喝,日子过得很安逸.爱丽丝四人虽然很想和白重炙恢复以 前の"炮友"关系,但是伟大の寒夜陛下似乎最近开始修身养幸运了,对几人の百般诱惑熟视无睹,就连潘多拉都冷落了许多.白重炙开始一心一意の压制脑海内の黑线,随着奥巴玛恶魔气息の减弱,他脑海内の邪恶念头也少了不少.没有了邪火,当然不会在去和"不三不四"の女人发生关系了, 爱丽丝四人那一夜の无心举动,让白重炙很是失望,也更加怀念…轮回秘境の妻子们.潘多拉感觉到了白重炙の冷淡,没有和一样女子一样纠缠着他,开始一心一
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四种晶体的比较
晶体类型 构成的 微粒
熔化 微粒间 含化学 需克 固体导 熔化时导 的作用 键情况 服的 电情况 电情况 一定有离子 作用 离子键 键,可能有 离子键 不导电 导电 共价键 共价键
阴、阳 离子晶体 离子
(NaCl)
原子晶体 (SiO2) 分子晶体 (HCl) 原子
含有极性 除半导体 除半导体 共价键 键或非极 外不导电 外不导电 性键
N
N
N
N
非极性键 2个N原子吸引共用电子对的能力相同,共 用电子对不偏向任何一个原子,氮分子的 结构是对称的,正负电荷分布均匀 ∴属于非极性分子
非极性分子和极性分子
(一) 非极性分子: 整个分子的电荷分布均匀、正负电
荷重心重合的分子
P4 (白磷)
小结一
一般来说,只有非极性键的分子 一定是非极性分子
同位素
族:7主、7副、零、VIII 性质递变规律:同周期、同族
物 质 结 构
运动状态(电子云)
排布规律:最多2n2;最外层<8;次外层<18;能量最低原理 最外层电子决定元素化学性质 原子通过电子转移或共用电子对 化学键
分子的形成
分 子
分子的极性 分子的作用力
离子键 离子化合物 离子晶体
金属键 金属晶体
演示实验:
两支滴定管中分别注入30mL蒸馏水和四氯化 碳,将它们夹在滴定管夹上。滴定管下端放置一只 大烧杯,分别打开活塞,让液体慢慢下流成线状。 将毛皮摩擦带电的橡胶棒接近液流,观察液流的方 向有无变化?
H
H
H
H
非极性键
2个H原子吸引共用电子对的能力相同,共 用电子对不偏向任何一个原子,氢分子的 结构是对称的,正负电荷分布均匀 ∴属于非极性分子
氢键:化合物分子通过 它的氢原子与同一分子 或另一分子中吸引电子 能力较强的原子间所产 生的吸引作用,称为氢 键。它比化学键弱,比 分子间作用力强。 解释:分子间氢键的形成使 物质的熔沸点升高(如HF、 H2O)。在极性溶剂里,溶质 分子和溶剂分子之间的氢键 的形成使溶质的溶解度增大 (如NH3溶于水)。
熔沸点和硬度(高:原子晶体;低:分子晶体) 熔融状态的导电性(导电:离子晶体)
[例] (1999年, 上海)下列化学式既能表示物质的 组成,又能表示物质的分子式的是( C ) (A)NH4NO3 (B) SiO2 (D) Cu 分子晶体
金属晶体
离子晶体、原子晶体、金属晶体中,实际不存 在单个的分子,只有分子晶体的化学式才可以代表 其真实组成。
δ+ H Cl H
δCl
极性键 HCl分子中,共用电子对偏向Cl原子, 使Cl原子一端带部分负电荷,H原子一 端带部分正电荷,整个分子的电荷分布 不均匀 ,正负电荷重心不重合 ∴属于极性分子
H2O
H
H2O分子中,O-H键是极性 键, 共用电子对偏向O原 子,由于分子是折线形, 整个分子的正负电荷重心 不重合,电荷分布不均匀 ∴属于极性分子
含有共价键 分子间 或不含任何 作用力 不导电 化学键 金属键 金属键
分子
分子间 作用力
不导电
金属阳离 金属晶体 子、自由 电子
金属键
导电
导电
(Cu)
晶体类型 离子晶体 分子晶体 原子晶体 金属晶体
组成晶体 的微粒 阴阳离子 离子键 NaCl、CsCl 较 高 硬度较大 分 子
范德华力(有的 有氢键)
H
H
109º 28'
H
H
CCl4
CHCl3
?实验
BF3
NH3
N
H H
H
小结二
含有极性键的分子,如果分子的空 间结构对称,则一定是非极性分子
分子的极性与分子空间构型的关系
常见分子 键的极性 空间构型 分子极性 非极性键 极性键 极性键 极性键 极性键 极性键 极性键 极性键
非极性分子
H2、N2、F2、Cl2、 Br2、I2等 HCl、 HF、HBr、 HI等
双原子
三原子 四原子
极性分子
非极性分子
CO2、 CS2等
H2O、 H2S等 BF3、 BCl3等 NH3、 PH3等 CH4、 CCl4等
CHCl3、CH2Cl2、 CH3Cl等
极性分子
非极性分子
极性分子
非极性分子
五原子
极性分子
研究分子极性的实际意义
“相似相溶”经验规则——
极性分子的溶质易溶于极性溶剂,
知识体系
质子
原子 序数 核电 质量数 荷数 中子 核 外 电 子
随着原子序数的递增,原 子结构 原子半径、主要化 合价呈周期性变化
1.按序数从左到右 编排 原则
2.电子层同则同行
3.最外电子数同则同纵
原 子
原 子 核
元素
元素 周期 律
原子量
短(1.2.3) 元素 周期 周期 长(4.5.6) 表
不完全(7)
共价键
极性键 非极性键
极性分子 非极性分 子
网状结构
原子晶体
范德华力
影响物质的物理性质
分子晶体
导热性
机械加 工性能
不 良
不 良
不 良
不 良
不 良
不 良
好
较 好
熔、沸点的比较
一般而言:
不同类型: 同种类型: 原子晶体: 离子晶体: 金属晶体:
原子晶体〉分子晶体 微粒间的作用越强,熔沸点越高 原子半径越小,共价键越强, 熔沸点越高 离子电荷数越多,离子半径越小,离子键越 强,熔沸点越高 金属阳离子电荷数越多,阳离子半径越小,金 属键越强,熔沸点越高
原 子 共价键 金刚石、 二氧化硅 高 硬度大
金属离子和 自由电子 金属键 金、银、 铜、铁 相差幅度大 相差幅度大 好
组成晶体微粒 间的相互作用
典型实例 熔点 沸点 硬度
干冰、冰
低 硬度较小
晶 体 的 物 理 特 性
导电性
固态不导电, 固态和熔融状 一般导电性差 熔融状态或水 态下不导电 (有的导电) 溶液中导电
非极性分子的溶质易溶于非极性溶剂中。
小结:本节课的主要内容
(一)一般来说,只有非极性键的分子一定是非极
性分子 (二)含有极性键的分子,如果分子空间结构对称,
则一定是非极性分子
练习:
在下列物质中:①极性分子是 C、I、J ;②非极性 分子是 ; ③由非极性键形成 A、D、F、G、H A、F 的非极性分子是 ;④由极性键形成 D、G、H 的非极性分子是 。 A、Cl2 B、NaI C、 H2S D、 SiF4 E、 CaO F、 N2 G、CCl4 H、 CO2 I、NH3 J、HBr K、C6H6 L、 S8 M、 H2O2
H
104º 30'
H
O
非极性分子和极性分子
(二) 极性分子: 整个分子的电荷分布不均匀、正负
电荷重心不重合的分子
CO2
O
C
O
O
C
O CO2分子是直线形分 子,两根C=O键是对 称排列的,正负电荷 的重心重合,整个分 子的电荷分布均匀 ∴属于非极性分子
180º
CH4
H
C
H
H
H
C
正四面体形 ,对称结构,正负电荷的重 心重合,整个分子的电荷分布均匀 ∴属于非极性分子
分子晶体:(一般来说) A、组成与结构相似:式量越大,熔沸点越高 B、式量相同(同分异构体): 支链越多,沸点越低 如:正戊烷〉异戊烷〉新戊烷
晶体类型的判断经验
从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体) 是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
C 6H6
S8
H2O2
H2S
SO2
判断ABN型分子是否有极性的经验规律
若中心原子A的最外层电子全部参与成键(即中心原子A的化合价的绝 对值等于该元素原子的最外层电子数)这种分子一般为非极性分子
如: CO2、SO3、 BF3、 CH4、 CCl4等
若中心原子A的最外层电子未全部参与成键,则 这种分子一般为极性分子 如: H2O、SO2、 NH3 等
[例](1999年,全国)关于晶体的下列说法正确的是( (A)在晶体中只要有阴离子就一定有阳离子
A
)
正确。离子晶体是由阳离子由阴离子通过离子键结合形成。
(B)在晶体中只要有阳离子就一定有阴离子
金属晶体中有金属阳离子,没有阴离子。
(C)原子晶体的熔点一定比金属晶体的高
晶体硅的熔点(1410 ℃)就比铁的熔点(1535℃)低。 (D)分子晶体的熔点一定比金属晶体的低 碘的熔点(113.5℃)就比金属汞的熔点(-38.9 ℃)高。 固体金属单质是由金属原子紧密堆积而成的晶体。金 属易失电子成为金属阳离子,金属阳离子与自由电子之间相互 作用形成金属晶体。
