分子实验常用试剂配制(精)
分子生物学实验常用试剂缓冲液的配制方法

分子生物学实验常用试剂缓冲液的配制方法1.常见试剂配制方法:(1)磷酸盐缓冲液(PBS)的配制方法:-配制PBS需要使用NaCl、KCl、Na2HPO4和KH2PO4等化学品。
-以10倍浓度配制PBS的浓缩溶液,然后稀释为需要的浓度。
-例如,1倍浓度的PBS可以通过将1升的10倍浓度PBS溶液加入9升蒸馏水来制备。
(2) 神经元无血清培养基(Neurobasal Medium)的配制方法:- 配制Neurobasal Medium需要使用神经元培养基基本成分及其他补充物质。
-根据制造商提供的配方,按照相应比例将各种化学品溶解在无菌蒸馏水中。
-配制好的培养基可以用于维持和培养神经元体外培养。
(3) 洗涤缓冲液(Washing Buffer)的配制方法:-配制洗涤缓冲液需要使用磷酸盐缓冲液(PBS)及其他添加剂。
- 将PBS溶液中加入适当浓度的Tween-20或者Tris-HCl来制备洗涤缓冲液。
-根据实验需求,可以调整洗涤缓冲液的成分和浓度。
(4) 乙醇(Ethanol)溶液的配制方法:-配制乙醇溶液常用的浓度有70%和100%。
- 70%的乙醇溶液可以通过将70ml无菌蒸馏水加入30ml无水乙醇中配制得到。
-100%的乙醇溶液可以直接使用无水乙醇。
2.常见缓冲液配制方法:(1) Tris/Tricine缓冲液的配制方法:- 配制Tris/Tricine缓冲液需要使用Tris(三羟甲基氨基甲烷)和Tricine(三甘胺酸)等化学品。
- 根据实验要求,在一定PH范围内,按照不同比例混合Tris和Tricine,溶解于适量的蒸馏水中。
(2) 氯化钾缓冲液(KCl Buffer)的配制方法:- 配制KCl Buffer需要使用KCl和其他添加剂。
-将适量的KCl和其他缓冲液成分溶解在蒸馏水中。
-根据实验要求,调整KCl的浓度和缓冲液的PH值。
(3) Tris/Acetate缓冲液的配制方法:- 配制Tris/Acetate缓冲液需要使用Tris和乙酸等化学品。
TAKARA实验室常规试剂配制方法

TAKARA实验室常规试剂配制方法TAKARA实验室是一家提供生命科学研究和临床诊断解决方案的公司。
其产品线包括分子生物学试剂、细胞培养耗材、蛋白质研究试剂和临床诊断试剂等。
在TAKARA实验室产品的使用过程中,常规试剂的配制方法是非常重要的一部分。
本文将介绍一些TAKARA实验室常规试剂的配制方法。
1. Tris缓冲液的配制方法Tris缓冲液可用于蛋白质电泳,DNA和RNA电泳等实验中。
配制方法如下:1)将Tris酸粉末称取至容器中。
2)加入蒸馏水溶解,并调节pH至所需值(一般为8.0)。
3)使用0.22μm的滤器进行过滤。
2.PBS缓冲液的配制方法PBS缓冲液是一种常用的生理盐水缓冲液,在细胞培养和免疫染色实验中经常使用。
配制方法如下:1)将NaCl、KCl、Na2HPO4和KH2PO4按指定比例称取至容器中。
2)加入蒸馏水溶解,并调节pH至所需值(一般为7.4)。
3)使用0.22μm的滤器进行过滤。
3.LB培养基的配制方法LB培养基是一种常用的大肠杆菌培养基,在分子生物学实验中经常使用。
配制方法如下:1)将Tryptone、Yeast Extract和NaCl按指定比例称取至容器中。
2)加入蒸馏水溶解,并使用自动调pH仪调节pH至所需值(一般为7.0)。
3)将容器密封,并在121℃高压灭菌器中高压灭菌15-20分钟。
4. RNase-Free水的制备方法RNase-Free水在RNA实验中非常重要,保证实验的可靠性和准确性。
制备方法如下:1)将蒸馏水倒入洁净的玻璃烧杯中。
2)放入微波炉中加热,每隔一段时间取出搅拌一次,直至水沸腾。
3)冷却后,使用0.22μm的滤器进行过滤。
4)将过滤后的水贮存在RNase-Free的容器中。
5.甲醛溶液的配制方法甲醛溶液可用于细胞固定和染色实验。
配制方法如下:1)将甲醛溶液称取至容器中。
2)加入蒸馏水溶解,使浓度达到所需值(一般为4%)。
3)使用0.22μm的滤器进行过滤。
实验室常用溶液及溶剂的配制

实验室常用溶液及试剂配制表一普通酸碱溶液的配制表二常用酸碱指示剂表三混合酸碱指示剂表四容量分析基准物质的干燥表五缓冲溶液的配制实验室常用试验方法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:X%(一水)= (V1-V0)×C×0.06404x m×(1-0.08566)×100X%(无水)= (V1-V0)×C×0.06404x m×100V1-----消耗氢氧化钠标准溶液的体积,ml;V0-----空白所消耗氢氧化钠标准溶液的体积,ml;C------氢氧化钠标准溶液浓度,mol/L;m---样品质量。
十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0.1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0.05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点。
Ca%= C×V×0.4008x m ×100C------EDTA标准溶液的浓度,mol/L;V-----消耗EDTA标准溶液的体积,ml;m----样品质量。
(二)氟(Fˉ)含量的测定:1、标准曲线的绘制;2、试样含量的测定:称取0.5g(精确到0.0002g)置于50ml纳氏比色管中,加1mol/L盐酸10ml,密闭提取1h (不时摇动),避免粘于管壁,提取后加总离子强度缓冲液25ml,加水至刻度,以滤纸过滤。
实验常用试剂、缓冲液的配制方法

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
分子生物学实验常用试剂配制

分子生物学实验常用试剂配制分子生物学实验常用试剂配制(1) 0.01M PBS缓冲液:一袋粉制PBS缓冲液(中杉有售)加1000ml蒸馏水。
0.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
(2) 0.01M枸橼酸盐缓冲液:一袋粉制枸橼酸盐缓冲液(中杉有售)加1000ml蒸馏水。
0.01mol/L柠檬酸盐缓冲液(CB,pH6.0,1000ml):柠檬酸三钠3g,柠檬酸0.4g。
(3)1mol/L的TBS缓冲液(pH8.0):在800ml水中溶解121gTris碱,用1N的HCl 调至pH8.0,加水至1000ml。
(4) 1‰DEPC水:1mlDEPC加入1000ml新鲜三蒸水中,剧烈震荡20分钟使充分混匀,37o C至少放置2h或过夜,HIRAYAMA HV-50高压灭菌器高温高压30分钟降解DEPC,4℃保存。
(5) 1%琼脂糖凝胶:取琼脂糖0.2g置烧杯中,加入20ml的1×TAE缓冲液,封闭锥形瓶口,放入微波炉内加热,不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液,待琼脂糖全部熔化后取出摇匀,冷却至60℃左右,加入10mg/ml溴化乙锭(EB)1μl,EB的终浓度为0.5μg/ ml,充分混匀。
将温热的凝胶倒入已经放好梳子的凝胶槽中,厚度约为3-5mm,注意不要有气泡,将凝胶放置室温待其自然凝固。
凝固后从胶槽中轻轻取出梳子。
(6)0.5mol/L EDTA缓冲液(pH8.0):700ml水中溶解186.1gEDTA·2H2O,用10 mmol/L NaOH调至pH8.0,加水至1000ml。
(7) 50×TAE缓冲液:Tris碱242g,17.4mol/L冰乙酸57.1ml,0.5mol/L EDTA (PH8.0)100ml加蒸馏水至1000ml。
常用试剂配方

常用试剂配方常用试剂:储存于阴凉、通风的地方;远离火种、热源。
避免光照。
室温不超过30℃,相对湿度不超过80%。
包装必须密封,切勿受潮。
应与易(可)燃物、还原剂、碱类、醇类、食用化学品分开存放,切忌混储,储区应备有合适的材料收容泄漏物。
操作注意事项:尽量在通风橱操作,加强通风,避免粉尘扩散。
远离易燃、可燃物,避免与还原剂、碱类、醇类接触,防止包装及容器损坏。
使用后应留意剩余量,注意及时订购。
8M Urea(尿素)组份浓度: 8mol/L Urea(MW:60.07)配制量: 1L配制方法: 1.称取尿素480g,置于1L的蓝盖瓶中。
2. 加水至1L,置于磁力搅拌器上充分搅拌。
3. 于棕色瓶中,4℃保存。
4.使用前,先在常温放置,使析出的尿素溶解。
0.25%AgNO3 (硝酸银)组份浓度:0.25%(W/V)AgNO3(MW:169.87)配制量: 500ml配制方法: 1.准确称取硝酸银1.25g。
2.加入500ml的去离子水,充分溶解。
3.于棕色瓶中,常温保存。
0.5M EDTA(PH 8.0)组分浓度: 0.5 mol/L EDTA(MW:372.24)配制量: 500ml配制方法: 1.称取93g Na2EDTA·2H2O置于500ml蓝盖瓶中。
2.加入400ml的去离子水,置于磁力搅拌器上充分搅拌。
3.用NaOH调节调节pH值至8.0(约需加入20g固体NaOH),当pH接近8.0时, EDTA方可完全溶解,加入去离子水定容至1L。
4.高温高压灭菌后,室温保存半年。
5M NaCl组份浓度: 5mol/L NaCl (MW:58.5)配制量: 1L配制方法: 1.准确称取氯化钠292.5g,置于1L的蓝盖瓶中。
2.用去离子水溶解并稀释至1L。
3.高温高压灭菌后,常温保存。
50% 甘油组分浓度: 50%(V/V) glycerol配制量: 100ml配制方法: 1. 量取下列试剂,置于250ml蓝盖瓶 中:100% glycerol 50ml2.加入50ml去离子水,充分搅拌溶解。
分子生物学实验报告试剂

一、实验背景分子生物学是一门研究生物大分子如核酸、蛋白质等结构与功能的科学。
在分子生物学实验中,试剂的选择和使用对实验结果的准确性至关重要。
本实验报告将详细介绍分子生物学实验中常用的试剂及其作用。
二、实验试剂1. 核酸提取试剂(1)酚/氯仿:用于从细胞中提取DNA和RNA,具有强烈的蛋白变性作用。
(2)异丙醇:用于DNA的沉淀,降低DNA的溶解度。
(3)无水乙醇:用于RNA的沉淀,降低RNA的溶解度。
(4)RNA酶抑制剂:防止RNA降解,保证实验结果的准确性。
2. DNA提取试剂(1)Tris-HCl缓冲液:用于DNA的提取,调节pH值,保持酶的活性。
(2)EDTA:抑制金属离子与DNA结合,防止DNA降解。
(3)SDS(十二烷基硫酸钠):用于蛋白质的变性,使蛋白质与DNA分离。
(4)蛋白酶K:降解蛋白质,去除蛋白质杂质。
3. DNA纯化试剂(1)琼脂糖凝胶:用于DNA的分离和纯化。
(2)DNA纯化试剂盒:用于DNA的纯化和回收。
4. DNA扩增试剂(1)PCR反应缓冲液:提供反应所需的pH值、盐浓度等。
(2)dNTPs(脱氧核苷三磷酸):作为PCR反应的原料。
(3)引物:用于PCR反应的特异性扩增。
(4)Taq酶:DNA聚合酶,负责DNA的合成。
5. DNA检测试剂(1)溴化乙锭(EB):用于DNA的染色,便于在紫外光下观察。
(2)琼脂糖凝胶电泳缓冲液:用于DNA的电泳。
(3)DNA标记物:用于DNA的定量分析。
6. 蛋白质提取试剂(1)裂解缓冲液:用于蛋白质的提取,保证蛋白质的完整性。
(2)蛋白酶抑制剂:防止蛋白质降解。
(3)SDS:使蛋白质变性,便于与核酸分离。
7. 蛋白质纯化试剂(1)柱层析:用于蛋白质的纯化。
(2)凝胶过滤:用于蛋白质的纯化。
8. 蛋白质检测试剂(1)考马斯亮蓝G-250:用于蛋白质的定量分析。
(2)BCA法:用于蛋白质的定量分析。
(3)SDS-PAGE凝胶:用于蛋白质的分离和纯化。
分子生物学实验常用缓冲液的配制方法
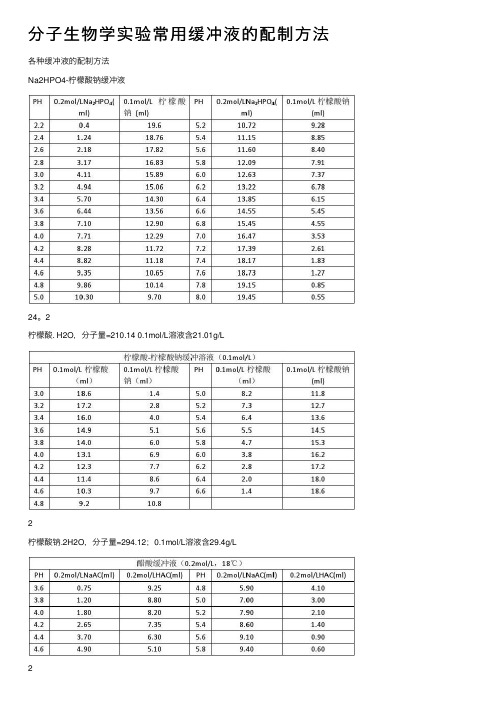
分⼦⽣物学实验常⽤缓冲液的配制⽅法各种缓冲液的配制⽅法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分⼦量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠.2H2O,分⼦量=294.12;0.1mol/L溶液含29.4g/L2(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加⽔稀释⾄250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取⽆⽔醋酸钠20g,加⽔300ml溶解后,加溴酚蓝指⽰液1ml及冰醋酸60~80ml,⾄溶液从蓝⾊转变为纯绿⾊,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加⽔50ml使溶解,⽤冰醋酸调节pH值⾄4.6,再加⽔稀释⾄100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加⽔稀释⾄500ml,即得。
⽤醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka 是醋酸的解离常数=1.8*10-5(1.8乘10的-5次⽅),PKa=-lgKa=4.75,将PH=5.5代⼊,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
﹡配制方法
1.称取2.5g卡那霉素置于50ml塑料离心管中。
2.加入40ml灭菌水,充分混合溶解之后定容50ml。
3. 0.22μm滤膜过滤除菌,小份分装(1ml/管后,置于-20℃保存。
RNase A
﹡组分浓度10mg/ml RNase A
﹡配制量50ml
﹡配制方法
1.取0.5g RNase A置于50ml塑料离心管中。
氨苄青霉素
﹡组分浓度100mg/ml氨苄青霉素
﹡配制量50mlin置于50ml塑料离心管中。
2.加入40ml灭菌水,充分混合溶解之后定容至50ml。
3. 0.22μm滤膜过滤除菌,小份分装(1ml/管后,置于-20℃保存。
卡那霉素(可配25mL
﹡组分浓度50mg/ml卡那霉素
DTT
﹡组分浓度1M DTT
﹡配制量10ml
﹡配制方法
1.称取1.54g DTT置于15ml塑料离心管中。
2.加入8ml的10mM NaAc(pH5.2 ,充分混合溶解之后定容至10ml。
3.用0.22μm滤膜过滤除菌,小份分装(1ml/管后,置于-20℃保存。
EDTA溶液
﹡组分浓度0.5M EDTA
2.加入40ml灭菌水,充分混合溶解之后定容50ml。
3. 100℃煮沸15min,缓慢冷却至室温,小份分装(1ml/管后,置于-20℃保存。
IPTG
﹡组分浓度24mg/ml IPTG
﹡配制量50ml
﹡配制方法
1.称取1.2g IPTG置于50ml塑料离心管中。
2.加入40ml灭菌水,充分混合溶解之后定容50ml。
3.用0.22μm滤膜过滤除菌,小份分装(1ml/管后,置于-20℃保存。
X-Gal
﹡组分浓度20mg/ml X-Gal
﹡配制量50ml
﹡配制方法
1.称取1g X-Gal置于50ml塑料离心管中。
2.加入40mlDMF (二甲基甲酰胺,充分混合溶解之后定容至50ml。
3.小份分装(1ml/管后,置于-20℃保存。
﹡配制量1L
﹡配制方法
1.称取186.1g Na2EDTA·2H2O置于1L烧杯中。
2.加入800ml的去离子水,置于磁力搅拌器上充分搅拌。
3.用NaOH调节调节pH值至8.0(约20gNaOH ,当pH接近8.0时, EDTA方可完全溶解,加入去离子水定容至1L。
4.小份分装后,高温高压灭菌,室温保存。
