氯气的实验室制法
氯气的实验室制法

④4HCl+Ca(ClO)2===CaCl2+2H2O+2Cl2↑
其中,①②④使用稀盐酸就可发生反应产生氯气。
氯气的实验室制法
(2)装置类型:固体+液体
气体。
氯气的实验室制法
(3)净化方法:用___饱__和_食__盐__水____除去HCl,再用浓 硫酸除去水蒸气。 (4)收集气体:___向_上__排__空_气_____法或排饱和食盐水法。 (5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用 Ca(OH)2 溶液吸收的原因是Ca(OH)2溶解度小,溶液 浓度低,吸收不完全。
【归纳提升】 Cl2的制备过程中的四点注意 (1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反 应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停 止,故浓盐酸中的HCl不可能全部参加反应。 (2)加热温度:不宜过高,以减少HCl挥发。
(3)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用的 吸收剂为NaOH溶液或碱石灰,不用澄清石灰水,因澄清
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸
收残余氯气,你认为其中错误的是________。
A.NaOH 溶液
B.Na2CO3 溶液
C.浓硫酸
(4)实验室用下列两种方法制取氯气:①用含 146 g HCl 的浓盐
酸与足量的 MnO2 反应;②用 87 g MnO2 与足量的浓盐酸反应,
则所得 Cl2________(填“①比②多”“②比①多”或“一样
多”)。
答案:(1)MnO2+4H++2Cl-==△===Mn2++Cl2↑+2H2O (2)酸性、还原性 (3)C (4)②比①多
3.(2019·泉州高三质检)下列制取 Cl2、探究其漂白性、收集并 进行尾气处理的原理和装置合理的是( )
氯气的三种实验室制法

氯气的三种实验室制法
氯气是一种有用的元素,它的实验室制法有三种,分别是锂——
氢氧化氯、钠—氢氧化氯和氯水法。
其中锂——氢氧化氯是最常用的
实验室制法,它是通过把锂硫酸和氢氧化钠放入温度控制在700℃的下间炉中;这时,在把氢氧化钾喷给溶液时,将产生氯气。
经过过滤和
冷却,最终就可以得到所需要的浓度是普通气体;其次是钠——氢氧
化氯,这种方法被称为氯气生产技术中“Fritsch”方法。
它是通过把
钠溶液放到白铁坛子中,再把氢氧化钾加入其中,并将温度维持在700℃;在这种情况下,就会产生氯气。
经过过滤和消毒,氯气就可以
使用了。
最后是氯水法,这种实验室制法也被称为酰胺法,通常使用
由除水以外的氯和酰胺头部组成的氯酰胺或者有机溶剂。
在实验室中,将氯气与氯酰胺接触;这将形成氯气,经过过滤和冷却,然后就可以
得到所需要的纯度的氯气。
总之,氯气的实验室制法有三种,即锂——氢氧化氯、钠—氢氧
化氯和氯水法,它们都是通过不同的反应方式来制备氯气,其中锂——氢氧化氯是最常用的实验室制法,而氯水法也是实验室中非常有效
的一种方法。
每种方法都要经过过滤、冷却和消毒等步骤,最终才可
以得到所需要的纯氯气。
氯气的实验室制法新
常见除杂装 置:
球形干燥管
U形干燥管
氯气的工业制法
方法:电解饱和食盐水
通电
原理: 2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
装置:
铁棒表面有气
H2
泡逸出,a管收
集到无色气体,
石墨棒表面有气 泡逸出,b管收 集到黄绿色气体, 使湿润的淀粉KI
(1)装置中有六处错误,请指出。 ⑤______________________________________________, ⑥______________________________________________。 (2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、 浓硫酸、氢氧化钠溶液的作用分别是: ①饱和食盐水的作用______________________________; ②浓硫酸的作用__________________________________; ③氢氧化钠的作用________________________________。 答案 (1)①烧瓶下面缺石棉网 ②铁圈下面缺酒精灯 ③原料使 用了稀盐酸 ④不应使用长颈漏斗 ⑤盛浓硫酸的洗气瓶和盛饱 和食盐水的洗气瓶位置颠倒了 ⑥洗气瓶D的气体入口导管应深 插在液面下,而出口导管应靠近瓶塞 (2)①吸收未反应的氯化氢 ②吸收水蒸气 ③吸收多余的氯气
进气管: 长进短出
除HCl气体
饱和食 盐水
除水蒸气
浓硫 酸
4、收集
向上排空气法(Cl2密度大于空气) a进b出 5、验满
饱和食盐水法 (h进g出)
方法1:将湿润的淀粉碘化钾试纸靠近集气瓶口,试纸变
氯气实验室制法1

的 HCl ,再通过盛有 浓H2SO4 的洗气瓶以除
去 H2O ,得到纯氯气。
氯气的危害
氯气被人吸入后,可迅速附着于呼吸道黏 膜,之后可以导致人体支气管痉挛、支气管炎、 支气管周围水肿、充血和坏死。呼吸道黏膜受 刺激,可造成局部平滑肌痉挛,再加上黏膜充 血、水肿及灼伤,可引起严重的通气障碍。人 吸入浓度为每立方米二点五毫克的氯气时,就 会死亡。
二、发生装置:
•氯气的制取必须加 热,所以在装置里 必须有加热的部 分.
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
可能含有的杂质: HCl (饱和NaCl溶液) H2O (浓H2SO4)
三、净化装置
先用饱和食盐水吸收氯气 中混有的氯化氢气体;再 用浓硫酸干燥氯气。
装配原则:先洗气后干
一旦发生氯气泄漏,应立即用湿毛巾捂住 嘴、鼻,背风快跑到空气新鲜处。
分析: 氯气的密度和溶解性
1、氯气的密度大于相同状况下空气密度
2、氯气能溶于水,但在饱和NaCl溶液 中溶解度很小
结论: 1、向上排空气法 2、不能用排水法,用排饱和食盐水法
氯 气 收 集 过 程 的 动 画
放好铁架台,根 据酒精灯外焰 的高度确定铁 圈和石棉网的 位置,最后固定 组合装置
浓硫酸
饱和食盐水
集气瓶
正确安装顺序为: AEFCDGHB
实验室制备氯气的装置图
问题与讨论:
1、实验室制氯气的反应方程式如下:
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
该反应产生的氯气能否达到理论产值?为 什么?
2、实验室用二氧化锰和浓盐酸制氯气时,除氯气外,
往往还含有
氯气的实验室制法

4、指出下图中的错误
稀HCl
浓Hห้องสมุดไป่ตู้SO4
饱和食盐水
Ca(OH)2溶 液
O2的制备 2KClO3Mn△O2 2KCl+3O2↑
CO2 , H2的制备
CaCO3+2HCl=CaCl2+CO2↑+H2O
Zn+HCl=ZnCl2+H2↑
固固加热型
固液不加热
①
②
型
Cl2的制备
MnO2+4HCl(浓)△=MnCl2+Cl2↑+2H2O
1772年瑞典化学家舍勒用软锰矿(主要为二氧化
锰)和浓盐酸作用,首先制得氯气:
MnO2+4HCl(浓)===MnCl2+2H2O+C12↑。 后来,法国化学家贝托雷巴用氯化钠、软锰矿和
浓硫酸的混合物装入铅蒸馏器中,经加热也制得了
氯气:
舍勒【瑞典】 公元1742-1786
3NaCl+3H2SO4(浓)+MnO2===NaHSO4+MnSO4+Cl2 ↑+2H2O
失e-×2=2e-
氧化剂:MnO2
还原剂:浓HCl
MnO2+4H++2Cl-△=Mn2++Cl2↑+2H2O
实验室也可用KMnO4、KClO3等作氧化剂氧化浓HCl制备氯气。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
气体净化:
Cl2含有的杂质: 除杂试剂:
H2O,
HCl
浓H2SO4 饱和食盐水
气体收集: 向上排空气法 或 排饱和食盐水法
氯气的实验室制法(精选上课好用)

例题分析
40克36.5%的浓盐酸与足量的二氧化锰加 热反应,求:能生成氯气的质量? 解:MnO2 + 4 HCl = MnCl2 + 2H2O + Cl2↑ 4×36.5 71 m(Cl2) 40g×36.5% 40g×36.5%×71 (mCl2)= = 7.1g 4×36.5 答:能生成氯气7.1 克 如变为8.7gMnO2 不对!随着反应的进行,浓盐酸变成稀盐酸, 与足量的浓盐酸 反应就停止了,故生成的氯气必少于7.1克。 呢?
固+液 不加热 气体 如制氢气
固+固 → 气体 如制氧气
加热
固+液 → 气体 如制氯气
加热
除杂、干燥装置:
洗气瓶: 盛液体试剂
球型干燥管: U型干燥管: 盛固体试剂 盛固体试剂
硬质玻璃管
加热条件下 用固体除杂
常见气体收集装置:
C
D
尾气的处理
B A 注:吸收溶解速度不很快,或溶解度不很大的气体用装置A; 若气体在吸收剂中溶速快且溶解度极大-易倒吸,选B; 少量难以吸收的尾气可集于气球中-选C; 难以吸收的可点燃处理-选D。 用固体试剂吸收尾气-选E。
化学史话
在1774年,瑞典化学家舍勒(Scheele K W,1742-1786)在 从事软锰矿的研究时发现:软锰矿与盐酸混合后加热就会生成一种 令人窒息的黄绿色气体,这种气体微溶于水,使水显酸性。能漂白 有色花朵和绿叶,还能和各种金属发生反应。当时,大化学家拉瓦 锡认为氧是酸性的起源,一切酸中都含有氧。舍勒及许多化学家都 坚信拉瓦锡的观点,认为这种黄绿色的气体是一种化合物,是由氧 和另外一种未知的基所组成的,所以舍勒称它为“氧化盐酸”。但 英国化学家戴维(Davy S H,1778-1829)却持有不同的观点,他 想尽了一切办法也不能从氧化盐酸中把氧夺取出来,他怀疑氧化盐 酸中根本就没有氧存在。1810年,戴维以无可辩驳的事实证明了所 谓的氧化盐酸不是一种化合物,而是一种化学元素的单质。他将这 种元素命名为“Chlorine”。它的希腊文原意是“绿色”。中文译 名为氯。
氯气的实验室制法

HCl和参加反应的HCl物质的量之比是 [ C ]
A.1∶1
B.2∶1
C.1∶2
D.任意比
3. 将0.15 mol的MnO2与过量的 12 mol/L的浓盐酸反应,和 50 mL 12 mol/L的浓盐酸与足量的MnO2反应两者产生的
Cl2相比(其他反应条件相同) [ B ]
A. 一样多
B.前者较后者多
C. 后者较前者多
D.无法比较
作业:
• 1. P57 1,2 • 2. P59 17 • 3. P60 19 (学有余力)
3.工业上制取氯气的方法?
问题探究
1.为什么不能加强热? 答:浓盐酸有较强的挥发性,若加强热会使氯气中有大量的 氯化氢杂质,另外也降低了HCl的利用率。
2.还能选用其他试剂反应制取氯气吗? 答:可以用高锰酸钾(氯酸钾)和浓盐酸反应 2KMnO4 + 16HCl =2KCl +2MnCl2 +5Cl2 + 8H2O 也可以氯化钠、浓硫酸和MnO2混合制取氯气 2NaCl +3H2SO4 +MnO2 =2NaHSO4 +MnSO4 +Cl2 +2H2O 3.工业上制取氯气的方法? 答:电解饱和食盐水可以得到氯气、氢气和氢氧化钠
试具体分析.
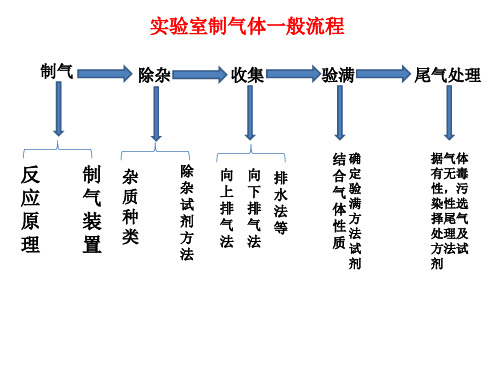
•气体发生装置
•气体净化装置
•气体收集装置
•尾气处理装置
发生装置 净化装置 收集装置
尾气处理 装置
根据反应物 的状态和反 应条件选用
根据气体的 性质和制取 要求选择
根据气体的 水溶性和对 空气的相对 密度选用
尾气有毒或 污染空气, 不能直接排 空
固体+固体 固体+液体 固体(液体)+液体
氯离子的检验:
Cl- + Ag+ = AgCl CO32- +2 Ag+ = Ag2CO3 Ag2CO3 +2H+ = 2Ag+ +CO2 + H2O 先加硝酸,再加硝酸银,以排除 CO32-等离子的干扰
氯气实验室制法

氯气实验室制法在化学实验室中,氯气的制备是一种常见的实验操作。
氯气是一种黄绿色、有毒、具有强烈刺激性的气体,其制备通常通过以下步骤进行。
实验室制备氯气通常采用二氧化锰(MnO2)与浓盐酸反应。
具体来说,就是将二氧化锰与浓盐酸在加热的条件下进行反应,生成氯化锰和氯气。
反应方程式可以表示为:4HCl(浓) + MnO2 → MnCl2 + 2H2O + Cl2↑需要注意的是,由于氯气的溶解度和腐蚀性,制备过程中需要使用安全措施以防止氯气泄漏和腐蚀。
实验所需材料和设备包括:二氧化锰(MnO2)、浓盐酸、玻璃棒、烧杯、加热装置、通风装置、手套、护目镜等。
准备实验设备:将浓盐酸倒入烧杯中,加入适量的二氧化锰,用玻璃棒搅拌均匀。
加热:将装有反应物的烧杯放置在加热装置上加热,观察反应情况。
收集氯气:随着反应的进行,氯气会不断产生并排出。
此时,开启通风装置以防止氯气积聚。
提取产物:当反应完成后,停止加热并冷却反应物。
然后,用玻璃棒将生成的固体产物与液体产物分离。
清洗和整理:清洗烧杯和其他实验设备,整理实验现场。
在实验过程中,要始终保持通风良好,防止氯气积聚导致中毒。
实验结束后,要彻底清洗烧杯和其他实验设备,防止腐蚀和污染。
不要将氯气直接排放到空气中,以免对环境和人体造成危害。
应将其通过特定的吸收装置进行处理。
在操作过程中要小心谨慎,避免烫伤和中毒等事故发生。
最好在导师或安全员的监督下进行实验。
实验后应及时清理实验现场,确保实验室的安全和卫生。
通过观察实验过程和收集到的产物,我们可以确认实验室制备氯气的成功与否。
如果观察到黄绿色的氯气产生,且固体产物为氯化锰,那么实验就达到了预期的效果。
此时,我们可以进一步研究氯气的性质和应用。
实验室制备氯气是一个重要的化学实验操作,它使我们能够更深入地了解氯气的性质和合成方法。
通过本实验的操作,我们不仅能够提高自己的动手能力和实践经验,还能够增强对化学知识的理解和掌握。
我们也应该注意实验过程中的安全问题,确保实验的顺利进行和自身的健康安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课堂练习
1.二氧化锰与浓盐酸作用制氯气的反应中,作为还原剂的 .二氧化锰与浓盐酸作用制氯气的反应中, HCl和参加反应的 和参加反应的HCl物质的量之比是 [ C ] 和参加反应的 物质的量之比是 A.1∶1 B.2∶1 . ∶ . ∶ C.1∶2 D.任意比 . ∶ . 2.在实验室中制取纯净、干燥的氯气,常使生成的氯气依 .在实验室中制取纯净、干燥的氯气, 次通过两个洗气瓶, ] 次通过两个洗气瓶,这两个瓶内盛放的试剂依次是 [ B ①盐酸 ②饱和食盐水 ③浓硫酸 ④石灰水 ⑤烧碱溶液 A.①② B.②③ . . C.③⑤ D.②④ . . 3.实验室制取下述各组物质,所用的气体发生装置相同的是 .实验室制取下述各组物质, [ C D] A.H2,O2 B.O2,HCl . . C.Cl2,HCl D.H2,CO2 . .
发生装置-----除杂装置—干燥装置--收集装置--吸收装置
A
B
C
D
讨论:制取氯气的过程中可能产生哪些杂质气体, 讨论:制取氯气的过程中可能产生哪些杂质气体,
如何除去,A瓶中是什么试剂,用于除去哪种杂质? 如何除去, 瓶中是什么试剂,用于除去哪种杂质? 瓶中是什么试剂 瓶呢? 那B瓶呢? 瓶呢
问题讨论
•
净 化 装 置
液态试剂
固态试剂
气体收集装置
收集比空气重 的气体 例如:氧气、 例如:氧气、 氯气
收集难溶或微溶 于水的气体 例如:氧气、 例如:氧气、氢气 一氧化碳
收集比空气轻的 气体 例如:氢气、 例如:氢气、氨气
度不很快,溶解度也不很大的气体用装置A; 说明:吸收溶解速度不很快,溶解度也不很大的气体用装置 ; 若气体在吸收剂中溶速快且溶解度极大,易倒吸,选用B; 若气体在吸收剂中溶速快且溶解度极大,易倒吸,选用 ; 少量尾气可以集于气球中,选用C; 少量尾气可以集于气球中,选用 ; 难以吸收的可以点燃处理,选用D。 难以吸收的可以点燃处理,选用 。 练习:请选出 练习:请选出Cl2 、HCl 、CO尾气处理的装置 尾气处理的装置
请思考图示的装置都有哪些用途? 请思考图示的装置都有哪些用途?
1.从A口进气,从B口排出瓶内的空气, 从 口进气 口进气, 口排出瓶内的空气, 口排出瓶内的空气 可收集O 可收集 2、Cl2等比空气重的气体 2.从B口进气,从A口排出瓶内的空气,可收集 2、NH3 从 口进气 口进气, 口排出瓶内的空气, 口排出瓶内的空气 可收集H 等比空气轻的气体。 等比空气轻的气体。 3. 在瓶内加入适量液态净化剂,从A口进气,B口出气,可作 在瓶内加入适量液态净化剂, 口进气, 口出气 口出气, 口进气 为气体净化装置。 为气体净化装置。 4.瓶内加入适量浓硫酸,从A口进气,B口出气,可作为气体 瓶内加入适量浓硫酸, 口进气, 口出气 口出气, 瓶内加入适量浓硫酸 口进气 干燥装置。 干燥装置。 5.在瓶内充满水,从B口进气,将瓶内水从 口压出,可作为 在瓶内充满水, 口进气, 口压出, 在瓶内充满水 口进气 将瓶内水从A口压出 排水取气装置。 排水取气装置。
氯气的实验室制法
化学方程式 MnO2 + 4HCl(浓)= MnCl2 +Cl2 + 2H2O (
得2e-
MnO2 + 4HCl(浓)= MnCl2 +Cl2 + 2H2O
失2e-
氧化剂: 氧化剂:MnO2
还原剂: 还原剂:HCl
离子方程式 MnO2 + 4H+ +2Cl-
Mn2+ +Cl2 +2H2O
!!
可以用排饱和食盐水 饱和食盐水的方法收集 饱和食盐水 Cl
氯离子的检验: 氯离子的检验:
Cl- + Ag+ = AgCl CO32- +2 Ag+ = Ag2CO3 Ag2CO3 +2H+ = 2Ag+ +CO2 + H2O 先加硝酸银,再加硝酸, 先加硝酸银,再加硝酸,以排除 CO32-的干扰
1.为什么不能加强热? 为什么不能加强热? 为什么不能加强热
2.还能选用其他试剂反应制取氯气吗? 还能选用其他试剂反应制取氯气吗? 还能选用其他试剂反应制取氯气吗
3.工业上制取氯气的方法? 工业上制取氯气的方法? 工业上制取氯气的方法
问题讨论
1.为什么不能加强热? 为什么不能加强热? 为什么不能加强热 答:浓盐酸有较强的挥发性,若加强热会使氯气中有大量的 浓盐酸有较强的挥发性, 氯化氢杂质,另外也降低了HCl的利用率。 的利用率。 氯化氢杂质,另外也降低了 的利用率 2.还能选用其他试剂反应制取氯气吗? 还能选用其他试剂反应制取氯气吗? 还能选用其他试剂反应制取氯气吗 氯酸钾)和浓盐酸反应 答:可以用高锰酸钾(氯酸钾 和浓盐酸反应 可以用高锰酸钾 氯酸钾 2KMnO4 + 16HCl =2KCl +2MnCl2 +5Cl2 + 8H2O 也可以氯化钠、浓硫酸和MnO2混合制取氯气 也可以氯化钠、浓硫酸和 2NaCl +3H2SO4 +MnO2 =2NaHSO4 +MnSO4 +Cl2 +2H2O 3.工业上制取氯气的方法? 工业上制取氯气的方法? 工业上制取氯气的方法 答:电解饱和食盐水可以得到氯气、氢气和氢氧化钠 电解饱和食盐水可以得到氯气、
一套完整的氯气制取装置应该包括 哪几步? 哪几步?
•气体发生装置 气体发生装置 •气体净化装置 气体净化装置 •气体收集装置 气体收集装置 •尾气处理装置 尾气处理装置
气体发生装置
固体反应物加热制气 例如: 例如:氧气等
固体和液体混合 制气 例如:氢气、 例如:氢气、 二氧化碳等
有液体反应物, 有液体反应物,反 应需要加热 例如:氯气、氯化 例如:氯气、 氢等
