化学反应速率计算习题图文稿
2023届高三化学高考备考二轮复习课件专题七 化学反应速率和化学平衡

衡状态,x<0.4,即x≠0.4,B正确;C.
实验①、实验②中0~20 min、20~40 min氨气浓度变化量都是4.00×10-4 mol·L-1,
实验②中60 min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①
中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60 min时反应未达到平衡
浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
答案:D
(
)
2Y的影响,各物质
解析:A.由图可知,无催化剂时,随时间推移,生成物浓度也在增加,说明反应也
在进行,故A错误;B.由图可知,催化剂Ⅰ比催化剂Ⅱ催化效果好,说明催化剂Ⅰ
答案:(2)5.4
相同催化剂,400 ℃的反应速率更快,相同温度,催化剂Ⅱ副产
物浓度低,甲烷与甲醇比例高
解析(2)在选择使用催化剂Ⅰ和350 ℃条件下反应,由表中信息可知,0~2 min
CH3OH的浓度由0增加到10.8 μmol·L-1,因此,0~2 min生成CH3OH的平均反应
. ·−
素,降低反应温度,化学反应速率减小,k减小,D项正确。
解题技法
信息条件下化学反应速率的比较方法
(1)讨论外界条件c、T、p、催化剂不同时,研究化学反应速率的大小。
(2)讨论不同反应的活化能,研究化学反应速率的大小。
(3)讨论化学反应方向,如Q与K相对大小、平衡建立过程等,研究v正、v逆的相对
大小,正向进行:v正>v逆,逆向进行:v正<v逆。
度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的条件之一,
化学反应速率图表题文档 全

1.(06年四川理科综合13)一定温度下, 在2 Λ的密闭容器中,Ξ、ψ、Z 三种气体 的物质的量随时间变化的曲线如下图所示:下列描述正确的是A 、反应开始到10σ,用Z 表示的反应速率为0.158μολ/(Λ·σ)B 、反应开始到10σ,Ξ的物质的量浓度减少了0.79μολ/Λ X 、反应开始到10σ时,ψ的转化率为79.0% ∆、反应的化学方程式为:Ξ(γ)+ ψ(γ)Z (γ)2.(2008广东化学20).(11分)某探究小组用HNO 3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。
所用HNO 3浓度为1.00 μολ·Λ-1、2.00 μολ·Λ-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K 、308 K ,每次实验HNO 3的用量为25.0μΛ、大理石用量为10.00γ。
2依据反应方程式21XαXO 3+HNO 3==21Xα(NO 3)2+21XO 2↑+21H 2O , 计算实验①在70~90σ范围内HNO 3的平均反应速率(忽略溶液体积变化,写出计算过程)。
(3)请在答题卡的框图中,画出实验②、③和④中XO 2质量随时间变化关系的预期结果示意图。
参考答案 1X2(2)由图读得:70σ--- 90σ时,μ(XO 2)=0.95γ-0.85γ=0.10γ,. (1分) 根据方程式可知molmol g g 2201/4410.02)=⨯=∆3n(HNO)/(1101)7090(025.02201s L mol s s L mol⋅=-⨯=)v(HNO 3(2分)(3)1.(07年高考广东理基)把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是 A .盐酸的浓度B .铝条的表面积 X .溶液的温度∆.加少量Nα2∑O 42.(06年上海16) 将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是 A .反应速率:两者相同 B .消耗硝酸的物质的量:前者多,后者少 X .反应生成气体的颜色:前者浅,后者深2468MN物质的量/mol ∆.反应中转移的电子总数:前者多,后者少分析上述数据,回答下列问题:(1)实验4和5表明,⎽⎽⎽⎽⎽⎽⎽⎽⎽对反应速率有影响,结论是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽反应速率越快,能表明同一规律的实验还有⎽⎽⎽⎽⎽⎽⎽⎽⎽(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有⎽⎽⎽⎽⎽⎽⎽⎽⎽(填实验序号);(3)本实验中影响反应速率的其他因素还有⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽,其实验序号是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
化学课件第四章、化学反应速率
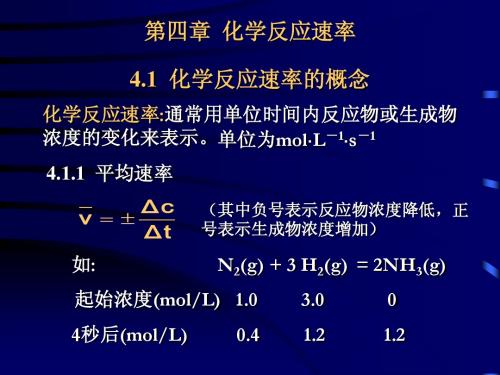
1 1 v = vNH3 = vH2 = vN2 = 0.15mol⋅L−1 ⋅ S−1 2 3
4.1.2 瞬时速率(即时速率) 瞬时速率(即时速率) 瞬时速率: 化学反应进行到某一时刻的速率. 瞬时速率: 化学反应进行到某一时刻的速率.
ν = κ ⋅ c (A)⋅ c (B)
a b
k称为速率常数,其数值为在一定条件(温度、 称为速率常数,其数值为在一定条件(温度、 催化剂) 当各反应物浓度均为1mol· 催化剂)下,当各反应物浓度均为1mol·L-1时的化 学反应速率。 值决定于反应的本性和反应温度, 学反应速率。k值决定于反应的本性和反应温度, 与反应物浓度无关。 值一般都由实验测定。 与反应物浓度无关。k值一般都由实验测定。 (a+b)称为反应总级数 (a+b)称为反应总级数
说明: (1)速率常数 的单位与反应总级数有关: 说明: (1)速率常数k的单位与反应总级数有关: 速率常数k a+b 0 1 2 反应总级数 0级 一级 二级 k的单位 mol·L mol·L-1 · S-1 S -1 L · mol-1 · S-1
(2) a+b称为反应总级数, a为反应物A的级数,b a+b称为反应总级数 a为反应物 的级数,b 称为反应总级数, 为反应物A 为反应物B的级数. 为反应物B的级数.
∆c dc v = ±lim = ± t dt ∆t→ ∆ 0
对任一化学反应: 对任一化学反应:
−ν A ⋅ A−νB ⋅ B = + Y ⋅Y +νΖ ⋅ Z ν 1 dc(A) 1 dc(B) 1 dc(Y) 1 dc(Z) v= = = = ν A dt νB dt νY dt νZ dt
化学反应速率及平衡计算(带答案)

化学反应速率及平衡计算一、化学反应速率有关计算1.根据化学反应速率的定义计算公式:V=△C/t2.根据化学计量数之比,计算反应速率:在同一个反应中,各物质的反应速率之比等于方程式中的系数比。
3.温度对化学反应速率的影响计算:【练1】某一化学反应的反应速率在每升高10度时就增大到原来的3倍,若此反应的温度从20度升高到50度时,则其反应速率是原来的()A.6倍B.9倍C.18倍D.27倍解析:温度每升高10度时就增大到原来的3倍,则v末=v初×3(T末-T初)/10=3(50-20)/10=33=27.答案:D4、根据已知的浓度、温度等条件,比较反应速率的大小【练2】把下列四种X溶液分别加入四个盛有10mL 2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是()A. 10℃20mL 3mol/L的X溶液B. 20℃30mL 2mol/L的X溶液C. 20℃10mL 4mol/L的X溶液D. 10℃10mL 2mol/L的X溶液解析:在化学反应中,当其它条件不变时,浓度越大,反应速率越快;温度越高,反应速率越快。
在本题中要综合考虑浓度和温度的影响。
先比较浓度的大小,这里的浓度应该是混合以后的浓度,由于混合后各烧杯中盐酸的浓度相等,因此只要比较X的浓度,X 浓度越大,反应速率越快。
因为反应后溶液的体积均为50mL,所以X的物质的量最大,浓度就最大。
通过观察可知,混合后A、B选项中X的浓度相等,且最大,但B中温度更高,因此B的反应速率最快。
答案:B5、利用参加反应的各物质物质的量浓度的变化或物质的量的变化数值或相关图像,确定化学反应方程式:6、综合计算【练3】将26H mol 和CO mol 3充入容积为L 5.0的密闭容器中,进行如下反应:)()(22气气CO H)(3气OH CH ,6秒末时容器内压强为开始时的0.6倍。
试计算:2H 的反应速率是多少?【练4】在一定条件下,发生反应:2X(g)+Y(g)2Z(g) ΔH =-197 kJ · mol -1,若将2 mol X 和1 mol Y 充入2 L 的恒容密闭容器中,反应10 min ,测得X 的物质的量为1.4 mol ,下列说法正确的是( )A .10 min 内,反应放出的热量为197 kJ 热量B .10 min 内,X 的平均反应速率为0.06 mol ·L -1·min -1C .第10 min 时,Y 的反应速率小于0.015 mol ·L -1·min -1(假如体系温度不变) D .第10 min 时,Z 浓度为0.6 mol ·L -17、化学反应速率的测定实验和计算:测定反应速率的方式和途径:化学反应的速率是通过实验测定的。
几种化学反应速率特殊图像及表格

Z%
b
0
a
t
A. 加入催化剂 B. 增大Y的浓度 C. 降低温度 D. 增大体系压强 E. 减小压强
X(g)+Y(g)
A 转 化 率
pZ(g)+W(s)
1.01107Pa
p =?
1.01106Pa
0
时间
2.浓度——平衡——时间曲线
mA(g)+nB(g)
浓 度
pC(g)+qD(s) ΔH=Q
C
转 化 率
B C
A
E D T
NO
0
5、可逆反应: mA(S) +nB(g) pC(g);△H<0
在一定温度的密闭容器中进行,B的
体积分数(VB%)与压强关系如图所示。
下列叙述正确的是( C D )
(A) m + n < p (B) n > p (C) n < p (D) x点时:ひ(正)>ひ(逆)
7.某化学反应2A B+D在四种不同条件下进 行,反应物A的浓度(mol/L)随反应时间 (min)的变化情况如下表:
正正逆逆c时在一密闭容器中将二氧化硫和氧气混合反应过程中物质的量变化如图反应处于平衡状态的时间2据图判断反应进行至20min时曲线发生变化的原因310min到15min的曲线变化的原因可能是a加入催化剂b缩小容器体积c降低温度d增加三氧化硫的物质的量6
化学反应的 方向
反应能否自 发进行
判据
化学反应的 限度
6.综合题
2SO2 (g) + O2(g)
O
2SO3(g)+Q
1、600 C时,在一密闭容器中, 将二氧化硫和氧气混合,反应过程 中物质的量变化如图,反应处于平 衡状态的时间 15—20min 25—30min 2、据图判断,反应进行至20min时, 曲线发生变化的原因 加入氧气 3、10min到15min的曲线变化的原因可能是( AB ) A、加入催化剂 C、降低温度 B、缩小容器体积 D、增加三氧化硫的物质的量
化学反应的速率和限度习题及答案

化学反应的速率和限度习题及答案1下列关于化学反应速率的说法正确的是( )A •化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的 增加B .化学反应速率为"0.8mol • 1 s 1 ”所表示的意思是时间为 1s 时,某物质的浓度为 0.8mol • 1C .根据化学反应速率的大小可以知道化学反应进行的快慢D .对于任何化学反应来说,反应速率越大,反应现象越明显 C [熟练掌握化学反应速率的概念是解答本题的关键。
化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加,是正值,是反应的平均速率,其中固体、纯液体反应物、 生成物浓度都视为1,所以A 、B 错误;对于无明显现象的化学反应来说,无法通过现象体 现反应速率的大小,所以 D 不正确。
]2、对于反应:CaCO3+ 2HC|===CaC| 2+出0 + CO 2 t 下列说法正确的是( A )A. 用HCI 和CaCl 2表示的反应速率数据不同,但所表示的意义相同B. 不能用CaC03的浓度变化来表示反应速率,但可用水来表示C. 用H 2O 和C02表示的化学反应速率相同D.可以用CaCl 2浓度的减小表示其反应速率3、化合物Bilirubin 在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下 图所示,计算反应 4〜8min 间的平均反应速率和推测反应 16min 时反应物的浓度, 是()2、反应4NH 3(g ) + 5O 2(g )===4NO (g ) + 6H 2O (g )在10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了 0. 45 mol ,则此反应的速率 v (X )(反应物的消耗速率或产物的生成速率结果应 A . B . C . D . 2.5 2.5 3.0 5.040 35 -和251\20 15IO H S1 mol • Imin 1 和 2.0 1 mol •1L min 1 和 2.5 1 mol •1L min 1 和 3.0 1 mol -1 Imin 1 和 3.0 1 mol - L1 mol 厂1 1 mol 厂1 1 mol 厂1 [据图可知,4min 时化合物Bilirubin 1—,因此4〜8min 间的平均反应速率为1的浓度为20 1 mol — L'8min 时其浓度为20 1 mol —L — 10 1 mol •—^ 1 1=2.5 1 mol —L min —'。
【高中化学】第一节 化学反应速率【知识点+习题+答案】

第一节 化学反应速率一、知识回顾1.表示方法通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
2.数学表达式及单位v =Δc Δt ,单位为mol·L -1·min -1或mol·L -1·s -1。
3.规律同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。
深度思考正误判断,正确的划“√”,错误的划“×”(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )(2)化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加( ) (3)化学反应速率为0.8mol·L -1·s -1是指1s 时某物质的浓度为0.8mol·L -1( ) (4)由v =ΔcΔt计算平均速率,用反应物表示为正值,用生成物表示为负值( )(5)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同( ) (6)根据反应速率的大小可以判断化学反应进行的快慢( ) 解析:×××√√二、课堂练习题组一 “v =ΔcΔt”的应用1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如图所示。
回答下列问题:(1)从反应开始到10s 时,v (Z)=____________________________________。
(2)反应的化学方程式为______________________________________。
答案 (1)0.079mol·L -1·s -1 (2)X(g)+Y(g)2Z(g)解析(1)Δn(Z)=1.58molv(Z)=1.58mol2L·10s=0.079mol·L-1·s-1。
高中化学化学平衡状态判断化学反应速率计算练习题(附答案)

高中化学化学平衡状态判断化学反应速率计算练习题一、单选题1.向绝热恒容密闭容器中通入SO 2和NO 2,一定条件下使反应SO 2(g)+NO 2(g)SO 3(g)+NO(g),正反应速率随时间变化的曲线如图所示。
由图可得出的正确结论是( )A.反应在c 点达到平衡状态B.反应物浓度:a 点小于b 点C.反应物的总能量低于生成物的总能量D.Δt 1=Δt 2时,SO 2的转化率:a~b 段小于b~c 段2.在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( ) A.v(A)=0.5mol·L -1·s -1 B.v(B)=0.5mol·L -1·s -1 C.v(C)=0.8mol·L -1·s-1D.v(D)=1mol·L -1·s -1 3.合成氨反应N 2+3H 22NH 3,某段时间内的平均反应速率分别用()()()223N H NH v v v 、、表示(单位均为mol·L -1·s -1)时,下列关系式中正确的是:( ) A.()()23H NH v v = B.()()23N 2NH v v = C.()()32NH H v v =D.()()22H 3N v v =4.可逆反应2NO 2(g)2NO(g)+O 2(g),在容积固定的密闭容器中达到平衡状态的标志是( )①单位时间内生成n mol O 2的同时生成2 mol n NO 2 ②单位时间内生成n mol O 2的同时生成2 mol n NO ③用NO 2、NO 、O 2表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部5.反应()()()()3224NH g +5O g =4NO g +6H O g 在10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率()X v (反应物的消耗速率或产物的生成速率)可表示为( )A.()()3NH =0.010 mol/L s v ⋅B.()()2O =0.0010 mol/L s v ⋅C.()()NO =0.0010 mol/L s v ⋅D.()()2H O =0.0045 mol/L s v ⋅6.—定温度下,在固定体积的密闭容器中发生下列反应:222HI =H +I 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应速率计算习题集团文件版本号:(M928-T898-M248-WU2669-I2896-
化学反应速率 练习题
一.选择题
1.下列关于化学反应速率的说法正确的是( )
A .对于任何化学反应来说,反应速率越大,反应现象就越明显
B .化学反应速率通常表示一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
C .化学反应速率为0.8 mol·L -1
·s -1
是指 1 s 时某物质的浓度为0.8
mol·L -1
D .根据化学反应速率的大小可以知道化学反应进行的快慢 2.下列关于化学反应速率的说法中正确的是( ) A .化学反应速率可用某时刻生成物的物质的量来表示
B .在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的
C .化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D .可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率
3.反应2SO 2(g)+O 2(g) 2SO 3(g)经一段时间后,SO 3的浓度增加了
0.4 mol/L ,在这段时间内用O 2表示的反应速率为0.04 mol/(L·s),则这段时间为( )
A .0.1 s
B .2.5 s
C .10 s
D .5 s
4.用纯净的CaCO 3与稀HCl 反应制取CO 2,实验过程记录如图所示。
根据分析、判断,正确的是( ) A .OE 段表示反应速率最快
催化△
B .EF 段表示反应速率最快,单位时间内收集的CO 2最多
C .FG 段表示收集的CO 2最多
D .OG 段表示随着时间的推移,反应速率逐渐增快
5.反应A(g)+3B(g)2C (g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A .v(D)=0.6 mol/(L ·min)
B .v(C)=0.5 mol/(L ·s)
C .v(B)=0.6 mol/(L ·s)
D .v(A)=0.15 mol/(L ·s) 6.一定温度下,向一个容积为2 L 的真空密闭容器中(事先装入催化剂)通入1 mol N 2和 3 mol H 2,发生下列反应:N 2+3H 22NH 3,3 min 后测得
密闭容器内的压强是起始时的0.9倍,在此时间内v (H 2)是( ) A .0.2 mol/(L·min) B .0.6 mol/(L·min) C .0.1 mol/(L·min) D .0.3 mol/(L·min) 7.在2L 的密闭容器中,发生以下反应:2A(g)+ B(g)
2C(g)+D(g) 。
若最
初加入的A 和B 都是4 mol ,在前10秒钟A 的平均反应速度为0.12 mol/(L ·s),则10秒钟时,容器中B 的物质的量是 ( )
A. 1.6 mol
B. 2.8 mol
C. 2.4 mol
D. 1.2 mol 8.反应4NH 3(g)+5O 2(g)
4NO(g)+6H 2O(g 气)在10L 密闭容器中进行,半
分钟后,水蒸气的物质的量增加了0.45mol ,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. v(NH 3 )=0.0100mol·L -1·S -1
B. v(O 2)=0.0010mol·L -1·S -1
C. v(NO)=0.0010mol·L -1·S -1
D. v(H 2O)=0.045mol·L -1·S -1
9.将4mol A 气体和2mol B 气体在2 L 的容器中混合并在一定条件下发生
如下反应
高温、高催化剂
2A(g)+B(g)2C(g)若经2 s秒后测得C的浓度为0.6mol·L-1,现有下列
几种说法:
①用物质A表示的反应的平均速率为0.3mol/(L·S)
②用物质B表示的反应的平均速率为0.6mol/(L·S)
③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol·L-1其
中正确的是
A.①③B.①④ C.②③ D.③④
10.在 2 L密闭容器中充有2 mol SO2和一定量的O2,发生反应2SO2(g)+
O2(g) 2SO3(g)。
当反应进行到4 min时,测得此时SO2为0.4 mol,
那么反应进行到2 min时,密闭容器中SO2物质的量是( )
A.1.6 mol B.1.2 mol C.大于 1.6 mol D.小于1.2 mol
11.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ
(A)、υ(B)、υ(C)(mol·L-1·s-1)表示,且υ(A)、υ(B)、υ(C)之间有
如下所示的关系υ(B)=3υ(A);3υ(C)=2υ(B)。
则此反应可表示为()。
A. 2A+3B=2C
B. A+3B=2C
C. 3A+B=2C
D.
A+B=C
12.已知2SO
2(g)+O
2
(g) 2SO
3
(g),若反应速率分别用v(SO2)、v
(O2)、v(SO3)表示,则下列式子正确的是()
A. 2v(SO3)=v(O2)
B. v(SO2)=v(O2)=v(SO3)
C. 1/2v(SO2)=v(O2)
D. v(O2)=2 v(SO2)
13.将等物质的量的X
2和Y
2
置于一密闭容器中,在一定条件下发生反应
mX
2(g)+nY
2
(g)pZ(g),达平衡时,测得容器中C(X
2
)=0.9mol·L-1,C
(Y
2)=0.1mol·L-1,C(Z)=0.8mol·L-1,则Z的化学式可能是催化
△
A.X
2Y
3
B.XY
3
C.X
2
Y
2
D.X
3
Y
2
14.反应4A(s)+3B(g)===2C(g)+D(g),经 2 min,B的浓度减少0.6 mol·L-1。
对此化学反应速率表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
15.在一定条件下,向容积为2 L的密闭容器中加入2 mol N
2和10 mol H
2
,
发生反应:N
2+3H
2
2NH
3,
2 min时,测得剩余的N
2
为1 mol,则下列化学
反应速率的表达式中正确的是( )
A.v(N2)=1 mol·L-1·min-1 B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=0.25 mol·L-1·min-1 D.v(N2)=0.5 mol·L-1·min-1
二、填空题
16.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为______ mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N
2和3 mol H
2
,在一定条件下发生反
应,3 s后测得N
2为 1.9 mol,则以H
2
的浓度变化表示的反应速率为
___________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)===2C(g),在最初 2 s 内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s 时,容器中有______ mol A,此时C的物质的量浓度为______。
17.在400℃时,将一定量的SO
2和14molO
2
压入一个盛有催化剂的10L密闭
容器中进行反应:2SO
2+O
2
2SO
3
,已知2min后,容器中剩余2molSO
2
和
12molO
2
,则:
(1)生成了______molSO
3,SO
2
的起始物质的量浓度是______.
(2)2min内平均反应速率:v(SO
2)是,v(SO
3
)是
(3) 2分钟末时容器内压强为开始时倍
18.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为、。
