原子的结构和电子构型
电子构型解析

电子构型解析电子构型是描述一个原子或离子中电子分布的一种方式。
它对于理解化学中的原子结构、化学键的形成以及物质的性质都具有重要意义。
本文将详细介绍电子构型的概念及其应用。
一、电子构型的概念电子构型是指一个原子或离子中电子的分布方式,它通过表示电子层和亚层的填充情况来描述。
在填充电子时,按照能级从低到高的顺序填充。
电子层由主量子数来表示,亚层由主量子数和轨道类型(s、p、d、f)共同确定。
电子在亚层中的填充原则遵循洪特规则和奥特伯规则。
二、电子构型的表示方法1. 能级表示法:采用数字和字母的组合来表示电子层和亚层,例如1s、2s、2p等。
2. 诺特方式:将电子的数量按照升序排列,用上标表示。
三、电子构型的应用1. 原子结构:电子构型是研究原子结构的基本依据。
通过电子构型可以知道一个原子中的电子分布情况,包括电子层数目、亚层及其填充情况等。
这对于理解原子的性质和行为具有重要意义。
2. 化学键的形成:化学键的形成涉及到原子中的电子重排。
通过电子构型可以判断出原子是否容易失去或获得电子,进而预测化学键的形成方式和性质。
3. 元素周期表:元素周期表是按照元素的电子构型进行排列的。
通过电子构型可以帮助我们理解元素的周期性规律,为化学反应和物质性质提供有用的信息。
结论电子构型是描述原子和离子中电子分布方式的重要概念。
通过电子构型的表示和解析,我们可以更好地理解原子结构、化学键的形成以及元素周期表的排序规律。
在化学研究和应用中,电子构型的理解和应用对于探索物质性质和化学反应具有重要的指导意义。
原子结构表达式

原子结构表达式
原子结构表达式是一种用于描述原子的结构的表示法。
它由原子的原子序数(即在原子序列中的位置)和电子构型组成。
原子序数表示原子在元素周期表中的位置,是指原子核中的质子数量。
例如,氢原子的原子序数为1,因为它的原子核中有1个质子。
电子构型描述的是原子的电子分布情况。
电子构型可以用简单的符号表示,例如用[He]2s^2来表示氦原子的电子构型。
在这个例子中,[He]表示原子内有两个电子,它们分别在2s和2p轨道上。
因此,氦原子的原子结构表达式为2, [He]2s^2。
好的,那么继续讲原子结构表达式。
当原子内有多个电子时,电子构型中的符号会变得更加复杂。
例如,铜原子的电子构型可以表示为[Ar]3d^10 4s^1。
在这个例子中,[Ar]表示原子内有18个电子,它们分别分布在3d、4s和4p轨道上。
另外,还有一种称为简写电子构型的表示法。
简写电子构型是指只写出原子内有电子的最外层轨道,其他轨道省略。
例如,铜原子的简写电子构型为[Ar]3d^10。
原子的结构和电子构型

原子的结构和电子构型原子是构成物质的最基本单位,它由质子、中子和电子组成。
质子和中子位于原子的核心,称为原子核,而电子则围绕着原子核旋转。
原子核是原子的中心,由质子和中子组成。
质子带正电荷,质子数决定了元素的原子序数。
中子不带电荷,其数量会影响原子的质量。
电子壳是电子的运动区域,分为n个主量子能级(n=1,2,3...)。
第一主量子能级(K壳)离原子核最近,第二主量子能级(L壳)紧随其后,以此类推。
每个主量子能级可以容纳不同数量的电子。
电子轨道是电子在主量子能级中的运动路径。
每个主量子能级可以含有不同数量的电子轨道,分别以s、p、d和f来表示。
s轨道是最简单的电子轨道,每个s轨道可以容纳最多2个电子。
s轨道有一个球形的分布,出现在所有主量子能级上。
p轨道比s轨道复杂一些,每个p轨道可以容纳最多6个电子。
p轨道有三个不同的方向(xyz轴),分别以px、py、pz表示。
d轨道相对更复杂,每个d轨道可以容纳最多10个电子。
d轨道有五个不同的方向,分别以dxy、dyz、dzx、dx2-y2和dz2表示。
f轨道更加复杂,每个f轨道可以容纳最多14个电子。
f轨道有七个不同的方向,分别以fxyz、fx2-y2、fyz2、fzx2、fz3和fx3-y2表示。
当电子填充到原子中时,要遵循一定的顺序。
这一顺序可以通过洪特规则和泡利不相容原理来确定。
洪特规则指出,当电子填充到电子轨道中时,首先填充最低能级的轨道。
泡利不相容原理指出,每个电子轨道上的电子应具有相反的自旋方向。
根据这些规则,我们可以确定原子的电子构型。
以氧(O)原子为例,氧原子有8个电子,因此电子构型为1s22s22p4、这意味着氧原子的电子首先填充到1s轨道中,然后填充到2s轨道中,最后填充到2p轨道中。
电子构型对于理解原子性质和化学反应非常重要。
它可以帮助我们预测原子的化学行为和物理性质,以及解释元素周期表的排列。
第八章 原子结构(2)
电负性( P)变化
主 族 元 素
元素的原子半径变化趋势
第四周期元素 r/pm 第五周期元素
Sc 161 Y
Ti 145 Zr
V 132 Nb
Cr 125 Mo
r/pm 第六周期元素 r/pm
181 Lu 173
160 Hf 159
143 Ta 143
146 W 137
镧系元素从左到右,原子半径减小幅 度更小,这是由于新增加的电子填入外数 第三层上,对外层电子的屏蔽效应更大, 外层电子所受到的 Z* 增加的影响更小。镧 系元素从镧到镱整个系列的原子半径减小 不明显的现象称为镧系收缩。
同一周期:
短周期:从左到右,Z*显著增加。 长周期:从左到右,前半部分有Z*增加 不多,后半部分显著增加。 同一族:从上到下,Z*增加,但不显著。
2. 原子半径
在同一周期中,从左到右减小 主 由于核电荷的增加,核外电子受核的引 族 力增大,原子半径减小。 元 素 在同一族中,从上到下增加 由于主量子数 n 的增加,原子半径一般增 加。 过渡元素:从左到右r 缓慢减小; 从上到下r略有增大。
Z=56,Ba: [Xe] 6s2 。
四个量子数小结:
原子中每个电子的运动状态可以用n,l,m, ms四个量子数来描述:主量子数n决定电子层 数和主要电子的能量;角量子数l决定原子轨道
的形状,同时也影响电子的能量;磁量子数m
决定原子轨道在空间的伸展方向;自旋量子数
ms决定电子自旋的方向。四个量子数确定后,
3. 电离能
第一电离能——处于基态的1mol气态原子失去 1mol电子成为气态一价正离子所需的能量,称 为该元素的第一电离能。 同一周期中 自左至右,第一电离能一般增加,但有一 些波动。当电子结构为全充满或半充满时, 其第一电离能相应较大。 同一族中 主族,自上而下第一电离能依次减小。
原子结构与电子分布规律

原子结构与电子分布规律原子是物质的基本单位,它通常由质子、中子和电子组成。
质子和中子位于原子核中,而电子则围绕着原子核运动。
原子的结构和电子的分布规律对于解释元素的性质和化学反应机制具有重要意义。
1. 原子结构原子由原子核和围绕核旋转的电子构成。
原子核由带正电荷的质子和质量近似于质子的中子组成。
质子的数量决定了原子的元素类型,电子的数量决定了元素的化学性质。
原子核的直径与原子整体直径之比可理解为一个篮球与篮球场直径之比。
这表明原子的绝大部分空间是空的,核外电子主要存在于一定的能级中。
2. 原子序数和元素周期表原子序数是指一个原子核中的质子数量,通常表示为Z。
元素周期表按照原子序数的增加顺序排列了所有已知元素,并以简洁的方式呈现了元素的化学性质和特征。
周期表的横行称为周期,纵列称为族。
原子序数的增加导致了电子壳层的增加和电子分布规律的变化。
3. 原子的壳层和能级原子的电子分布规律可以通过壳层和子壳层的概念来解释。
壳层是指电子分布的主要能级,由数字和字母表示。
数字表示主能级,字母表示子壳层。
例如,1s表示第一个主能级上的s子能级。
原子的壳层分布规律为2、8、18、32。
第一个壳层最多容纳2个电子,第二个壳层最多容纳8个电子,第三个壳层最多容纳18个电子,以此类推。
根据能级的填充顺序,电子趋向于填充最低能级。
4. 电子的填充顺序和原子稳定性电子的填充顺序遵循通过增加质子数量和原子序数来增加电子数量的规律。
根据塞德伯格填充规则,电子首先填充低能级的壳层。
当一个壳层被填满后,电子开始填充下一个壳层。
例如,氧原子的电子配置为1s2 2s2 2p6,其中1s2是填满的K壳层,2s2和2p6分别是填充的L壳层。
当原子的填充顺序不满足填充规则时,会出现稳定性较低的不稳定原子。
5. 常见的电子分布规律有几个常见的电子分布规律对于理解元素性质和化学反应机制至关重要。
八个电子规律说明了填充到第二能级(L壳层)的最后一个电子是稳定的,因为这种配置类似于惰性气体。
原子的结构完整版PPT课件

工业领域应用
放射性同位素可用于材料 检测、无损探伤、辐射加 工等。
其他领域应用
放射性同位素还可用于科 学研究、环境保护、农业 生产等领域。
放射性同位素对环境影响及安全防护措施
对环境影响
放射性同位素衰变产生的射线会对环境和生物体造成危害,如污 染空气、水源和土壤等。
安全防护措施
为了保障人类和环境安全,需要采取一系列安全防护措施,如合 理选址、屏蔽防护、废物处理等。
放射性同位素概念及来源
放射性同位素定义
01
具有相同原子序数但质量数不同的同位素,能自发地放出射线
并转变为另一种元素。
放射性同位素来源
02
天然放射性元素和人工合成放射性元素。
放射性同位素衰变类型
03
α衰变、β衰变和γ衰变。
放射性同位素在医学、工业等领域应用
医学领域应用
放射性同位素可用于诊断 和治疗疾病,如放射性碘 治疗甲状腺疾病、PET扫 描等。
过渡元素位于周期表中间部分, 包括3~12列的元素。它们具有 多种氧化态和丰富的化学性质, 是构成众多合金和催化剂的重要
成分。
稀有气体元素
稀有气体元素位于周期表的最右 侧,它们具有稳定的8电子构型 (氦为2电子构型),化学性质 极不活泼,一般不易与其他物质
发生化学反应。
04
化学键与分子间作用 力
化学键类型及特点
分子间作用力影响物质的物理性质
分子间作用力主要影响物质的熔点、沸点、密度、硬度等物理性质。一般来说,分子间作用力越强,物质的熔点 、沸点越高,密度越大,硬度也越大。例如,氢键的存在使得水的熔沸点异常高,范德华力则主要影响由分子构 成的物质的物理性质。
05
原子光谱与能级跃迁
原子的结构和电子构型
原子的结构和电子构型原子是物质的基本单位,由原子核和围绕核运动的电子组成。
原子核位于原子的中心,由质子和中子组成。
质子带有正电荷,中子不带电荷。
电子带有负电荷,绕着原子核的轨道运动。
原子核的质量主要由质子和中子的质量决定,质子和中子的质量几乎相等。
质子的电荷为+1,中子没有电荷。
原子核的直径约为1/10,000分之1个原子直径。
电子的质量远小于质子和中子,电子的质量约为1/1836个质子质量。
电子的电荷为-1,质子和电子的电荷大小相等但异号。
电子围绕着原子核的轨道运动,根据量子力学理论,电子的位置不能确定,只能确定在一些轨道上的概率分布。
电子轨道是描述电子运动的数学函数,通常用主量子数(n)、角量子数(l)、磁量子数(m)和自旋量子数(s)来表示。
主量子数决定了电子的能级大小,角量子数决定了电子的轨道形状,磁量子数决定了电子在轨道上的位置,自旋量子数决定了电子的自旋方向。
电子的能级和轨道:根据量子力学理论,电子围绕着原子核的轨道可以分为不同的能级,能级越高,电子的能量越大。
第一个能级(n=1)最靠近原子核,能级数依次增加。
每个能级可以容纳的电子数由角量子数决定,第一个能级(n=1)只能容纳最多2个电子,第二个能级(n=2)最多容纳8个电子,以此类推。
每个能级又可以分为不同的子能级,子能级由角量子数决定,角量子数的取值范围为0到n-1、例如,第一个能级(n=1)只有一个子能级(l=0),称为s轨道;第二个能级(n=2)有两个子能级(l=0和l=1),分别称为s轨道和p轨道。
电子的填充原则:根据电子填充原则,电子首先填充低能级的轨道,然后逐渐填充高能级的轨道。
在填充同一个能级的轨道时,按照泡利不相容原理,每个轨道最多只能容纳两个电子,并且这两个电子的自旋方向相反。
根据能级和轨道的填充规律,我们可以推导出元素周期表的结构。
元素周期表是根据元素的原子序数(原子核中质子的数量)和电子构型排列的。
每个元素的电子构型可以通过填充电子的方式来确定,电子构型的不同决定了元素的化学性质和反应能力。
原子结构与电子排布
原子结构与电子排布原子结构是指构成原子的基本组成部分,包括原子核和围绕核外部运动的电子。
而电子排布则指的是电子在不同能级和轨道上的分布方式。
本文将从原子结构和电子排布的概念入手,探讨原子结构和电子排布的相关知识。
一、原子结构原子是物质的基本单位,是由带正电荷的原子核和带负电荷的电子组成。
原子核由质子和中子组成,质子带正电荷,中子不带电荷。
电子围绕在原子核的外部轨道上,并带有负电荷。
1. 原子核原子核位于原子的中心,质子和中子组成了原子核。
质子的质量和电荷均为1,中子的质量为1,不带电荷。
原子核的质量主要集中在质子和中子上,电子的质量可忽略不计。
2. 电子电子是负电荷的基本粒子,围绕在原子核的轨道上。
电子的质量很小,在计算原子质量时可以忽略。
每个原子的电子数目是不同的,决定了元素的化学性质。
电子在原子中的分布是不均匀的,分别存在于不同的能级和轨道上。
二、电子排布电子排布是指电子在原子的能级和轨道上的分布方式,遵循一定的规律。
下面将介绍两种常见的电子排布方式:布居数法和能级填充顺序。
1. 布居数法布居数法是指用数字表示每个能级中的电子数目。
第一个能级只能容纳2个电子,第二个和第三个能级可以容纳8个电子,第四个能级可以容纳18个电子。
一个完整的能级是指在前一个能级填充满后才填充下一个能级。
2. 能级填充顺序能级填充顺序是指按照一定的规则填充能级和轨道上的电子。
能级顺序是依次增加的,电子的填充规则遵循“电子优先填充低能级”的原则。
按照能级填充顺序,电子的填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s等。
三、电子排布的规律和应用电子排布遵循一定的规律,可以通过电子排布的规律来推测元素的化学性质和反应能力。
以下是几个常见的电子排布规律和应用:1. 阻塞原理根据阻塞原理,填充轨道上的电子时,电子会尽可能地占据不同的轨道。
这意味着在填充3d轨道之前,先填充4s轨道,因为4s轨道的能量较低。
2. 稳定性能级填充顺序决定了某些配置的电子排布比其他配置更稳定。
原子结构原子核与电子构型的关系
原子结构原子核与电子构型的关系原子结构、原子核与电子构型的关系原子是构成物质的基本单位,而原子结构的重要组成部分是原子核和电子。
原子核位于原子的中心,而电子则围绕原子核运动。
原子核和电子之间存在着一定的关系,这种关系决定了原子的化学性质和物理性质。
本文将探讨原子结构、原子核与电子构型之间的关系。
一、原子结构的组成原子结构主要由原子核和电子组成。
原子核是由质子和中子组成的,质子带有正电荷,中子不带电荷。
原子核位于原子的中心,占据很小的体积,但质量非常大。
电子是带有负电荷的粒子,围绕着原子核旋转,形成电子云。
二、原子核和元素的关系原子核中的质子数目决定了元素的性质。
每个元素都有一个特定的原子序数,就是其原子核中质子的数目。
例如,氢元素的原子核中只有一个质子,所以它的原子序数为1;氧元素的原子核中有八个质子,所以其原子序数为8。
原子序数不同的元素具有不同的化学性质。
三、原子核和质量数的关系原子核中还包含中子,中子的数目和质子的数目之和称为质量数。
原子的质量主要由原子核的质量决定。
质量数不同的同位素在化学性质上相同,但物理性质可能有所不同。
例如,氢元素有三种同位素,氘(D)、氚(T)和正常氢(H),它们的质量数分别为2、3和1。
四、电子的能级和电子壳层电子围绕原子核运动,其运动轨道被划分为不同的能级,每个能级可以容纳一定数量的电子。
不同的能级由数字表示,能级数字越高,能级越远离原子核,能量也越高。
每个能级又可以进一步分为不同的轨道,称为电子壳层。
在电子壳层中,每个轨道可以容纳一定数量的电子,按顺序填充。
五、电子构型和元素周期表电子的排布遵循一定的规律,即泡利的不相容原理和洪特规则等。
根据这些规律,可以确定每个元素的电子构型。
电子构型描述了一个原子中各个能级和电子壳层的填充情况。
通过电子构型,我们可以推测出元素的化学性质和反应行为。
元素周期表中的元素按照其原子序数排列,并以电子构型的方式展示。
六、原子核与电子构型的关系原子核的质子数目决定了元素的化学性质,而电子构型则决定了元素的电子行为。
原子的核外电子排布
04 核外电子排布的实例
氢原子的核外电子排布
1
氢原子只有一个电子,排布在1s轨道上。
2
氢原子是所有原子中最简单的,其核外电子排布 遵循泡利不相容原理和能量最低原理。
3
氢原子核外电子排布的能量状态由主量子数n决 定,本例中n=1。
轨道表示式
轨道表示式是另一种表示原子核外电 子排布的方法,它通过图形的方式表 示电子云的分布和电子的运动状态。
轨道表示式的优点是可以直观地展示 电子云的分布情况和电子的运动状态, 有助于理解电子的行为和性质。
能级交错现象
能级交错现象是指在实际的原子核外电子排布中,有些电子 会出现在比其理论能级高的能级上,这种现象称为能级交错 。
。
05 核外电子排布的意义
对元素性质的影响
决定元素的化学性质
核外电子排布决定了元素的化学性质,因为元素的化学反应主要涉及电子的得失或偏移。
元素周期表中的位置与性质
同一周期内,随着原子序数的增加,核外电子数增多,电子填充到更高能级,元素的非金属性增强,金属性减弱。
对周期律的解释
周期表的形成
核外电子排布规律是形成元素周期表的基础,周期表中元素的排列顺序是根据核外电子排布来确定的 。
最低。
当电子从高能级跃迁到低能级时, 会释放出能量,这个能量可以通
过发射光子的方式释放出去。
洪特规则
洪特规则指出,在任何一个原子中,对于同一 能级上的电子,总是优先以等价的方式占据不 同的轨道。
这个规则的原因是,当电子以等价的方式占据 不同的轨道时,它们之间的相互作用是最小的, 从而使得整个原子的能量最低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子在原子中处于不同的能层
电子在原子中如何分布? 电子在原子中如何分布?
每个圆圈表示一个能级,每一行对应一个能层, 每个圆圈表示一个能级,每一行对应一个能层,各圆圈连接 线方向表示随核电荷数递增而增加的电子填入能级顺序
电子在原子中如何分布? 电子在原子中如何分布?
能级交错
?
E3d>E4s
钻穿效应和屏蔽效应
原子核外电子排布规律
规则1: 规则 :能量最低原理
顺序, 按1s→2s → 2p → 3s → 3p → 4s → 3d顺序,先填充 顺序 能量最低的轨道。
规则2: 规则 :泡利不相容原理
一个轨道最多仅能填充两个电子, 一个轨道最多仅能填充两电子,且必须自旋相反
规则3: 规则 :洪特规则
在能量相等的轨道上,自旋平行的电子数目最多时, 在能量相等的轨道上,自旋平行的电子数目最多时,原 子的能量最低。所以在能量相等的轨道上, 子的能量最低。所以在能量相等的轨道上,电子尽可能 自旋平行地多占不同的轨道。 自旋平行地多占不同的轨道。
一些元素的基态电子排布式
H P Na O
1 15 11 8
1s 1s22s22p63s23p3 1s22s22p63s1 1s22s22p4
2p 2s 1s
多电子原子轨道能级
电子在原子中如何分布? 电子在原子中如何分布?
s能级的原子轨道图 ns能级的各有 个轨道 呈球形 能级的各有1个轨道 能级的各有 个轨道,呈球形
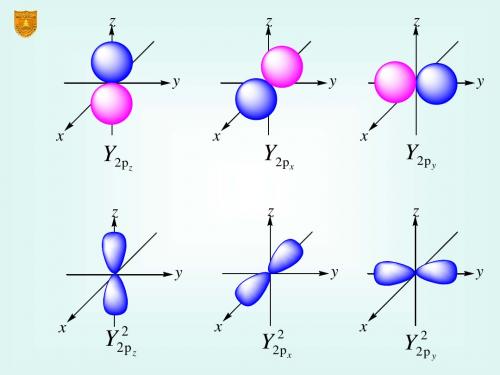
p能级的原子轨道图 能级的原子轨道图 np能级的各有 个轨道,呈哑铃 能级的各有3个轨道 能级的各有 个轨道, 形, 3个轨道相互垂直 个轨道相互垂直
原子的结构和电子构型
原子的结构
原子示意图:密集的、带正电荷的原子核包含了原子的大部 原子示意图:密集的、 分质量, 分质量,它被带负电荷的电子包围
电子在原子中如何分布? 电子在原子中如何分布?
原子核外的电子是分层排布的,每一层都 原子核外的电子是分层排布的, 可以叫做能层,可以分为K.L.M.N.O.P.Q这 可以叫做能层,可以分为 这 7个能层,每个能层最多能排 2个电子,每 个能层, 个能层 每个能层最多能排2n 个电子, 个能层又可以为多个能级。 个能层又可以为多个能级。 能级的划分是因为电子能量不同,一般来 能级的划分是因为电子能量不同, 电子先排在能量较低的轨道, 说,电子先排在能量较低的轨道,再排能量 高的轨道
