络合物(配合物)
络合物_百度百科

[编辑本段]概述络合物 complex compound配位化合物的旧称。
按英文名称,络合物有两种含义:一种是指分子中含有配位键的化合物;另一种是不含配位键,而由特有的相互反应形成的聚集体,例如淀粉与碘形成的蓝色物质,抗原与抗体分子的结合物等。
前一种化合物按照1980年中国化学会《无机化学命名原则》应称“配位化合物”。
后一种宜称复杂化合物,简称复合物。
络合物之一络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。
配合物又称络合物。
络合物的组成以[Cu(NH3)4]SO4为例说明如下:(1)络合物的形成体,常见的是过渡元素的阳离子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
(2)配位体可以是分子,如NH3、H2O等,也可以是阴离子,如CN-、SCN-、F-、Cl-等。
(3)配位数是直接同中心离子(或原子)络合的配位体的数目,最常见的配位数是6和4。
络离子是由中心离子同配位体以配位键结合而成的,是具有一定稳定性的复杂离子。
在形成配位键时,中心离子提供空轨道,配位体提供孤对电子。
络离子比较稳定,但在水溶液中也存在着电离平衡[1],例如:[Cu(NH3)4]2+=Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S时,容易生成CuS(极难溶)络合物之二含有络离子的化合物属于络合物。
我们早已知道,白色的无水硫酸铜溶于水时形成蓝色溶液,这是因为生成了铜的水合离子。
铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4·5H2O就是一种络合物,其组成也可写为[Cu(H2O)4]SO4·H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
在硫酸铜溶液里加入过量的氨水,溶液由蓝色转变为深蓝。
2-3 配合作用

三、地下水中溶解组分的存在形式
在地下水中,溶解组分以各种形式存在,不同的组分存在形 式可以具有不同的特性。三种溶解组分的存在形式:
单一离子形式: Ca2+, Mg2+, Na+, K+, Cl-, F络阴离子形式: HCO3-, SO42- , CO3 2 -, NO3 2 - 复杂络合物(离子对):有机,无机
用K1、K2、K3…Kn表示。
M L ML ML L ML2
ML K1 M L
K2
ML2 MLL
.
.
. MLn1 L MLn
Kn
MLn MLn1 L
此时,同一级的K稳与K不稳不是倒数关系。
显然,上述体系中形成各级络合物的平衡浓度为:
ML K1 M L ML2 K1K2 L2
m Ca2+ : 游离Ca2+的浓度(mol/L); m CaHCO3-, m CaCO30, m CaSO40 : 分别为Ca2+与HCO3-
CO32-和SO42-结合的离子对浓度。
通常的水分析结果只能代表浓度m Ca2+(T),游离 离子及离子对浓度是未知数。
2.1 络合物对矿物溶解度的影响
例:在标准状态下,如考虑CaSO40的影响,那么石膏的 溶解度是多少?
例1.6: 某水分析结果见表(离子含量单位为mg/l),t=10℃。求各 溶解组分存在形式的分配,以及水与方解石和白云石溶解反 应的饱和指数。
组分 浓度(mg/L)
组分 浓度(mg/L)
Na+
Ca2+
Mg2+
K+
325
136
63
9
HCO3-
SO42-
配合物的定义和组成(精)

8
4、配位平衡与氧化还原平衡 ①、在配合物溶液中加入氧化剂或还原剂 在配合物溶液中加入氧化剂或还原剂,使中 心离子或配体发生氧化还原反应,从而使 配离子离解。 ②、氧化还原平衡体系中加入配体: 往氧化还原平衡体系中加入配体,可使其 中的氧化型物质或还原型物质生成配离子, 从而改变电对物质氧化还原性的相对强弱。
9
5、配位平衡之间的相互转化
平衡时
ML L ML L
/ 11 //
/
K K K
θ j
f(ML )
//
/K
f(ML/ )
结论:K稳(ML// ) ↗,K稳( ML/ ) ↘,则Kθ↗。所 以反应总是由稳定常数小的向稳定常数大的 配合物方向转化。
10
4
二、配位平衡移动 1、 配体浓度对配位平衡移动的影响 2、 配位平衡与酸碱平衡 通式: MLn+nH+ nHL+M (其中:L=F-、SCN-、CN-、NH3) 结论: K 稳 、 Ka越小, K 就越大,配离子越 容易解离。称之为配体的酸效应。
5
注意:并非酸度越低越好,由于反应 [FeF6]3-+3OH-Fe(OH)3+6F- 同样也使配离子解离。这种现象称金属离 子的水解效应。 结论:由于存在着配体的酸效应和金属离 子的水解效应,所以配离子只能在一定的酸 度范围内稳定存在。
③、当为同类配体时,则按配位原子英文字 母顺序排列;若配位原子相同,则将含较少 原子数的配体排在前。 三、配位平衡常数 1、稳定常数与不稳定常数 K稳为配离子在该温度下的稳定常数,其值 愈大,则配离子愈稳定。
1 K K
稳
不稳
3
2、平衡常数的应用: ①、可比较配离子的稳定性。 对同类型配离子(配位数相同),相同条 件下,K稳越大则配离子越稳定。 ②、计算配位平衡体系中 [M] 、 [L] 与 [ML] 。
第七章 配位化合物

15:03
20
类别 配酸
化学式 H2[SiF6]
系统命名 六氟合硅(Ⅳ)酸
H2[PtCl6]
配碱 [Ag(NH3)2]OH [Cu(NH3)4]SO4 [CrCl2(H2O)4]Cl 配盐 [Co(NH3)5(H2O)]Cl3
六氯合铂(Ⅳ)酸
氢氧化二氨合银(Ⅰ) 硫酸四氨合铜(Ⅱ) 氯化二氯•四水合铬(Ⅲ) 氯化五氨•一水合钴(Ⅲ)
常见配位数为2、4、6。个别的也有奇数的,如: Fe(CO)5、[TiF5]3-
15:03
10
(四)配离子的电荷 配离子的电荷=中心离子电荷+配体电荷
Fe(CN)6
+3
3
Co(H 2O)2 Cl 4
+2 -1
2
反过来,根据配离子的电荷数和配体的电荷 数,也可以推算出中心离子的电荷数。
15:03
23
二、配合物的空间构型
(一) 配位数为2:sp杂化 ,直线型
中心离子Ag+的结构 4d 5s 5p
[Ag(NH3)2]+的结构
4d
sp杂化
5p
H3N
NH3
结果: 在NH3的作用下,Ag+的1个S和1个P轨道杂化,形成
直线型SP杂化轨道。N的两个孤对电子进入空的sp杂化轨道形 成配合物。[Ag(NH3)2]+形成之前和之后, 中心原子的d电子排布 没有变化 。配合物是直线型。
15:03
8
单齿配体:只含有一个配位原子的配体 多齿配体:含有两个或两个以上配位原子的配体 (多为有机分子)
en:
N H 2CH 2CH 2 N H 2
EDTA :
配合物复习解析

M
性分子,则提供5个π电子,若看作C5H5—,则提供6个
π电子,该负电荷可看作中心体给C5H5 1个电子所得。
第二种:
,C5H5提供3个π电子,表示成
( η3_C5H5 )M。
第三种:
M
,C5H5提供1个电子,形成σ键
H
,表示成η1 C5H5或σ C5H5。
几种常见配体的结构和名称
M←SCN 硫氰酸根 (SCN) M←NCS 异硫氰酸根 (NCS)
乙二胺为双齿配体,2个N个提供一对孤对 电子与Cd2+形成配位键,犹如螃蟹的螯把中 心原子钳住一样,从而形成环状结构,将中 心原子嵌在中间。
少数无机
物,也可形 成螯合物, 如三聚磷酸 钠与Ca2+可 形成螯合物。 (链接到 10.2-磷的含 氧酸盐)
(3).多核配合物
一个配位原子与二个中心离子结合所成的配 合物称多核配合物.
• 吉布斯方程: ΔG = ΔH - TΔS 反应的焓变项ΔH = -13 kJ/mol (很小) (配合物的配位原子和配位数未变) 反应的熵变项 TΔS = 54 kJ/mol 反应的熵变很大(熵增大)是螯合效应的基本原 因(熵增大即混乱度增大,是反应产物得到更多小分 子“氨”所致) 大环效应与此类似。
M←NO2 硝基 (NO2) 来自HO - NMO←2ONO 亚硝酸根 (ONO) 来自H - ONO
• π键配位体:利用成键的π电子和反键的空 轨道同时和金属离子配位的配位体
一些常见的配体:
(1) 单基配体:X-:F-、Cl-、Br-、I-、H2O 、 CO 、NO 、C5H5N 、OH- •规律: H2O作配体时,水分子的个数一般是离 子电荷的2倍。 但+2价离子常为[M(H2O)6]2+,如: [Fe(H2O)6]2+ [Co(H2O)6]2+
实验十 配合物(络合物)磁化率的测定 - 副本
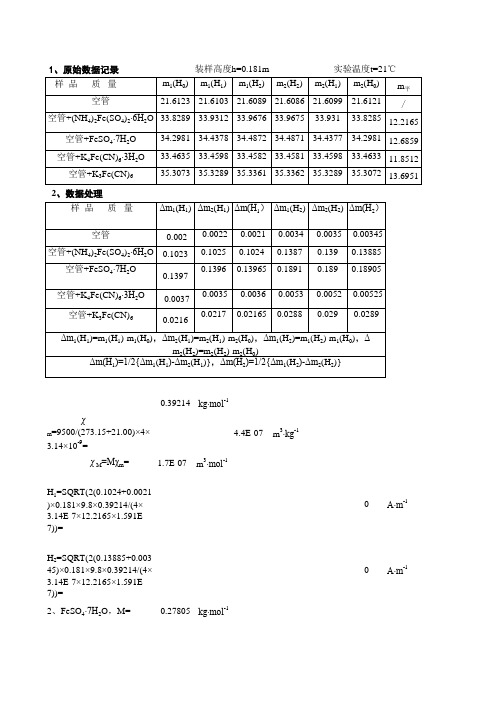
1、原始数据记录2、数据处理0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg-1χM =Mχm =1.7E-07m 3∙mol-1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -1 H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.6E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.6E-07m 3∙mol -1 χM =1/2(1.473+1.469)×10-7= 1.6E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=5.2E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=31.0161n= 4.65827≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-3E-09装样高度h=0.181m 实验温度t=21℃12(H 0)χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-2E-09 χM =1/2(-2.535-2.234)×10-7= - 2.385×10-9m 3∙mol -1<0n=04、K 3Fe(CN)6,M=0.32926kg∙mol -1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=2.9E-08 χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=2.9E-08χM =1/2(2.708+2.709)×10-8= 2.9E-08m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=2.1E-23n(n+2)=(u m /u B )2=(2.089×10-23/9.274×10-24)2=5.06883n= 1.4635≈11、原始数据记录2、数据处理1、莫尔盐, M=0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg -1χM =Mχm =1.7E-07m 3∙mol-1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m-1H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1装样高度h=0.138m 实验温度t=22.5℃12(H 0)χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.8E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.8E-07m 3∙mol -1 χM =1/2(1.473+1.469)×10-7= 1.8E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=5.2E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=31.0161n= 4.65827≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-1E-09 χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-1E-09 χM =1/2(-2.535-2.234)×10-7=-1E-09m 3∙mol -1<0n=04、K 3Fe(CN)6,M=0.32926kg∙mol -1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=3.9E-08 χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=3.8E-08 χM =1/2(2.708+2.709)×10-8= 3.9E-08m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=2.4E-23 n(n+2)=(u m /u B )2=(2.089×10-23/9.274×10-24)2=6.69553n=1.77408≈11、原始数据记录2、数据处理12(H 0)装样高度h=0.121m实验温度t=27.2℃1、莫尔盐, M=0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg -1χM =Mχm =1.7E-07m 3∙mol -1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -1 H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.7E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.7E-07m 3∙mol -1 χM =1/2(1.473+1.469)×10-7= 1.7E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=5E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=28.914n= 4.46937≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-3E-09 χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-2E-09 χM =1/2(-2.535-2.234)×10-7=-3E-09m 3∙mol -1<0n=04、K 3Fe(CN)6,M=0.32926kg∙mol -1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=3.4E-08 χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=3.4E-08 χM =1/2(2.708+2.709)×10-8= 3.4E-08m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=2.3E-23n(n+2)=(u m /u B )2=(2.089×10-23/9.274×10-24)2=5.92154n= 1.63088≈11、原始数据记录2、数据处理装样高度h=0.121实验温度t=27.2℃1、莫尔盐, M=0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg-1χM =Mχm =1.7E-07m 3∙mol -1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m-1 H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.7E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.7E-07m 3∙mol -1 χM =1/2(1.473+1.469)×10-7= 1.7E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=5E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=28.914n= 4.46937≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-3E-09 χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-2E-09 χM =1/2(-2.535-2.234)×10-7=-3E-09m 3∙mol -1<0n=04、K 3Fe(CN)6,M=0.32926kg∙mol -1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=3.4E-08 χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=3.4E-08 χM =1/2(2.708+2.709)×10-8= 3.4E-08m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=2.3E-23 n(n+2)=(u m /u B )2=(2.089×10-23/9.274×10-24)2=5.92154n=1.63088≈11、原始数据记录12(H 0)装样高度h=0.181m 实验温度t=27.0℃2、数据处理1、莫尔盐, M=0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg -1χM =Mχm =1.7E-07m 3∙mol -1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -1 H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m-12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.6E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.5E-07m 3∙mol -1χM =1/2(1.473+1.469)×10-7= 1.6E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=4.8E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=26.9671n= 4.28839≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-3E-09 χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-4E-09 χM =1/2(-2.535-2.234)×10-7=-3E-09m 3∙mol -1<0n=04、K 3Fe(CN)6,M=0.32926kg∙mol -1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=4.1E-0812(H 0)χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=4.1E-08 χM =1/2(2.708+2.709)×10-8= 4.1E-08m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=2.5E-23 n(n+2)=(u m /u B )2=(2.089×10-23/9.274×10-24)2=7.09137n=1.84453≈11、原始数据记录1、莫尔盐, M=0.39214kg∙mol -1χm =9500/(273.15+21.00)×4×3.14×10-9=4.4E-07m 3∙kg-1χM =Mχm =1.7E-07m 3∙mol -1H 1=SQRT(2(0.1024+0.0021)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m -1H 2=SQRT(2(0.13885+0.00345)×0.181×9.8×0.39214/(4×3.14E-7×12.2165×1.591E-7))=0A∙m-12、FeSO 4∙7H 2O ,M=0.27805kg∙mol -1χM1=(0.13965+0.0021)/(0.1024+0.0021)×12.2165/ 12.6839×278.05/392.14×1.591E-7=1.6E-07m 3∙mol -1 χM2=(0.18905+0.00345)/(0.13885+0.00345)×12.2165/12.6839×278.05/392.14×1.591E-7=1.6E-07m 3∙mol -1 χM =1/2(1.473+1.469)×10-7= 1.6E-07m 3∙mol -1u m =SQRT(3KT χM /N 0u 0=3×1.38E-23×(273.15+21.00)×1.472E-7/(6.023E+23×4×3.14E-7))=4.9E-23 n(n+2)=(u m /u B )2=(4.866×10-23/9.274×10-24)2=28.4248n=4.42446≈43、K 4Fe(CN)2∙3H 2O ,M=422.39:0.42239kg∙mol -1χM1=(-0.0036+0.0021)/(0.1024+0.0021)×12.2165/11.8512 ×422.39/392.14×1.591E-7=-3E-09 χM2=(-0.00525+0.00345)/(0.13885+0.00345)×12.2165/11.8512×422.39/392.14×1.591E-7=-3E-0912(H 0)装样高度h=0.178m 实验温度t=27.5℃χM=1/2(-2.535-2.234)×10-7=-3E-09m3∙mol-1<0n=04、K3Fe(CN)6,M=0.32926kg∙mol-1χM1=(0.02165+0.0021)/(0.1024+0.0021)×12.2165/12.69505×329.26/392.14×1.591E-7=-3E-09 χM2=(0.0289+0.00345)/(0.13885+0.00345)×12.6165/12.69505 ×329.26/392.14×1.591E-7=-2E-09 χM=1/2(2.708+2.709)×10-8=-3E-09m3∙mol-1u m=SQRT(3KTχM/N0u0=3×1.38E-23×(273.15+21.00)×2.71E-8/(6.023E+23×4×3.14E-7))=#NUM! n(n+2)=(u m/u B)2=(2.089×10-23/9.274×10-24)2=#NUM!n=#NUM!≈1J∙T-1m3∙mol-1m3∙mol-1m3∙mol-1 m3∙mol-1J∙T-1J∙T-1m3∙mol-1 m3∙mol-1m3∙mol-1 m3∙mol-1J∙T-1J∙T-1m3∙mol-1 m3∙mol-1m3∙mol-1 m3∙mol-1J∙T-1J∙T-1m3∙mol-1 m3∙mol-1m3∙mol-1 m3∙mol-1J∙T-1J∙T-1m3∙mol-1 m3∙mol-1m3∙mol-1m3∙mol-1 J∙T-1J∙T-1m3∙mol-1 m3∙mol-1m3∙mol-1 m3∙mol-1J∙T-1。
结构化学3

b. 组态d4 d5 d6 d7 的电子排布则随场强变化
即: 弱场——高自旋
强场——低自旋
2). 正四面体场 Tetrahedral complex
由于分裂能仅为正八面体场的4/9,一般小于成 对能,因而多是高自旋络合物
3). 实验表明: 络合物的△=10000~30000cm-1,则d -d 跃迁的频率在近紫外和可见光谱区,过渡 金属络合物一般都有颜色
1923-1935 贝特Bethe 范弗莱克VanVleck 模型: 静电作用 M———— L
把M和L的作用看作类似离子晶体中正、负离 子间的静电作用,中心离子处在配体形成的 场中。
一、d轨道能级的分裂 原来简并的5个d轨道由于配体的静电场存在,由于 配体形成场的对称性不同,5个伸展方向不同的d轨道 受到不同程度的影响,其能量发生不同程度的变化, 从而引起d轨道能级分裂。
MxLn
spd外轨杂化,高自旋; dsp内轨杂化,低自旋。 配位场理论(LFT)
分子轨道理论(MOT)
配位场理论是在晶体场理论的基础上, 将分子轨道理论的共价成键作用容纳进 去,并引进多个可调节的参数,这种经 过修改的晶体场理论称为配位场理论, 他是晶体场理论和分子轨道理论的结合。
晶体场理论(CFT)
正四面体场:
dz2
2 r 2
dx2-y2
dxz, dyz, dxy
r 2 斥力大
斥力小
t2 Es e Td场
在Td场中d轨道能级的分裂 注:四面体无对称中心,故不含角标g
4 则: E E 9
t2 e t
0
解得:
2 E 5
t2
t
3E 2E 0
t2 e
3 E 5
配位化合物

dsp2
5 6 d2sp3 dsp3 sp3d2
正方形
三角双锥形
[Ni(CN)4]2[Fe(CO)5] [CoF6]3[Co(CN)6]320
正八面体形
(二)内轨型和外轨型 内轨配键:由次外层 (n-1)d 与最外层 ns、np 轨道杂化 所形成的配位键。 内轨型配合物:由内轨配键形成的配合物。
如 [Fe(CN)6]3-、[Co(NH3)6]3+、[Ni(CN)4]2外轨配键:全部由最外层 ns、np、nd 轨道杂化所形成的 配位键。
9
(三)配位数
1 个中心原子所具有的配位键数目,称为该中心原子的 配位数。常见配位数是 6 和 4。
若配合物中的所有配体都是单齿配体,则配位数等于配 体数;若其中某些配体含有 2 个或 2 个以上配位原子,则 配位数大于配体数。例如: [Cr(NH3)6]3+ 配位数 6,配体数 6
[Cr(H2NCH2CH2NH2)3]3+ 配位数 6,配体数 3
11
2. 若配体不止一种,则先无机,后有机;在无机或有机配 体中,先离子,后分子;不同配体之间可用圆点隔开。 化学式书写方式为:[M-无机阴离子-无机分子-有机物]
其命名方式为:无机阴离子-无机分子-有机物-合-金属(氧 化数)
例如:[CoCl(NH3)3en]2+ 一氯· 三氨· 乙二胺合钴(Ⅲ)离子 同类配体按配位原子元素符号的英文字母顺序排列。 例如:[Co(NH3)5H2O]3+ 五氨· 一水合钴(Ⅲ)离子
28
例 已知 [Mn(CN)6]4- 的磁矩 实测=1.57 B.M.,请推测这 个配合物的空间构型和稳定性。 解 由配位数为 6 可知,需要 6 个空杂化轨道,杂化方式 可能为 d 2s p 3 或 s p 3d 2 已知 Mn2+ 3d 5 根据表 实测=1.57 B.M.,与 1 个单电子相当
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C— O—
●●
在螯合物中,中心离子和鏊合剂的分子比一般不叫配位数,而叫鏊 合比。例如:一个中心离子和一个配体结合,螯合比为1∶1。 例如: 在[Zn(en)2]中,Zn2+:en的螯合比为1∶2, 在[Zn(EDTA)]中,Zn2+:en的螯合比为1∶1
Hale Waihona Puke 9.2.2螯合物的性质 9.2.2螯合物的性质
螯合物比普通络合物要稳定得多,五元环或六元环的螯合物最为稳定, 四元环、七元环和八元环的螯合物比较少见,形成螯环的数目越多,稳定 性也越大。 金属螯合物不仅有较高的稳定性,还常常是难溶于水的或带有特征颜 色的化合物,在分析工作中利用这一特点可作为离子的分离和检验试剂。
例如:丁二酮肟是鉴定Ni2+的特效试剂,它与Ni2+在稀氨溶液中生成樱桃红色 的沉淀,生物学中测定蛋白质用的二缩脲反应也是利用二缩脲与Cu 2+生产特殊的兰 色螯合物。 生物中的血红素是Fe2+的螯合物,叶绿素是Mg2+离子的螯合物,配体都是卟啉。 土壤中直接施加磷肥,P会和Fe3+,Al3+等金属离子形成难溶解的AlPO4 FePO4,不能被作物吸收。当施加磷肥后,在施加有机肥,其中的羟基酸,如柠檬 酸、酒石酸等与Fe3+,Al3+等金属离子形成易溶解的螯合物,可提高可溶性P的肥效。 微量元素在人体内几乎全部以螯合物的形式吸收和利用。
带入稳定常数式 [ Ag(NH3)2]/[Ag+][NH3]2=(0.01 -x)/ x(4.0+2x )2=1.07×107 x=5.8 ×10—11molL— 结论 在AgNO3溶液中NH3过量的越多,所剩余的Ag+越少。 解此题时可知,由于Kf比较大,所以先假定溶液中的AgNO3与过量NH3完全生成[ Ag (NH3)2]。然后再按此络离子的解离进行计算。 (2)络合与沉淀交错 例1:在上例的溶液中加入KCl(s),使Cl—(aq)的浓度为0.01 molL—时,能否生 成Ag Cl沉淀? 解:在此发生了络合平衡和沉淀的多重平衡,即NH3和Cl—同时竞争Ag+。 Ag++2 NH3 [ Ag(NH3)2] + Cl— Ag Cl 可以写成 [ Ag(NH3)2]+ Cl— 2 NH3+ Ag Cl 已知溶液中c(Cl—)=0.01 molL—,即可求出离子积Q 在0.01molL—NH3溶液中: Q= c(Cl—) c( Ag+ )=9.3 ×10—6 ×0.010=9.3 ×10—8> Ksp 所以能生成沉淀。
第一步:Cu2++NH
3
[Cu(NH3)] [Cu(NH3)2] [Cu(NH3)3] [Cu(NH3)4]
K1=[Cu(NH3)]/[Cu2+][NH3] = 1.4×104(mol/l)—1 第二步: [Cu(NH3)]+ NH 3 第三步: [Cu(NH3)2]+ NH3 第四步: [Cu(NH3)3]+ NH3 K2=[Cu(NH3)2]/[Cu(NH3)][NH3] = 3.1×103(mol/l)—1 K3=[Cu(NH3)3]/[Cu(NH3)2][NH3] = 7.7×102(mol/l)—1 K4=[Cu(NH3)4]/[Cu(NH3)3][NH3] =1.4×102(mol/l)—1
在4.0molL—NH3溶液中: Q= c(Cl—) c( Ag+ )=5.8 ×10—11 ×0.010 =5.8 ×10—13< Ksp 所以不生成沉淀。 例2:欲将0.01molAgI(s)分别溶解在1.0L的NH3溶液和KCN溶液中,它们的浓度至少应为 多大? 解:AgI溶解在NH3中有多重平衡 AgI+ NH3 [ Ag(NH3)2]+I— K= [ Ag(NH3)2][I—]/[NH3] 将其分子分母同乘以[Ag+],可得 =Kf×Ksp 要使欲将0.01molAgI(s)完全溶解须维持I—的浓度为0.010molL—1,此时 至少取NH3 浓度 为
总稳定常数是逐级稳定常数之积。 即Kf=K1× K2 × K3 × K4 且K1> K2 > K3 > K4 做一般计算时,只考虑Kf
9.3.2有关稳定常数的计算 9.3.2有关稳定常数的计算
(1)根据Kf计算络合体系中有关离子的浓度 例如:在0.01mol/l的AgNO3溶液中加入过量氨水使生成[Ag(NH3)2]+络离子,当 溶液中有过量NH3的浓度为0.01mol/l或4.0mol/l时,分别计算溶液中Ag+的浓度。 解: Ag+(aq)+2NH3 [ Ag(NH3)2] 开始浓度/mol L— 0 0.010 0.010 平衡浓度/mol L— x 0.010+2x 0.010 - x 带入稳定常数式 [ Ag(NH3)2]/[Ag+][NH3]2=(0.01 - x)/ x( 0.010+2x )2 =1.07 ×107 在过量NH3存在下, [ Ag(NH3)2] 的解离很小,故可做近似处理, 0.010-x ≈0.01, 0.010+2x ≈0.01。即 (0.01 -x)/ x( 0.010+2x )2 ≈0.01/ x0.0102=1.07 ×107 解得x= [Ag+]=9.3 ×10—6molL— [Ag+]占加入量为9.3 ×10—6/0.01=9.3 ×10—4 在过量4.0 mol L— NH3存在下,做近似处理, [ Ag(NH3)2] =0.01 -x ≈0.01mol L [NH3]=4.0+2 x
9.2螯合物 9.2螯合物
9.2.1螯合物的定义 9.2.1螯合物的定义
前面见到的络合物中,配体如F 、—OH 、CN 、 —SCN 、 — NO2 、NH3、H2O等全以一个配位原子与中心离子(原子)结合,因此这类配 体叫单齿(单基)配体。 如果一个配体上有两个配位原子同时与中心离子结合时,这个配体叫二齿配体。 — — 如C2O4 、H2N—CH2 —CH2 —NH2、 H2N —CH2 —COO 有一些络合物是有机化合物作配体,配位原子两个或两个以上,并且形成闭合的 环状,象这种含有两个以上配位原子并且能与中心离子(原子)进行多点结合的配 体,叫多齿配体。形成的络合物叫螯合物。 例如: 中 H2N—CH2 —CH2 —NH2
G 2 G G G sp G 0.G × 0.01 01 G (1.5 × 10 16)(1.07 × 10 7) G
=
=250mol/L 这么大的浓度当然是不可思议了,所以AgI(s)不能溶于氨水中。 对于AgI(s)溶于KCN时,可有 AgI+2 CN[ Ag( CN)2]+I—
K=
[Ag(CN) 2 ][I ] [CN ]
例如: [Pt (NH2)(NO2)(NH3)2]命名为氨基硝基二氨合铂(Ⅱ) 6.有时一个配体可以用不同原子同中心与中心原子相结合,命名时配体的名字也不同。 例如:—SCN— 配位原子为“S”,叫“硫氰酸根” — — NCS 配位原子为“S”,叫“异硫氰酸根离子” — —ONO 配位原子为“O”,叫“亚小硝酸根离子” — — NO2 配位原子为“N”,叫“硝基”
以M表示金属离子,L代表配体,络合反应可写为: M+N MLn 平衡常数Kf= [MLn] [M][L]n K 表示生成常数,或叫稳定常数。有时也用稳定常数的倒数表示络合物的稳定性,叫
f
不稳定常数,用Kd来表示。
Kd=1/Kf 例如:Cu2++4NH3 [Cu(NH3)4] Kf=[Cu(NH3)4]/[Cu2+][NH3]4 = 1.67×1012(mol/l)—4 Kf为实验平衡常数,是有量纲的,但一般的教科书中习惯上都要省略。 Kd=2.41×10—13 (mol/l)4 相同类型的络合物Kf越大,在水溶液中越稳定。常见络合物的稳定常数列于附 录中。 事实上,络合物是分步形成的,每一步都有它的逐级稳定常数。例如[Cu (NH3)4]的形成。
2
= K f K sp
[Ag(CN) 2 ][I ] [CN—]= K sp K f
=
0.01× .01 0 ( .25×1021)( .5×1016) 1 1
=2.4×10—5mol/L
由于溶解时消耗掉0.020mol/L CN ,加上维持平衡所需要的2.4×10 5 mol/L CN 。 因此,在1L溶液中要求KCN的浓度为0.02+0.000024 mol/L 结论:络合反应与沉淀反应交叉而发生多重平衡时,反应方向总是向着生成更难溶 解的沉淀或更稳定的络离子方向进行。 (3)络合与络合平衡(络离子之间的转化) — 例:在0.10 mol/LFeSCN红色溶液中加入NaF固体,需要多大浓度的F 才能使溶 液变成无色的FeF2+ ? — — 此反应是SCN 与F 竞争Fe2+
—
—
—
—
—
M代表金属离子,两个配位原子和 心离子结合形成五元环。
M
●●
O—C=O M O—C=O
●●
草酸根离子,有两个配位原子,和金属离子形成五员环
—
●●
O—C
●●
C—O— N—CH2 —CH2 —N
●●
●●
乙二胺四乙酸根离子, 共有6个配位原子,和Ca、 Mg等离子结合,形成5个五员环。
—
O—C
络合物(配合物)
9.1络合物的配位结构 9.1络合物的配位结构
9.1.1络合物的组成 9.1.1络合物的组成
络合物一般是由一个金属离子或原子和围绕在它周围的几个阴离子或极性 分子所组成的。这个金属离子叫中心离子,按一定空间位置排列在中心离子周 围的其它离子或极性分子叫配体。中心离子和若干个配体所构成的单位叫络合 单元。在化学式上用方括号括起来,表示络合物的内界,络合单元可以是电中 性的,也可以是带电荷的,带电荷者叫络离子,络离子同带相反电荷的离子组 成中性的盐时也叫络合物。例如: 中心离子 [Ag(NH3)2]Cl K3[Fe(CN)6] [Ni(CO)4] [Co(NH3 )3Cl3] [Ag(S2O3)2]3- Ag+ Fe3+ Ni Co3+ Ag+ 外界 Cl - K+ 内界 络合单元
