稳定性试验方案
注射用重组人生长激素稳定性试验方案

注射用重组人生长激素稳定性试验方案一、研究目的本试验旨在评估注射用重组人生长激素的稳定性,以确定其在一定条件下的质量保持期限。
二、试验方法1.试验样品-收集符合规定的注射用重组人生长激素样品,确保其符合药品质量标准。
-样品应避免暴露在光线和高温等有害因素下,同时在试验过程中避免反复冻融。
2.试验条件-温度:在25°C±2°C的条件下进行试验。
-湿度:相对湿度控制在60%±5%。
-光照条件:采用黑暗遮光的环境,避免光照影响。
-储存容器:试验样品储存在由玻璃或塑料制成的密封容器中。
3.试验项目-化学稳定性:包括药物活性、纯度、杂质含量、溶解度等方面的评估内容。
-物理稳定性:包括药物的颜色、外观、稠度等方面的评估内容。
-微生物稳定性:包括细菌、真菌等微生物污染的评估。
4.试验过程-样品储存在不同时间点下,在试验结束时进行检测。
-化学稳定性:使用适当的化学分析方法,对样品进行相关化学指标的测定。
-物理稳定性:通过观察样品的外观、颜色、气味等特征判断其稳定性。
-微生物稳定性:使用适当的微生物检测方法,对样品进行微生物污染的评估。
5.数据分析-根据试验结果,综合分析药物在不同条件下的稳定性表现。
-结合药物质量标准,确定药物的质量保持期限。
三、质量控制2.试验操作:试验过程中严格按照标准操作规程进行,保证数据的准确性和可靠性。
3.试剂和仪器设备:选择合适的试剂和仪器设备,保证试验结果的准确性和可靠性。
4.数据分析:对试验结果进行统计分析和合理解释。
四、安全防范措施1.安全操作:试验过程中保持良好的个人卫生,严格遵循实验室的操作规程。
2.废弃物处理:将试验所产生的废弃物进行分类和正确处理,遵循相关的废弃物处理规范。
通过以上试验方案,可以对注射用重组人生长激素的稳定性进行评估,并确定其质量保持期限,以保证药物在使用过程中的有效性和安全性。
同时,该方案还包括了质量控制和安全防范措施,以确保试验过程的可靠性和安全性。
留样观察及稳定性试验(GMP)方案

留样观察
留样观察要填写留样申请单和留样登记表。
留样申请单内容包括:
文件编号、代号、品名、批号、规格、日期、留检样 品的法定样及实验样、需要的样品量及理由、申请人签 名留样员签名和填写申请单日期等。
留样登记表内容包括:
文件编号、日期、代号、品名、批号、数量单位、留 样量及经手人等
3
留样观察
留样观察还要填写留样观察记录,并建立 留样台帐。
2、质量管理部门应开展对原料、中间产品 及成品质量稳定性的考察,根据考察结果 来评价原料、中间产品及成品的质量稳定 性,为确定物料储存期和有效期提供数据。 3、稳定性试验的内容:
(1)加速破坏试验,预测样品的有效期; (2)样品在规定的保存条件下观察若干年限的
检测结果。
8
稳定性试验
4、稳定性试验的基本要求:
(1)稳定性试验包括影响因素试验、加速试验 和长期试验。 影响因素试验适用于原料药的考察,用 1
批原料药进行; 加速试验和长期试验适用于原料药与药物制
剂,要求用 3 批供试品进行。
9
稳定性试验
4、稳定性试验的基本要求:
(2)原料药供试品是一定规模生产的,供试品量相 当于制剂稳定性实验所要求的批量,原料药合成 工艺路线、方法、步骤应与大生产一致。 药物制剂的供试品应是放大试验的产品(如片 剂或胶囊剂在10000片左右或10000粒左右,特殊 剂型、特殊品种所需数量,根据具体情况灵活掌 握),其处方与生产工艺应与大生产一致。
稳定性试验
1、影响因素试验:
(2)高湿度试验:
供试品置于恒湿密闭容器中,在25℃分别于相对 湿度90%±5%条件下放置10天,于第5天和第10天取 样,按稳定性重点考察项目要求检验,同时准确称量 试验前后供试品的重量,以考察供试品的吸湿潮解 性能。若吸湿增重5%以上,则在相对湿度75%±5% 条 件下,同法进行试验;若吸湿增重5%以下,且其他考 察项目符合要求,则不再进行此项试验。
食品加速破坏性试验、稳定性试验方案

食品加速破坏性试验、稳定性试验方案本文给出了基于温度条件的加速破坏性试验和长期稳定性试验的设计要素,供食品生产企业参考。
在确定食品的保质期时,可选择两种方式中的一种,也可以两种方式结合使用。
一、试验原理加速破坏性试验通过将食品样品置于一个或多个温度、湿度、气压和光照等外界因素高于正常水平的环境中,促使样品在短于正常的劣变时间内达到劣变终点,再通过定期检测、收集样品在劣变过程中的各项数据,经分析计算后,推算出食品在预期贮存环境参数下的保质期。
温度是最关键的食品劣变影响因素。
设计加速破坏性试验时,常将温度作为关键因素,甚至作为唯一因素。
1、通常情况下温度每上升10°C则劣变反应速度加倍。
将温差为10°C的两个任意温度下的保质期的比率定义为Q10,见式(1)。
式(1):Q10=θs(T1)/θs(T2),Q10为加速破坏性试验条件下,温差为10°C的两个温度(试验温度T2和T1)下的保质期的比率;θs(T1)为在T1温度下进行加速破坏性试验得到的保质期;θs(T2)为在T2温度下进行加速破坏性试验得到的保质期。
2、实际贮存环境参数下的保质期与加速破坏性试验温度下的保质期呈以下关系,见式(2)。
式(2):θs(T)=θs(T1)xQ10△Ta/10,θs(T)为实际贮存温度T下食品的保质期;θs(T1)为在T1温度下进行加速破坏性试验得到的保质期;△Ta为较高温度(T1)与实际贮存温度(T)的差值(T1-T),单位为摄氏度(°C)。
将试验数据代入式(1)计算出Q10,再通过式(2)可计算出实际贮存温度下的保质期θs(T)。
二、双试验温度法双试验温度法的优点是简便和节约试验时间,缺点是误差较大。
其中T1、T2均应高于实际贮存温度。
1、在任意两个相差10°C的试验温度T1、T2下分别进行加速破坏性试验,根据需要在每个考察时间点对设定的指标进行考察直至劣变终点。
产品稳定性试验方案
产品稳定性试验方案1、目的
考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
2、参考资料
食品药品监管总局办公厅关于印发保健食品稳定性试验指导原则的通知
食品储存期加速测试及其应用蔡燕芬佳百欧洲食品(惠州)有限公司516005
3、试验要求
3.1、样品类型粉体类、液体类
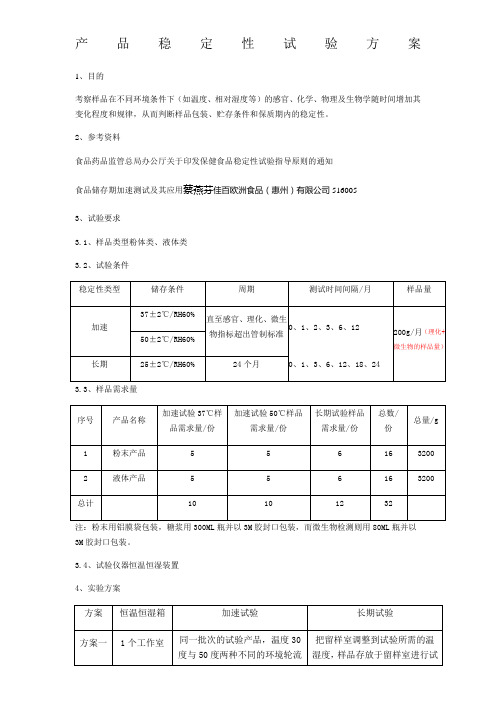
3.2、试验条件
3.3、样品需求量
注:粉末用铝膜袋包装,糖浆用300ML瓶并以3M胶封口包装,而微生物检测则用80ML瓶并以3M胶封口包装。
3.4、试验仪器恒温恒湿装置
4、实验方案
注:1、仪器尺寸的选择,由于实验室空间有限,在选购的恒温恒湿箱空间尺寸时有所限制,而我们公司的产品种类较多,试验时只能分批次来进行。
(后附恒温恒湿箱的各种型号及市场价格)
2、仪器工作室的选择,由于试验有加速试验和长期试验,试验的时间较长,建议选购3个工作室的仪器较适合。
5、考察指标与检测方法应按照产品质量标准规定的方法,对样品的卫生学及其与产品质量有关的指标在保质期内的变化情况进行的检测。
6、数据记录、汇总。
稳定性试验规定_稳定性指导原则_稳定性试验方法

稳定性试验考察计划为考察我公司所有生产品种的质量稳定性,决定对所有生产品种进行长期稳定性考察试验,为确保患者能够安全、有效的用药和对各品种试行标准转正及有效期确定等提供有效的数据。
一、稳定性考察要点:1.性状2.鉴别(显微鉴别、理化鉴别、薄层鉴别等)3.检查(水分、杂质、总灰分、酸不溶灰分等)4.浸出物5.含量测定6.其他项目二、具体方案:1.对各品种生产的前三批进行稳定性考察,每批拟计划一定量(注:各品种留样量一览表)进行考察。
其余批次只做一般留样考察,留样量为三次复检的全项检验量。
2.考察方法(长期试验):2.1按市售包装,在按产品要求的储存条件下放置12个月。
每3个月取样一次,分别于0个月,3个月,6个月,9个月,12个月取样,按各品种具体的稳定性考察要点项目进行检验。
12个月后,仍继续考察,分别于18个月,24个月,36个月、42个月、48个月(以此类推)末取样检测。
将结果与0月比较以确定药品有效期。
2.2对原辅料、半成品等在留样存储期进行质量稳定性跟踪考察,做到原辅料使用前的质量有效评估,确保成品安全、有效、稳定。
2.3由于实测数据的分散性,按95%可信限进行统计分析,得出合理的有效期。
如三批统计数据分析差别较小,则取平均值为有效期。
若差别较大,则取其最短的为有效期。
同时能够明确各剂型品种的安全性、稳定性及有效性。
三、方案实施:本方案由质量部完成,记录上述所有数据,并对试验过程中异常情况记录。
四、在产品正式生产阶段,已建立了详细的生产工艺资料,可将实验室的数据和生产情况相结合,用具有代表性的批号产品对稳定性进行考察,进一步修正产品的有效期。
如果需要改变工艺、包装,就必须重新进行稳定性的研究。
如果以上的变化影响了产品的稳定性,应该对产品重新设计。
在此阶段一般可用加速实验的方法进行有关稳定性的研究,并将目前的产品与原有的产品进行稳定性的比较。
但最后的结论仍应该在完全的、正常的稳定性研究基础上得出。
产品稳定性试验加速试验方案

文件制修订记录鉴于目前国家尚无出台食品添加剂稳定性试验指导原则,参照《中国药典》2020年版9001原料药物与制剂稳定性试验指导原则,根据公司产品质量稳定性考察计划,结合XXX产品特点和公司总部要求,现拟定XXX稳定性试验加速试验方案。
1、目的:在加速条件下进行加速试验,目的是通过加速产品的化学或物理变化,考察市售包装品在有效期内的质量稳定性,为产品设计、包装、运输、贮存提供必要的资料。
加速试验所用包装应采用模拟小包装,但所用材料与封装条件应与大包装一致。
2、范围:本方案适用于公司生产的市售包装XXX产品。
3、责任:质量部经理负责稳定性考察加速试验方案与报告的起草和批准,QC 人员按照本方案完成实验并报告检验结果。
4、质量标准依据与考察项目:5.1考察批次及样品数:本产品市售包装成品规格为25千克/铝箔袋,选择连续生产的三批模拟市售包装小袋(50g/铝箔袋)产品,每批次10袋,三批次共30袋。
5.2考察方法5.2.1贮存地点:XXX公司稳定性试验室。
5.2.2试验条件:在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
在试验期间第1个月、2个月、3个月、6个月末分别取样一次,按稳定性考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃、相对湿度65%±5%的情况下(可用Na2Cr04饱和溶液,30℃,相对湿度64.8%)进行加速试验,时间仍为6个月。
样品留样管理人员应在检测日的当天将样品取出交给检验人员,检验人员应在样品接收后立即安排进行测定,并将检验结果报告QC主管。
5.2.4合格标准5.2.4.1按照该稳定性考察方案完成所有测试,测试结果合格;5.2.4.2没有偏差,或者偏差的调查结果和产品质量无关。
6、产品稳定性考察报告6.1试验报告内容的要求应包括产品考察指标与合格标准、考察过程中出现的偏差及处理情况、数据统计、考察结论、附表(实验数据)。
稳定性试验方案

原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察中药在温度、湿度、光线、微生物的影响下随时间变化的规律。
为中药的生产、包装、贮存、运输条件提供科学依据,同时根据试验结果建立药品的有效期。
稳定性试验的基本要求有以下几个方面:(1)稳定性试验包括加速试验与长期试验。
加速试验与长期试验要求用三批供试品进行。
(2)中药制剂的供试品应是放大试验的产品,其处方与工艺应与大生产一致。
每批放大试验的规模,丸剂应在10000g或10000丸左右、片剂10000片左右、胶囊剂10000粒左右,大体积包装的制剂(如静脉输液、口服液等)每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况,灵活掌握。
(3)供试品的质量标准应与各项基础研究及临床验证所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的容器和包装材料及包装方式应与上市产品一致。
(5)研究中药稳定性,要采用专属性强、准确、精密、灵敏的分析方法并对方法进行验证,以保证中药稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比大规模生产的数量要小,故申报者应在获得批准后,从放大试验转入大规模生产时,对最初通过生产验证的三批大规模生产的产品仍需进行加速试验与长期稳定性试验。
1、加速试验此项试验是在超常的条件下进行,其目的是通过加速中药的化学或物理变化,探讨中药的稳定性,为中药审评、工艺改进、包装、运输及贮存提供必要的资料。
供试品要求3批,按市售包装,在温度40℃±2℃,相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末各取样一次,按稳定性重点考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即温度30℃±2℃,相对湿度60%±5%的情况下进行加速试验,时间仍为6个月。
药物稳定性试验方案

***药物稳定性试验方案一、试验目的***药物稳定性试验的目的是考察***药物在温度、湿度、光线的影响下随时间变化的规律,考察其在影响因素试验、加速试验的条件下各项指标是否符合***药物产品质量标准的要求。
二、试验要求***药物稳定性试验的基本要求有以下几个方面:1、稳定性试验项目包括影响因素试验与加速试验。
2、***药物供试品可以从橡胶膏生产车间生产的同一批制剂中抽取,抽样数量符合稳定性试验要求。
3、加速试验与长期试验***药物所用供试品的容器和包装材料及包装方式应与上市产品一致。
4、***药物稳定性试验,要采用专属性强、准确、精密、灵敏的药物分析方法,以保证药物稳定性结果的可靠性。
三、试验方法(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是考察***药物的固有稳定性,了解其在高温、高湿及低温条件下各项质量指标的稳定性及变化情况。
1.高温试验***药物置药物稳定性检查仪中,60℃温度下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检。
若***药物供试品有明显变化(如含量下降5%),则在40℃条件下同法进行试验。
若60℃无明显变化,不再进行40℃试验。
2.高湿度试验***药物置恒湿密闭容器中,在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。
若吸湿增重5%以上,则在相对湿度75%±5%条件下,同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此项试验。
恒湿条件可通过在密闭容器如干燥器下部放置饱和盐溶液实现,根据不同相对湿度的要求,选择NaCl饱和溶液(15.5~60℃,相对湿度75%±1%)或KNO3饱和溶液(25℃,相对湿92.5%)。
3.低温试验***药物置适宜的密封洁净容器中,0℃温度下放置10天,于第5天和第10天取样,按***药物成品质量标准进行全检。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Stability Study Protocol for Exhibit Batch ofChloroquine Phosphate Tablets USP, 250mg规格为250 mg的USP磷酸氯喹片长期、中期及加速稳定性研究方案$/Prepared By: Date:起草者:日期:Reviewed By QA: Date:审核者:日期:Approved By: Date:批准者:日期:Starting Date: Completed Date:开始日期:结束日期:`Contents目录1.P u r p o s e目的 (1)2.S c o p e范围 (1)3.R e f e r e n c e s参考资料 (1)4.G e n e r a l I n f o r m a t i o n基本信息 (1)S t a b i l i t y S a m p l e s稳定性研究样品 (1)P r o d u c t O u t l i n e样品概述 (1)F o r m u l a t i o n处方 (1)C o n t a i n e r-C l o s u r e S y s t e m s包装 (1)L a b e l i n g标签 (1)S a m p l e s a n d P a c k a g e样品与包装 (1)5.S t a b i l i t y Te s t i n g稳定性测试 (1)S a m pl e Rec ei pt a n d S to ra ge样品接收与储存 (1)Storage Conditions and Testing Time Points储存条件与检测时间点 (1)S a m p l i n g取样 (1)Te s t i n g M a t r i x稳定性测试项目表 (1)Parameters and Acceptance Criteria检测项目及质量标准 (1)D e g r a d a t i o n p r o d u c t s降解产物 (1)6.D a t a P r e s e n t a t i o n数据汇总 (1)7.R e p o r t i n g报告 (1)I n t e r m e d i a t e R e p o r t s中期报告 (1)S u m m a r y R e p o r t总结报告 (1)S t a b i l i t y D o c u m e n t s稳定性文件夹 (1)8.A p p e n d i x附件 (1)1.Purpose目的The purpose of stability testing is to provide evidence of how the Quality, Strength, Degradation Products and Purity of the Chloroquine Phosphate Tablets USP, 250mg will change with time under the influence of environmental room temperature and relative humidity conditions. Data collected from the stability study will enable recommended storage conditions and provide justification for establishing and submitting the data to regulatory authorities for approving the shelf life for marketing purposes.In addition, 3 months of the stability data will be submitted to US FDA as required for submission purposes of the ANDA application.此稳定性研究的目的是为了考察磷酸氯喹片在环境因素的影响下(例如:温度和湿度)其性质、规格、降解产物和含量等随时间而变化的规律,依据稳定性研究的数据确定该产品的储藏条件和有效期。
2.Scope范围This procedure is applicable to Finished Product Stability Lab at Hisun Pharmaceutical (Hangzhou) Co.Ltd. Fuyang, Hangzhou.适用于浙江台州海正药业成品药稳定性实验室。
3.References参考资料ICH Harmonized Triparties Guideline for Stability Testing of New Drug Substances and Drug Product06, 2003. [ICH Q1A (R2)]新原料药和新制剂的稳定性测试指南06, 2003. [ICH Q1A(R2)]ASSAY METHOD VALIDATION REPORT FOR CHLOROQUINE PHOSPHATE, USP, API AND CHLOROQUINE PHOSPHATE, USP TABLETS, 250 mg AND 500 mg. (ARD-VDR-FPTM025A)磷酸氯喹原料药、250mg和500mg片的含量测定方法验证报告。
RELATED SUBSTANCES METHOD VALIDATION REPORT FOR CHLOROQUINE PHOSPHATE, USP, API AND CHLOROQUINE PHOSPHATE, USP TABLETS, 250 mg AND 500 mg.(ARD-VDR-FPTM025B)磷酸氯喹原料药、250mg和500mg片有关物质方法验证报告。
DISSOLUTION METHOD VALIDATION REPORT FOR CHLOROQUINE PHOSPHATE, USP TABLETS, 250 mg AND 500 mg. (ARD-VDR-FPTM025C)磷酸氯喹250mg和500mg片溶出度方法验证报告。
4.General Information基本信息4.1Stability Samples稳定性样品4.1.1 One Exhibit Batch for 250mg strength will be included in the stability study.规格为250mg的磷酸氯喹片各一批。
4.1.2 One batch of 250mg reference product will also be placed on stability study.规格为250mg和的磷酸氯喹对照制剂各一批。
4.2Product Outline样品信息4.3Formulation处方4.3.1The formulation of Chloroquine Phosphate USP Tablets, 250 mg, is as follows:规格为250mg的USP磷酸氯喹片处方如下:Table 1. Formula and batch size4.4不适用4Container-Closure Systems 包装Packing Material 包材Batch No.批号Packing Material Description包材描述Manufacturer供应商60 cc HDPE bottle 60 cc HDPE瓶WE070601Bottle: 60 cc opaque white HDPE round bottle瓶:60cc白色不透明HDPE圆瓶Cap: φ32 mm opaque white CRC cap, with inductionsealing盖:φ32mm白色不透明CRC圆盖,带内封Triveni PolymersPvt. Ltd (Bottle)VBC Inc. (CRC Cap)Tekniplex (Liner)上海海昌120 cc HDPE bottle 120 cc HDPE瓶KQ080101Bottle: 120 cc opaque white HDPE round bottle瓶:120cc白色不透明HDPE圆瓶Cap: φ36 mm opaque white CRC cap, with inductionsealing盖:φ36mm白色不透明CRC圆盖,带内封Triveni PolymersPvt. Ltd (Bottle)VBC Inc. (CRC Cap)Tekniplex (Liner)上海海昌450 cc HDPE bottle 450 cc HDPE瓶WA080101Bottle: 450 cc opaque white HDPE round bottle瓶:450cc白色不透明HDPE圆瓶Cap: φ58 mm opaque white CT cap, with inductionsealing盖:φ58mm白色不透明CT圆盖,带内封Triveni PolymersPvt. Ltd (Bottle andCap)Tekniplex (Liner)上海海昌4.5Labeling标签The Product Name, Batch Number, Strength, Storage Condition, Package Type, No. and Stored by/ Store Date will be included on the label.标签应包括品名、批号、规格、储存条件、包装类型、编号及储存人/日期。
FP Stability Lab成品药稳定性实验室Product Name品名:Batch No./ Strength批号/规格:Storage Condition储存条件:Package type包装类型:No.编号:Stored By/ Date储存人/日期:4.6Samples and Package样品与包装The drug product for stability testing will be packaged in the same configuration as that for the marketing purposes.稳定性研究样品与上市的包装要一致,同时药品的大包装也进行稳定性实验。
