物理化学电子教案第一章(1).ppt
01章_热力学第一定律及其应用-例题和习题课解析

W V pdV p(V2 V1 ) 330.56 103 (40.00 15.00) 10 3 2864 J
1
V2
上一内容
下一内容
回主目录
返回
2018/12/28
例题
例: 10mol理想气体,压力为1000kPa,温度为300 K , 求下列 各种情况下的W: 1.在空气中( p )体积胀大1dm 3 ; 2.在空气中胀大到气体的压力也为p ; 3.等温可逆膨胀至气体的压力也为p。
3
1000 p1 10 8.314 300 ln 3.W nRT ln 100 p2 57.43kJ
上一内容
下一内容
回主目录
返回
2018/12/28
七、例题
例:气体He从0C, 5 105 Pa, 10dm3,经一绝热可逆 过程膨胀至10 Pa,试计算T2、Q、W、U和H。
物理化学电子教案—第一章
U Q W
上一内容
下一内容
回主目录
返回
2018/12/28
例题
例1:在25C时, 2molH 2的体积为15dm3,此气体 ( 1 )在定温下,反抗外压为105 Pa时,膨胀到体 积为50dm3 ; (2)在定温下可逆膨胀到体积为50dm3 , 试计算两种膨胀过程的功。
3
4865J
上一内容
下一内容
回主目录
返回
2018/12/28
例题
W
(2)
(3)
p(V2 V1 ) 105 (40.00 15.00) 103
2500 J
根据理想气体状态方程
pV nRT nRT 2 8.314 298.2 330.56kPa p 3 V 15.00 10
物理化学电子教案绪论(1).ppt

上一内容 下一内容 回主目录
返回
2020/11/23
0.4 物理化学学科的战略地位
(1)物理化学是化学科学的理论基础及重要组成学科 (2)物理化学与其它学科相结合极大地扩充了化学研
究的领域 (3)物理化学与国计民生密切相关
上一内容 下一内容 回主目录
返回
2020/11/23
0.5 物理化学课程的学习方法
---自然科学学科发展战略调研报告---
上一内容 下一内容 回主目录
返回
2020/11/23
0.2 物理化学的研究内容和方法
研究内容: (1) 化学变化的方向、限度 (2) 化学反应的速率和机理问题 (3) 物质的性质与其结构之间的关系问题
上一内容 下一内容 回主目录
返回
2020/11/23
0.2 物理化学的研究内容和方法
2020/11/23
0.2 物理化学的研究方法
•统计力学方法:
用概率规律计算出体系内部大量质点微观运动的 平均结果,从而解释宏观现象并能计算一些热力学的 宏观性质。 •量子力学方法:
用量子力学的基本方程(E.Schrodinger方程)求 解组成体系的微观粒子之间的相互作用及其规律,从 而指示物性与结构之间的关系。
研究方法: a.热力学方法 以众多质点组成的宏观体系作为研究对象,以两 个经典热力学定律为基础,用一系列热力学函数 及其变量,描述体系从始态到终态的宏观变化, 而不涉及变化的细节。经典热力学方法只适用于 平衡体系。
上一内容 下一内容 回主目录
返回
2020/11/23
0.2 物理化学的研究内容和方法
2020/11/23
0.1 物理化学的定义
物理化学是从物质的化学现象和物理现象之间 的相互联系入手来探求化学变化及相关的物理 变化基本规律的一门学科
物理化学电子教案一章-PPT课件

返回
2019/3/3
热和功
热(heat) 体系与环境之间因温差而传递的能量称为 热,用符号Q 表示。 Q的取号: 体系吸热,Q>0; 体系放热,Q<0 。 功(work) 体系与环境之间传递的除热以外的其它能量 都称为功,用符号W表示。
功可分为膨胀功和非膨胀功两大类。W的取号:
上一内容
下一内容
回主目录
返回
2019/3/3
热力学的研究内容
•研究热、功和其他形式能量之间的相互转换及
其转换过程中所遵循的规律;
•研究各种物理变化和化学变化过程中所发生的
能量效应;
•研究化学变化的方向和限度。
上一内容
下一内容
回主目录
返回
2019/3/3
热力学的方法和局限性
热力学方法的特点 •只研究物质变化过程中各宏观性质的关 系,不考虑物质的微观结构; •只研究物质变化过程的始态和终态,而 不追究变化过程中的中间细节,也不研究 变化过程的速率和完成过程所需要的时间。 局限性 不知道反应的机理、速率和微观性质, 只讲可能性,不讲现实性。
返回
2019/3/3
第一章 热力学第一定律及其应用
1.8 1.9 1.10 赫斯定律 几种热效应 反应热与温度的关系——基尔霍夫定律
上一内容
下一内容
回主目录
返回
2019/3/3
1.1 热力学概论
1.热力学的研究内容 2.热力学方法的特点和局限性 3.基本概念:
•体系与环境 •体系的分类 •体系的性质 •状态函数 •过程与途径 •热和功
上一内容
下一内容
回主目录
返回
2019/3/3
体系分类
01章-热力学第一定律及其应用1
T2 T1
Hale Waihona Puke CVdT= CV (T2 T1)
(设CV 与T 无关)
因为计算过程中未引入其它限制条件,所以该公式适 用于定组成封闭体系的一般绝热过程,不一定是可逆过 程。
上一内容 下一内容 回主目录第18页,共29页。
返回
2022/2//1188
节流过程的U和H
节流过程是在绝热筒中进行的,Q=0 ,所以:
绝热过程的功
在绝热过程中,体系与环境间无热的交换,但可以 有功的交换。根据热力学第一定律:
dU Q W
= W
(因为Q 0)
这时,若体系对外作功,热力学能下降,体系温度必然 降低,反之,则体系温度升高。因此绝热压缩,使体系温度 升高,而绝热膨胀,可获得低温。
上一内容 下一内容 回主目录第15页,共29页。
可逆过程的特点:
(1)状态变化时推动力与阻力相差无限小,体系与环 境始终无限接近于平衡态;
(2)过程中的任何一个中间态都可以从正、逆两个
方向到达;
(3)体系变化一个循环后,体系和环境均恢复原态,变 化过程中无任何耗散效应;
(4)等温可逆过程中,体系对环境作最大功,环境对体系作最 小功。
上一内容 下一内容 回主目录第9页,共29页。
返回
2022/22//1188
燃烧焓
指定产物通常规定为:
C CO2 (g) S SO2 (g) Cl HCl(aq)
H H2O(l)
N N2 (g)
金属 游离态
显然,规定的指定产物不同,焓变值也不同,查表时应注
意。298.15 K时的燃烧焓值有表可查。
上一内容 下一内容 回主目录第25页,共29页。
2022/22//1188
《物理化学》电子教案上册

《物理化学》电子教案上册第一章:引言1.1 课程介绍1.2 物理化学的基本概念1.3 物理化学的研究方法1.4 学习目标与要求第二章:气体2.1 气体的性质2.2 气体的压力与体积2.3 气体的温度与热量2.4 气体的化学反应第三章:溶液3.1 溶液的定义与组成3.2 溶液的浓度与稀释3.3 溶液的蒸馏与沸腾3.4 溶液的离子平衡第四章:固体4.1 固体的结构与性质4.2 固体的相变与相图4.3 固体的溶解与熔点4.4 固体的电导与磁性第五章:液体5.1 液体的性质与表面现象5.2 液体的蒸发与凝结5.3 液体的扩散与对流5.4 液体的相变与相图第六章:热力学第一定律6.1 能量守恒定律6.2 内能与热量6.3 功与热传递6.4 热力学第一定律的应用第七章:热力学第二定律7.1 熵与无序度7.2 可逆与不可逆过程7.3 热力学第二定律的表述7.4 热力学第二定律的应用第八章:化学平衡8.1 平衡常数与反应方向8.2 酸碱平衡与pH值8.3 沉淀平衡与溶解度积8.4 化学平衡的计算与应用第九章:动力学9.1 反应速率与速率常数9.2 零级、一级和二级反应9.3 反应机理与速率定律9.4 化学动力学的应用第十章:电化学10.1 电解质与离子传导10.2 电极与电极反应10.3 电池与电势10.4 电化学的应用重点和难点解析一、气体的化学反应补充和说明:气体之间的化学反应是物理化学中的重要内容,例如气体的合成、分解、置换等反应。
这些反应在工业生产、环境保护等领域具有重要的应用价值。
教案中应详细介绍气体化学反应的基本原理、反应类型及其应用实例,并通过实际案例分析,使学生能够深入理解和掌握这一部分内容。
二、溶液的离子平衡补充和说明:溶液中的离子平衡是物理化学中的关键概念,对于理解电解质溶液的性质和行为具有重要意义。
教案中应详细讲解离子平衡的基本原理、离子平衡常数的计算及其在实际应用中的作用,如酸碱平衡、溶解度积等。
物化课件

13:24:58
上一内容
下一内容
回主目录
实际气体的液化
270K时CO2相变过程
p=3.204MPa
峭, , 由 如 上在 体 于 果 升等 积 液 继 的温 仅 体 续 线线 有 压 增 段上 微 缩 加 。出 小 性 压 现改很力 陡变小,
上一内容 下一内容
气 体 全 部 凝 结 为 液 体
以上三式结合 理想气体状态方程
pV = nRT
单位:p Pa V m3
TK
n mol R J mol-1 K-1
摩尔气体常数:R = 8.314510 J mol-1 K-1
上一内容 下一内容 回主目录
返回
13:24:58
理想气体状态方程
理想气体状态方程也可表示为: pVm=RT pV = (m/M)RT 以此可相互计算 p, V, T, n, m, M, (= m/ V)
l’1 l’2 T1<T2<Tc<T3<T4
p / [Pa]
1) T < Tc 气相线 g1g’1: p , Vm 气-液平衡线 g1l1 : 加压,p*不变, gl, Vm g1: 饱和蒸气摩尔体积Vm(g) l1: 饱和液体摩尔体积Vm(l)
g’2 g’1ຫໍສະໝຸດ C l2 l1T4
T3 g2 g1 Tc
2) 质量分数wi
wi
def
mi / mi
(单位为1)
wi = 1
上一内容 下一内容 回主目录
返回
13:24:58
理想混合气体状态方程
2. 理想气体方程对理想气体混合物的应用 因理想气体分子间没有相互作用,分子本身 又不占体积,所以理想气体的 pVT 性质与气体的 种类无关,因而一种理想气体的部分分子被另一 种理想气体分子置换,形成的混合理想气体,其 pVT 性质并不改变,只是理想气体状态方程中的 n 此时为总的物质的量。
物理化学》电子教案上册

《物理化学》电子教案上册第一章:引言1.1 课程介绍1. 理解物理化学课程的重要性2. 了解课程的学习目标和内容1.2 物理化学的基本概念1. 物质的量与质量2. 状态与状态函数3. 热力学第一定律1.3 实验技能1. 掌握基本实验操作方法2. 熟悉实验仪器的使用和维护第二章:温度与热量2.1 温度的概念与计量1. 温度的定义与度量单位2. 温度计的使用与校准2.2 热量与热传递1. 热量的定义与计量单位2. 热传递的方式与速率2.3 热力学第二定律1. 熵的概念与计算2. 热力学第二定律的表述与意义第三章:压力与体积3.1 压力的概念与计量1. 压力的定义与度量单位2. 压强计的使用与校准3.2 体积的概念与测量1. 体积的定义与度量单位2. 量筒与容量瓶的使用与校准3.3 理想气体状态方程1. 理想气体状态方程的推导与理解2. 理想气体的状态变化计算第四章:物质的量与质量4.1 物质的量的概念与计量1. 物质的量的定义与度量单位2. 摩尔质量与摩尔数4.2 质量的概念与测量1. 质量的定义与度量单位2. 天平的使用与校准4.3 物质的量的计算1. 物质的量的计算公式与方法2. 物质的量的转换与计算实例第五章:实验方法与技术5.1 实验设计与方案制定1. 实验目标与步骤2. 实验材料的准备与选择5.2 实验操作与数据采集1. 实验操作方法与技巧2. 数据采集与记录1. 实验结果的整理与分析第六章:溶液的浓度与渗透压6.1 溶液的定义与组成1. 理解溶液的概念2. 熟悉溶剂和溶质的分类6.2 溶液的浓度表示方法1. 摩尔浓度2. 质量分数3. 体积分数6.3 渗透压与溶液的活度1. 渗透压的概念与计算2. 溶液的活度与活度系数第七章:化学平衡7.1 化学平衡的基本概念1. 平衡态的定义2. 平衡常数与平衡常数表达式7.2 酸碱平衡1. 酸碱理论基础2. 酸碱平衡的计算与调节7.3 氧化还原平衡1. 氧化还原反应的基本概念2. 标准电极电势与氧化还原平衡的计算第八章:动力学反应8.1 化学反应速率1. 反应速率的定义与表示方法2. 反应速率的影响因素8.2 化学反应机理1. 机理的定义与表示方法2. 速率方程与机理的关系8.3 反应动力学的应用1. 催化反应动力学2. 生物化学反应动力学第九章:相平衡与相图9.1 相与相变1. 相的概念与分类2. 相变的类型与特点9.2 相平衡条件与相平衡常数1. 相平衡的必要条件2. 相平衡常数的计算与表达9.3 典型体系的相图1. 水-冰相图2. 铁-碳相图第十章:实验数据分析与处理10.1 实验数据的误差分析1. 误差的概念与分类2. 误差的计算与减小方法10.2 实验数据的处理方法1. 平均值的计算与误差分析2. 数据的图表表示方法10.3 实验数据的回归分析1. 线性回归与曲线拟合2. 回归分析的应用与实践重点和难点解析重点一:第二章中的热量与热传递详细补充和说明:热量与热传递是物理化学中的重要概念。
(2)-01章-热力学第一定律(可逆过程,体积功,焓,热容)
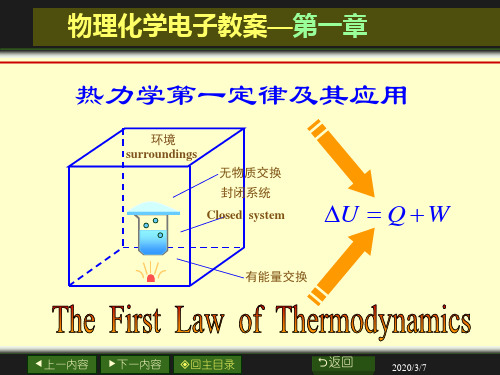
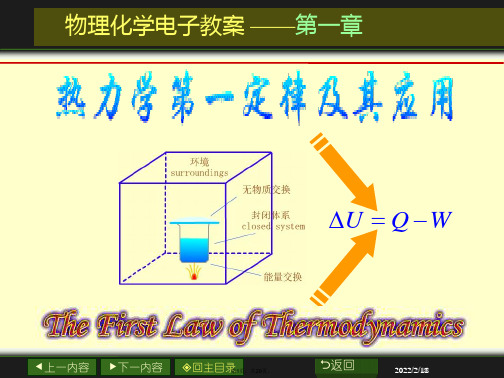
热力学第一定律及其应用
环境 surroundings
无物质交换 封闭系统
Closed system
U Q W
有能量交换
上一内容 下一内容 回主目录
返回
2020/3/7
热力学第一定律
Joule(焦耳)和 Mayer(迈耶尔)自1840年 起,历经20多年,用各种实验求证热和功的转 换关系,得到的结果是一致的。
也可以表述为:第一类永动机是不可能制成的
第一类永动机(first kind of perpetual motion machine):一种既不靠 外界提供能量,本身也不减少能量,却可以不断对外作功的机器 称为第一类永动机,它显然与能量守恒定律矛盾。
热力学第一定律是人类经验的总结,事实证明违背该定 律的实验都将以失败告终,这足以证明该定律的正确性。
U U2 U1 QW 对于微小变化 dU Q W
热力学能的单位: J
热力学能是状态函数,用符号U表示,它的 绝对值尚无法测定,只能求出它的变化值。
上一内容 下一内容 回主目录
返回
2020/3/7
热力学第一定律的文字表述
热力学第一定律是能量守恒与转化定律在热现 象领域内所具有的特殊形式,说明热力学能、热和 功之间可以相互转化,但总的能量不变。
自然界的一切物质都具有能量,能量有各 种不同形式,能够从一种形式转化为另一种形 式,但在转化过程中,能量的总值不变。
上一内容 下一内容 回主目录
返回
2020/3/7
热力学能
系统总能量通常有三部分组成:
(1)系统整体运动的动能 (2)系统在外力场中的位能 (3)热力学能,也称为内能 热力学中一般只考虑静止的系统,无整体运动, 不考虑外力场的作用,所以只注意热力学能
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一内容 下一内容 回主目录
返回
2020/11/23
(1) 混合物的组成
a 摩尔分数x或y:
xB 或yB
nB nA
显然 xB 1 或 yB 1
A
B
B
b 质量分数
wB
mB mA
A
wB 1
B
c 体积分数
B
xB Vm,B xA Vm, A
A
B 1
B
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/11/23
§1.1 气体分子动理论
一 气体分子动理论的基本公式 二 理想气体状态方程 三 理想气体模型 四 理想气体混合物 五 分子平均平动能与温度的关系
上一内容 下一内容 回主目录
返回
2020/11/23
1 气体分子动理论的基本公式
气体分子运动的微观模型
返回
2020/11/23
(2) 理想气体混合物状态方程
• 理想气体混合物状态方程为:
pV n总RT nB RT B
pV m RT M mix
上一内容 下一内容 回主目录
返回
2020/11/23
(3) 道尔顿定律与分压力
⑴ 道尔顿定律:
混合气体的总压力等于各组分单独存在于混 合气体的温度、体积条件下所产生压力的总和。
u ( niui2 ) / n
i
n为单位体积内的分子数。
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
• 17~19世纪三个著名的低压气体经验定律:
• 波义尔定律(R.Boyle,1662):
pV = 常数
(T, n 一定)
• 盖.吕萨克定律(J. Gay-Lussac,1808):
返回
2020/11/23
1 气体分子动理论的基本公式
气体分子动理论的基本公式
压力
力 面积
质量 加速度 面积
质量 速度 面积 时间
动量 面积 时间
利用统计平均的方法,求出体积为V分子数为N的气
体系统的总动量。则可得出气体分子动理论的基本公式
pV 1 mNu2 3
式中,m是一个分子的质量,u为均方根速率。
pV = nRT
单位:p Pa V m3 T K n mol R J mol-1 K-1
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
由三个经验定律导出理想气体状态方程的过程:
设 V=V(T,p,n) 则有
dV
V T
dT
p,n
V p
dp T ,n
V / T = 常数
(n, p 一定)
• 阿伏加德罗定律(A. Avogadro, 1811)
V / n = 常数
(T, p 一定)
气体分子运动公式可以对几个经验定律作出解释。
反过来也证明了气体分子运动基本公式的正确性。
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
• 将以上三式归纳整理,得到理想气体状态方程:
在的,它只是真实气体在p→0时的极限情况。
4 建立理想气体模型的意义:
⑴ 建立了一种简化的模型:理想气体不考虑气体
的体积及相互作用力,使问题大大简化,为研究实
际气体奠定了基础。 ⑵ 低压下的实际气体可近似按理想气体对待。
上一内容 下一内容 回主目录
返回
2020/11/23
4 理想气体混合物
(1) 混合物的组成 (2) 理想气体混合物状态方程 (3) 道尔顿定律 (4) 阿马加定律
d ln( pV ) d ln(nT)
积分
ln( pV ) ln(nT) ln C
C是积分常数,通常用R表示,去掉对数得
pV nRT
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
•理想气体状态方程也可写为:
pV NkBT kB R / L N / L n pVm RT pV m RT M
以此可相互计算 p, V, T, n, m, M, (= m/ V)
上一内容 下一内容 回主目录
返回
2020/11/23
3 理想气体模型
1 理想气体定义: 任何温度、压力下均服从理想气体状态
方程的气体,称为理想气体。
2 理想气体的特征(或条件): ⑴ 分子本身无体积: 意味着:分子是质点(有质
量无体积),若p→∞,则Vm →0。
见下页图
p
n总 R T
V
nA
nB
RT V
nART nBRT
V
V
B
nB RT V
B
pB
适用于理想气体和低压气体。
上一内容 下一内容 回主目录
返回
2020/11/23
道尔顿定律示意图
△○△△○ ○△○△○ △○△○△ ○△○△○
△ △△ △△
△ △△ △△
△:组分A
p总
n总RT V
○:组分B
物理化学电子教案—第一章
气体
上一内容 下一内容 回主目录
返回
2020/11/23
第一章 气体
§1.1 气体分子动理论 §1.2 摩尔气体常数(R) §1.3 理想气体的状态图 §1.4 分子运动的速率分布 §1.5 分子平动能的分布 §1.6 气体分子在重力场中的分布 §1.7 分子的碰撞频率与平均自由程 §1.8 实际气体 §1.9 气体间的转变—实际气体的等温线和液化过程 §1.10 压缩因子图--实际气体的有关计算 §1.11 分子间的相互作用力*
⑵ 分子间无相互作用力: 由p=nRT/V,温度恒定
时,p∝n/V,与分子间距离无关,所以分子间无
相互作用力。
上一内容 下一内容 回主目录
返回
2020/11/23
3 理想气体模型
3 理想气体微观模型: 理想气体是一种分子本身没有体积,分子间
无相互作用力的气体。 理想气体是 p
由盖.吕萨克定律
V V T p,n T
由波义尔定律
V p
T ,n
V p
由阿伏加德罗定律
V V n T , p n
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
代入得
整理得 或写成
dV V dT V dp V dn
T
pn
dp dV dT dn pV T n
(1)气体是大量分子的集合体。相对于分子与分子间 的距离以及整个容器的体积来说,气体分子本身的体积 很小,可以忽略不计,常将气体分子当作质点来处理。 (2)气体分子不断地做无规则的运动,均匀分布于整 个容器中。 (3)分子彼此的碰撞以及分子与器壁的碰撞是完全弹 性的(碰撞前后总动量不损失)。
上一内容 下一内容 回主目录
pA
nART V
上一内容 下一内容 回主目录
