RCT文献质量评价
如何对护理研究进行质量评价?

如何对护理研究进行质量评价?全球各循证机构均推出了对文献评价的原则和方法,本文主要介绍澳大利亚JBI循证卫生保健中心对干预性研究(包括随机对照试验研究(RCT)和类实验性研究(CCT))的质量评价原则和方法。
循证护理强调将最佳的研究证据应用于临床护理实践,在应用证据之前,必须评价证据是否真实有效、是否可信、是否能应用于临床情境。
目前很多护理人员出现了误用循证护理的问题,其中最常见的一种误用现象是不对文献进行质量评价,将所有公开发表的研究结果都视为“最佳证据”,从而误导了临床决策。
因此,本文主要介绍进行文献质量评价的意义、基本要素,以及对干预性护理研究论文进行质量评价的原则和方法。
JBI循证卫生保健中心对RCT评价原则澳大利亚JBI循证卫生保健中心(2010)对随机对照试验提出了以下10条研究质量严格评价原则(critical appraisal)。
评价者需对每个条目做出“是、否、不清楚”的判断,并最终经过小组讨论,决定该研究是纳入、审慎纳入、还是剔除。
1. 是否真正采用了随机分组方法?2. 是否对研究对象实施了盲法?3. 是否对分组者采用了分配隐藏?4. 是否描述了失访对象的结局,并将其纳入分析?5. 是否对结果测评者实施了盲法?6. 试验组与对照组在基线时是否具有可比性?7. 除了要验证的干预措施外,各组接受的其他措施是否相同?8. 是否采用相同的方式对各组研究对象的结局指标进行测评?9. 结果测评方法是否可信?10. 资料分析方法是否恰当?JBI循证卫生保健中心对CCT评价原则对于类实验性研究,澳大利亚JBI循证卫生保健中心于2004年提出10条质量评价原则。
1. 研究目的是否明确?立题依据是否充分?2. 是否清晰描述了样本的入选过程、分组过程、入选标准和排除标准?3. 是否对研究对象和结果测评者实施了盲法?4. 试验组和对照组在基线时是否具有可比性?5. 是否描述样本流失情况?流失的样本是否也纳入分析?6. 是否采用相同的方式对各组研究对象的结局指标进行测评(要求培训测量者)?7. 除了要验证的干预措施外,试验组和对照组接受的其他措施是否相同?8. 是否描述了评估不良反应或副作用的方法?9. 结局指标的设立是否恰当?测评方法是否可信?10. 资料分析方法是否恰当?对文献质量进行评价,从而审慎地将最佳证据提炼出来,应用到临床决策中,是循证护理的精髓之一。
文献质量评价

⽂献质量评价⽂献质量的评价⼀、⽂献质量评价的基本要素在进⾏⽂献质量评价时,应依据科学、规范的评价标准,⽽不是靠评价者的主观感觉、临床或研究经验来判断。
通常,⽂献质量评价的基本要素包括⽂献内部真实性、临床重要性和适⽤性3个⽅⾯。
(⼀)内部真实性内部真实性是指某个研究结果接近真值的程度,即研究结果受各种偏倚的影响程度。
偏倚主要来源于4个⽅⾯。
1.选择偏倚选择偏倚主要发⽣在选择和分配研究对象时。
如果在分配研究对象时,所采取的随机⽅法不完善,可能会造成各组的基线资料不具有可⽐性,从⽽亏⼤或缩⼩护理⼲预措施的效果。
另外,如果⽤于分组的随机序列公开化,使得研究者和研究对象能够预计到下⼀个研究对象会将会⼊选到哪⼀组,可能会掺杂研究者或患者的主观因素,从⽽带来偏倚。
因此,为了降低选择偏倚,在分配研究对象时,应采⽤严格的随机法,并对随机分配⽅案做到分配隐藏。
分配隐藏的措施包括下列⼏种:由不直接参与研究的药房⼈员或中⼼办公室⼈员控制随机分配⽅案;采⽤相同外观的、按顺序编号的药物容器;使⽤按顺序编号不透明密闭信封等。
分配⽅案的隐藏应⾄少维持到实际分配研究对象时,确定某研究对象被分配到哪⼀组后,不要随意改变分组情况。
2.实施偏倚实施偏倚主要发⽣在⼲预措施的实施过程中。
指除了要验证的措施外,向实验组和对照组提供的其他措施也不相同,从⽽出现系统偏差,降低实施偏倚的措施是将⼲预⽅案进⾏标准化,并尽可能对研究对象和⼲预提供者实施盲法。
如果⼲预提供者知道研究对象接受的时哪⼀种⼲预,会有意⽆意的对⼲预组的研究对象提供格外的关注;如果研究对象知道⾃⼰接受的是哪⼀种措施,会倾向于提供更多症状。
另外,在研究过程中,如果对照组的研究对象由于各种原因有意或⽆意地应⽤了实验组的措施,也会导致实施偏倚。
3.失访偏倚失访偏倚是指在研究的随访过程中,实验组和对照组因退出、失访、违背⼲预⽅案的⼈数或失访者的特征不同⽽造成的系统差异。
失访的原因往往是发⽣副反应、疗效差、出现并发症、搬迁或死亡等,如果失访率较⾼或各组间失访情况不⼀样,会使研究结果失真。
cochrane纳入的RCT文献质量评价(风险偏倚评估工具)中英文对照版

交替或循环
出生日期
病历号
其它明确的非隐藏过程
风险未知
没有足够信息判断为低风险或高风险。通常因分配隐藏的方法未描述或描述不充分。例如描述为使用信封分配,但为描述信封是否透明?密封?顺序编号?
对参与者和实施者的盲法
因参与者和实施者了解干预情况而导致实施偏倚
低风险判断标准
参与者以及纳入参与者的研究者因以下掩盖分配的方法或相当的方法,事先不了解分配情况
中心分配(包括电话,网络,药房控制随机)
相同外形的顺序编号的药物容器;
顺序编号、不透明、密封的信封
高风险判断标准
参与者以及纳入参与者的研究者可能事先知道分配,因而引入选择偏倚,譬如基于如下方法的分配:
使用摊开的随机分配表(如随机序列清单)
Selectionbias(biasedallocationtointerventions)duetoinadequateconcealmentofallocationspriortoassignment.
Performancebias.
BlindingofparticipantsandpersonnelAssessmentsshouldbemadeforeachmainoutcome(orclassofoutcomes).?
可能存在偏倚风险,但存在以下两种中的一种
没有足够信息评估是否存在其它重要的偏倚风险
没有足够的证据认为发现的问题会引入偏倚
summaryassessmentsoftheriskofbiasforeachimportantoutcome(acrossdomains)withinandacrossstudies
文献质量评估

文献质量评估
各纳入RCT的方法学质量评价采用Cochrane5.1手册推荐的简单评估法[9],评价的关键指标:①随机方法是否正确;②是否做到分配隐藏,分配方法是否正确;③是否实施盲法;
④是否报告失访和退出情况;⑤基线是否可比。
对于分配隐藏,将试验评为A(完全隐藏)、B(不清楚是否隐藏)、C(隐藏不充分)和D(没有使用隐藏)4个等级。
在其他方面将试验评为A(是)、B(不清楚)、C(否)三级。
如各评价条目均为A级,则为低度偏倚,发生各种偏倚的可能性最小,质量评为A级;若有一条目或多个条目为B,则该试验有发生相应偏倚的中等度可能性,质量评为B级;如其中有一条目或多个条目为C,则该试验有发生相应偏倚的高度可能性,质量评为C级。
文献质量评价

•文献介绍
目的 对危重症患者实施早期主动 活动,探讨其能否改善患者的营养指标 研究设计 前瞻性随机对照研究
分组方法 依据患者入院时的BMI (BMI≥28、18.5<BMI<27.9/BMI≤18.5), 采用分层随机抽样的方法,依次分为试验组 及对照组。
1
•文献介绍
干预措施 对照组给予常规护理及康复锻 炼,试验组在常规护理的基础上制定早期 主动活动标准,拟定早期主动活动方案
结局指标 分别在患者入院时、入院 3 天、 7 天、14 天,测量患者的前白蛋白、白蛋 白、视黄醇结合蛋白,比较两组患者的营 养指标、肌力、机械通气时间及深静脉血 栓发生率、ICU 住院时间。
•Cochrane循证医学中心对 RCT的评价原则
Cochrane协作网关于干预 性研究系统评价手册5.1.0 版(2011年)
17a
ቤተ መጻሕፍቲ ባይዱ危害
19
报告各组主要 / 次要结局指标的结果, 23-30 效应估计值及精度(95%可信区间) 对于二分类结局指标,建议同时提供相 对效应值和绝对效应值 报告所做的其他分析,如亚组分析、调 整分析,指出哪些是预先设定的,哪些 是探索性的分析 报告各组出现的所有不良事件或非预期 28 效应
3.报告清单
分对 配随 隐机 藏方 案 的 偏倚 风险低
不清楚 高
使用研究者或研究对象能预见到的分配顺 序,例如:公开的随机分配表或透明的信 封等。
随机方案隐藏
偏移风 险低
2.评价原则
作者提及对研究对象及研究 信息不充分,无法 人员采取盲法,且不易识破; 判断。 或未采取但不影响结果。
实对 施研 者究 采对 取象 盲及 法干 预 偏倚 风险低
感谢在座各位聆听
文献质量评价

文献质量评价文献质量的评价一、文献质量评价的基本要素在进行文献质量评价时,应依据科学、规范的评价标准,而不是靠评价者的主观感觉、临床或研究经验来判断。
通常,文献质量评价的基本要素包括文献内部真实性、临床重要性和适用性3个方面。
(一)内部真实性内部真实性是指某个研究结果接近真值的程度,即研究结果受各种偏倚的影响程度。
偏倚主要来源于4个方面。
1.选择偏倚选择偏倚主要发生在选择和分配研究对象时。
如果在分配研究对象时,所采取的随机方法不完善,可能会造成各组的基线资料不具有可比性,从而亏大或缩小护理干预措施的效果。
另外,如果用于分组的随机序列公开化,使得研究者和研究对象能够预计到下一个研究对象会将会入选到哪一组,可能会掺杂研究者或患者的主观因素,从而带来偏倚。
因此,为了降低选择偏倚,在分配研究对象时,应采用严格的随机法,并对随机分配方案做到分配隐藏。
分配隐藏的措施包括下列几种:由不直接参与研究的药房人员或中心办公室人员控制随机分配方案;采用相同外观的、按顺序编号的药物容器;使用按顺序编号不透明密闭信封等。
分配方案的隐藏应至少维持到实际分配研究对象时,确定某研究对象被分配到哪一组后,不要随意改变分组情况。
2.实施偏倚实施偏倚主要发生在干预措施的实施过程中。
指除了要验证的措施外,向实验组和对照组提供的其他措施也不相同,从而出现系统偏差,降低实施偏倚的措施是将干预方案进行标准化,并尽可能对研究对象和干预提供者实施盲法。
如果干预提供者知道研究对象接受的时哪一种干预,会有意无意的对干预组的研究对象提供格外的关注;如果研究对象知道自己接受的是哪一种措施,会倾向于提供更多症状。
另外,在研究过程中,如果对照组的研究对象由于各种原因有意或无意地应用了实验组的措施,也会导致实施偏倚。
3.失访偏倚失访偏倚是指在研究的随访过程中,实验组和对照组因退出、失访、违背干预方案的人数或失访者的特征不同而造成的系统差异。
失访的原因往往是发生副反应、疗效差、出现并发症、搬迁或死亡等,如果失访率较高或各组间失访情况不一样,会使研究结果失真。
cochrane纳入的RCT文献质量评价(风险偏倚评估工具)中英文对照版
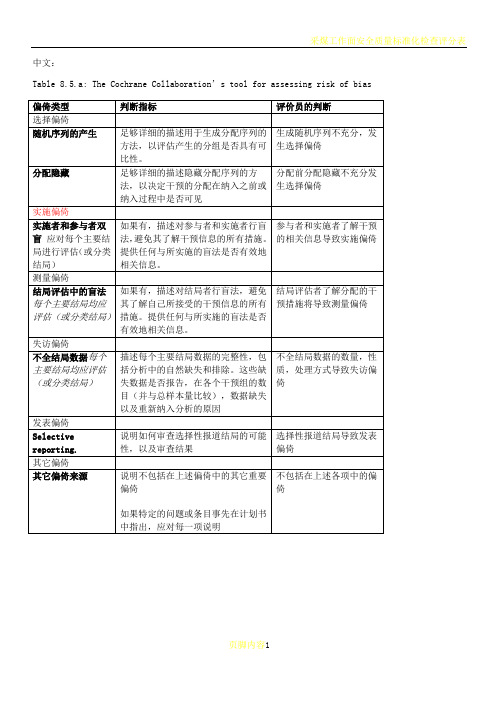
中文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment tool研究者描述随机序列产生过程譬如:参考随机数字表使用计算机随机数字生成器扔硬币洗牌的卡片和信封掷骰子抽签最小化*最小化,可实现无随机元素,被认为相当于是随机的。
研究者描述序列的产生使用的是非随机的方法。
通常是系统的非随机方法,例如:通过奇偶或出生日期产生序列通过入院日期产生序列通过类似住院号或门诊号产生序列相对于上面提到的系统方法,其它非随机的方法少见的多,也更明显。
通常包括对参与者进行判断或非随机的方法,例如:临床医生判断如何分配参与者判断如何分配基于实验室检查或系列测试的结果分配基于干预的可获取性进行分配中心分配(包括电话,网络,药房控制随机)相同外形的顺序编号的药物容器;顺序编号、不透明、密封的信封参与者以及纳入参与者的研究者可能事先知道分配,因而引入选择偏倚,譬如基于如下方法的分配:使用摊开的随机分配表(如随机序列清单)分发信封但没有合适的安全保障(如透明、非密封、非顺序编号)交替或循环出生日期病历号其它明确的非隐藏过程任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无盲法或盲法不充分,但系统评价员判断结局不太可能受到缺乏盲法的影响参与者和主要实施者均实施可靠的盲法,且盲法不太可能被打破任何如下标准:无盲法或盲法不充分,但系统评价员判断结局很可能受到缺乏盲法的影响尝试对关键的参与者和实施者行盲法,但盲法很可能被打破,结局很可能受到缺乏盲法的影响任何如下标准:没有足够信息判断为低风险或高风险研究未描述此情况任何如下标准:无缺失数据缺失数据的产生不大可能与真实结局相关(对于生存数据,删失不大可能引入偏倚)缺失数据的数目在各干预组相当,且各组缺失原因类似对二分类变量,与观察事件的发生风险相比,缺失比例不足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)不会大到影响观察的效应规模;缺失的数据用合适的方法进行估算任何如下标准:缺失数据的产生很大可能与真实结局相关, 缺失数据的数目及缺失原因在各干预组相差较大对二分类变量,与观察事件的发生风险相比,缺失比例足以影响预估的干预效应对连续性结局数据,缺失数据的合理效应规模(均数差或标准均数差)足以影响观察的效应规模;意向治疗分析中存在实际干预措施与随机分配的干预相违背的情况对缺失数据进行简单的不合适的估算任何如下标准:没有报道缺失或排除的情况,无法判断高风险或低风险(如未说明随机的数量,未提供数据缺失的原因)研究未描述此情况任何如下标准:实验的计划书可获取,系统评价感兴趣的所有首要或次要结局均按计划书预先说明的方式报道实验计划书不可得,但很明显发表的报告包括所有的结局,包括预先说明的结局(这种性质的有说服力的文字可能少见)任何如下标准:不是所有的预先说明的首要结局均被报道一个或多个首要结局为采用预先说明的测量方法、分析方法或数据子集来报道系统评价感兴趣的一个或多个首要结局报道不全,以至于不能纳入meta分析研究未报道此研究应当包含的主要关键结局具有与特殊试验设计相关的潜在偏倚来源或被指欺诈或其它问题可能存在偏倚风险,但存在以下两种中的一种没有足够信息评估是否存在其它重要的偏倚风险没有足够的证据认为发现的问题会引入偏倚Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies英文:Table 8.5.a: The Cochrane Collaboration’s tool for assessing risk of biasTable 8.5.d: Criteria for judging risk of bias in the ‘Risk of bias’ assessment toolprocess such as:Referring to a random number table;Using a computer random number generator;Coin tossing;Shuffling cards or envelopes;Throwing dice;Drawing of lots;Minimization*.*Minimization may be implemented without a random element, and this isconsidered to be equivalent to being random.judgement The investigators describe a non-random component in the sequence generation process. Usually, the description would involve somesystematic, non-random approach, for example:Sequence generated by odd or even date of birth;Sequence generated by some rule based on date (or day) of admission;Sequence generated by some rule based on hospital or clinic recordnumber.Other non-random approaches happen much less frequently than thesystematic approaches mentioned above and tend to be obvious. Theyusually involve judgement or some method of non-random categorization ofparticipants, for example:Allocation by judgement of the clinician;Allocation by preference of the participant;Allocation based on the results of a laboratory test or a seriesof tests;Allocation by availability of the intervention.Criteria for a judgement Participants and investigators enrolling participants could not foreseeassignment because one of the following, or an equivalent method, was usedto conceal allocation:Central allocation (including telephone, web-based andpharmacy-controlled randomization);Sequentially numbered drug containers of identical appearance;Sequentially numbered, opaque, sealed envelopes.judgement Participants or investigators enrolling participants could possiblyforesee assignments and thus introduce selection bias, such as allocationbased on:Using an open random allocation schedule (e.g. a list of randomnumbers);Assignment envelopes were used without appropriate safeguards(e.g. if envelopes were unsealed or nonopaque or not sequentiallynumbered);Alternation or rotation;Date of birth;Case record number;Any other explicitly unconcealed procedure.Criteria for a judgement Any one of the following:No blinding or incomplete blinding, but the review authors judgethat the outcome is not likely to be influenced by lack of blinding;Blinding of participants and key study personnel ensured, andunlikely that the blinding could have been broken.judgementAny one of the following:No blinding or incomplete blinding, and the outcome is likely tobe influenced by lack of blinding;Blinding of key study participants and personnel attempted, butlikely that the blinding could have been broken, and the outcomeis likely to be influenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or ‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No blinding of outcome assessment, but the review authors judge thatthe outcome measurement is not likely to be influenced by lack ofblinding;Blinding of outcome assessment ensured, and unlikely that theblinding could have been broken.judgementAny one of the following:No blinding of outcome assessment, and the outcome measurement islikely to be influenced by lack of blinding;Blinding of outcome assessment, but likely that the blinding couldhave been broken, and the outcome measurement is likely to beinfluenced by lack of blinding.judgement ‘Unclear risk’ ofAny one of the following:Insufficient information to permit judgement of ‘Low risk’ or‘High risk’;The study did not address this outcome.Criteria for a judgement Any one of the following:No missing outcome data;Reasons for missing outcome data unlikely to be related to trueoutcome (for survival data, censoring unlikely to be introducingbias);Missing outcome data balanced in numbers across interventiongroups, with similar reasons for missing data across groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk not enough to have a clinicallyrelevant impact on the intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesnot enough to have a clinically relevant impact on observed effectsize;Missing data have been imputed using appropriate methods.judgement Any one of the following:Reason for missing outcome data likely to be related to trueoutcome, with either imbalance in numbers or reasons for missingdata across intervention groups;For dichotomous outcome data, the proportion of missing outcomescompared with observed event risk enough to induce clinicallyrelevant bias in intervention effect estimate;For continuous outcome data, plausible effect size (difference inmeans or standardized difference in means) among missing outcomesenough to induce clinically relevant bias in observed effect size;‘As-treated’ analysis done with substantial departure of theintervention received from that assigned at randomization;Potentially inappropriate application of simple imputation.judgement ‘Unclear risk’ ofAny one of the following:Insufficient reporting of attrition/exclusions to permit judgement of ‘Low risk’ or ‘High risk’ (e.g. number ran domized not stated,no reasons for missing data provided);The study did not address this outcome.Criteria for a judgement Any of the following:The study p rotocol is available and all of the study’spre-specified (primary and secondary) outcomes that are of interestin the review have been reported in the pre-specified way;The study protocol is not available but it is clear that thepublished reports include all expected outcomes, including thosethat were pre-specified (convincing text of this nature may beuncommon).judgementAny one of the following:Not all of the study’s pre -specified primary outcomes have beenreported;One or more primary outcomes is reported using measurements,analysis methods or subsets of the data (e.g. subscales) that werenot pre-specified;One or more reported primary outcomes were not pre-specified(unless clear justification for their reporting is provided, suchas an unexpected adverse effect);One or more outcomes of interest in the review are reportedincompletely so that they cannot be entered in a meta-analysis;The study report fails to include results for a key outcome thatwould be expected to have been reported for such a study.judgementThere is at least one important risk of bias. For example, the study: Had a potential source of bias related to the specific study designused; orHas been claimed to have been fraudulent; orHad some other problem.judgement ‘Unclear risk’ ofThere may be a risk of bias, but there is either:Insufficient information to assess whether an important risk of bias exists; orInsufficient rationale or evidence that an identified problem willintroduce bias.Table 8.7.a: Possible approach for summary assessments of the risk of bias for each important outcome (across domains) within and across studies。
RCT文献评价工具

The Joanna Briggs Institute Critical Appraisal toolsfor use in JBl Systematic Reviews澳大利亚JBI循证卫生保健中心对RCT的真实性评价RCT是原始研究中质量最高的证据,对RCT进行文献质量评价的工具有Cochrane协作网的评价工具,澳大利亚JBI循证卫生保健中心的评价工具,英国文献质量评价项目CASP的评价工具等。
澳大利亚JBI循证卫生保健中心(2016)对RCT论文的质量评价工具包含13个评价项目。
评价者需对每个评价项目做出“是”、“否”、“不清楚”、“不适用”的判断,并最终经过小组讨论,决定该研究是纳入、排除,还是需获取进一步的信息。
此评价工具具体条目如下所示。
澳大利亚JBI循证卫生保健中心对RCT的真实性评价评价项目评价结果1. 是否对研究对象真正采用了随机分组的方法?是否不清楚不适用2. 是否做到了分配隐藏?是否不清楚不适用3. 组间基线是否具有可比性?是否不清楚不适用4. 是否对研究对象实施了盲法?是否不清楚不适用5. 是否对干预者实施了盲法?是否不清楚不适用6. 是否对结果测评者实施了盲法?是否不清楚不适用7. 除了要验证的干预措施外,各组接受的其他措施是否相同?是否不清楚不适用8.随访是否完整,如不完整,是否采取措施处理失访?是否不清楚不适用9. 是否将所有随机分配的研究对象纳入结果分析?是否不清楚不适用10. 是否采用相同的方式对各组研究对象的结局指标进行测评?是否不清楚不适用11. 结局指标的测评方法是否可信?是否不清楚不适用12. 资料分析方法是否恰当?是否不清楚不适用13.研究设计是否合理?在实施研究和资料分析过程中是否有不同于标准RCT之处?是否不清楚不适用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
data exist but do not have an impact on observed clinical effects. High risk of bias: missing outcome data do exist and have an impact on observed clinical effects. Uncertain risk of bias: insufficient reporting of attrition and exclusions to permit judgment of "Yes" or "No" of missing data and its effects.
提出问题,制定研究计划 检索资料 选择符合纳入标准的研究 纳入研究的质量评价 提取纳入文献的数据信息 资料的统计学处理 敏感性分析 形成结果报告
Tools for assessing quality and risk of bias
Scales(评分), in which various components of quality are scored and combined to give a summary score; Checklists(清单、分类), in which specific questions are asked
(2) Was allocation adequately concealed?
Low risk of bias: concealed allocation was
completed by clearly described methods so that either participants or investigators could not foresee assignment. High risk of bias: participants or investigators enrolling participants could possibly foresee assignments Uncertain risk of bias: insufficient information to permit judgment of 'Yes' or 'No' of concealment
不正确: 未采用盲法或盲法不完善,结果判断或测量会受影响 对患者和主要研究人员采用盲法,但盲法可能被破坏 对患者和主要研究人员均未采用盲法,可能导致偏倚:
不清楚 信息不全,难以判断是否正确 文中未提及盲法
(4) Were incomplete outcome data adequately addressed?
的人数较多; 不恰当应用简单赋值
不清楚: 信息不全,难以判断数据是否完整(缺失人数或原因未报
告); 文中未提及数据完整性问题
(5) Are reports of the study free of any suggestion of selective outcome reporting?
Allocation concealment(分配方案隐藏) Blinding (盲法) Selective outcome reporting(选择性报告结
Incomplete outcome data (结果数据不完整)
果) Other bias(其它影响真实性因素:无其它偏 倚)
Low risk of bias: the study appears to be
free risk of bias. High risk of bias: there is at least one important risk of bias existing in the study. Uncertain risk of bias: insufficient information to assess whether an important risk of bias exists.
Low risk of bias: all outcomes of interest in
the review have been reported in a prespecified way by the authors High risk of bias: not all outcomes of interest in the review have been reported in a prespecified way by the authors Uncertain risk of bias: insufficient information to permit judgment of 'Yes' or 'No' of this question.
Cochrane handbook5_0_1
第八章: Table 8.5.c: Criteria for judging risk of bias in the ‘Risk of bias’ assessment tool
Assessment of risk of bias
Sequence generation(随机分配方案产生 )
是否按顺序编码、密封、不透光
随机分配方案Байду номын сангаас隐藏
随机分配受试对象的过程中,受试对象和选
择合格受试对象的研究人员不能预先知道随 后的分配方案,目的在于防止选择性偏倚
未隐藏分配方案或分配方案隐藏不完善的试
验,常常夸大治疗效果(30%-41%)
(3) Was knowledge of the allocated intervention (s)
(2)分配方案隐藏
完善:
中心随机,包括采用电话、网络和药房控制的随机 按顺序编号或编码的相同容器 按顺序编码、密封、不透光的信封
不完善:
公开随机分配序列如列出随机数字 未密封、透光或未按顺序编号的信封 交替分配 根据住院号、生日等末尾数字的奇数或偶数
不清楚:
未提及分配方案隐藏 提供的信息不能判断是否完善,如使用信封,但未描述
adequately prevented during the study?
( Blinding?)
Low risk of bias: blinding of participants and key
study personnel, or the outcome measurement was not likely to be influenced by lack of blinding; High risk of bias: no blinding of participants and key study personnel, or the outcome measurement was likely to be influenced by lack of blinding Uncertain risk of bias: insufficient information to permit judgment of "Yes" or "No" of blinding
双盲(Double-blind):受试对象和试验措 施实施者双方都不知道干预措施分组情况。
三盲(Triple-blind):受试对象、研究者和 资料分析或报告者都不知道受试对象分配在 哪一组和接受哪一种干预措施。
不能把“分配隐藏”与盲法混淆 分配隐藏实质是产生随机序列者和决定分配
序别者不能参与纳入受试者,也不宜参与以 后的试验过程,尤其不能参与结果的测量。
RCT文献质量评价
严格文献评价 --证据的质量
表 循征医学证据分级水平及依据 推荐分级 治疗、预防、病因的证据 A 高质量 RCTs 的系统综述 B 单个大样本 RCT C 未使用 RCT 但设计很好的队列研究、病例-对照研 究或无对照的系列病例观察 D 专家个人意见、个例报告
Meta-分析的基本步骤
盲法 (Blindness)
临床试验中,试验的研究者或受试者,都不
知道试验对象的分配情况,即不知道受试对 象在试验组还是对照组,接受的是试验措施 还是对照措施。
盲法主要用于研究措施的实施者、 结果测量,
也可用于资料分析和报告
目的:避免测量性偏倚
盲法的分类
单盲(Single-blind):只是受试对象不知 道他们是在试验组或对照组。检验人员、病 理医师等不知道受试对象的诊断情况也属于 单盲。
结果数据不完整
完整: 无缺失数据; 缺失数据不影响结果分析(生存分析中缺失值); 组间缺失的人数和原因相似; 缺失数据不足以对效应值产生重要影响; 缺失数据采用恰当方法赋值 不完整: 组间缺失的人数和原因不平衡; 缺失数据足以对效应值产生重要影响;
采用“as-treated”分析(实际治疗分析 ),但改变随机入组时干预措施
隐蔽分组(分配隐藏)和盲法的概念、实施与报告 吴泰相 刘关键中国循 证医学杂志, 2007, 7(3): 222~225.
盲法
正确: 没有采用盲法,但结果判断和测量不会受影响 对患者和主要研究人员采用盲法,且盲法不会被破坏 对结果测量者采用盲法,未对患者和主要研究人员采用盲 法,但不会导致偏倚
For each entry, an answer ‘Yes’ indicates a low risk of bias, and an answer ‘No’ indicates high risk of bias, and ‘Unclear’ indicates unclear or unknown risk of bias.
