第四章晶体中的点缺陷与线缺陷第三讲
合集下载
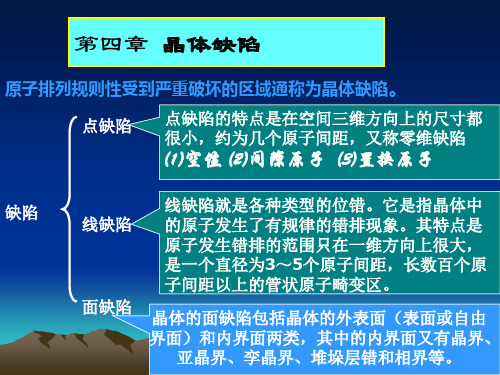
点线面缺陷

密度的变化: 简单地考虑肖脱基空位。 密度的变化: 简单地考虑肖脱基空位。空位的形 使得体积增加,由此而将引起密度的减小。 成,使得体积增加,由此而将引起密度的减小。
过饱和点缺陷(如淬火空位,辐照, 过饱和点缺陷(如淬火空位,辐照,塑性变形产生的大 量间隙原子-空位对)还可以提高金属屈服强度。 量间隙原子-空位第 三 节 原 子 的 不 规 则 排 列
(14)
• •
1.3.2.1 位错的基本类型 (2)螺型位错:左螺型位错、右螺型位错 螺型位错: 螺型位错 左螺型位错、 螺位错具有如下的几何特征: (1)螺位错线与其滑移矢量d平行,故纯螺位错只能是 直线。 (2)根据螺旋面的不同,螺位错可分左和右两种,当 螺旋面为右手螺旋时,为右螺位错,反之为左螺位错。 (3)螺位错没有多余原子面,它周围只引起切应变而 无体应变。
(11)
刃型位错的几何特征: 刃型位错的几何特征: (1)位错线与其滑移矢量 垂直,刃型位错可以为任意形 位错线与其滑移矢量d垂直 位错线与其滑移矢量 垂直,刃型位错可以为任意形 状的曲线。 状的曲线。 (2)有多余半原子面。 有多余半原子面。 有多余半原子面 习惯上, 习惯上,把多余半原子面在滑移面以上的位错称为 正刃型位错,用符号“ 表示,反之为负刃型位错, 正刃型位错,用符号“┻”表示,反之为负刃型位错, 表示。 用“┳”表示。刃型位错周围的点阵畸变关于半原子 面左右对称。 面左右对称。
(19)
P 11 12 13Q
O 8 9 10
76 5
4
P 12 13 Q 11
N 3 2 1 M
§1.3.2 线缺陷
第 三 节 原 子 的 不 规 则 排 列 1.3.2.2 柏氏矢量 (1)确定方法 ) a 在位错周围沿着 点阵结点形成 右螺旋的封闭 回路。(柏氏 回路) 回路) b 在理想晶体中按 同样顺序作同 样大小的 样大小 的 回路 。 c 在理想晶体中从 终点到起点的 矢量即为柏氏 矢量。 矢量。 1 2 3 1 2 3 4 4 3 2 1 2 1 1 1
第4章 晶体缺陷

刃位错的滑移
螺位错的滑移
刃、螺型位错的滑移特点
特征差异:
切应力方向不同 刃型:F⊥l;螺型:F∥l
位错运动方向与晶体滑移方向关系 刃型:运动方向与滑移 方向一致;螺型:运动方向与滑移方向垂直。 统一之处: 两者的滑移情况均与各自的b一致。
b) 位错环(混合型位错)的滑移
A、B处为刃型位错,C、D处为螺型位错,其余各处为 混合型位错。 位错环可以沿法线方向向外扩张而离开晶体;也可以反 向缩小而消失。
透射电镜下观察到的位错线
第三节 位错的能量及交互作用
位错线周围的原子偏离平衡位置,处于较高的能量状 态,高出的这部分能量称为位错的应变能(位错能)
一、位错的应变能
位错的应变能可分为:位错中心畸变能Ec和位错应 力场引起的弹性应变能Ee。 Ec:位错中心点阵畸变较大,需借助点阵模型直接考虑晶体
结构和原子间的相互作用,其能量约为总应变能的1/10~ 1/15,常予以忽略。
和间隙原子的“间隙-空位”对。
Frenkel defect
化合物离子晶体中的两种点缺陷 金属晶体:弗兰克尔缺陷比肖脱基缺陷少得多 离子晶体:结构配位数低-弗兰克尔缺陷较常见
结构配位数高-肖脱基缺陷较重要
间隙原子
定义:晶体中的原子进入晶格的间隙位置而形成 的缺陷。
Interstitial defect
b 2 r
Gb 2 r
b 2 r dr L L Gb
位错线
半原子面
刃型位错的特点
滑移面
a、属于线型位错,但在晶体中为狭长的管道畸变区;
b、是晶体中滑移区与未滑移区的分界线,不一定是 直线,也可以是折线或曲线; c、不能中断于晶体内部
《材料科学基础》课件之第四章----04晶体缺陷

41
刃位错:插入半原子面,位错上方,原子间距变小, 产生压应变,下方原子间距变大,拉应变。过渡处 切应变,滑移面处有最大切应力,正应力为0。x NhomakorabeaGb
2 (1 )
y(3x2 (x2
y2) y2 )2
y
Gb
2 (1
)
y(x2 y2) (x2 y2)2
z ( x y )
x
xy
Gb
2 (1 )
21
刃位错b与位错线 垂直
螺位错b与位错线 平行
bb
l
l
正
负
b
b
右旋
左旋
任意一根位错线上各点b相同,同一位错只有一个b。
有大小的晶向指数表示
b a [uvw] 模 n
b a u2 v2 w2 n
22
Burgers矢量合成与分解:如果几条位错线在晶体内
部相交(交点称为节点),则指向节点的各位错的伯氏矢量 之和,必然等于离开节点的各位错的伯氏矢量之和 。
不可能中断于晶体内部(表面露头,终止与 晶界和相界,与其他位错相交,位错环)
半原子面及周围区域统称为位错
18
2. 螺位错
晶体在大于屈服值的切应力作用下,以某晶面为滑移面发生滑移。由于位错线周围 的一组原子面形成了一个连续的螺旋形坡面,故称为螺位错。
几何特征:位错线与原子滑移方向相平行;位错线周围原子的配置是螺旋状的。
d
34
六、位错应变能
位错原子偏移正常位置,产生畸变应力, 处于高能量状态,但偏移量很小,晶格为弹 性应变。
位错心部应变较大,超出弹性范围, 但这部分能量所占比例较小, <10%,可以近似忽略。
35
1. 理论基础:连续弹性介质模型
晶体的缺陷

第四章 晶体的缺陷
原子绝对严格按晶格的周期性排列的晶体是不存 在的,实际晶体中或多或少都存在缺陷,至少晶 体不可能是无穷大的。晶体缺陷按几何形态划分 为点缺陷、线缺陷和面缺陷。
点缺陷是原子热运动造成的,在平衡时,这些热 缺陷的数目是一定的。缺陷的扩散不仅受到晶格 周期性的约束,还会发生复合现象。杂质原子的 扩散系数比晶体原子自扩散系数大。离子沿外电 场方向的扩散便构成了离子导电。
-e
Na+ Cl- Na+
用X射线或 射线辐照、用中子或电子轰击晶体。
色心是指晶体中存在的能对特定波长的光产生吸 收的点缺陷。在特定的条件下,很多材料中都可 观察到色心。容易产生色心的材料有碱金属卤化 物、碱土金属氟化物和部分金属氧化物。色心可 以在电离辐射的照射下产生,也可以在一定的氧 化或还原性气氛中加热晶体得到,还可以用电化 学方法产生出一些特定的色心。最常见并研究的 最充分的是碱金属或碱土金属卤化物中的F色心, F色心是俘获了电子的负离子空位。正离子空位 缺陷俘获空穴形成的色心称做V色心。另外,还 有其他类型的色心,如H色心、M色心和R色心 等。BaFBr:Eu中的F色心有F(F)和F(Br) 两种,分别对应于材料中俘获了电子的两种阴离 子空位。
替位式杂质在晶体中的溶解度也决定于原子的 几何尺寸和化学因素。如果杂质和基质具有相近的 原子尺寸和电负性,可以有较大的溶解度。但也只有 在二者化学性质相近的情况下,才能得到高的固溶 度。 元素半导体、氧化物及化合物半导体晶体中的 替位式杂质,通常引起并存的电子缺陷,从而明显 的改变材料的导电性。例如:Si晶体中含有As5+时, 由于金刚石四面体键仅需4个电子,所以每个As多 了一个电子;如果Si晶体中含有三价原子时,由于 共价键中缺少一个电子而形成电子空位即空穴,这 种掺杂的Si晶体都因杂质原子的存在而是电导率有 很大提高。
原子绝对严格按晶格的周期性排列的晶体是不存 在的,实际晶体中或多或少都存在缺陷,至少晶 体不可能是无穷大的。晶体缺陷按几何形态划分 为点缺陷、线缺陷和面缺陷。
点缺陷是原子热运动造成的,在平衡时,这些热 缺陷的数目是一定的。缺陷的扩散不仅受到晶格 周期性的约束,还会发生复合现象。杂质原子的 扩散系数比晶体原子自扩散系数大。离子沿外电 场方向的扩散便构成了离子导电。
-e
Na+ Cl- Na+
用X射线或 射线辐照、用中子或电子轰击晶体。
色心是指晶体中存在的能对特定波长的光产生吸 收的点缺陷。在特定的条件下,很多材料中都可 观察到色心。容易产生色心的材料有碱金属卤化 物、碱土金属氟化物和部分金属氧化物。色心可 以在电离辐射的照射下产生,也可以在一定的氧 化或还原性气氛中加热晶体得到,还可以用电化 学方法产生出一些特定的色心。最常见并研究的 最充分的是碱金属或碱土金属卤化物中的F色心, F色心是俘获了电子的负离子空位。正离子空位 缺陷俘获空穴形成的色心称做V色心。另外,还 有其他类型的色心,如H色心、M色心和R色心 等。BaFBr:Eu中的F色心有F(F)和F(Br) 两种,分别对应于材料中俘获了电子的两种阴离 子空位。
替位式杂质在晶体中的溶解度也决定于原子的 几何尺寸和化学因素。如果杂质和基质具有相近的 原子尺寸和电负性,可以有较大的溶解度。但也只有 在二者化学性质相近的情况下,才能得到高的固溶 度。 元素半导体、氧化物及化合物半导体晶体中的 替位式杂质,通常引起并存的电子缺陷,从而明显 的改变材料的导电性。例如:Si晶体中含有As5+时, 由于金刚石四面体键仅需4个电子,所以每个As多 了一个电子;如果Si晶体中含有三价原子时,由于 共价键中缺少一个电子而形成电子空位即空穴,这 种掺杂的Si晶体都因杂质原子的存在而是电导率有 很大提高。
第四章 晶体中的点缺陷和面缺陷

热平衡态点缺陷:纯净和严格化学配比的晶体中,由于体系能量涨落而形
成的,浓度大小取决于温度和缺陷形成能。
非平衡态点缺陷:通过各种手段在晶体中引入额外的点缺陷,形态和数量
完全取决于产生点缺陷的方法,不受体系温度控制。
晶体中引入非平衡态点缺陷的方法:
快速冷却 低温,形成过饱和点缺陷 (1)淬火 :高温---------
23
P22
(a)M离子空位VM″ ;
· X离子空位VX·
· (b)M离子填隙Mi· ; ( c)M离子错位MX; X离子错位X X离子填隙Xi″ M 24
6.带电缺陷:
对于离子晶体 MX ,如果取走一个 M2+和取走一个 M原子相比,少取了二个电子。 因此,M空位必然和二个附加电子 2e′相联系,如果这二个附加电子被束缚在 M空位上,则M2+空位可写成VM″(=VM2+); 同样,如果取走一个X2-,即相当于取走一个X原子加二个电子,则在X空位上留
16
表4-1为某些化合物的缺陷形成自由能。 目前,对缺陷形成自由能尚不能精确计算,但其大小与晶 体结构、离子极化等因素有关。
17
表2-7为由理论公式计算的缺陷浓度。由表中数据可见,随⊿Gf升高,温度降 低,缺陷浓度急剧下降。
当⊿Gf不太大,温度较高时,晶体中热缺陷的浓度可达百分之几。
18
§4-2 非热力学平衡态点缺陷
1
第四章 晶体中的点缺陷与线缺陷
理想晶体:热力学上最稳定的状态,内能最低,存在于0K。 真实晶体: 在高于 0K 的任何温度下,都或多或少地存在着对理想
晶体结构的偏离。 实际晶体结构中和理想点阵结构发生偏离的区域,就是晶体结 构缺陷。或:造成晶体点阵结构的周期势场畸变的一切因素,都称 之为晶体缺陷。 晶体结构缺陷与固体的电学性质、机械强度、扩散、烧结、化 学反应性、非化学计量化合物组成以及对材料的物理化学性能都密 切相关。只有在理解了晶体结构缺陷的基础上,才能阐明涉及到质 点迁移的速度过程。掌握晶体结构缺陷的知识是掌握材料科学的基 础。
成的,浓度大小取决于温度和缺陷形成能。
非平衡态点缺陷:通过各种手段在晶体中引入额外的点缺陷,形态和数量
完全取决于产生点缺陷的方法,不受体系温度控制。
晶体中引入非平衡态点缺陷的方法:
快速冷却 低温,形成过饱和点缺陷 (1)淬火 :高温---------
23
P22
(a)M离子空位VM″ ;
· X离子空位VX·
· (b)M离子填隙Mi· ; ( c)M离子错位MX; X离子错位X X离子填隙Xi″ M 24
6.带电缺陷:
对于离子晶体 MX ,如果取走一个 M2+和取走一个 M原子相比,少取了二个电子。 因此,M空位必然和二个附加电子 2e′相联系,如果这二个附加电子被束缚在 M空位上,则M2+空位可写成VM″(=VM2+); 同样,如果取走一个X2-,即相当于取走一个X原子加二个电子,则在X空位上留
16
表4-1为某些化合物的缺陷形成自由能。 目前,对缺陷形成自由能尚不能精确计算,但其大小与晶 体结构、离子极化等因素有关。
17
表2-7为由理论公式计算的缺陷浓度。由表中数据可见,随⊿Gf升高,温度降 低,缺陷浓度急剧下降。
当⊿Gf不太大,温度较高时,晶体中热缺陷的浓度可达百分之几。
18
§4-2 非热力学平衡态点缺陷
1
第四章 晶体中的点缺陷与线缺陷
理想晶体:热力学上最稳定的状态,内能最低,存在于0K。 真实晶体: 在高于 0K 的任何温度下,都或多或少地存在着对理想
晶体结构的偏离。 实际晶体结构中和理想点阵结构发生偏离的区域,就是晶体结 构缺陷。或:造成晶体点阵结构的周期势场畸变的一切因素,都称 之为晶体缺陷。 晶体结构缺陷与固体的电学性质、机械强度、扩散、烧结、化 学反应性、非化学计量化合物组成以及对材料的物理化学性能都密 切相关。只有在理解了晶体结构缺陷的基础上,才能阐明涉及到质 点迁移的速度过程。掌握晶体结构缺陷的知识是掌握材料科学的基 础。
第四章晶体缺陷
空位形成引起点阵畸变,亦会割断键力,故空位形成需能量, 空位形成能(ΔEV)为形成一个空位所需能量。
点缺陷是热力学稳定的缺陷: 点缺陷与线、面缺陷的区别 之一是后者为热力学不稳定的缺陷 。在一定温度下,晶体中
有一定平衡数量的空位和间隙原子,其数量可近似算出。
设自由能G=H-TS H为焓,S为系统熵(包括振动熵SV和排列熵SC) 空位的引入,一方面由于弹性畸变使晶体内能增加; 另一方面又使晶体中混乱度增加,使熵增加。而熵 的变化包括两部分: ① 空位改变它周围原子的振动频率引起振动熵,SV ② 空位在晶体点阵中的排列可有许多不同的几何 组态,使排列熵SC增加。
一些能量较大的质点 离开平衡位置后,进 入到间隙位置,形成间隙质点,而在原来位置上 形成空位
(2)肖特基空位: 如果正常格点上的 质点,在热起伏过程中 获得能量离开平衡位置迁移到晶体的表面,而在晶体
内部正常格点上留下空位
材料科学基础
2 间隙原子 原子或离子进入晶体中正常结点之间的间隙位置, 成为填隙原子(或离子)或间隙原子(或离子)。 从成分上看,填隙质点可以是晶体自身的质点,
Example 6.1 SOLUTION The lattice parameter of FCC copper is 0.36151 nm. The basis is 1, therefore, the number of copper atoms, or lattice points, per cm3 is:
Example 4.1 The Effect of Temperature on Vacancy Concentrations
Calculate the concentration of vacancies in copper at room temperature (25oC). What temperature will be needed to heat treat copper such that the concentration of vacancies produced will be 1000 times more than the equilibrium concentration of vacancies at room temperature? Assume that 20,000 cal are required to produce a mole of vacancies in copper.
晶体结构缺陷
含量一般少于0.1%。
类型:置换式杂质原子和间隙式杂质原子
特征: 杂质缺陷的浓度与温度无关。
只决定于溶解度 杂质缺陷对材料性能的影响
3. 非化学计量结构缺陷
定义:指组成上偏离化学计量而形成的缺陷。 特点:其化学组成随周围气氛的性质及其分压大 小而变化,它是产生n型和p型半导体的基础, 为一种半导体材料。 如: TiO2 x
离子尺寸因素
晶体结构类型
离子的电价因素
电负性因素
(1)离子尺寸因素
பைடு நூலகம்离子尺寸越接近,固溶体越稳定
15%规则:
r1 r2 r1
< 15%, 连续型固溶体MgO-NiO 15~30%,不连续型固溶体MgO-CaO > 30%,不形成固溶体
(2)晶体的结构类型
晶体结构类型相同,易形成连续型固溶体 例如:
1、 按杂质原子在固溶体中的位置分类
(1)置换型固溶体 杂质原子进入晶体中正常格点位置所生成的 固溶体。如:MgO-CaO,MgO-CoO,
PbZrO3-PbTiO3,Al2O3-Cr2O3等
(2)间隙型固溶体 杂质原子进入溶剂晶格的间隙位置所生成 的固溶体。
2、按杂质原子在晶体中的溶解度分类
1. 写缺陷反应方程式应遵循的原则
(1)位置关系 (2)质量平衡
(3)电中性
(1)位置关系
在化合物MaXb中,无论是否存在缺陷,其
正负离子位置数(即格点数)的之比始终是一
个常数a/b,即:
M位置数 a = X位置数 b
注意:
V、M X — —算位置 M i — —不算位置
位置增值、表面位置
热缺陷
杂质缺陷 非化学计量结构缺陷 其它:电荷缺陷,辐照缺陷……
4-晶体结构缺陷的类型
在一定温度下,热缺陷是处在不断地产生和 消失的过程中,当单位时间产生和复合而消失的 数目相等时,系统达到平衡,热缺陷的数目保持 不变。
根据质量作用定律,可以利用化学平衡方法 计算热缺陷的浓度。
1.化学平衡方法计算热缺陷浓度
(1)MX2型晶体肖特基缺陷浓度的计算
CaF2晶体形成肖特基缺陷反应方程式为:
2.间隙原子:亦称为填隙原子,用Mi、Xi来表示,其含义为M、X原子位
于晶格间隙位置。
3. 错位原子 错位原子用MX、XM等表示,MX的含义是M
原子占据X原子的位置。XM表示X原子占据M原子的
位置。
4. 自由电子(electron)与电子空穴 (hole)
分别用e,和h· 来表示。其中右上标中的一撇“,”
4.1.3.1杂质缺陷反应方程式
例1· 写出NaF加入YF3中的缺陷反应方程式 以正离子为基准,反应方程式为:
NaF Na Y ' 'FF 2V
YF3
F
以负离子为基准,反应方程式为:
例2· 写出CaCl2加入KCl中的缺陷反应方程式
以正离子为基准,缺陷反应方程式为:
CaCl2 Ca ClCl Cli '
4.1.3 杂质缺陷
对于杂质缺陷而言,缺陷反应方程式的一般式:
杂质 (组成缺陷或非本征缺陷) 缺陷反应方程式──杂 质在基质中的溶解过程,因此,固溶体即可以看作是 一种杂质缺陷。 杂质进入基质晶体时,一般遵循杂质的正负离子 分别进入基质的正负离子位置的原则,这样基质晶体 的晶格畸变小,缺陷容易形成。在不等价替换时,会 产生间隙质点或空位,
肖特基缺陷
弗仑克尔(Frenkel)缺陷
晶格中的原子由于热振动能量的涨落跳进间隙 位置,从而产生一个空位和一个填隙原子。这 是晶格中点缺陷的第二种类型。由于它是由弗 仑克尔最早提出的,因此把这种空位填隙原子 对称为弗仑克尔缺陷。 在一定的温度下,弗仑克尔缺陷的产生和复合 的过程相平衡。
根据质量作用定律,可以利用化学平衡方法 计算热缺陷的浓度。
1.化学平衡方法计算热缺陷浓度
(1)MX2型晶体肖特基缺陷浓度的计算
CaF2晶体形成肖特基缺陷反应方程式为:
2.间隙原子:亦称为填隙原子,用Mi、Xi来表示,其含义为M、X原子位
于晶格间隙位置。
3. 错位原子 错位原子用MX、XM等表示,MX的含义是M
原子占据X原子的位置。XM表示X原子占据M原子的
位置。
4. 自由电子(electron)与电子空穴 (hole)
分别用e,和h· 来表示。其中右上标中的一撇“,”
4.1.3.1杂质缺陷反应方程式
例1· 写出NaF加入YF3中的缺陷反应方程式 以正离子为基准,反应方程式为:
NaF Na Y ' 'FF 2V
YF3
F
以负离子为基准,反应方程式为:
例2· 写出CaCl2加入KCl中的缺陷反应方程式
以正离子为基准,缺陷反应方程式为:
CaCl2 Ca ClCl Cli '
4.1.3 杂质缺陷
对于杂质缺陷而言,缺陷反应方程式的一般式:
杂质 (组成缺陷或非本征缺陷) 缺陷反应方程式──杂 质在基质中的溶解过程,因此,固溶体即可以看作是 一种杂质缺陷。 杂质进入基质晶体时,一般遵循杂质的正负离子 分别进入基质的正负离子位置的原则,这样基质晶体 的晶格畸变小,缺陷容易形成。在不等价替换时,会 产生间隙质点或空位,
肖特基缺陷
弗仑克尔(Frenkel)缺陷
晶格中的原子由于热振动能量的涨落跳进间隙 位置,从而产生一个空位和一个填隙原子。这 是晶格中点缺陷的第二种类型。由于它是由弗 仑克尔最早提出的,因此把这种空位填隙原子 对称为弗仑克尔缺陷。 在一定的温度下,弗仑克尔缺陷的产生和复合 的过程相平衡。
晶体缺陷线缺陷
晶体滑移时,作用于微元位错dL上的 力Fd所做的功为:
Fd×dL×ds 外加切应力τ所做的功为:
τ×b×dL×ds 因为:Fd×dL×ds =τ×b×dL×ds 所以有: Fd =τ×b Fd 垂直于位错线沿位错线运动方向一致!
(2)位错滑移时作用在位错线上的力
Fd =τ×b
6.位错的交割
在滑移面上运动的某一位错,必与穿过 此滑移面上的其它位错相交截,该过程即为 “位错交割”。
空位
晶体结构中原来应该有原子的某些结点上因某种 原因出现了原子空缺而形成。
①肖特基空位 脱位原子进入其它空位或逐渐迁移至 晶面或界面。肖特基空位仅形成空位。
②弗兰克空位
脱位原子挤入节点的间隙,同时形成 间隙原子从而产生间隙原子-空位对。
间隙原子 晶体结构中间隙处因某种原因存在的同种原子。
一、点缺陷的类型 --- 空位和间隙原子
晶体缺陷名为缺陷但实际上是材料科学与工程的重要基础例如完美的晶体人们难以改变其性质而晶体的缺陷则赋予人们丰富的材料加工手段如材料的强化方法无不与位错有着直接或间接的关系材料的变形则是依赖于位错的运动实现的材料中的扩散主要借助于点缺陷及其运动
晶体缺陷线缺陷
复习:点 缺 陷
一、点缺陷的类型 --- 空位和间隙原子
“割阶”都是刃型位错,有滑移割阶和攀移割 阶,割阶不会因位错线张力而消失。
五、位错密度
单位体积晶体中所包含的位错线的总长度或穿越单位截 面积的位错线的数目(单位为m-2)。
ρ = S/V 或 ρ = n/A
①一般情况下,金属退 火后,位错密度为103 -104m/cm3。
②一般情况下,金属强 化后的位错密度为1014— 1016m/cm3。
1、位错的滑移
Fd×dL×ds 外加切应力τ所做的功为:
τ×b×dL×ds 因为:Fd×dL×ds =τ×b×dL×ds 所以有: Fd =τ×b Fd 垂直于位错线沿位错线运动方向一致!
(2)位错滑移时作用在位错线上的力
Fd =τ×b
6.位错的交割
在滑移面上运动的某一位错,必与穿过 此滑移面上的其它位错相交截,该过程即为 “位错交割”。
空位
晶体结构中原来应该有原子的某些结点上因某种 原因出现了原子空缺而形成。
①肖特基空位 脱位原子进入其它空位或逐渐迁移至 晶面或界面。肖特基空位仅形成空位。
②弗兰克空位
脱位原子挤入节点的间隙,同时形成 间隙原子从而产生间隙原子-空位对。
间隙原子 晶体结构中间隙处因某种原因存在的同种原子。
一、点缺陷的类型 --- 空位和间隙原子
晶体缺陷名为缺陷但实际上是材料科学与工程的重要基础例如完美的晶体人们难以改变其性质而晶体的缺陷则赋予人们丰富的材料加工手段如材料的强化方法无不与位错有着直接或间接的关系材料的变形则是依赖于位错的运动实现的材料中的扩散主要借助于点缺陷及其运动
晶体缺陷线缺陷
复习:点 缺 陷
一、点缺陷的类型 --- 空位和间隙原子
“割阶”都是刃型位错,有滑移割阶和攀移割 阶,割阶不会因位错线张力而消失。
五、位错密度
单位体积晶体中所包含的位错线的总长度或穿越单位截 面积的位错线的数目(单位为m-2)。
ρ = S/V 或 ρ = n/A
①一般情况下,金属退 火后,位错密度为103 -104m/cm3。
②一般情况下,金属强 化后的位错密度为1014— 1016m/cm3。
1、位错的滑移
晶体的缺陷
第四章 晶体的缺陷
4.1 晶体缺陷的基本类型
晶体缺陷按几何形态分,有点缺陷、线缺陷和面缺陷
4.1.1 点缺陷
( 1).弗仑克尔(Frenkel)缺陷 正常格点上的原子,无时无刻 不在作围绕平衡点的振动.由 于存在热振动的涨落,振幅达 的原子就会摆脱平衡位置而进 入原子间隙位置.这种由一个 正常原子同时产生一个填隙原 子和一个空穴的缺陷称为弗仑 克尔缺陷。
τ1:空位从一个格点跳到相邻格点所需等待的时间 τ2:填隙从一个间隙跳到下一个间隙所需等待的时间
假设τ2》τ1, 与空位相邻的原子跳入空位所要等待的时间
可得出单位时间内一个原子由正常格点跳到间隙位置变 成填隙原子的几率为
当τ1》τ2时,即空位从一个格点跳到相邻格点所需等 待的时间比填隙原子从—个间隙位经跳到相邻间隙位置 所需等待的时间长得多时,可以近似把空位看作相对静 止.由类似的分析可得
从N个院子中取出n个原子形成n个空位的可能方式数目
N! W N n 形成间隙院子的方式数目为
' N ! W1'' ' N n !n!
有缺陷后晶格的微观状态数目为
' N ! N ! W W1'W1''W0 ' N n !N n(n!) 2
4.3 热缺陷的统计理论
4.3.1 热缺陷的产生几率
弗仑克尔缺陷和肖持基缺陷,存在产生、运动 和复合问题. 当温度一定时,热缺陷的产生和复合达到平衡, 热缺陷的统计平均数目为一定值,热缺陷在晶体内均 匀分布.设晶体是由N个原子构成,空位数目为nl,填 隙原子数目为n2; P代表在单位时间内,一个正常格点 上的原子跳到间隙位置的几率,τ=l/P代表一个正常 格点上的原子成为填隙原子所需等待的时间.
4.1 晶体缺陷的基本类型
晶体缺陷按几何形态分,有点缺陷、线缺陷和面缺陷
4.1.1 点缺陷
( 1).弗仑克尔(Frenkel)缺陷 正常格点上的原子,无时无刻 不在作围绕平衡点的振动.由 于存在热振动的涨落,振幅达 的原子就会摆脱平衡位置而进 入原子间隙位置.这种由一个 正常原子同时产生一个填隙原 子和一个空穴的缺陷称为弗仑 克尔缺陷。
τ1:空位从一个格点跳到相邻格点所需等待的时间 τ2:填隙从一个间隙跳到下一个间隙所需等待的时间
假设τ2》τ1, 与空位相邻的原子跳入空位所要等待的时间
可得出单位时间内一个原子由正常格点跳到间隙位置变 成填隙原子的几率为
当τ1》τ2时,即空位从一个格点跳到相邻格点所需等 待的时间比填隙原子从—个间隙位经跳到相邻间隙位置 所需等待的时间长得多时,可以近似把空位看作相对静 止.由类似的分析可得
从N个院子中取出n个原子形成n个空位的可能方式数目
N! W N n 形成间隙院子的方式数目为
' N ! W1'' ' N n !n!
有缺陷后晶格的微观状态数目为
' N ! N ! W W1'W1''W0 ' N n !N n(n!) 2
4.3 热缺陷的统计理论
4.3.1 热缺陷的产生几率
弗仑克尔缺陷和肖持基缺陷,存在产生、运动 和复合问题. 当温度一定时,热缺陷的产生和复合达到平衡, 热缺陷的统计平均数目为一定值,热缺陷在晶体内均 匀分布.设晶体是由N个原子构成,空位数目为nl,填 隙原子数目为n2; P代表在单位时间内,一个正常格点 上的原子跳到间隙位置的几率,τ=l/P代表一个正常 格点上的原子成为填隙原子所需等待的时间.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2y
y
y
则化学式为:Ca2yZr1-yO2 x、y为待定参数,可根据实际掺入量确定。
写出固溶体的化学式后,即可确定质点占据正常格点的百分 含量。
如置换型固溶体CaxZrl~xO2-x中:
x Ca 实际所占分数= 1 1 x 4 Zr 实际所占分数= 1 2 x 2 O 实际所占分数= 2
2
(三)固溶体类型的实验判别
对于金属氧化物系统,最可靠而简便的方法
是写出生成不同类型固溶体的缺陷反应方程,根
据缺陷方程计算出杂质浓度与固溶体密度的关系,
并画出曲线,然后把这些数据与实验值相比较,
哪种类型与实验相符合即是什么类型。
1、理论密度计算
( 含 有 杂 质 的 ) 固 溶的 体晶 胞 质 量 W 理论密度 d理 晶胞体积 V
3、 举例 若固溶体的摩尔组成为 0.15molCaO 和 0.85molZrO2 ,写 成原子比形式为Ca0.15Zr0.85O1.85 。
置换式固溶体:化学式 CaxZrl~xO2-x
即X=0.15 1-X=0.85 2-X=1.85 可得X=0.15,所以置换固溶体的化学式为Ca0.15Zr0.85O1.85 ZrO2 属立方晶系,萤石结构, Z=4 ,晶胞中有 Ca2+ 、 Zr4+ 、 O2-三种质点。
2、活化晶格
3、固溶强化
4、形成固溶体后对材料物理性质的影响
1、稳定晶格,阻止某些晶型转变的发生
(1) PbTiO3是一种铁电体,纯PbTiO3烧结性能极差,居里
点为490℃,发生相变时,晶格常数剧烈变化,在常温下
发生开裂。PbZrO3是一种反铁电体,居里点为230℃。两 者结构相同,Zr4+、Ti4+离子尺寸相差不多,能在常温生
1 2TiTi 4OO 2Ti' Ti V 3Oo O 2 2
O
又∵
TiTi+e’= TiTi’
O
1 2TiTi OO 2TiTi 2e ' V
特点:点缺陷是带电溶质和填隙正离子。 低价置换高价,形成正离子填隙。
③阴离子填隙
2O3 2ZrO2 Y 2ZrY Oi 3OO
特点:点缺陷是带电溶质和填隙负离子。
高价置换低价,形成负离子填隙。
形成固溶体后对晶体性质的影响
1、 稳定晶格,阻止某些晶型转变的发生
d空
wi
i
n
V
由于d间与实测值更接近,所以形成间隙固溶体例。
4.5.5
非化学计量化合物
定义:把原子或离子的比例不成简单整数比或固定的比 例关系的 化合物称为非化学计量化合物。 实质:同一种元素的高价态与低价态离子之间的置换型 固溶体。
例
:方铁矿只有一个近似的组成Fe0.95O,它的结
构中总是有阳离子空位存在,为保持结构电 中性,每形成一个 V Fe ,必须有2个Fe2+转变 为Fe3+。
81.251023 (g)
W 81.25 1023 3 d理,间 6.014 g / cm V 135.11024
d实测=5.477g/cm3 ∴ 可判断生成的是置换型固溶体。
★
钇,化学符号Y。它是稀土金属元素之一,是一种灰色金
属。可制特种玻璃和合金。
【例】用 0.2molYF3加入CaF2中形成固溶体,实验测得 固体的晶胞参数a0=0.55nm,测得固溶体密度为
4.5.3 间隙型固溶体
形成间隙型固溶体的条件 填隙式固溶体的固溶度仍然取决于离子尺寸、离子价、 电负性,结构等因素。 1 杂质质点大小 即添加的原子愈小,易形成固溶体,反之亦然。 2 晶体(基质)结构 离子尺寸是与晶体结构的关系密切相关的,在一定程度 上来说,结构中间隙的大小起了决定性的作用。一般晶体 中空隙愈大,结构愈疏松,易形成固溶体。
子空位,加快扩散,有利于烧结进行。
3、固溶强化
定义:固溶体的强度与硬度往往高于各组元,而塑性则较低,
称为固溶强化。 固溶强化的特点和规律:固溶强化的程度 (或效果 )不仅取决 与它的成分,还取决与固溶体的类型、结构特点、固溶度、 组元原子半径差等一系列因素。 1)间隙式溶质原子的强化效果一般要比置换式溶质原子 更显著。 2)溶质和溶剂原子尺寸相差越大或固溶度越小,固溶强 化越显著。
d间
wi
i
n
V
0.8 0.2 2.2 4 40.08 4 88.9 8 19 3 1 1 2 3.659 g/cm 23 7 3 6.022 10 0.55 10
0.7 0.2 2 4 40.08 4 88.9 8 19 3 1 1 2 3.346 g/cm 23 7 3 6.022 10 0.55 10
固溶体的强度与硬度往往高于各组元,而塑性
则较低。
4.5.4 固溶体的研究方法
(一)、固溶体组成的确定 (二)、固溶体类型的大略估计 (三)、固溶体类型的实验判别
(一)固溶体组成的确定
1、点阵常数与成分的关系—Vegard定律
内容:点阵常数正比于任一组元(任一种盐)的
浓度。
实际应用:当两种同晶型的盐(如KCl-KBr)形
成连续固溶体Pb(ZrxTi1-x)O3,x=0.1~0.3。在斜方铁电体
和四方铁电体的边界组成Pb(Zr0.54Ti0.46)O3处,压电性 能、介电常数都达到最大值,烧结性能也很好,被命名为 PZT陶瓷。
(2) ZrO2是一种高温耐火材料,熔点2680℃, 但发生相变时
单斜四方
伴随很大的体积收缩,这对高温结构材料是致 命的。若加入CaO,则和ZrO2形成固溶体,无 晶型转变,体积效应减少,使ZrO2成为一种很 好的高温结构材料。
Wi
i 1
n
2、 固溶体化学式的写法
以 CaO 加入到 ZrO2 中为例, 以 1mol 基质晶体为基准 ,掺 入xmolCaO。
形成置换式固溶体:
2 '' CaO ZrO CaZr Oo VO
空位模型
x
x
x
则化学式为:CaxZrl~xO2-x 形成间隙式固溶体:
2 '' 间隙模型 2CaO ZrO Cai 2OO CaZr
于同样的外来杂质原子,可以预料形成填隙式固溶体的可能 性或固溶度大小的顺序将是沸石>萤石>TiO2>MgO.实验证
明是符合的。
常见填隙型固溶体的实例 ①原子填隙。金属晶体中,原子半径较小的H、C、B元素进
入晶格间隙形成间隙型固溶体。钢就是碳在铁中形成的填隙 型固溶体。
②阳离子填隙
2CaO Ca Ca Zr 2OO
计算方法1)先写出可能的缺陷反应方程式; 2)根据缺陷反应方程式写出固溶体 可能的化学式 由此可见,固溶体化学式的写法至关重要。 3)由化学式可知晶胞中有几种质点,计算出晶胞中i质点的 质量:
晶胞中i质点的位置数 i质点实际所占分数 i的原子量 i质点质量Wi 阿佛加德罗常数N0
据此,计算出晶胞质量W: W
3 电价因素 外来杂质原子进人间隙时,必然引起晶体结构中电价的不 平衡,这时可以通过生成空位,产生部分取代或离子的价态 变化来保持电价平衡。
例如 YF3加入到CaF2中:
YF3 Y 2FF Fi
CaF2
Ca
'
当F-进入间隙时,产生负电荷,由Y3+进入Ca2+位置来保持位 置关系和电价的平衡。 间隙式固溶体的生成,—般都使晶格常数增大,增加到一 定的程度,使固溶体变成不稳定而离解,所以填隙型固溶体 不可能是连续的固溶体。晶体中间隙是有限的,容纳杂质质 点的能力≤10%。
1.85 1.85
建立一一对应关系:2y=0.15/1.85×2, 1-y=0.85/1.85×2,
得 y=0.15/1.85 故间隙式固溶体化学式为Ca0.3/1.85Zr1.7/1.85O2
晶胞质量 W Wi
4
0.3 /1.85 1.7 /1.85 2 M Ca 2 4 M Zr 4 8 M O 2 1 1 2 6.022 1022
填隙型
Ca1xYx F2x
YF3 Y
CaF2 Ca
Ca1- 3 x VCa 1 x Yx F2 2 2 也可以写成Ca 3 Yx F2
1- x 2
1 '' VCa 3FF 2
空穴型
③由化学式对固溶体密度进行计算。 因CaF2是面心立方堆积,有4个分子,固溶体的密度分别为:
成连续固溶体时,固溶体的点阵常数与成分成
直线关系。
2、物理性能和成分的关系 固溶体的电学、热学、磁学等物理性质随成 分而连续变化。 实际应用:通过测定固溶体的密度、折光率
等性质的改变,确定固溶体的形成和各组成间
的相对含量。如钠长石与钙长石形成的连续固 溶体中,随着钠长石向钙长石的过渡,其密度 及折光率均递增。通过测定未知组成固溶体的 性质进行对照,反推该固溶体的组成。
非化学计量化合物可分为四种类型: 阴离子缺位型
阳离子填隙型 阴离子间隙型
阳离子空位型
一、阴离子空位型
Ti02、ZrO2会产生这种缺陷,分子式可写 为TiO2-x, ZrO2-x,产生原因是环境中缺氧, 晶格中的氧逸出到大气中,使晶体中出现了 氧空位。
缺陷反应方程式应如下: 1 2TiO2- O2 2Ti'Ti VO 3OO 2
1200C
2、活化晶格
形成固溶体后,晶格结构有一定畸变,处
于高能量的活化状态,有利于进行化学反应。
如,Al2O3熔点高(2050℃),不利于烧结, 是因为Al2O3 与TiO2形成固溶体,Ti4+置换
