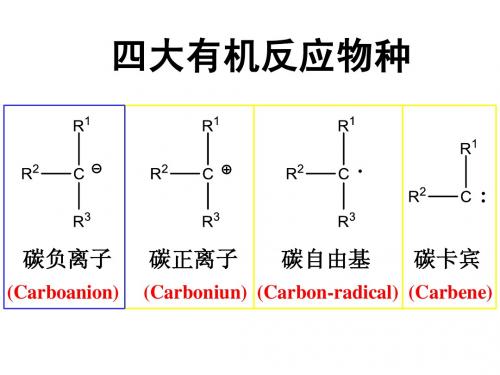
第四章导向基
7第四章碳负离子型延伸碳链反应2
酯的分子内醇解
γ-羟基酯
γ-内酯
24
25
26
4.3 酰基化反应
27
4.4 缩合反应
28
29
4.4.1 Knoevenagel反应
2.反应通式:
30
3.反应机理:(p103-104)
4.影响因素:反应的产率与羰基化合物的反应活性、位 阻、催化剂的种类及其它反应条件有关。
41
4.4.4 Dickmann缩合
分子内的Claisen酯缩合-Dickmann缩合
Dickmann(迪克曼)缩合反应主要用于制备 五元和六元环状β-酮酸酯。
42
4.4.5 Thorp反应
Thorpe反应与Dickmann缩合相似:
β-羰基腈
Dickmann(迪克曼)缩合反应主要用于制备五元和 六元环状β-酮酸酯。 但Thorpe缩合反应,只要改变反应条件,从二腈化 合物就能合成较满意的大环。在苯溶液中加入碱以及大 量的乙醚,反应在很稀的溶液中进行,产率可以提高到 95%(七元环)、 88%(八元环)、 60~80%(十四 元或更多元环). 43
1.自身缩合:碳链增加一倍
2.混合缩反应
醛、酮与没有α-氢的酯(甲酸酯、苯甲酸酯或 草酸酯)发生的缩合反应,制备β-酮或β-二酮的 重要方法。
脱羰基
(有机化合物致活策略)
导向基
在有机合成路线的设计中,经常需要用到导向基来引 导原子或原子团进入到某些特定的位置,然后再将导 向基除去,得到合成产物。
膦酸酯α-碳的去质子化, 生成碳负离子
氧负离子进攻磷原子, 生成氧杂的四元环中间体
62
63
56学时的课件,未完待续
64
塑料模具设计第七周 第一讲(第四章)

第七周第一讲目的和要求:了解注射模具导向机构设计(导柱导向机构、锥面和合模销精定位装置),初步了解脱模机构设计的内容(方式、原则),脱模力的计算,一次脱模机构。
重点难点:导柱导向机构、锥面和合模销精定位装置、一次脱模机构类型4.8 注射模具导向机构设计—每套塑料模具必备。
注射模具导向机构的作用:(1)在模具工作时,导向机构可以维持动模与定模的正确合模然后保持其型腔的正确形状;(2)导向机构可以引导动模按顺序合模,防止型芯在合模过程中损坏,并能承受一定的侧向力;(3)对于三板式结构的模具(双分型面注射模),导柱可承受卸料板和定模型腔板(点浇口的浇口板)的重载荷作用;(4)对于大型模具的脱模机构,或脱模机构中有细长推杆或推管时,导向机构可以保持其机构运动的灵活平稳。
4.8.1导柱导向机构导柱导向是指导柱与导套采用间隙配合,使导套在导柱上滑动,配合间隙有一定级别,主要零件有导柱和导套。
1. 导柱如图4-127所示,导柱主要有两种结构形式,一种是带头直通式导柱,用于简单小型模具。
小批量生产时,一般不需要导套,导柱直接与模板导向套配合;而在大多数情况下,导柱需要与导套配合。
另一种是有肩导柱,用于大型模具。
所有的导柱都必须具有足够的抗弯强度,且表面要耐磨,心部要坚韧,因此导柱材料多采用低碳钢渗碳淬火,或用碳素工具钢淬火处理,硬度大。
另外导柱的端部常设计成锥形或半球形,便于导柱顺利进入导套。
2. 导套导套的几种结构形式如图4-128所示,其中有直导套、I型带头导套和II型带头导套。
为使导柱进入导套比较顺利,在导套的前端倒一圆角。
导向孔最好打通,否则导柱进入未打通的导柱孔时,孔内气体无法逸出,产生反压力,给导柱的进入造成阻力。
当结构需要开不通孔时,就要在不通孔的侧面增加通气孔,或在导柱的侧壁磨出排气槽。
导套可用淬火钢或铜等耐磨材料制造,但其硬度应低于导柱硬度,这样可以改善摩擦,防止导柱或导套被拉毛。
导柱、导套的相关结构形式和尺寸,可由设计模具时选定的标准模架对应的导柱、导套结构形式和尺寸决定。
第四章导向基与合成的导向

3 2 4 5
β
1 α 6
CHO
CO 2H
+ CH3COOH
需导向
FGI
OH OH
dis
O 2
合成:
O 2
①Hg-Mg/苯 ②H3O+
OH OH
AI2O3/ 360℃
CH2(COOEt)2/C5H6N (Knoevenagel)
CO 2H
经验之四 以上两种单环化合物的合成中,片呐醇的制备及其酸性条件下 的脱水、亲核重排为片呐酮等,在有机合成中用途广泛。
合成:
NH2 + (CH3CO)2O
H2O
NHCOCH3
Br NHCOCH3 NHCOCH3 Br
NHCOCH3
+ Br2
CCI4
H2O / H+
TM
例2:设计N-丙基苯胺的合成路线。
HN
NH2
+
分析:
Br
这样拆开结果不好,因为反应产物的亲核性比反应物更强, 容易发生多烷基化的反应. 合成:
NH2
1)HOCI 2)OH O2/Ag/
C
C
C
C
C
C
C
O C C
古老方法,适合碱性条件
方法较新,适于中性 条件温和,适于酸性环境
C O C
CH3COOOH
-
H2O2 /HO
适用于αβ-不饱和羰基化合物
H2O2 , OsO4
C
C
催化剂较贵
通式:
C O C
C
+ 环氧化反应试剂
C
O
FGI
O O
O O
O
O
+
第四章导向基与合成的导向

CO 2H
Br + H3C CO2H
Br FGI
OH FGI
D_Adis
C O 2Et
+
C O 2Et
CO2Et CO2Et
合成:
C O 2Et
+
C O 2Et
LiAIH4
OH PBr3
Br
H2C(COOEt)2 NaOEt
①稀NaOH ②H+, △
CO2Et CO2Et
C O 2H + 2 HOEt + CO2
CH2(COOEt)2/ C5H6N (Knoevenagel)
CO2H
经验之四
以上两种单环化合物的合成中,片呐醇的制备及其酸性条件下 的脱水、亲核重排为片呐酮等,在有机合成中用途广泛。
例5 设计1,7- 二甲基-△1,9,7,8-六氢萘-2-酮的合成路线。 分析:
O
1,5 -dis
+
O
O
需活化导向
(1) 有利于合成的需要; (2) 便于引入; (3) 便于去掉。 招之即来,挥之即去。
三、导向基的选择与作用
有机合成中常用的导向方法有三种: 活化导向、钝化导向、封闭特定位置导向。
§4-1 活化导向——导向的主要手段
由于分子中引入导向基,分子的反应得到了活化,更有利 于反应进行;同时又起到了导向的作用,所以活化导向常是 导向的主要手段。
假设: ①C1处原是C=O。
②C2 之间C3有一个双健。
O
Ph
Ph
回忆几种除去它的方法。
OO C
+H
O
Br O
+
需活化导向
Br
合成:
CH3COCH2COOEt +
药物合成反应习题集.

《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2C CHCH 3CHCH 2Br(CH 3)2C 1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.O2CH 2OH CH 2CH 2OHOCH 2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 32CH 2C(COOC 2H 5)NHCOCH 3CH 2Br2CH 2C(COOC 2H 5)39.CH 2NO 2CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
导向基与合成的导向

O O
O
O
+
2
O
活化导向
合成:
2
O
?
O
O COOEt NaOEt
EtO2C
O O
O ?
CH3CO3H
O O
经验之八
遇到环状或开链的环氧结构,可拆开为烯健。
例7:设计2-甲基-6-烯丙基环己酮的合成路线。 分析:
O
1,4-dis
O
+
Br
这样的拆开是合理的,但再合起来时,有可能生成α和α’两处被 取代的混合产物,为了得到唯一产物,就需要活化导向.
O
+
O C OEt
HO -
O O
三乙
OEt
合成:
O O
NaOEt Br Ph
O O OEt Ph
O Ph
OEt
经验之一
当在有机合成中需要丙酮作原料时,为导向并活化,可改用乙酰 乙酸乙酯。
例2:设计β-[4-环己烯]基丙酸的合成路线。
分析:
CO 2H
Br
FGI
+
H3C CO 2H
Br
FGI
CO 2Et
O
经验之五 C=O基化合物的α-氢也可以用酯基活化导向。
经验之六
Michael加成反应,是合成六员环及其衍生物的重要手 段。
经验之七
无论在合成开链或环状化合物中,羟醛型缩合反应都有 着重要的用途,也是合成环状化合物的重要手段。
例6:设计3,5,5-三甲基-2,3-环氧环己酮的合成路线。 分析:
O
环氧羰基化合物,1,2-环氧结构有哪些 O 合成方法呢?
OH
合成:
+
邻位导向基团作用机理

邻位导向基团作用机理全文共四篇示例,供读者参考第一篇示例:邻位导向基团作用是有机合成领域中一个重要的概念,其机理涉及到分子结构的性质和化学反应的进行。
在有机化学中,邻位导向基团通常指的是对位或邻位上的一个基团,它可以通过各种方式影响分子的反应性和立体结构。
邻位导向基团的作用机理是一种非常有趣且复杂的化学现象,它可以极大地影响有机合成的产率和选择性。
邻位导向基团作用最常见的形式是在芳香性化合物中出现。
芳香性化合物的芳香环上的基团会对邻位的反应产生显著影响。
一个典型的例子是苯甲酸的自由基取代反应。
当苯环上存在一个甲基基团时,自由基取代反应通常发生在对位或邻位上,而不是在间位或远位上。
这是因为邻位上的基团可以通过电子共轭效应影响到自由基的攻击位置,从而导致反应发生在邻位。
邻位导向基团作用的机理可以从分子结构和反应动力学两个方面来解释。
从分子结构的角度来看,邻位导向基团可以通过空间位阻效应或电子效应影响分子的构象和电子分布,从而影响反应的进行。
空间位阻效应可以阻碍反应中间体的形成,导致反应发生在邻位。
而电子效应则可以调控反应活性,使得反应偏向于在邻位进行。
从反应动力学的角度来看,邻位导向基团可以通过影响反应的速率常数和选择性改变反应的进行。
基团的存在可以改变反应的活化能,使得反应更容易发生在邻位。
基团还可以影响反应的选择性,使得特定位置上的反应优先进行。
邻位导向基团作用是有机合成中一个重要且广泛存在的现象。
通过深入研究和了解邻位导向基团作用的机理,我们可以更好地设计和控制有机反应的进行,提高产率和选择性。
希望本文可以帮助读者更好地理解和应用邻位导向基团作用机理。
【2000字】第二篇示例:邻位导向基团作用机制是有机化学中一个重要的结构化学概念,它指的是分子中的一个基团对邻近位置上的反应活性产生影响,从而导致不同的反应途径或产物选择。
邻位导向基团作用机制在有机合成中具有广泛的应用,可以有效地控制反应的方向性和产物的选择性。
第五章 导向基与保护基

O
O OC2H5 Ph
KOH,△ KOH,△
O
O OK Ph
H3+O,△ O,△
O
Ph
Example 2:
COOH Br
+ CH3COOH
• 乙酸的α-H不够活泼! • 引入乙酯基(导向基),使α-H活化,以丙二酸 二乙酯为原料。 • 完成任务后,将酯基水解成羧酸,再利用两个羧 基连在同一碳上受热容易失去CO2的特征将导向基 去掉。
ROH
Li,NH3
ROCH2Ph
问题:反应机理?
• 四)形成甲氧基甲醚(ROCH2OCH3) 制备时,使用甲氧基氯甲烷与醇类 作用,并以三级胺吸收生成的HCl。
ROH
ClCH2OCH3,i-Pr2NC2H5 TiCl4或CF3CO2H
ROCH2OCH3
注意:甲氧基甲醚在碱性条件下和一般质子酸中有 相当的稳定性,但此保护基团可用强酸或Lewis酸 在激烈条件下脱去。
Example: :
Br Br
目标分子
①HNO2 ②H3PO2 / H2O Br NO2 Fe + HCl NH 2 Br2 Br NH2 Br
Br
总产率: 总产率:64%~71%
相关知识点回顾:定位规律
属于第一类取代基的主要有:-O - 、-NR2 、 -NHR、-NH2、-OH、-OR、-NHCOR、-OCOR、 -F、-Cl、-Br、-I、-NHCHO、-C6H5、-CH3、 -C2H5、-CH2COOH、-CH2F等; 属于第二类取代基的主要有:—N(+)R3、— CF3 、—NO2 、—CN、—SO3H、—COOH、—CHO、— COOR、—COR、—CONR2、—N(+)H3和—CCl3等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1
活化是导向的主要手段
O Ph
O Ph
设计苄基丙酮 的合成路线
O
+
Br
Ph
直接采用上述方法制备的苄基丙酮收率低,因为 反应中除了副反应丙酮的自身缩合外,还会有对称的 二苄基丙酮等副产物形成:
4.1
活化是导向的主要手段
拟解决这个困难的办法在于设法使丙酮的两个甲 基有显著的活性差异。在合成时使用的原料是乙酰乙 酸乙酯,任务完成后将乙酯基水解成羰基,再利用 β -酮酸用于脱羧的性质将导向基去掉。
4.1
活化是导向的主要手段
O Br2 HBr Br O
O O O 1) NaOEt OC2H5 2)
Br O
C2H5O2C O
4.1
活化是导向的主要手段
O O
O
第四章 导向基的引入
OCH2Ph
O
O
OCH2Ph FGI O O Ar CO2H OH Ar FGI O CO2H
Ar
+
O CO2H
4.1
O CH3COCl AlCl3
MgBr
OH
H+
H2 Pd C
4. 2
钝化也能导向
活化能够导向,纯化能不能导向呢?回 答是肯定的,不妨在此举一些例子来说明:
NH2
1 )氨基是很强的邻,对位定位基,进 行取代反应时容易生成多元取代物。
NH2 Br NH2 Br
+ 3 Br2
Br
Br
+
3 HBr
4. 2
NH2 NHCOCH3 H2SO4 HNO3 NHCOCH3 NHCOCH3 NO2
+
NO2
如要制备邻—硝基 苯胺,则需采用封闭特定 位置进行导向合成:
微量
NH2
NO2
4.3 利用封闭特定位置进行导向
NH2 NHCOCH3 H2SO4 SO3H
NHCOCH3 NO2 57% H SO 2 4 NH2 NO2
4.3 利用封闭特定位置进行导向
OH OH CO2+ KHCO3 57~60% OH Br2+ HOAc OH CO2H 57~63%
合 成
Br
OH Br OH CO2H 90~92%
OH
OH
本法的巧妙之处在于无论羧基的引入和脱去都利用了间一苯二 酚的结构特点,原来两个互居间位的羟基是有利于在环上引入羧基, 而在脱羧-反应中,羧基的邻对位的两个羟基则有利于它的脱去。
PhNH
PhNH2
+
Br
4. 2
钝化也能导向
解决的办法是将胺酰化,生成的酰胺可用 LiAlH4还原为所要的胺:
中具有定域化的未共享电子对, 比原来的 PhNH2 活性要小。
4.3 利用封闭特定位置进行导向
NH2 NO2
1〕分析:苯胺容易被氧化。如果苯胺 直接用硝酸作硝化剂,则苯 胺容易被氧化成为复杂的氧 化产物。如果用混酸硝化, 则主要产物是间-硝基苯胺。
4.3 利用封闭特定位置进行导向
OH Cl Cl
Cl OH Cl OH
+
Cl2
苯环上的亲电核取代反应中羧基是邻,对位定位 基,要使两个氯原子只进入羟基的两邻位,需要先将 羟基的对位值封闭,这个可以利用叔丁基为阻塞基, 它有下列两个特点: 1)叔丁基体积大,具有一定的空间阻碍效应,不 仅可以堵塞它所在的部位,还能旁及其左右两侧;
活化是导向的主要手段
Ar CO2C2H5 CO2C2H5 NaBH4
Ar CO2C2H5 1) NaOH H2O CO2C2H5 + 2) H OH
O
4.1
O
活化是导向的主要手段
(α-甲基-6-烯丙基环已酮-1)的合成
O
O
+
Br
可以预料,当 α- 甲基环乙酮与烯丙基溴作用时会生 成混合产物,这个困难可以利用活化导向的办法来解决。
钝化也能导向
如果要在苯胺的苯环上只要取代一个溴原子,则必 须将氨基的活性降低,这可以通过乙酰化反应来达到:
O CH3 C NH
当乙酰苯胺进行溴化时 ,主要产物是对位溴代乙酰 苯胺。
NH2 NHCOCH3 NHCOCH3 NH2
合成:
Br Br
4. 2
PhNH
钝化也能导向
目标分子如上拆开结多烷基化的反应:
第四章
设计
导向基的引入
1,3,5—三溴苯的合成:
Br
Br
Br
第四章 导向基的引入 第四章 导向基的引入
那么,什么基团可以满足上述要求?显然,根据 我们所学的知识会想到氨基,它是一个强的邻,对位 定位基,即便于如下方式引入: —H —NO2 —NH2
也便于如下去掉: —NH2 —N2+OSO3H —H
N+H3HSO4 N+H3 NaOH NO2 NO2 NH2
NH2 H2SO4
HNO3
反应同时生成一定量的邻位和对位的硝基苯胺,但 间位硝基苯胺的收率则随硫酸的浓度增加而提高。
4.3 利用封闭特定位置进行导向
如果要防止在用硝酸作用时苯胺被氧化,又要使代 入的基团主要进入到原来氨基的邻,对位处,则可以使 氨基乙酰化,使苯胺以N-乙酰基衍生物参加反应。
第四章 导向基的引入 第四章 导向基的引入
NO2 NH2 Br NH2 Br Br
N2+OS
Br
Br
Br
Br
Br
4.1
活化是导向的主要手段
同样是为了导向,有时需要采用不 同的手段。在上例中,氨基所以能充任 导向基,是由于它对邻对位有较强的活 化作用。
利用活化作用来导向,是导向手段 中使用最多的,可以下面我们可举出的 众多实例得到证明。
4.1
O
活化是导向的主要手段
O
_
O CHO
+ HCO2CH3
O
NaOMe
O CH
O CHO OH
_
_
O
O H
_ OH
O
O H OH
_ O
+
HCO2H
4.1
1 2 3
活化是导向的主要手段
1)分析:要拆开这个化合物,困难在于它是一个 官能团的烃类化合物,似乎是“无懈可击”,为将两 个环之间的饱和碳链拆开,我们不妨设想在合成过程中 碳链上曾存在着官能团, 就创造了“可乘之机”。 首先设想 C1 是个羰基的碳原子,做这样的设想是允 许的,因为羰基通过下列反应是可以变回亚甲基的。
CO2H CO2H
CH3CO2H + CO2
R R
CO2H CO2H
R R
CO2H + CO2
+
CO2C2H5
CO2C2H5
1) LiAlH4 2) PBr3
Br
CO2Et CO2Et
Na+
CO2C2H5 CO2C2H5
1) H+ 2)
CO2H
4.1
O
活化是导向的主要手段
O
O O O O
+
需要活化导向
O NH
Ph Ph
O Cl
Ph
+
H2N Ph O
Cl PhH O
4.1
活化是导向的主要手段
4.1
活化是导向的主要手段
1)分析:若用最大的侧链中的分 支点为指南,我们就可 以放入一个羟基:
OH
TM
O
+
MgBr
H
+
CH3COCl
4.1
活化是导向的主要手段
2 )合成:要注意,对付氏反应来说,只有一个活泼 位置可起反应,即两个甲基的邻,对位, 而不是甲基之间的那个位置(位阻)。
4.3 利用封闭特定位置进行导向
2) 叔丁基易于从环上去掉而不致扰动环上的其它取代基, 叔丁基的除去可用热解作用,但更方便的办法是将化 合物与苯中与三氧化铝共热,使发生烷基转移作用。
OH
(CH3)2C=CH2, H2SO4 Cl2 / Fe
OH
OH Cl Cl
OH Cl Cl
课堂作业
CH3 Cl
设计出目标 化合物的合 成路线:
Br Br
O 1) H3+O CO2CH3 2)
O
4.1
O H
活化是导向的主要手段
O H2/Cat O
1) NaBH4 2) TsCl 3) LiAlH4
4.1
Ph N H
Ph p
活化是导向的主要手段
Ph
R
1
2C
R
N OH
LiAlH4 Na,C2H5OH
R
1 2 CH
R
NH2
Ph p
N H
FGI Ph
NHCOCH3
HNO3
SO3H
在反应的过程中用磺酸基封闭乙酰氨基的对位,这就是以“先 来居上”的手段使磺酸基霸占对位,以致在随后的硝化的硝基只能 进入邻位,最后水解,不仅使磺酸基去掉,也使乙酰基水解为氨基。
4.3 利用封闭特定位置进行导向
OH Br HO
HO OH Br OH
+
HO
Br2
间—苯二酚的直接溴化要控制在一取代是很困难的 ,这不仅因为羟基对芳环有较强的活化效应,还由于 两羟基互居间位,具有相互增强活化作用。 解决这一问题的办法可以在溴化之前先引入一个羧 基,封闭一个溴原子要进入的部位,同时也降低了环上 亲电取代的活性,溴化完毕再将羧基去掉。
4.1
O O
活化是导向的主要手段
O C2H5ONa OC2H5 _
O KOH, OC2H5 Ph Ph OK H+ Ph O
O OC2H5 Na
