14:勒夏特列原理应用易错点精析
《化学反应原理》主题之——勒夏特列原理应用分析

《化学反应原理》主题之——勒夏特列原理应用分析【化学平衡理论】1、化学平衡定义:2、勒夏特列原理:3、勒夏特列原理的应用:【讨论归纳】生产生活实例涉及的平衡根据勒原理所采取的措施或原因解释1.接触法制硫酸2SO2+O22SO3通入过量的空气2.合成氨工业N2+3H22NH3高压(20MPa-50MPa),及时分离液化氨气3.金属钠从熔化的氯化钾中置换金属钾Na + KCl NaCl + K↑控制好温度使得钾以气态形式逸出。
4.候氏制碱法NH3+CO2+H2O==NH4HCO3NH4HCO3+NaCl NaHCO3↓+NH4Cl先向饱和食盐水中通入足量氨气5.草木灰和铵态氮肥不能混合使用CO32-+H2O HCO3-+ OH-NH4++H2O NH3·H2O + H+两水解相互促进,形成更多的NH3·H2O,损失肥效6.配置三氯化铁溶液应在浓盐酸中进行Fe3++3H2O Fe(OH)3+3H+在强酸性环境下,Fe3+的水解受到抑制7.用热的纯碱水洗油污或对金属进行表面处理CO32-+H2O HCO3-+OH-加热促进水解,OH-离子浓度增大1、下列事实中不能用勒夏特列原理来解释的是()A.往硫化氢水溶液中加碱有利于S2-的增加B.加催化剂有利于合成氨反应C.合成氨时不断将生成的氨液化,有利于提高氨的产率。
D.合成氨时常采用500℃的高温2、已知工业上真空炼铷(熔融)原理如下:2RbCl +Mg == MgCl2 +2Rb(g),对于此反应的进行能给予正确解释的是()A.铷的金属活动性不如镁强,故镁可置换铷B.铷的沸点比镁低,把铷蒸气抽出时平衡右移C.氯化镁的稳定性不如氯化铷强D.铷的单质状态较化合态更稳定3、在加热条件下,KCN 溶液中会挥发出剧毒的HCN,从平衡移动的角度来看,挥发出HCN的原因是。
为了避免产生HCN,应采取的措施是向KCN溶液中加入。
4、把FeCl3溶液蒸干并灼烧,最后得到的主要固体产物是其原因是。
高三化学一轮复习《化学反应平衡》《勒夏特列原理的应用》精品
对于可逆反应:N2(g)+3H2(g)
2NH3(g); △H<0,下列图象正确的是:
【交流与讨论】小组内交流你的解题思路
整理课件
5
【变式练习】 25℃时,在密闭容器中发生如下反应:
升高温度
H2(g)+I2(g) 减小反应
2HI(g) ΔH<0 加压或使 用催化剂
物浓度
若t3、t5、t6时都只改变了一种条件,根据上图判断:
样的温度下达到平衡状态时,则下列物理量如何变化?
① H2的转化率 不变
2倍 ②HI(g)的浓度
③HI(g)的百分含量 不变
整理课件
8
【变式训练】
(1)某温度下在密闭容器甲中发生如下反应:
N2(g)+3H2(g)
2NH3(g); △H<0,
若开始时只充入1mol N2和3mol H2,达到平衡状态后测得NH3的 百分含量为m%。则:
总压强为0.10 MPa。
平衡状态由A变到B时,
平衡常数K(A)
K(B)
(填“>”、“<”或“=”)。
②若在某恒压条件下,请画出N2的平衡转化率(α)与温度的 关系图像:
【思考】若要提高N2的转化率:还可以采取哪些措施? 该措施会使平衡如何移动?平衡常数K值如何变化 ?
整理课件
4
【典型例题2】 二.勒夏特列原理与图像相结合的应用
12
链接高考
(10山东.28)
一定温度下,向1L密闭容器中加入1mol HI(g)发生反应:
2HI(g)
H2(g)+I2(g) ΔH>0,
H2物质的量随时间的变化如图所示。相同温度下,若开始
b 加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
14勒夏特列原理应用易错点精析

14勒夏特列原理应用易错点精析勒夏特列原理是量子力学中最重要的原理之一,它被广泛应用于原子、分子和固体物理等领域,用于解释和预测微观粒子的行为。
然而,由于勒夏特列原理的复杂性和深度,其应用常常容易出现一些易错点。
下面将对勒夏特列原理的应用易错点进行精析。
首先,勒夏特列原理的应用易错点之一是对态的表示的不正确。
勒夏特列原理指出,一个多粒子系统的所有态可以由各个粒子的单粒子态的直积表示。
然而,在具体应用中,很容易将态的表示定义错误,特别是在考虑相同粒子的情况下。
例如,在考虑两个全同粒子组成的系统时,每个粒子的态可以是自旋向上或向下,那么系统的两个粒子的态可以有四种情况:两个粒子都向上、两个粒子都向下、一个粒子向上一个粒子向下、一个粒子向下一个粒子向上。
这种表示方式是错误的,因为勒夏特列原理要求全同粒子的交换对最终的态没有影响,所以两个粒子的态只能是两种情况,即两个粒子都向上或两个粒子都向下。
其次,勒夏特列原理的应用易错点之二是对哈密顿算符的选择错误。
勒夏特列原理要求多粒子系统的哈密顿算符必须对应于各个粒子的哈密顿算符的直和,即H=H1+H2+...+Hn。
然而,在实际应用中,很容易选择错误的哈密顿算符形式,导致结果的错误。
例如,在考虑两个全同粒子组成的系统时,每个粒子的哈密顿算符可以是自旋向上或向下的能量,那么系统的哈密顿算符可以有四种情况:两个粒子都向上、两个粒子都向下、一个粒子向上一个粒子向下、一个粒子向下一个粒子向上。
这种选择方式是错误的,因为勒夏特列原理要求哈密顿算符是各个粒子哈密顿算符的直和,即只有两种情况,即两个粒子都向上的能量和两个粒子都向下的能量。
最后,勒夏特列原理的应用易错点之三是对全同粒子体系的对称性的识别错误。
勒夏特列原理要求多粒子系统的波函数必须是对称或反对称的,具体取决于粒子的统计性质。
然而,在具体应用中,很容易忽略或错误识别粒子的统计性质,导致波函数的对称性错误。
例如,在考虑两个自旋向上的全同粒子组成的系统时,由于自旋向上只有两个粒子的态,如果错误地将其视为对称态,则波函数的对称性将错误,因为两个全同粒子的交换反对称,应该是反对称态。
勒夏特列原理应用

一、勒夏特列原理应用(平衡移动原理)1、根据条件的改变,判断平衡移动地方向2、根据平衡移动的方向,判断条件的改变例题:在高温下,反应2HI(g)H2(g)+I2(g)正反应为吸热反应,达到平衡时,要使混合气体的颜色加深,可采取的方法是()A、减小压强B、缩小体积C、升高温度D、增大H2的浓度例题:在密闭容器中发生如下反应:aX(g)+bY(g)cZ(g)+dW(g)反应达平衡后,保持温度不变,将气体体积缩小到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍,下列叙述不正确的是()A、平衡向逆反应方向移动B、a+b>c+dC、Z的体积分数增加D、X的转化率下降3、勒沙特列原理还适用于下列情况:①溶解平衡②电离平衡③水解平衡例题:把Ca(OH)2放入一定量水中,一定温度下达到平衡Ca(OH)2(s)Ca(OH)2(溶液)Ca2++2OH—,当向悬浊液中加入少量生石灰后,若温度保持不变,下列正确的是()A、溶液中Ca2+数减少B、c(Ca2+)增大C、c(OH—)不变D、c(OH—)增大4、重难点透析:(1)化学平衡的建立与反应途径无关,从正反应或逆反应开始都可以建立平衡状态。
可逆反应,同时向正、逆两方向进行,但只要V正≠V逆,在外观上反应就会向某个方向进行,最终使V正=V逆(2)化学平衡的移动原因:反应条件改变引起V正≠V逆方向:向速率相对大的方向移动结果:速率、组成含量均发生改变,重新建立新条件下的平衡(3)平衡移动与反应速率是既有联系又有区别的两个不同概念。
一个平衡向哪个方向移动,由正、逆两个反应速率相比较决定的。
而正、逆反应速率大小则由条件决定。
例题:2A(g) 2B(g)+C(g)-Q(未使用催化剂),改变一个外界条件而能满足下列量的改变,请将相应的改变条件填入空格上。
⑴使υ正增大,而c(A)不变___________ ⑵使υ正减小,而c(B)增大___________⑶使υ正增大,而c(C) 减小____________⑷使υ逆增大,而c(A)减小___________(4)平衡发生移动时,并不是所有的量都变,平衡不移动时也并不是所有量都不变。
高中化学——勒夏特列原理定义及相关知识点练习

勒夏特列原理:定义:如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。
勒夏特列原理又叫平衡移动原理。
注意事项:(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)增大并不意味着平衡一定向正反应方向移动,只有V正>V逆时才可以肯定平衡向正反应方向移动。
(3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
习题:1.下列事实,不能用勒夏特列原理解释的是A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率B.对2HIH2+I2平衡体系增加压强使颜色变深C.开启啤酒瓶后,瓶中立刻泛起大量泡沫D.滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深2.下列不能用勒夏特列原理解释的是()A.Fe(SCN)3溶液中加入固体KSCN后颜色变深B.棕红色NO2加压后颜色先变深后变浅C.SO2催化氧化成SO3的反应,往往需要使用催化剂E.合成氨工业中通入过量氮气可提高H2转化率3.下列事实不能用勒沙特列原理解释的是()①氯化铁溶液加热蒸干最终得不到氯化铁固体②铁在潮湿的空气中容易生锈③实验室可用排饱和食盐水的方法收集氯气④常温下,将1mL pH=3的醋酸溶液加水稀释至l00mL,测得其pH<5⑤钠与氯化钾共融制备钾Na(l)+KCl(l)=熔融K(g)+NaCl(l)4.下列事实中能应用勒沙特列原理来解释的是A.往硫化氢水溶液中加碱有利于S2-的增加B.加入催化剂有利于氨氧化的反应C.高压不利于合成氨的反应D.500℃左右比室温更有利于合成氨的反应1.解析:A、硫酸工业中,增大O2的浓度平衡向生成三氧化硫的反应进行,因此有利于提高SO2的转化率,适用于勒夏特列原理;B、对2HIH2+I2平衡体系增加压强,反应速率加快,但反应前后体积不变,因此平衡不移动。
浅谈勒夏特列原理的一点应用

动,所以,增加 PCl5 的浓度,平衡必然向正方向移动;
问题中所涉及的过程,就是Ⅰ→Ⅱ的过程,这个过程中等效于
(2)由勒夏特列原理知,增大压强,平衡向体积缩小的方向移 经过一个中间过渡状态Ⅲ的Ⅰ→Ⅲ→Ⅱ的整个过程。
动。所以,增加 PCl5 的浓度,相当于增大体系的压强,压强增大,平
平衡移动方向的判断:为使讨论中只有单个因素改变,可以直
起的变化,否则,就会产生错误的判断。
引起多个因素的同时改变,分析平衡移动时就必须单一因素逐个
图像解释法:
进行分析。
对这个问题的整个过程可用下图表示:
作者单位:山东省临邑县第一中学化学组
再谈启发式在高中化学课堂教学中的运用
■崔恒荣
Hale Waihona Puke 我们知道,启发式教学在教学实践中 水平与心理特点设计课堂教学程序,力求
三、重视实验教学
2009 -1
教学实践
浅谈勒夏特列原理的一点应用
■张成新
化学平衡知识是中学化学教学中的一个难点,在运用勒夏特 列原理判断平衡移动方向时,经常会碰到与勒夏特列原理有矛盾 的问题,特别是浓度对化学平衡移动的影响,其判断有时会使学生 感到束手无策,请看下面一个例子:
t℃时,在 1L 密闭容器中加入 1 mol PCl5 后,反应:PCl(5 g) PCl(3 g)+Cl(2 g)达到平衡,当向体系中再加入 1 mol PCl5 反应物时, 对该化学平衡的移动有两种解释:
勒夏特列原理是这样表述的:如果改变影响平衡的任一个条 移动,只有过程Ⅲ→Ⅱ才影响平衡移动,所以,可以把过程Ⅰ→Ⅱ
件(如浓度、温度、压强等)时,平衡就向减弱这种改变的方向移动。 总的平衡移动影响因素看作就是过程Ⅲ→Ⅱ的平衡移动影响因
如何处理用勒夏特列原理处理此类问题

如何处理用勒夏特列原理处理此类问题皖智教育 胡征善 勒夏特列原理是平衡移动的原理——若改变影响平衡的一个条件(如浓度、压强或温度),平衡就向能够减弱这种改变的方向移动。
但是下面的问题勒夏特列原理就遇到了“麻烦”! 恒温下,密闭容器内反应:CaCO 3(s)CaO(s)+CO 2(g)建立平衡,反应的平衡常数K = c 平(CO 2)。
一、恒温恒容(设容积为V L)时,若充入x mol CO 2,再次建立平衡后,平衡常数不变K = c 平(CO 2),则:1、若x <c 平(CO 2)V ,因平衡常数不变即c 平(CO 2)不变,充入的x mol CO 2完全反应。
并不是“减弱这种改变”,而是“这种改变”完全消失了。
2、若x =c 平(CO 2)V ,充入的x mol CO 2将CaO 全部反应,体系中没有了CaO ,不存在化学平衡了,但容器内) c (CO 2)=c 平(CO 2。
3、若x >c 平(CO 2)V ,体系中没有CaO ,不存在化学平衡,容器内c (CO 2)>c 平(CO 2)。
就2、3两点来说,只改变影响平衡物质的浓度,平衡可以“消失”!二、恒温恒压(变容)时,改变反应体系的压强,再次建立平衡后,平衡常数亦不变K = c 平(CO 2),则:1、增大反应体系的压强,平衡后c 平(CO 2)[V (前)—V (后)]的CO 2全部转化为CaCO 3,也不是“减弱这种改变”,而是压强增大的倍数被平衡完全“消灭”了。
2、若减小反应体系的压强(不妨作如下处理):设有x molCaCO 3参加反应,平衡后反应体系的体积为V L 。
现减小压强,使反应体系的体积变为a V L(a >1),若x >a Vc 平(CO 2),再次建立平衡,c (CO 2)被减小的量全部CaCO 3由分解补充。
若x =a Vc 平(CO 2),反应体系中没有CaCO 3存在,不存在化学平衡。
若再减小压强,容器内c (CO 2)<c 平(CO 2)。
三招攻克勒夏特列原理

三招攻克勒夏特列原理作者:王京来源:《散文百家·下旬刊》2018年第08期勒夏特列原理统领化学平衡移动方向,是分析化学平衡的精髓。
由于原理抽象,使其成为化学平衡习题中较难攻克的对象。
一、勒夏特列原理内容勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向能够减弱这种改变的方向移动。
勒夏特列原理适用范围广,化学平衡、溶解平衡、电离平衡、水解平衡等均可应用。
其内涵意义深远,隐含的考点很多,是历年来全国及各省市高考命题的热点和难点。
二、攻克勒夏特列原理三妙招1.吃透“只减弱不消除”。
例1:已知可逆反应2NO2N2O4 △H解析:体系颜色将先变深后变浅。
本题考查的重点是勒夏特列原理中的“减弱”。
其他条件不变时,体积压縮至原平衡的一半,各组分浓度在瞬间增至原来的2倍,颜色先变深。
又由于增大压强平衡必向气体体积减小的方向移动,即向生成N2O4(无色)方向移动,故体系颜色又变浅。
勒夏特列原理中强调“只减弱这种改变”,意味着并不消除这种改变,新平衡NO2的浓度仍比原平衡中NO2的浓度大,所以新平衡体系颜色即使后变浅也要比原平衡体系的颜色深些。
我们只要吃透勒氏原理的精髓“只减弱不消除”,就可以顺利解除类似这种颜色随压强多变的困扰。
2.注意。
同等程度的改变反应混合物中各组分的浓度,应视为压强的影响。
例2:已知N2+3H22NH3,恒温恒容某密闭容器起始投入1molN2,3molH2,达平衡时N2的体积分数为20%。
若其他条件不变,起始投入2molN2,6molH2,达平衡时N2的体积分数 20%。
(填“大于”“小于”或“等于”)解析:小于。
图示分析如下:将两次的反应物分别通人如下的两个密闭容器中:达到平衡后,三份气体必为等效平衡,现在对第二次的容器作以下变化:由于增大压强此平衡向正反应方向移动,不再是原平衡状态,此条件下虽两次所加反应物的物质的量之比相等,但①、②不等效。
本题解题思路是先建立“等效平衡“,分析可知开始2投料量是开始1投料量的二倍,体积也是二倍,与开始1等效(即恒温恒压条件下等效)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
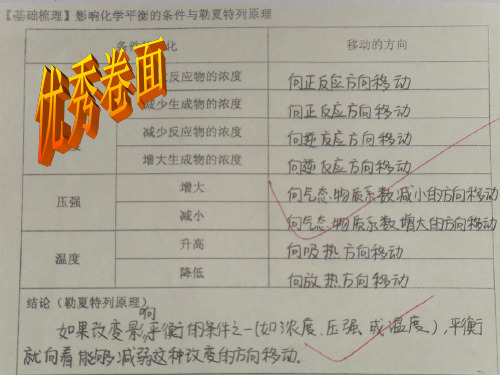
勒夏特列原理应用易错点精析一、勒夏特列原理内容浓度、压强、温度对化学平衡的影响可以概括为平衡移动原理,又称之为勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强、温度等)平衡就向减弱这种改变的方向移动。
该原理是判断平衡移动方向的重要依据,适用于所有的动态平衡,如:化学平衡、电离平衡、溶解平衡等。
1)浓度:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应向正方向进行。
减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应向反方向进行。
反之亦然。
2)压强:增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行。
减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向逆方向进行。
反之亦然。
3)温度:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行。
4)催化剂:仅改变反应进行的速度,不影响平衡的改变,即对正逆反应的影响程度是一样的。
二、勒夏特列原理应用的易错点1.改变条件却没有改变平衡【例1】某密闭容器,放入一定量的SO2、O2,发生反应2SO2+O22SO3(正反应放热),在达到平衡后,采取下列措施可以使得平衡向右移动的为()A.通如 N2B.升温C.减少体积D.加入 SO3【易错选】A【错选原因】A选项中通入氮气之后,因为是密闭容器,所以容器内的压强增大,由勒夏特列原理可知,平衡向体积减少的方向移动,所以平衡向右移动。
【错选分析】在影响平衡的条件中,压强改变平衡是通过改变反应物的浓度来改变的,通入氮气后,反应物的浓度并没有改变,所以平衡不移动。
勒夏特列原理是在平衡移动的成立,平衡不移动,勒夏特列原理就不适用。
而勒夏特列原理只适用于改变条件能导致平衡移动的反应。
【正确选项】B【总结】密闭容器中进行的可逆反应,达到平衡后,在温度不变的条件下,通入不参加反应的气体,如:N2、稀有气体等,平衡并没有移动,此时就不能用勒夏特列原理。
2.只有一种反应物【例2】在恒温时,一固定容器内发生如下反应2NO2(g)N2O4(g)(正反应放热),达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体的相对分子质量减小的是()A.通入 Ne B.通入 NO2C.通入 N2O4D.降低温度【易错选】B【错选原因】通入NO2后,NO2的体积分数增大,由勒夏特列原理可知,平衡向减弱这种改变的方向进行,但是不能消除这种改变,故NO2的体积分数最终还是增大的,所以混合气体的平均相对分子质量变小。
【错误分析】在2NO2(g)N2O4(g)的反应中,反应物只有一种,即:NO2,再通入NO2后,相当于压强变大,平衡向右移动,NO2的体积分数最终会变小,其混合气体的平均相对分子质量变大。
【正确选项】A【总结】在多种反应物的可逆反应达到平衡之后,加入其中的一种反应物,重新达到平衡后,可以使得其他反应物的转化率升高,而本身的转化率降低,本身的体积分数变大。
但是只有一种反应物的平衡要区别对待。
3.发生其他反应【例3】浅绿色Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O Fe(OH)2+2H+,若向该溶液中滴加足量的盐酸,则溶液的颜色()A.变黄B.变深C.变浅D.无变化【易错选】B【错选原因】加入盐酸后,溶液中的H+的浓度增大,由勒夏特列原理可知,平衡向逆反应方向移动,Fe2+的浓度增大,所以溶液的颜色要变深。
【错误分析】Fe(NO3)2溶液中存在大量的Fe2+和NO3—,加入盐酸后,NO3—在大量H+的作用下具有很强的氧化性,可以将Fe2+氧化为Fe3+,因为Fe3+在溶液中显黄色,所以溶液要变黄。
【正确选项】A【总结】在有多个反应发生时,要从宏观的角度分析主反应,抓住主要因素。
4.溶液的稀释【例4】已知:草酸(H2C2O4)是二元弱酸,0.1mol/L的KHC2O4溶液中存在如下的平衡:HC2O4-+H2O H2C2O4+OH-,若向该溶液中加水,则下列说法正确的是( )A.溶液中 c(HC2O4-)和 c(OH-)都减小B.溶液中 c(OH-)增大C.HC2O4-的水解平衡逆向移动D.溶液的 pH 增大【易错选】B、D【错选原因】加入水后,由勒夏特列原理可知,水的参与使得平衡向正反应方向移动,所以c(OH-)增大。
【错误分析】加入水后,造成了溶液的稀释,而溶液稀释的话,平衡就向溶液中粒子数量增多的方向移动,因而平衡是向正反应方向移动。
但是整个溶液中离子的浓度是减小的,因为溶液增加的倍数大于溶液中离子浓度增加的倍数。
【正确选项】A【总结】在溶液中存在的平衡不仅要考虑平衡的移动,还要看溶液存在的各种离子之间是否会发生反应,如果可以发生反应,那么并非仅仅是平衡的移动的问题了。
三、勒夏特列原理应用过程中的注意点1、勒夏特列原理的适用条件:勒夏特列原理是一条普遍的规律,它对于所有的动态平衡(包括物理平衡)都是适用的,但必须注意,它只能应用在已经达到平衡的体系,对于未达到平衡的体系是不能应用的。
2、勒夏特列原理对维持化学平衡状态的因素的改变才是有效的,若改变的不是维持化学平衡状态的因素无效。
例如:对于化学平衡CO(g)+H2O(g)CO2(g)+H2(g),你改变系统的总压,不会引起平衡的移动,因为总压不是维持这一平衡状态的因素。
同样,你若改变催化剂的用量或组成,也不会引起平衡移动,因为催化剂不是维持化学平衡的因素。
3、只能影响化学平衡的一个条件。
如:对于一个已达平衡的可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。
如果既增大压强,又升高温度,我们就不能用勒夏特列原理判断平衡向哪个反应方向移动了。
因为增大压强,使平衡向正反应方向移动,而升高温度又会使平衡向逆反应方向移动,我们无法判断出平衡向哪个方向移动。
4、“减弱”并不等于抵消和消除。
增大一种反应物浓度化学平衡会向正反应方向移动。
如对于反应a(g)+b(g) c(g),增大a的浓度,平衡正向移动,此时我们都知道a、b浓度减小,c浓度增大,达到新平衡时,要使平衡常数不变,a浓度会不会降低到等于或小于原平衡浓度呢?根据K=c(c)/c(a) c(b)可知,新平衡中a浓度应大于原平衡浓度,由此可见,平衡移动的结果,仅仅是减弱外界条件的影响,而不能完全抵消外界条件的变化量。
四、纠错练习1、在 CH3COOH CH3COO—+H+的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是()A.加入 NaOHB.加入盐酸C.加水D.升高温度2、一定温度下,存在下列平衡:Ca(OH)2(s) Ca2+(aq)+OH−(aq),当向一定量石灰乳悬浊液加入少量生石灰时,下列说法正确的是()A.溶液中 Ca2+离子数目减少B.溶液中 c(Ca2+)增大C.溶液中 pH 增大D.溶液中溶质的质量分数增大3、在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则()A.平衡向逆反应方向移动了B.物质 A 的转化率减少了C.物质 B 的质量分数增加了D.a>b4、二氧化氮存在下列平衡:2NO2(g) N2O4(g)+Q 在测定 NO2的相对分子量时,下列条件中较为适宜的是()A.温度 130℃、压强 3.03×105PaB.温度 25℃、压强 1.01×105PaC.温度 130℃、压强 5.05×104PaD.温度 0℃、压强 5.05×104Pa5、在密闭容器中,反应 2HI H2+I2(正反应吸热),当达到平衡时,欲使混合气体颜色加深,可采取的措施有()A.减小容器体积B.升高温度C.加入催化剂D.恒容下充入 HI 气体6、勒沙特列原理是自然界一条重要的基本原理。
下列事实能用勒沙特列原理解释的是()A.NO2气体受压缩后,颜色先变深后变浅B.对 2HI(g) H2(g)+I2(g)平衡体系加压,颜色迅速变深C.合成氨工业采用高温、高压工艺提高氨的产率D.配制硫酸亚铁溶液时,常加入少量铁屑防止氧化7、下列不能用平衡移动原理解释的事实是A.压缩盛有 I2和 H2混合气体的针筒,气体颜色变深B.pH 均为 4 的盐酸和 NH4Cl(aq)中水的电离度后者大C.打开汽水瓶盖,即有大量气泡逸出D.用排饱和食盐水的方法收集氯气8、下列事实不能用勒夏特列原理解释的是A.用浓氨水和氢氧化钠制取氨气B.加热蒸干 AlCl3溶液不能得到无水 AlCl3C.工业上 SO2和 O2在常压下生成 SO3D.水中的 c(H+)比 0.1 mol/LNaOH 溶液中的大9、下列实验事实或数据不能用勒沙特列原理解释的是A. B.C. D.10、有以下描述的事实:①氯化铁溶液加热蒸干最终得不到氯化铁固体;②铁在潮湿的空气中容易生锈;③实验室可用排饱和食盐水的方法收集氯气;④在可逆反应中,使用催化剂有利于提高反应物的转化率;⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l);⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深。
其中能用勒夏特列原理解释的是A.①②③B.④⑤⑥C.①③⑤D.①③④⑤【参考答案】1.D2.A3.C4.C5.D6.A7.A8.C9.B10.C。
