第七章 配位平衡
18-药用化学基础-第七章-配位平衡与配位滴定法

H 2[PtCl6]
酸
[Cu(NH3)4] (OH)2 碱
配 合 物
[Cu(NH3)4] SO4 [Ni(CO)4]
盐
电中性
2、配合物的组成
❀ 配合物的组成: [ Cu ( NH 3 ) 4 ] SO4
中心原子 配体 配位数
内界(配离子)
外界
配合物
(1)内界与外界:
①内界:具有一定稳定性的结构单元。
③举例:
形成体
(中心离子或中心原子)
[Cu(NH3)4]2+ [Fe(CN)6]3Cu2+ Fe3+ Pt2+ Fe原子 Si4+
[PtCl2(NH3)I2]
[Fe(CO)5] [SiF6 ]2-
(3)配位体和配位原子:
①配位体:(配体)
在配合物中,与中心离子(或原子) 相结合的分子或离子,称为配位体,简 称配体。 例如:
(4)配位数
直接与中心离子(或原子)结合的配位原子的数目。 配位数=配位键数目 配合物 [Cu(NH3)4] 2+ [Cu(en)2] 2+ [Co(en)2(NH3) Cl] 2+ 配位数 4 4 6 配位原子 N N N、N、Cl
练习:
一、指出下列配合物的配位原子和配位数: 配合物 配位原子 Cl、N N N N Cl、N 配位数 4 6
通常K稳较大,为书写方便常用lgK稳来表示。 (2)lgK稳的影响因素:
①配体的电荷越高,配离子的lgK稳值越大。
②配体的半径越小,配离子的lgK稳值越大。
6、配离子稳定常数的应用: 计算配合物中有关离子的浓度。 例7-1:
在含有0.10 mol/L [Cu(NH3)4]2+ 配离子溶 液中,当NH3浓度分别为 (1)1.0 mol/L, (2)2.0 mol/L 时, 处于平衡状态时游离Cu2+的浓度分别是 多少? (已知 [Cu(NH3)4]2+ 的 K稳=2.1×1013)
溶液中的化学平衡-配位平衡

工业废水中的重金属离子常通过配位反应进行沉 淀或吸附,从而达到净化废水的目的。
环境化学中的配位平衡问题
土壤污染修复
土壤中的重金属离子与有机配体发生配位反应,影响重金属的迁移 和生物有效性,从而影响土壤污染修复效果。
水质监测与净化
水体中的重金属离子、有机污染物等可通过配位反应进行转化和去 除,确保水质安全。
02
在化学分析中,可以利用配位平衡常数来计算溶液中各组分的浓度。
03
在生物学中,配位平衡常数可以用来描述生物体内的金属离子与蛋白 质、酶等生物大分子之间的相互作用。
04
在环境科学中,配位平衡常数可以用来研究重金属离子在土壤、水等 环境介质中的迁移转化行为。
04
配位平衡在化学反应中的作 用
配位反应的速率影响
由能变化等参数,从而预测反应结果。
05
实际应用中的配位平衡问题
工业生产中的配位平衡问题
1 2 3
金属冶炼
在金属冶炼过程中,配位平衡对于控制金属离子 的溶解度和稳定性至关重要,直接影响金属的提 取率和纯度。
化学品的合成与分离
许多化学品的合成和分离涉及到配位平衡,如利 用配位反应合成有机金属化合物、分离稀有元素 等。
03
配位平衡的计算与表示方法
配位平衡的计算
配位平衡是溶液中一种重要的化学平衡, 主要涉及配位体和中心离子之间的相互 作用。
配位平衡的计算通常需要使用平衡常数,如 稳定常数和不稳定常数,来描述配位体和中 心离子之间的结合和解离程度。
平衡常数的值取决于温度、压力和 溶液的组成,可以通过实验测定或 计算得出。
形成配合物的条件
金属离子和配位体需要在一定的条件下形成配合物,如温度、压 力、浓度等。
配合物在水溶液中的稳定性

[Ag(CN)2]- +
判断[Ag(NH3)2]+是否可能转化为[Ag(CN)2]-。
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
上页
下页
返回
帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
Cu2+ + 4NH3
[Cu(NH3)4]2+
平衡浓度/( mol/L) 1.0×10-3
x
1.0
已知[Cu(NH3)4]2+ 的= 2.09×1013
上页 下页 返回 帮助
§7–2 配合物在水溶液中的稳定性
第七章 配位平衡与配位滴定
将上述各项代入累积稳定常数表示式:
K稳
[Cu(NH 3 ) 4 ] 2 [Cu 2 ][NH 3 ] 4
1.比较同类型配合物的稳定性 较高。但不同类型配合物的稳定性则不能仅用 K 比较。 稳
K 对于同类型配合物,稳定常数 稳 较大,其配合物稳定性
例1:比较下列两配合物的稳定性: [Ag(NH3)2]+ [Ag(CN)2]= 107.23 = 1018.74
由稳定常数可知[Ag(CN)2]-比[Ag(NH3)2]+稳定得多。
3.判断配离子与沉淀之间转化的可能性
配离子与沉淀之间的转化,主要取决与配离子的稳定性和 沉淀的溶解度。配离子和沉淀都是向着更稳定的方向转化。
【例3】
在1L[Cu(NH3)4]2+溶液中(c(Cu2+)为4.8×10-17mol/L), 加入0.001molNaOH,问有无Cu(OH)2沉淀生成? 若加入 0.001molNa2S,有无CuS沉淀生成? (设溶液体积基本不变)。
第七章-配合物

配位体中提供孤对电子并能与中心离子直接 结合的原子。常见的有N、C、O、S、X等。
二、 配合物的组成
❖ 4. 配位数:
中心离子所接受的配位原子的数目。
❖ 5. 外界离子:
配合物中距离中心离子较远的简单离子或原子 团,与配离子以离子键相结合。
❖ 6.配离子的电荷数:
中心离子电荷数与配位体电荷数的代数和。 例:[Ag(NH3)2] +配离子的电荷数为+1,
❖ 2.特点:
(1)分步进行; (2)符合化学平衡的特点及移动原理
❖等、动、 定、 变 ❖吕·查德里原理或称勒夏特利原理
(二) 配合物的不稳定常数K不稳和 稳定常数K稳
❖ 1.表达式:
离解
[Cu(NH3)4]2+ 配合
Cu2+ + 4NH3
K不稳=
[Cu 2 ][NH3 ]4 [Cu(NH3 )42 ]
a.血红蛋白中的Fe2+ b.植物体内叶绿素中的Mg2+ c.治疗恶性贫血的药物V-B12中的Co2+
一、 配合物的概念
❖ 3、配合物与复盐的区别:
在水溶液中复盐能完全电离成组成它的简单离子; 配合物在水中只能电离出配离子和外界离子,不能
完全电离出组成它的简单离子。
❖ 例如:
复盐:
❖KAl(SO4)2·12H2O=K++Al3++2SO42-+2H2O
配合物:
❖[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-
❖举例:
[Ag(NH3)2]+ [Fe(CN)6]3-
❖ 2.配合物:
二氨合银(Ⅰ)配离子 六氰合铁(Ⅲ)配离子
第7章 配位平衡和配位滴定法

本章主要内容: 第一节 配位化合物的基本概念 第二节 配位平衡 第三节 配位滴定法
配位化合物的生物医药应用
实验
CuSO4溶液 适量氨水
(浅蓝色)
乙醇
[Cu(NH3)4]SO4晶体
(深蓝色)
Cu2(OH)2SO4
↓
过量氨水
(蓝色)
[Cu(NH3)4]2+
(深蓝色)
N
N
N
N
名称 草酸根
乙二胺
邻菲罗啉
联吡啶 乙二胺 四乙酸
缩写符号 (OX) (en)
(o-phen) (bpy)
(H4edta)
CH2 H2N
CH2 NH2
NN
乙二胺(en)
联吡啶(bpy)
O O 2–
N
N
1,10-二氮菲(邻菲咯啉)
CC
O• •
O• •
C2O42-
3.配体数和配位数
配体数:配合物中配体的总数 配位数:与中心原子结合成键的配位原子的数目 单基配体形成的配合物:
配体命名顺序
同类配体中配位原子相同,较少原子数的配体在前, 较多原子数的配体列后
例:[Pt(NH3)2 (NH2OH)NO2]Cl 氯化一硝基 ·二氨·一羟胺合铂(Ⅱ)
配离子为阴离子,则在配离子与外界阳离子之间用
“酸”字连接;若外界为氢离子,则在配离子之后缀以
“酸”字,即“某酸”。
K[Al(OH)4]
1、配合物的命名顺序 内外界顺序与一般无机化合物的命名原则相同。 阴离子名称在前,阳离子名称在后。
2、内界(配离子)的命名顺序
配体数
配体名称
合
(汉字数字) (不同配体间用圆点·分开)
配位平衡及其影响因素

2019/4/13
3
7.2.1配位平衡与平衡常数
配离子的稳定性:
7.2.1配位平衡与平衡常数
如[Cu(NH3)4]2+的第一级形成平衡: Cu2+ + NH3 ⇌ [Cu(NH3)]2+ [Cu(NH3)2+] K 稳1 = =104.27 [Cu2+] [NH3] 再如[Cu(NH3)4]2+的第四级形成平衡: [Cu(NH3)3]2+ + NH3 ⇌ [Cu(NH3)4]2+ [Cu(NH3)42+] 2.18 K 稳4 = =10 [Cu(NH3)32+] [NH3] 另2级形成常数分别为:K 稳2 = 103.55;K
休息
2019/4/13
11
7.2.1配位平衡与平衡常数
配离子转化,通常是稳定性小的向稳定性大的 转化.转化的完全程度可用转化反应常数衡量. 如:[Ag(NH3)2]+ + 2CN- ⇌ [Ag(CN)2]- + 2NH3 K =
[Ag(CN)2-][NH3]2 [Ag+]
[Ag(NH3)2+][CN-]2 [Ag+] = K 稳([Ag(CN)2]-)/K 稳([Ag(NH3)2]+)
[NH3] = [Ag(NH3)2+]≈0.010 mol· L-1
休息
2019/4/13
10
7.2.1配位平衡与平衡常数
(2)判断两种配离子间转化的可能性: 例2:在含有NH3和CN-的溶液中加入Ag+,可能会形 成[Ag(NH3)2]+和[Ag(CN)2]-. 试问哪种配离子先 形成? 若在[Ag(NH3)2]+溶液中加入KCN,问否能 发生配离子的转化? 解: 由附录可查得: [Ag(NH3)2]+ K 稳 = 107.40 [Ag(CN)2]- K 稳 = 1021.1 同型配离子,一般是稳定性大的配离子先形成. 故[Ag(CN)2]-会先形成.
南昌大学大学化学第七章习题答案
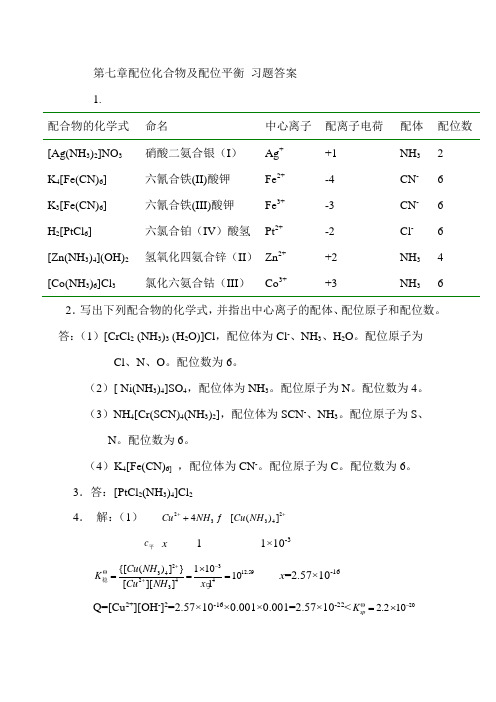
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
配位平衡的定义

配位平衡的定义配位平衡是指在一个系统中不同配位体之间的相对含量达到一定的平衡状态。
配位体是指与中心离子或原子形成配位键的分子或离子。
在配位化学中,配位平衡是非常重要的概念,因为它能够帮助我们理解配位体之间的相互作用以及它们在化学反应中的角色。
配位平衡的概念最早是由法国化学家保罗·萨布莱特(Paul Sabatier)提出的。
他在研究铂催化剂的反应机理时,发现不同配位体之间的相对含量对反应速率有重要影响。
后来,这个概念被广泛应用于配位化学的研究中。
在配位平衡中,不同配位体之间的相对含量是通过一个平衡常数来描述的。
平衡常数是指在平衡状态下反应物和产物的浓度比值。
对于一个配位反应,平衡常数可以表示为:K = [MLn] / ([M] × [L])其中,[MLn]表示配合物的浓度,[M]和[L]分别表示金属离子和配位体的浓度,n表示配位体的配位数。
配位平衡的影响因素包括温度、溶剂、PH值、金属离子的价态、配位体的种类和数量等。
其中,温度是影响配位平衡最重要的因素之一。
一般来说,随着温度升高,反应速率会增加,但是平衡常数会减小。
这是因为高温下反应物的活性增加,但是产物的稳定性降低。
另外,溶剂也对配位平衡有影响。
不同的溶剂对于不同的配位体有不同的溶解度和配位能力。
例如,在水溶液中,氨和水的配位能力相似,但是氨的溶解度比水低,因此在水溶液中,水配位体的含量会更高。
PH值也能够影响配位平衡。
在酸性溶液中,配位体中的羧基和氨基会质子化,从而影响它们与金属离子的配位能力。
另外,金属离子的价态也会影响配位平衡。
例如,在Fe3+和Fe2+之间的配位平衡中,Fe3+的配位能力更强,因此在配位体浓度相同的情况下,Fe3+的配合物含量会更高。
总之,配位平衡是配位化学中的一个重要概念,它能够帮助我们理解配位体之间的相互作用以及它们在化学反应中的角色。
配位平衡的影响因素包括温度、溶剂、PH值、金属离子的价态、配位体的种类和数量等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
外界 SO
2 4
Cu
2
配位原子
(NH 3) 4
配位数
注: 中心离子与配体之间以配位键结合。 内界与外界之间以离子键结合。
1. 形成体: 中心离子或原子
(1) 中心离子
如:Cu2+,Fe2+,高氧化态的非金属。 如 SiF62-中的Si4+
(2)中心原子: 如 Ni(CO)4中的Ni
第七章
配位平衡
7.1 配合物的基本概念
7.2 配合物的化学键理论
7.3 配位平衡
7.1 配合物的基本概念
1.1 配合物的定义
1.2 配合物的组成
1.3 配合物的化学式及命名
1.4 配合物的类型 1.5 空间结构和异构现象
1.1 配合物的定义:
配合物:中心离子(原子)与配位
体之间以配位键结合而形
成的复杂离子(分子)。
解: 起始: C(Ag+)=0.02mol/l , C(NH3)=1.0mol/L 2NH3 + Ag+ → [Ag(NH3)2]2+ 起始: 1.0 0.02 0 转化: 2(0.02-x) (0.02-x) 平衡: 1-2(0.02-x) x (0.02-x) C([ Ag ( NH ) ] ) 0.02 x 3 2 K稳 C( NH3 ) C( Ag ) x[1 2(0.02 x)]2
反磁性:被磁场排斥 n =0 , µ = 0
铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 磁 矩: µ =[n(n+2)]1/2 (B.M.)玻尔磁子
举例:
n 0 1 2 3 4 5 µ /B.M. 0 1.73 2.83 3.87 4.90 5.92
如: [Ti(H2O)6]3+
Ti3+:
3d1 µ 实=1.73 n=1 µ 实=3.18 n=2
故:有沉淀生成。
例:求25oC时,1L6.0mol/L的NH3•H2O溶液中可 溶解多少摩尔的AgCl? 淀?已知:K0稳[Ag(NH3)2] + =1.12 × 107 K0sp(AgCl)=1.77 × 10-10 解: AgCl + 2NH → [Ag(NH ) ]2+ + Cl-
K
C[ Ag ( NH
PtCl6
2
Fe(CN )
6
4
Fe :3d64s2
Fe2+ :3d6
3d
4S
4P
分子空间构型: 正八面体
3. 外轨型配合物和内轨型配合物
仅用外层轨道进行杂 (1)外轨型配合物:
化而形成的配合物 如: sp杂化 sp3杂化 sp3d2杂化
特点:中心离子保持原有电子构型,
未成对电子数不变。
H F HF
2. 沉淀生成的影响 [Cu(NH3)4]2+ + S2+→CuS↓ + 4NH3
3. 氧化还原反应的影响
Ag (CN )2 (aq)
Ag (aq ) 2CN (aq )
4. 配离子之间转化的影响
Ag ( NH ) ( aq ) 2 CN ( aq ) [ Ag ( CN ) ] (aq) 2 NH 3 3 2 2
中心离子:
26
3
64s2 3d Fe
Fe3+ 3d5
4p
3d5 4s 4s 后的能量相近的轨道都叫价电子轨道。
1. 常见的杂化类型: sp杂化 sp3杂化 sp3d2杂化 d2sp3杂化
2.几种不同类型的杂化
dsp2杂化
(1) sp杂化:
Ag ( NH ) 如: 3 2
Ag :4d105s1
如: Cu( NH 3 ) 4 SO4
Cu( NH 3 ) 4
2
1.2 配合物的组成
K 4 Fe(CN )6
外界 (K ) 4
内界
Fe(CN )6
Fe
2
4
配体 中心离子
配位原子
(CN ) 6
配位数
Cu( NH3 )4 SO4
内界 2 Cu( NH3 )4
5 有多种配体时,先阴离子后中性分子,先无机 后有机。同种类型,按配位原子的原子序数由小 到大顺序。
例:命名
Ag ( NH 3 )2Cl Cu( NH 3 ) 4 SO4 2 Cu( NH 3 ) 4 Co( NH 3 )5 ( H 2O)Cl3
Ag ( NH 3 ) 2 Cl 一氯化二氨合银(Ⅰ) Cu( NH 3 ) 4 SO4 硫酸四氨合铜(Ⅱ) 2 Cu( NH 3 ) 4 四氨合铜(Ⅱ)配阳离子 Co( NH 3 )5 ( H 2O)Cl3
sp
C C ) ] ( Cl ) ( Ag ) 3 2 2 C ( NH 3 ) C( Ag )
3
3 2
K
K
稳 3
K 3.06 10
1.98 10
(2) 可溶解的AgCl为x摩尔 AgCl + 2NH3 → [Ag(NH3)4]2+ + Cl起始: 6.0 0 0 转化: 2x 平衡:
7.2
配合物的化学键理论
7.2.1 价键理论
7.2.2
晶体场理论(自学)
7.2.1 价键理论
价键理论的要点 1. 形成体(有空轨道)与配位体(有孤对电子)
之间是靠配位键结合。
2. 形成配位键的条件是:a.配位体至少有一孤 对电子;b.形成体要有空的价电子轨道。 3.空间构型与杂化方式有关
如:FeF6
2. 配位体、配位原子
配位体:与中心原子或离子相结合的分子或离子 配位原子:与中心原子直接形成配位键的原子 •配位原子必须有孤对电子
•常见的配位原子:
N
NH3
O
H2O
S
SCN-
C
CN-
X
Cl-
1.3
配合物的化学式及命名
•命名规则: 1 配阳离子: X化X , X酸X
2 配阴离子:在配阳离子前加上“酸” 3 中心离子与配位体间加上“合” 字 即:中心离子- “合”-配位体 4 配体的个数用“一、二、三”等 中心离子的个数用罗马数字表示
Ag+ :4d10
4d
5S
5P
分子空间构型: 直线型
键角: 180度。
H3 N Ag H3 N
(2) sp3杂化:
Zn( NH )
3 4
如:Zn( NH 3 ) 4
2
2
Ni( NH 3 ) 4 HgI 4
2
2
Zn :3d104s2
Zn2+ :3d10
6.0-2x
2
x
x
x 3 K 1.98 10 2 (6.0 2 x)
x 0.045 1 x 0.247mol l (6.0 2 x)
7.3.2. 影响配离子平衡的因素 1. 酸度的影响
3 FeF ( aq ) Fe ( aq ) 6 F (aq) 6 3
K PtCl5 ( H 2O)五氯化一水合铂(Ⅳ)酸钾
三氯化•五氨•一水合钴(Ⅲ)
K 4 Fe(CN ) 6
六氰合铁(Ⅱ)酸钾
K (C2 H 4 ) Pt (OH )Cl2
一羟基•二氯•一乙烯合铂(Ⅱ)酸钾
Ag ( NH 3 ) 2 (OH ) 氢氧化二氨合银(Ⅰ) Pt ( NH 3 ) 6 PtCl4
0.02 7 1.7 10 2 x (0.96)
x 1.28 10 mol l
C ( NH 3 ) 0.96mol l
7 1 1
7
1
C ( Ag ) 1.28 10 mol l
(2) Q=C(Ag+) × C(Cl-)=1.28•10-7 × 10-2>Ksp
Ni :3d84s2
Ni2+ :3d8
3d
4S
4P
分子空间构型: 正方型
(4) sp3d2杂化:
如:Fe( H 2O) 6
3
Fe( H O)
2 6
3
Fe :3d64s2
Fe3+ :3d5
3d
4S
4P
分子空间构型: 正八面体
(5) d2sp3杂化: 如: Fe(CN ) 6
4
3d
4S
4P
分子空间构型:
正四面体型
(3) dsp2杂化:
Cu( NH 3 ) 4 如:
2
Ni(CN ) 4
2
Cu( NH )
3 4
2
Cu :3d104s1
Cu2+ :3d9
3d
4S
4P
分子空间构型: 正方型
注意:只能由空间构型推导杂化类型 例:Ni(CN )
4
2
即:磁矩大(顺磁性强),稳定性差。
有内层轨道参与杂 (2)内轨型配合物:
化而形成的配合物 如;dsp2杂化 d2sp3杂化
特点:中心离子原有电子构型发生变化, 未成对电子数减少。 即:磁矩减小(有抗磁性),稳定性强。
4. 如何判断外轨型配合物和内轨型配合物 依据:由磁性进行判断
(1)由磁矩计算出未成对电子数
4
x
4x
1 x( 4 x) 5 17 x 1.89 10 13 2.09 10 (0.1 x)
x 4.5 10 mol L
4
