第二章 固体的能量状态
材料物理性能课件第二章能带理论

3
光电子器件性能分析
能带理论用于分析光电子器件的性能,如LED、 激光器等,有助于优化其性能参数。
在能源科学中的应用
新能源材料设计
能带理论在新能源材料的设计中 发挥了重要作用,如太阳能电池
、燃料电池等。
能源转化与存储
03
电子填充
根据泡利不相容原理,每个能带只能填充有限个电子, 而电子填充的方式决定了材料的物理和化学性质。
能带理论的重要性
01
02
03
预测材料性质
通过能带理论,可以预测 材料的电子结构和性质, 如导电性、光学性质等。
指导材料设计
能带理论为材料设计提供 了理论基础,帮助科学家 了解材料性能的来源和变 化规律。
揭示新现象
能带理论的发展和应用, 不断揭示出新的物理现象 和材料特性,推动了科学 技术的发展。
能带理论的发展历程
初创期
能带理论起源于20世纪初的金属电子 论,初步建立了固体电子结构的理论 基础。
发展期
成熟期
现代计算技术和计算机模拟的进步, 使得能带理论在材料科学、物理学等 领域得到广泛应用,成为研究材料性 能的重要工具。
半导体能带结构
03
半导体的导电性
电子导电
在半导体中,部分电子可 以获得足够的能量越过禁 带,形成自由电子,在电 场作用下参与导电。
空穴导电
当价电子被激发到导带时 ,会在价带中留下空穴, 空穴也可以参与导电。
离子导电
在某些半导体中,离子的 迁移也是导电的主要方式 。
半导体的光电效应
光电导效应
当光照射在半导体表面时,光子能量 大于禁带宽度的部分光子可以激发电 子从价带跃迁到导带,产生自由电子 和空穴,从而改变半导体的导电性。
无机化学 第五版第二章 热化学

4
热力学的标准状态
(1) 气体物质的标准状态,是气体在指定温度T,压力p = p的状态, p=100 kPa; (2) 纯固体和液体的标准状态,分别是在指定温度T,压 力p = p时纯固体和纯液体的状态; (3) 溶液中溶质B的标准状态,是在指定温度T,压力p =
p,质量摩尔浓度b = b时溶质的状态, b = 1
l
热和功均不是状态函数 ① 热和功是与过程相联系的物理量,系统不发生变
化,就没有热或功,故热和功均不是状态函数。
② 在处理热和功的问题时,不仅要考虑过程,还必
须考虑途径。
一定量的理想气体,从压强 p1 = 16×105 Pa,体积 V1= 1×10 -3 m3 经过两个途径分别恒温膨胀至压强 p2 = 1×105 Pa,体积 V2 = 16×10-3 m3 的状态。
U Q p pex V
U 2 U1 Q p pex V2 V1 U 2 U1 Q p p2V2 p1V1 Q p (U 2 p2V2 ) U1 p1V1
令:U + pV = H ——焓,状态函数
H = H2 - H1 ——焓变
U 2 U1 U
热力学能变化只与始态、终态有关, 与变化途径无关。
2.2.3 热力学第一定律
热力学第一定律的实质是能量守恒与 转化定律。
U1 Q U W 2
U2 = U 1 + Q + W U2 - U1 = Q + W
V1
pex
l
对于封闭系统热力学第一定律的数学 表达式为: U Q W
统的热焓
焓H ① 焓是系统的状态函数,其数值的大小只与始态和
终态有关,与途径无关;
黄昆 固体物理 讲义 第二章

第二章 固体的结合晶体结合的类型 晶体结合的物理本质固体结合的基本形式与固体材料的结构、物理和化学性质有密切联系 § 2.1 离子性结合元素周期表中第I 族碱金属元素(Li 、Na 、K 、Rb 、Cs )与第VII 族的卤素元素(F 、Cl 、Br 、I )化合物(如 NaCl , CsCl ,晶体结构如图XCH001_009_01和XCH001_010所示)所组成的晶体是典型的离子晶体,半导体材料如CdS 、ZnS 等亦可以看成是离子晶体。
1. 离子晶体结合的特点以CsCl 为例,在凝聚成固体时,Cs 原子失去价电子,Cl 获得了电子,形成离子键。
以离子为结合单元,正负离子的电子分布高度局域在离子实的附近,形成稳定的球对称性的电子壳层结构;,,,Na K Rb Cs Ne Ar Kr Xe FClBrI++++−−−−⇒⇒⇒⇒离子晶体的模型:可以把正、负离子作为一个刚球来处理;离子晶体的结合力:正、负离子之间靠库仑吸引力作用而相互靠近,当靠近到一定程度时,由于泡利不相容原理,两个离子的闭合壳层的电子云的交迭会产生强大的排斥力。
当排斥力和吸引力相互平衡时,形成稳定的离子晶体; 一种离子的最近邻离子为异性离子;离子晶体的配位数最多只能是8(例如CsCl 晶体);由于离子晶体结合的稳定性导致了它的导电性能差、熔点高、硬度高和膨胀系数小;大多数离子晶体对可见光是透明的,在远红外区有一特征吸收峰。
氯化钠型(NaCl 、KCl 、AgBr 、PbS 、MgO)(配位数6) 氯化铯型(CsCl 、 TlBr 、 TlI)(配位数8)离子结合成分较大的半导体材料ZnS 等(配位数4) 2. 离子晶体结合的性质 1)系统内能的计算晶体内能为所有离子之间的相互吸引库仑能和重叠排斥能之和。
以NaCl 晶体为例,r 为相邻正负离子的距离,一个正离子的平均库仑能:∑++−++321321,,2/122322222102)(4)1('21n n n n n n r n r n r n q πε ——遍及所有正负离子,因子1/2—库仑作用为两个离子所共有,一个离子的库伦能为相互作用能的一半。
第二章 物质的状态 气体、液体、溶液
临界现象? 临界现象
课本p26 课本
Tb (沸点) < 室温 沸点) Tc < 室温, 室温, 室温下加压不能 液化
Tb < 室温, 室温, Tc > 室温, 室温, 室温下加压可液 化 Tb > 室温 Tc > 室温, 室温, 在常温常压下为 液体
24
临界常数: 临界常数:
p26
• 每种气体液化时 各有一个特定温度叫临界温度 每种气体液化时, 各有一个特定温度叫临界温度 临界温度Tc. 在Tc 以 无论怎样加大压力, 都不能使气体液化. 上, 无论怎样加大压力 都不能使气体液化 • 临界温度时 使气体液化所需的最低压力叫临界压力 临界温度时, 使气体液化所需的最低压力叫临界压力 临界压力Pc. • 在Tc 和 Pc 条件下 1 mol 气体所占的体积叫临界体积 条件下, 气体所占的体积叫临界体积 临界体积Vc.
17
压力P愈小 温度T愈高 愈高, 压力 愈小, 温度 愈高 愈接近理想气体 愈小
1mol N2气
Z=
18
不同气体的比较 (1mol, 300K )
Z=
19
图总结: 气体 Z-P 图总结:
1. 常压常温下,沸点低的气体,接近理想气体 常压常温下,沸点低的气体, 2. 起初增加压力时,对于分子量较大的分子,分子间作用力增 起初增加压力时,对于分子量较大的分子, 加占主导, 加占主导,使得 Z < 1 3. 增加较大压力时,分子的占有体积占主导,使得 Z > 1 增加较大压力时,分子的占有体积占主导,
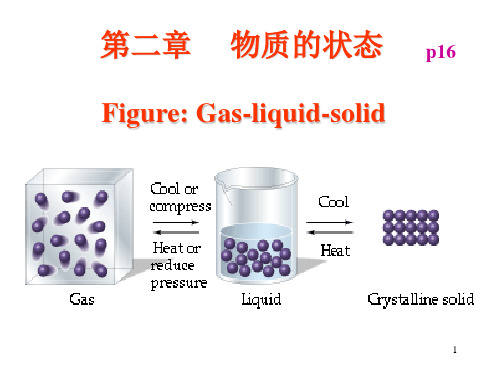
第二章
物质的状态
p16
Figure: Gas-liquid-solid Gas-liquid-
1
本章主要内容: 本章主要内容: 一、气体
第二章 无机固体化学

离子晶体中最简单的结构类型(structure type)-AB型
外界条件变化时,晶体类型也能改变。 如CsCl 常温下CsCl型 高温下NaCl型 同质多晶现象: 化学组成相同而晶体构型不同的现象。
离子晶体的稳定性(stability) 晶格能越大,离子晶体越稳定。
电荷相同,核间距越小,晶格能越大。 离子电荷数越多,晶格能越大。 晶格能越大,熔点越高,硬度越大。
如:MX晶体中掺Y2X3
掺低价阳离子化合物Z2X时
这些新缺陷形成,必将显著改变晶体中原来各种缺陷 的浓度,
缔合中心
在上面讨论点缺陷无序分布的模型,假定缺陷之间是彼此无关并不 相互作用。事实上并非如此,在同类缺陷之间,由于存在着弹性应 力和库仑斥力,使它们相互推开;受量子力学交换作用的制约还存 在着吸力。若吸力足够大,缺陷可相互接近。对不同类型,特别是 对带相反电荷的缺陷,它们可以通过库仑吸力缔合而形成缔合中心。 缔合中心的生成可表示为:
导带:未充满电子的能带 如Li 1s22s1 2s分子轨道能带
有空的分子轨道存在,在这种能带的电子,只要吸收微小的能量,就能跃 迁到带内能量稍高的空轨道上运动,从而使金属具有导电、导热作用。
禁带:相邻的能带间的间隙 如Li 1s22s1 1s能带和2s能带之间的间隙
禁带是电子的禁区, 电子是不能在此停留的。若禁带不太宽, 电子获能量可 从满带越过禁带跃迁到导带; 若禁带太宽, 跃迁难以进行。
第二章 无机固体化学(inorganic solid state chemistry)
引言
固体化学的内容
固体化学:从化学的观点论述: ①物资(无机物、有机物、金属)的结构和物理化学性质
的关系。
②固体的不完整性(缺陷、位错等)和其动力学的性质 ③固体反应而产生的晶核化、晶核生、物性化学和反应化学。
凝固热力学

通过对金属固、液、气态转变的热化学数据分析和X 射线衍射分析,得到如下 结论: (1)液态金属中的平均原子间距比固态稍大; (2)液态金属中的配位数一般在8—11之间,配位数 变化不大; (3)液态金属中原子排列规则性降低,呈短程有序。
液态金属中的结构起伏 液态金属中的原子并非完全混乱,在要达到结晶温度 时,在液体内部存在许多在很短距离内有序排列的原 子集团,称为近程有序原子集团或晶坯。 结构起伏(相起伏):近程有序原子集团大小不等, 取向不同,时有时无,此起彼伏的现象。 结构起伏的晶坯尺寸与温度有关:温度低,晶坯的尺 寸大。
三、液态金属的遗传性
体现在以下几方面: (1)炉料的组织和缺陷对凝固后铸件或毛坯的组织、 缺陷有影响; (2)液态合金中加入合金元素后,改变了合金中元素 之间的相互作用,进而影响凝固后铸件或毛坯的组织; (3)液态金属或合金的结构不同(如:过冷度、净化 程度等),对凝固后铸件或毛坯组织有影响。 ——这些影响液态金属或合金熔体结构进而影响凝固后 铸件或毛坯的组织与性能现象称为液态金属或合金的遗 传性。 组织遗传性 炉料组织对铸锭组织有遗传性: 铝合金回炉料中含铁针片状化合物的组织对铝合金铸锭 组织的影响:
将纯铁片加入含0.4%Fe的ZL108,熔化保温,在 700C°浇铸,制成含1.26%Fe的ZL108—3合金。 组织:细小针状含铁化合物; 可见:回炉料组织中含铁相的形态对所配合金中含铁相 的形态具有明显的遗传性。 原因:含铁相是高熔点化合物,在铝合金熔体中难彻底 溶解,凝固时,新析出含铁相依附在原未溶含铁相上生 长,从而保留了原有含铁相的形态。
3、熔化熵 熔化温度定义为:液、固两相自由能相等的温度。 金属熔化时熵是增加的,但增加不大。考虑到金属熔化 时配位数和原子间距变化不大,则熵的增加主要增加了 原子排列的无序度。 4、热容量 可以作为判断原子运动特性的依据。实验发现,金属液 固两态的热容量差别不大。 证明:液固两态中原子运动状态也是相近的,与气态差 别较大。 5、导电性 大多数金属熔化后电阻增加近一倍,并且随温度的升高 继续增大,即:具有正的电阻温度系数。 说明:液体金属仍然是电子导电,具有金属键结合;气 体金属则和一般气体一样,完全失去了金属特性。
固体物理第二章复习
式中
B
1
6
;
A2
A
4B
'N 1
A12
j
a12 j
A6 , A12 是仅与晶体结构有关的常数。
'N 1
A6
j
a6 j
3.原子晶体、金属晶体和氢键晶体
(1)原子晶体
结构:第Ⅳ族、第Ⅴ族、第Ⅵ族、第Ⅶ族元素都可以形成
原子晶体。
结合力: 共价键 (2)金属晶体
饱和性 方向性
层一共有 8 个量子态, 最多能接纳(8- N)个电子, 形成(8- N)个共价键. 这就 是共价结合的 “饱和性”.
共价键的形成只在特定的方向上, 这些方向是配对电子波函数的对称轴方向, 在这个方向上交迭的电子云密度最大. 这就是共价结合的 “方向性”.
10. 为什么许多金属为密积结构? 金属结合中, 受到最小能量原理的约束, 要求原子实与共有电子电子云间的
(2)结合力: 范德瓦尔斯力。
(3)配位数: 通常取密堆积,配位数为12。
(4)互作用势能:
u(r )
4
12
6
r r
U ( R)
2 N
A12
R
12
A6
R
6
雷纳德-琼斯势
r1 rA a, a1 1, r2 rB 2a, a2 2, r3 rC 3a, a3 3,
2( 1 1 1 1 ) ln( 1 x ) x x2 x3 x4
描述物体能量状态的概念
描述物体能量状态的概念能量是物质存在的一种形式,是物体在作用力的影响下所执行的能力。
它是自然界中不可或缺的基本概念之一,可以存在于不同的形式和状态中。
物体的能量状态是指能量的特定形态和表现方式,可以通过不同的参数和属性来描述。
本文将从宏观和微观的角度,探讨描述物体能量状态的概念。
一、宏观角度:热、动、势能在宏观尺度上,我们可以通过热能、动能和势能来描述物体的能量状态。
1. 热能:热是物体内部粒子之间运动和碰撞所具有的能量。
热能的大小与物体的温度有关,温度越高,分子运动越剧烈,热能越大。
例如,热能可以使水沸腾,将固体融化为液体,或将液体蒸发为气体。
2. 动能:动能是物体由于运动而具有的能量。
动能的大小取决于物体的质量和速度,质量越大、速度越快,则动能越大。
例如,运动的汽车具有较大的动能,而静止的物体则没有动能。
3. 势能:势能是物体由于位置或相互作用而具有的能量。
常见的势能有重力势能、弹性势能和电势能等。
重力势能是指物体由于离地面高度而具有的能量,例如天然气向下流动时所具有的势能;弹性势能是指物体由于被拉伸或压缩而具有的能量,如弹簧的弹性势能;电势能则是指带电体由于位置而具有的能量,例如电荷在电场中的势能。
二、微观角度:分子动能和能级在微观尺度上,能量状态的描述需要借助分子动能和能级等参数。
1. 分子动能:物体的分子在运动中具有动能,其大小与分子的质量和速度相关。
分子速度越大、质量越大,则分子动能越大。
物体温度的提高,相当于提高了分子的平均动能。
2. 能级:能级是描述分子或原子能量状态的量子力学概念。
在能级理论中,物体的能量状态可以看作是分子或原子在具有不同能量的量子态之间跃迁的结果。
当能级的差值越大,物体的能量状态越高。
例如,光子的能量与其频率成正比,频率越高,光子的能量也越大。
三、物体能量状态的转换和守恒物体的能量状态可以相互转换,遵循能量守恒定律。
1. 转换:物体能量状态之间可以相互转换,例如动能可以转化为势能,热能可以转化为机械能等。
固体物理第二章 固体的结合
(四)范德瓦耳斯结合
1879年范德瓦耳斯(Van der Waals)提出在实际气体 分子中,两个中性分子(或原子)间存在着“分子力”, 即范德瓦耳斯力。由范德瓦耳斯力的作用所组成的晶体称 为分子晶体。
范德瓦耳斯结合往往产生于原来具有稳固电子结构的 原子或分子之间,如:具有满壳层结构的惰性气体元素, 或价电子已用于形成共价键的饱和分子。
18
固体物理
固体物理学
共价键与离子键间的混合键
完全离子结合(如NaCl):正负离子通过库仑相互 作用结合在一起, Na+和Cl-的电子云几乎没有重叠。
19
固体物理
固体物理学
完全共价结合(如金刚石):相邻两个C原子各出一个 未配对的自旋相反的电子归这两个原子所共有,在这两个原 子上找到电子的概率相等,即这两个C原子对共价键的贡献
15
固体物理
固体物理学
1
1 2
(j2s
j2 px
j2 py
j2 pz
)
2
1 2
(j2s
j2 px
j2 py
j2 pz
)
3
1 2
(j2s
j2 px
j2 py
j2 pz
)
4
1 2
(j2
s
j2 px
j2 py
j2pz )
“杂化轨道”
原来在2s和2p轨道上的4个电子,分别处于 1 , 2 , 3 , 4
21
固体物理
固体物理学
1. 有效离子电荷 q*
以 GaAs 为例:GaAs的离子实分别为带+3q 和+5q 的离 子Ga3+和As5+,每一对Ga 和As 共有8个价电子。 (1) 若为完全的共价结合,共价键上的每对电子均分在两 个近邻原子上,则:Ga-1As+1。 (2) 若为完全的离子结合(设Ga原子的3个价电子转移到As 原子),则:Ga3+As3-。 (3) 实际介于二者之间,引入有效离子电荷q*,(以电子 电荷为单位)Ga原子的q*肯定介于-1和+3之间。
第2章 固体材料的原子排列
氢原子在两个电负性较大的原子或原子团之间形成一个桥梁,把 两者结合起来,成为氢键
氢键可以表达为:X-H—Y
氢键的结合力
氢键的结合力比范德瓦尔斯键结合力强
在带有—COOH、—OH、—NH2原子团的高 分子聚合物依靠氢键将长链分子结合起来 氢键在一些生物分子如DNA中也有重要作用
各种结合键比较
电负性
同一周期元素自左至右电负性逐步增加 同一族元素自上而下电负性逐渐减少 过渡族元素的电负性比较接近。
这种变化趋势可以这样理解:对于具有N个价电子的原子,其中每个 价电子不仅受到带正电的原子核的库仑吸引作用,还受到其他(N- 1)个价电子对原子核电荷的屏蔽作用。由于这种屏蔽作用不完全, 因此,作用在价电子上的有效电荷在+e到+Ne之间,随N增大,有 效电荷将加强,因而在同一周期中元素自左至右电负性增大。对于同 一族元素,自上而下价电子距原子核距离越来越远。因此库仑作用减 弱,电负性减小。
共价键(cov子活动能力小,共价键晶体的 断裂必须断开了两个原子间的公用电子对,因此,共价键 晶体熔点高、质硬脆、导电能力差
非金属(C、Si、Sn、 Ge),聚合物和无机非金属材料 实质:由二个或多个电负性差不大的原子间通过共用电子对而成
某些陶瓷化合物中混合键的相对比例
混合键
一些材料中独立存在两种类型的键
一些气体分子以共价键结合,分子凝聚则依靠范德瓦尔斯键 高分子聚合物和许多有机材料的长链分子内部是共价键结合, 链与链之间以范德瓦尔斯键或氢键结合 石墨(碳)的片层上是共价键结合,片层与片层之间是范德 瓦尔斯键结合
6 . 材料的结合键与性能
结合键:原子(离子或分子)间的作用力
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 固体的能量状态
辐射场与原子体系的总哈密顿量
0S R I I H H H H H H =++≡+
零级近似
()00S R H H H E Θ≡+Θ=Θ
体系总的状态 ()
(),n κΘ=
ΞψR r
辐射场的本征状态 用{}n κ标记。
(模标记:,k κκπ)
()()R R H n E n κκΞ=Ξ
(){
}12...,,.........n n n n n n κκκκκκΞ===
()...,,...R E n n κκκ
κ
ω=∑
固体的本征状态
()()
,,S S H E =ψψR r R r
固体是由大量带负电的电子和带正电的核构成的多粒子体系。
这些带电粒子间存在库仑相互作用。
如果忽略磁的,以及其它相对较弱的相互作用,体系(固体)的总能量,或哈密顿量,包括: 所有电子的动能
2
2
ˆ2e
i i
e
T m =-∇
∑,
所有核的动能 2
2ˆ2L
I I
I
T M =-∇∑,
电子间的库仑相互作用
()2
1
4ee i j
j i
e V r r πε<=
-∑
r ,
核之间的库仑相互作用
()
2
14I J LL I J
I
J
Z Z e V R
R πε<=
-∑R ,
以及电子与核间的库仑相互作用
()
2
,0
1,4I eL i I
I
i
Z e V R
r πε=-
-∑R r 。
上面的表示式中i r 为电子位置,下标i 或j 标记不同的电子,e m 为电子质量,I R 为核坐标,下标I 或J 标记不同的核,M 为核的质量,Z 为核电荷数。
原子体系(固体)总的哈密顿量为:
()
()()
2
2
2222
,002
0ˆˆˆˆˆ,ˆˆ,2211
4414S e L e L ee eL LL
e L e
LL
i
I
i
I
e I
I i j i I
j i I i I J I J I J
H T T V T T V V V T T V V m M e Z e r r R r Z Z e R R πεπεπε<<=++≡++++≡+++=-∇-∇
⎛⎫
⎪+- ⎪
--⎝
⎭
+-∑
∑
∑∑
∑R r R r R
描述体系状态的波函数是原子体系中所有粒子的位置
的函数,我们用()
,ψR r 来表示,其中简略地用R 和r 分别代表体系中所有核和电子的位置。
体系的定态波函数满足定态薛定谔方程,或哈密顿方程:
()()
ˆ,,S S
H E =ψψR r R r (2.1-2)
其中本征值S E 为相应本征态或定态的能量。
一个由存在相互作用的微观粒子组成的系统,体系中每个粒子的运动都与其它粒子的运动密切相关,无法确切地给出每个粒子的状态,只能确定整个体系的状态。
体系状态的描述非常复杂。
10量级,显然,对这样考虑到构成固体的粒子数多达23
的多粒子体系,上面的方程是无法严格求解的。
必须作近似,使问题简化
为便于对固体能量状态的描述和讨论,人们引进了一些有效的近似。
一个经常采用的近似:
上述问题中,很多电子是牢固地束缚在某个核的周围,它们与核一起组成所谓的原子实:
原子核 + 相应原子的内层电子(构成满壳层)
在光跃迁过程中,原子实内部运动状态很少受影响,因而这些结合紧密的粒子集合—原子实,在所考虑的问题中可以近似地看成是一个粒子,于是整个固体就变成由大量的原子实和外层(价)电子组成,体系的粒子数大大减少。
问题没有实质性的改变。
