(完整版)饲料中霉菌总数测定方法
饲料总菌数的测定

饲料中细菌总数的测定方法标准类别:农业饲料标准实施日期:点击:236本标准参照采用国际标准 ISO4833—1978《食品和动物饲料中微生物学检验方法》。
1 主题内容与适用范围本标准规定了饲料中细菌总数的测定方法。
本标准适用于饲料中细菌总数的测定。
2 原理将试样稀释至适当浓度,用特定的培养基,在30±1℃下培养72±3h,计数平板中长出的菌落数,计算每克试样中的细菌数量。
3 仪器、设备3.1 天平:感量为0.1g。
3.2 振荡器:往复式。
3.3 干热灭菌箱:50-200±1℃。
3.4 高压灭菌锅。
3.5 冰箱:普通冰箱。
3.6 恒温箱30±51℃。
3.7 电炉:可调式。
3.8 平皿:直径为9cm。
3.9 吸管:容量为1、10mL。
3.10 三角烧瓶:容量为 250、500mL。
3.11 玻璃珠。
3.12 试管:18×180mm。
3.13 水浴锅46±1℃。
3.14 酒精灯。
3.15 试管架。
3.16 橡皮乳头。
4 检验程序细菌总数的检验程序如下:检样↓做成几个适当倍数的稀释液↓选择2-3个适宜稀释度,各以1ml量加入灭菌皿内↓每平皿内加入适量琼脂30±1℃↓ 72±3h菌落计数↓报告5 操作步骤5.1 采样采样时必须特别注意样品的代表性和避免采样时的污染。
首先准备好灭菌容器和采样工具,如灭菌牛皮纸袋或广口瓶,金属勺和刀,在卫生学调查基础上,采取有代表性的样品,样品采集后应尽快检验,否则应将样品放在低温干燥处。
根据饲料仓库、饲料垛的大小和类型,分层定点采样,一般可分三层五点或分层随机采样,不同点的样品,充分混合后,取500g左右送检,小量存贮的饲料可使用金属小勺采取上、中、下各部位的样品混合。
海运进口饲料采样:每一船仓采取表层、上层、中层及下层四个样品,每层从五点取样混合,如船仓盛饲料超过10000t,则应加采一个样品。
饲料中霉菌毒素快速检测技术

Veratox 组胺检测试剂盒
检测线2.5-50ppm
检测结果
NEOGEN公司ELISA试剂盒特点
1-操作简单,速度快-所有的霉菌毒素检测只需移液器和酶标 仪就可以获得准确结果,并且所有试剂盒操作步骤几乎一 样;大部分试剂盒的前期样品处理时间不超过3分钟,检测时 间不超过20分钟,同传统方法相比有明显的优势; 2-使用广泛-世界各地普遍使用,适合于目前中国大多数饲料 企业实验室检测; 3-质量可靠-试剂盒灵敏度和重复性非常高,其它公司产品无 法达到;黄曲霉毒素试剂盒是美国农业部指定使用产品,呕 吐毒素试剂盒是世界同类产品金标准,玉米烯酮试剂盒为 AOAC官方方法;
Veratox 伏马毒素试剂盒
检测线1-6ppm和 50-600ppb
检测结果
Veratox T-2毒素试剂盒
第一步 样品处理 1-取代表性的样品,粉碎,使75%的样品过20目筛; 2-取5g到25ml 50%甲醇溶液中,震荡3分钟; 3-静止2-3分钟,过滤,收集滤液;。 第二步 检测 1-向每个红色微孔中加入100ul酶结合物溶液; 2-再分别加入100ul标准品和样品处理液,混匀; 3-从红色微孔中取100ul到抗体孔中,室温下温育5分钟; 4-洗涤3-5次; 5-每孔加入100ul底物,室温下温育5分钟; 6-每孔加入100ul终止液,混匀; 7-在酶标仪上读数。
Veratox黄曲霉毒素试剂盒 (美国农业部指定使用产品 USDA认证号#2005-102)
Veratox黄曲霉毒素试剂盒 (美国农业部指定使用产品,USDA认证号 #2005-102)
第一步 样品处理 1-取代表性的样品,粉碎,使75%的样品过20目筛; 2-取5g到25ml 70%甲醇溶液中,震荡3分钟; 3-静止2-3分钟,过滤,收集滤液; 第二步 检测 1-向每个红色微孔中加入100ul酶结合物溶液; 2-再分别加入100ul标准品和样品处理液,混匀; 3-从红色微孔中取100ul到抗体孔中,室温下温育2分钟; 4-洗涤3-5次; 5-每孔加入100ul底物,室温下温育3分钟; 6-每孔加入100ul终止液,混匀; 7-在酶标仪上读数
霉菌、酵母检验

霉菌、酵母菌检验(一)实验原理霉菌和酵母菌菌数的测定是指食品检样经过处理,在一定条件下培养后,所得1g 或1mL检样中所含的霉菌和酵母菌菌落数(粮食样品是指1g粮食表面的霉菌总数)。
(二)实验器材1.培养基:马铃薯-葡萄糖-琼脂培养基马铃薯(去皮切块)300 g葡萄糖20.0 g琼脂20.0 g氯霉素0.1 g蒸馏水1000 mL制法:将马铃薯去皮切块,加1000mL蒸馏水,煮沸10 min-20 min。
用纱布过滤,补加蒸馏水至1000 mL。
加入葡萄糖和琼脂,加热溶化,分装后,121 ℃灭菌20 min。
倾注平板前,用少量乙醇溶解氯霉素加入培养基中。
2.器皿:已灭菌的平皿(9套/组),1mL吸管(6支/组),试管(15×150)(6/组),三角锥瓶500mL、三角锥瓶500mL(内装蒸馏水250mL),10mL吸管。
3.其他:牛皮纸或报纸,酒精灯,棉花,高压蒸汽菌锅,电烘箱,线绳,毛刷等。
(三)操作步骤1.检验程序2.操作要点1)采样选取有代表性的样品并避免采样时的污染。
2)样品处理(1)以无菌操作称取检样25mL,放入含有225mL灭菌水的玻塞三角瓶中,振摇30 min,即为1:10稀释液。
(2)用灭菌吸量管吸取1:10稀释液10mL,注入试管中,另用带橡皮乳头的1mL 灭菌吸量管反复吹吸50次,使霉菌孢子充分散开。
(3)取1mL 1:10稀释液注入含有9mL灭菌水的试管中,另换一支1mL灭菌吸量管吹吸5次,此液为1:100稀释液。
(4)按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
3)接种培养根据对样品污染情况的估计,选择3个合适的稀释度,分别在做10倍稀释的同时,吸取1mL稀释液于灭菌平皿中,每个稀释度做2个平皿,然后将凉至45 ℃左右的培养基注入平皿中,待琼脂凝固后,倒置于25-28℃温箱中,3d后开始观察,共培养观察5d。
4)计算方法通常选择菌落数在10-150之间的平皿进行计数,一个稀释度使用两个平板,采用两个平板的平均数;选择稀释度也选择平均菌落数在10-150之间的稀释度,菌落平均数乘以稀释倍数,即为每克(或毫升)检样中所含霉菌和酵母数。
饲料中霉菌毒素检测技术

霉菌毒素是霉菌产生的次级代谢产物
酵母
次
级 代
抗生素
真菌
霉菌
谢
产
物
霉菌毒
素
蕈菌
精品PPT
一、饲料(sìliào)中霉菌毒素的危害
2、霉菌毒素(dú sù)产生的原因
霉菌无处不在,它们可在农作物生长、收获、运输 和储存期间生长并产生毒素 农作物作为饲料原料在生产、销售、储存、运输 过程中如果受到霉菌污染也会发生霉变、遭受霉 菌毒素污染
2、竞争(jìngzhēng) ELISA 的原理
精品PPT
三、ELISA法的操作(cāozuò)要点及注意事项
2、检测(jiǎn cè)步骤及注意事项
(1)准备阶段 • 详细阅读说明书
• 确认试剂盒试剂组成、数量及其用途
• 试剂配制 • 试样的制备、提取及稀释
• 试剂盒试用前要充分回温
• 实验室室温最好控制在20-25℃ • 准备好实验器具(移液枪机及枪头) • 确认仪器设备运行正常
GB/T19540-2004
DB51/T 1080-2010
饲料中黄曲霉毒素B1、B2、G1、G2的测定 免疫亲和柱净化-高效液相色谱法 饲料中黄曲霉毒素B1的测定 酶联免疫吸附法 饲料中黄曲霉毒素B1的测定 半定量薄层色谱法 饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定液相色谱-串联质谱法 饲料中黄曲霉毒素B1的测定 胶体金法 饲料中黄曲霉毒素B1的测定 免疫亲和荧光光度法 饲料中黄曲霉毒素B1的测定 时间分辨荧光免疫层析法 饲料中黄曲霉毒素B1的测定 高效液相色谱法 饲料中玉米赤霉烯酮的测定 免疫亲和柱净化-高效液相色谱法
取样 GB/T14699.1 2005 饲料 采样
准确、简单、快速有效地检测饲料中的霉(真)菌毒素

July 2011 CHINA FOOD SAFETY 41准确、简单、快速有效地检测饲料中的霉(真)菌毒素□ 拜发分析系统销售(北京)有限公司 供稿分析与检测 ANAlySIS & TEST“当前玉米100%被霉菌污染,90%以上的混合饲料(预混、浓缩、全价)被污染”!在霉(真)菌毒素实用快速检测技术及解决方法讲座上,某企业的负责人语出惊人。
现实如此还是商家在炒作与霉(真)菌毒素相关的产品呢?在对中国13个省的玉米、全价饲料、蛋白饲料等样品进行调查以后,我们发现全价饲料中6种霉(真)菌毒素(黄曲霉毒素、T-2毒素、呕吐霉素、玉米赤霉烯酮、赭曲霉毒素、烟曲霉毒素)检出率均在90%以上。
蛋白质饲料中黄曲霉毒素及玉米样品中呕吐霉素和玉米赤霉烯酮检出率高达100%,且有不同程度的超标。
可见霉菌广泛存在是不争的事实,且霉(真)菌毒素中毒一般是很难解毒的。
美国油脂协会王征用“随处可见”来形容当前饲料行业的霉(真)菌毒素污染程度!在其资料中显示,在配合饲料和饲料原料中玉米和配合饲料的黄曲霉毒素含量高达30μg/kg。
除此之外多种霉(真)菌毒素的共存,混合污染的霉(真)菌毒素的协同作用令其产生更大的破坏力。
因此只有对食品和饲料中霉(真)菌毒素进行定性和定量检测并及时监控——德国拜发R-Biopharm公司试剂盒为美国农业部和欧盟推荐方法和处理,才能保障人畜的健康。
鉴于霉(真)菌毒素独特的结构,寻找快速、高灵敏度、高特异性的霉(真)菌毒素检测方法,显得尤为重要。
德国拜发R-Biopharm公司在2010年正式完成了对美国Trilogy Lab的收购后,成功使得国际上两大霉(真)菌毒素检测领域的研发生产商和服务商(认证实验室)强强结合,在霉(真)菌毒素检测领域,所能提供的产品已毋庸置疑地成为最全面、最专业的代名词。
其中包括美国Trilogy Lab一贯具有国际优势的PuriTox SR 霉(真)菌毒素检测多功能净化柱、Trilogy ®国际认证的霉(真)菌毒素标准品、RIDASCREEN ®霉(真)菌毒素ELISA检测试剂盒、霉(真)菌毒素样品处理装置以及CEN法规唯一规定的霉(真)菌毒素HPLC衍生装置KOBRA CELL等等。
食品微生物霉菌和酵母菌计数检验操作规程
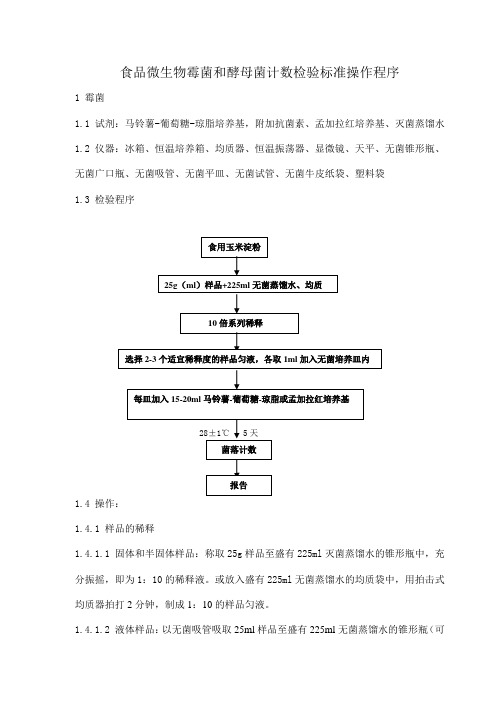
食品微生物霉菌和酵母菌计数检验标准操作程序1 霉菌1.1 试剂:马铃薯-葡萄糖-琼脂培养基,附加抗菌素、孟加拉红培养基、灭菌蒸馏水1.2 仪器:冰箱、恒温培养箱、均质器、恒温振荡器、显微镜、天平、无菌锥形瓶、无菌广口瓶、无菌吸管、无菌平皿、无菌试管、无菌牛皮纸袋、塑料袋1.3 检验程序1.4 操作:1.4.1 样品的稀释1.4.1.1 固体和半固体样品:称取25g样品至盛有225ml灭菌蒸馏水的锥形瓶中,充分振摇,即为1:10的稀释液。
或放入盛有225ml无菌蒸馏水的均质袋中,用拍击式均质器拍打2分钟,制成1:10的样品匀液。
1.4.1.2液体样品:以无菌吸管吸取25ml样品至盛有225ml无菌蒸馏水的锥形瓶(可在瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
1.4.1.3 取1 ml 1:10稀释液注入含有9 ml无菌水的试管中,另换一支1 ml无菌吸管反复吹吸,此液为1:100稀释级。
1.4.1.4 按上述操作顺序制备10倍系列稀释样品匀液,每递增稀释一次,换用一支1ml无菌吸管,1.4.1.5根据对样品污染情况的估计,选择2-3个适宜稀释度的样品匀液,在进行10倍递增稀释的同时,每个稀释度分别吸取1ml样品匀液于2个无菌平皿内,同时分别取1ml样品稀释液加入2个无菌平皿人空白对照。
1.4.1.6 及时将15-20ml冷却至46℃的马铃薯-葡萄糖-琼脂或孟加拉红培养基(可放置于46±1℃恒温水浴箱中保温)倾注平皿,并转动平思虑使其混合均匀。
1.4.2 培养1.4.2.1 待琼脂凝固后,倒置于28±1℃温箱培养5天,观察并记录。
1.4.3 菌落计数1.4.3.1肉跟观察,必要时可用放大镜,记录各稀释倍数和相应的霉菌和酵母菌。
以菌落形成单位CFU表示。
1.4.3.2 选取菌落数在10-150CFU的平板,根据菌落形态分别计数霉菌笔酵母数。
霉菌蔓延生长覆盖整个平板的可记录为多不可计。
饲料中霉菌毒素检测技术

紫外检测器 荧光检测器
荧光检测器 荧光检测器 串联质谱 需柱前化学衍生 荧光检测需柱前 化学衍生
甲醇-水
甲醇-水 甲醇-水
免疫亲和柱
免疫亲和柱 免疫亲和柱 SAX净化柱
四、HPLC法在饲料霉菌检测中的应用
2、免疫亲和柱净化原理
加入待净化样本 洗涤干扰物 洗脱目标物
四、HPLC法在饲料霉菌检测中的应用
检测方法
高效液相色谱法(荧光) 酶联免疫吸附法 薄层色谱法 液相色谱-串联质谱法 胶体金法 荧光光度法 免疫层析法 高效液相色谱法 高效液相色谱法(荧光) 薄层色谱法 酶联免疫吸附法 高效液相色谱法 液相色谱-串联质谱法 高效液相色谱法(紫外) 薄层色谱法
高效液相色谱法
黄曲霉毒素
NY/T 2071-2011 NY/T 2550-2014 NY/T 2549-2014 NY/T 2548-2014 DB37/T 2617-2014 GB/T 28716-2012
四、HPLC法在饲料霉菌检测中的应用
1、HPLC法检测霉菌毒素的关键点比较
霉菌毒素 名称
黄曲霉毒素 玉米赤霉烯酮
提取液
甲醇-水 乙腈-水 水
净化
免疫亲和柱 多功能净化柱 免疫亲和柱 免疫亲和柱
检测器
荧光检测器 串联质谱 荧光检测器 串联质谱
备注
荧光检测需柱前 光化学衍生
脱氧雪腐镰刀菌 烯醇(呕吐毒素) 赭曲霉毒素A
•
•
加洗液不要溢出微孔,防止交叉污染
拍板用力适当,看不到明显液体为宜
三、ELISA法的操作要点及注意事项
2、操作要点及注意事项(续)
(5)显色 • • • • 加显色液要快速准确 回形振荡混匀,消除气泡 严格按照说明书控制温度、时间及避光要求 防止微孔内液体挥发,加以密封
饲料霉菌总数的测定国标

饲料霉菌总数的测定国标一、引言饲料是动物生产过程中重要的营养来源。
然而,由于储存条件不当或生产过程中的不洁,饲料可能会受到霉菌污染。
霉菌不仅会降低饲料的品质和营养价值,还可能产生有害的毒素,对动物的健康造成威胁。
因此,为了保证饲料的质量和安全性,饲料霉菌总数的测定国标应当制定和实施。
二、目的和范围本国标的目的在于规定了饲料霉菌总数的测定方法和评价标准,以确保饲料的质量和安全性。
本国标适用于各类饲料样品的霉菌总数测定。
三、术语和定义1. 霉菌总数:指在给定条件下,饲料样品中可生长的霉菌的总数。
2. CFU/g:菌落形成单位/克,表示饲料中每克含有的活菌数量。
四、设备和试剂1. 培养基:按照相关标准配制。
2. 培养皿:直径90-100mm,透明的玻璃或塑料培养皿。
3. 称量仪器:用于准确称量饲料样品。
4. 移液器、均衡培养皿等常规实验室设备。
五、操作步骤1. 取样:从饲料样品中随机取样,确保样品具有代表性。
2. 准备培养基:按照相关标准配制培养基。
3. 加入样品:将取得的样品加入到含有培养基的培养皿中。
4. 均匀涂布:使用均衡培养皿,将样品均匀涂布在培养基上。
5. 培养:将培养皿置于恒温培养箱中,在适当的温度下培养一定时间。
6. 菌落计数:在培养箱中取出培养皿,使用放大镜和计数器进行菌落计数。
7. 记录结果:记录每个培养皿中的菌落数量,并计算平均值。
8. 结果评价:根据国家标准,评价菌落总数是否符合规定的标准要求。
六、结果评价标准根据国家标准,饲料霉菌总数的评价标准如下:1. 优等品:霉菌总数不超过×× CFU/g。
2. 一等品:霉菌总数不超过×× CFU/g。
3. 合格品:霉菌总数不超过×× CFU/g。
4. 不合格品:霉菌总数超过×× CFU/g。
七、注意事项1. 操作过程中要注意无菌操作,避免样品污染。
2. 使用的培养基要符合相关标准,以确保结果的准确性和可比性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
霉菌总数检测操作规程
1 原理
根据霉菌生理特性,选择适宜霉菌生长而不适宜细菌生长的培养基,采用平板计数法测定霉菌总数。
2 试剂与仪器
2.1 所用器具
三角烧瓶、玻璃珠、具塞试管、培养皿、1000μL枪头、5mL枪头、称量勺、接种环、接种针、移液器
2.2 仪器:分析天平、恒温培养箱、微型振荡器、超净工作台、高压灭菌锅
2.3 所用试剂和培养基
高盐察氏培养基
取高盐察氏培养基109g,加入蒸馏水1L,搅拌加热至完全溶解,分装三角瓶,115℃高压灭菌30 min,备用。
3、操作步骤
3.1配制0.85%生理盐水
称取氯化钠8.5g溶于1000mL蒸馏水中。
3.2 锥形瓶加入生理盐水90mL,试管中加入生理盐水9mL,121℃灭菌30min。
(三角烧瓶个数与样品数量一致,试管数量与稀释次数相关)。
3.3 将1000μL枪头、培养皿、5mL枪头、称量勺、带6颗玻璃珠具塞试管,121℃灭菌30min。
(注意计算数量)
3.4 枪头、培养皿置于烘箱103℃烘干。
(1-3步需提前一天完成)
3.5 对称量房间进行紫外灭菌30分钟,关灯静置60 min。
以无菌操作取样品10g于含90mL 生理盐水三角烧瓶中,于振荡器上振荡30min,制成1:10的均匀稀释液。
3.6 吸取1:10稀释液10mL注入带玻璃珠的试管,置微型混合器上混合3min。
3.7 用1000μL枪头吸取1:10稀释液1mL,沿管壁慢慢注入含有灭菌生理盐水9mL的试管中,于振荡器上混合均匀,制成1:100的均匀稀释液。
3.8 另取一只1mL灭菌吸管,按照上述操作方法,作10倍递增稀释,如此每递增稀释一
次,更换一支灭菌吸头。
3.9 选择3个适宜稀释度,分别在作10倍递增稀释的同时,吸取该稀释的吸管移1mL稀释液于灭菌平皿内,每个稀释度作两个培养皿。
3.10 稀释液移入培养皿后,及时将凉至46℃±1℃的高盐察氏培养基(可放置46℃±1℃水浴锅内保温)注入培养皿约15mL,小心转动培养皿使试样与培养基充分混匀。
3.11 待琼脂凝固后,倒置平皿于28℃±1℃恒温培养箱内培养3天后开始观察,培养观察一周。
计算平板内菌落总数目,菌落总数乘以稀释倍数,即得每克试样所含霉菌总数。
4 霉菌总数计算方法
做平板菌落计数时,可用肉眼观察,如菌落形态较小可借助放大镜观察。
在计算出各平板菌落总数后,求出同稀释度的两个平板菌落的平均值。
4.1 霉菌总数的报告形式
菌落总数在100以内时,按其实有数报告,大于100时,采用两位有效数字,在两位有效数字后面的数值,以四舍五入方法修约。
为了缩短数字后面的零数,也可以用10的指数表示。
(见表1)
4.2霉菌总数计数的报告
4.2.1 平板霉菌总数的选择
选择菌落总数在10~100之间的平板进行霉菌总数测定,每一稀释度使用两个平板菌落的平均数。
两个平板其中一个平板有较大片状菌落生长时不宜采用;若片状菌落不到平板的一半,而另一半菌落分布又很均匀,即可计算半个平板后乘2以代表全平皿霉菌总数。
4.2.2 稀释度的选择
①应选择平均菌落总数在10~100之间的稀释度,乘以稀释倍数报告之(见表1中例次1)
②若有两个稀释度,其生长的菌落总数均在10~100之间,则视两者之比如何来决定。
若其比值(高稀释度数值:低稀释度数值)≤2,应报告其平均值;若>2则报告其中较小的数字(见表1中例次2及例次3)。
③若所有稀释度的平均菌落总数均大于100,则应按稀释度最高的平均菌落总数乘以稀释倍数报告之(见表1中例次4)。
④若所有稀释度的平均菌落总数均小于10,则应按稀释度最低的平均菌落总数乘以稀释倍数报告之(见表1中例次5)。
⑤若所有稀释度均无菌落生长,则以小于1乘以最低稀释度报告之(见表1中例次6)。
⑥若所有稀释度的平均菌落总数均不在10~100之间,其中一部分>100,或者小于10时,则以最接近10或100的平均菌落总数乘以稀释倍数报告之(见表1中例次7)。
例次稀释液及菌落总数稀释液
之比
稀释度选择
霉菌总数
/[CFU/g(mL)]
报告方式
/[CFU/g(mL)] 10-110-210-3
1 多不
可计
80 8 —
取平均菌落总数在10~100之间
的稀释度
8000 8.0×103
2 多不
可计
87 12 1.4
10~100之间,比值(12000:8700)
≤2,报告平均值
10350 1.0×104
3 多不
可计
95 20 2.1
10~100之间,比值(20000:9500)
>2,报告较小的数值
9500 9.5×103
4 多不
可计
多不
可计
110 —
所有稀释度的平均菌落总数均
大于100,报告稀释度最高的数
110000 1.1×105
5 9 2 0 —所有稀释度的平均菌落总数均
小于10,报告稀释度最低的数
90 90
6 0 0 0 —所有稀释度均无菌落生长,则以
<1乘以最低稀释度
<1×10<10
7 多不
可计
102 3 —
所有稀释度的平均菌落总数均
不在10~100之间,报告最接近
10或100的数
10200 1.0×104注:CFU/g(mL)与个/g(mL)相当。
