第三章 小专题 大智慧(五) 晶体熔、沸点高低的比较
人教版高中化学选修3课件 第三章 晶体结构和性质复习 (共14张PPT)

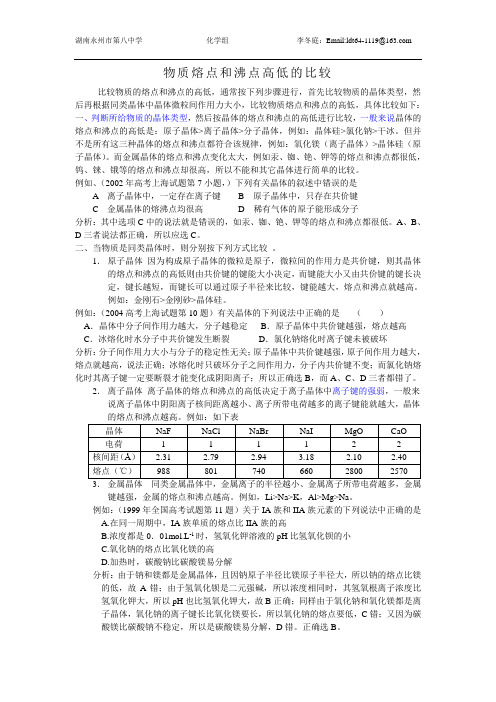
如:NaCl>KCl>RbCl>CsCl
(4)分子晶体: 结构和组成相似的物质,相对分子质量越大,熔、沸 点越高(注意氢键影响),如:HF>HI>HBr>HCl 相对分子量接近的物质,极性越强,熔、沸点越高, 如:CO>N2
规 定 的 实 施 细则》 ,加深公 司党员 干部对 改变 工 作 作 风 重 要性的 认识,不 断提升 工作效 率和水 平,严格 遵守廉 洁从业 规定,依 法依
规行权履职
6
个碳原子。
109°28′
共价键
晶体硅、碳化硅结构与金刚石类似
2、二氧化硅 ①每个硅原子与 4 个氧原子相连;
每个氧原子与 2 个硅原子相连。 ②最小环上有 6 个硅原子, 6 个氧原子。 ③晶体中是否存在分子?
几类晶体结构模型
1、金刚石 ①每个碳以 共价 键与相邻 4 个碳结合,
成为正四面体 构型。
②晶体中碳碳键夹角为 109°28′ ,碳原子 采取了 sp3 杂化。
③最小环有
公 司 纪 检 党 风廉政 建设和 反腐败 自查报 告 一 、 主 体 责 任落实 情况
年 初 ,XX公 司 召 开了 党风廉 政建设 和反腐 败工作 专题会 议,公 司党委 书记传 达宣贯 了 集 团 公 司 、XX分 公司党 风廉政 建设和 反腐败 专题会 议精神 ,并在会议上就公司工 作 做 出 了 具 体要求 。纪委 书记在 会上领 学了《 关于印 发的通 知》、 XX集团 有限公
XX份 。 同 时 ,公 司纪 委组织 层以上 领导干 部手写 廉洁自 律承诺 书并上 墙公示 。 党 风 廉 政 宣 教月期 间,制定 了XX公 司党风 廉政宣 教月活 动方案 ,开展 一系列 活动。 党 委 书 记 作 了专题 党课,重 温党的 十九大 报告对 党风廉 政建设 暨反腐 败重遏 制、强 高 压 、 长 震 慑的坚 决打击 态度,促 进党员 干部增 强廉洁 自律意 识和廉 洁从政 的自觉 性 。 纪 委 书 记专题 辅导再 学习《 XX公司 党委落 实关于 改进工 作作风 密切联 系群众
物质熔点和沸点高低的比较
物质熔点和沸点高低的比较比较物质的熔点和沸点的高低,通常按下列步骤进行,首先比较物质的晶体类型,然后再根据同类晶体中晶体微粒间作用力大小,比较物质熔点和沸点的高低,具体比较如下:一、判断所给物质的晶体类型,然后按晶体的熔点和沸点的高低进行比较,一般来说晶体的熔点和沸点的高低是:原子晶体>离子晶体>分子晶体,例如:晶体硅>氯化钠>干冰。
但并不是所有这三种晶体的熔点和沸点都符合该规律,例如:氧化镁(离子晶体)>晶体硅(原子晶体)。
而金属晶体的熔点和沸点变化太大,例如汞、铷、铯、钾等的熔点和沸点都很低,钨、铼、锇等的熔点和沸点却很高,所以不能和其它晶体进行简单的比较。
例如、(2002年高考上海试题第7小题,)下列有关晶体的叙述中错误的是A离子晶体中,一定存在离子键 B 原子晶体中,只存在共价键C 金属晶体的熔沸点均很高D 稀有气体的原子能形成分子分析:其中选项C中的说法就是错误的,如汞、铷、铯、钾等的熔点和沸点都很低。
A、B、D三者说法都正确,所以应选C。
二、当物质是同类晶体时,则分别按下列方式比较。
1.原子晶体因为构成原子晶体的微粒是原子,微粒间的作用力是共价键,则其晶体的熔点和沸点的高低则由共价键的键能大小决定,而键能大小又由共价键的键长决定,键长越短,而键长可以通过原子半径来比较,键能越大,熔点和沸点就越高。
例如:金刚石>金刚砂>晶体硅。
例如:(2004高考上海试题第10题)有关晶体的下列说法中正确的是()A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏分析:分子间作用力大小与分子的稳定性无关;原子晶体中共价键越强,原子间作用力越大,熔点就越高,说法正确;冰熔化时只破坏分子之间作用力,分子内共价键不变;而氯化钠熔化时其离子键一定要断裂才能变化成阴阳离子;所以正确选B,而A、C、D三者都错了。
高中化学如何判断晶体熔沸点高低

高中化学如何判断晶体熔沸点高低第一篇:高中化学如何判断晶体熔沸点高低如何判断常见晶体物质熔点高低一般来说:原子晶体>离子晶体>分子晶体如果为同一种晶体如何判断1、如果都是原子晶体就按照已有顺序排2、如果都是离子晶体则:第一步如果电荷量相同,则比较不通的晶体的库仑力,简单的说就是比较他们原子半径的大小,第二部,如果他们的电荷量不同,一般来说电荷量大的离子晶体熔沸点高3、如果是同为分子晶体看分子量一般来说分子量大的高但是也要需要考虑分子的对称性及有无氢键,一般来说有对称性的有氢键的高,掌握了这几个小点一般啊高中不会出一些让你分辨不清的,呵呵。
这是本人高中学习化学心得,不过现在忘得很多,如有不足还请谅解第二篇:物质熔沸点高低的规律小结物质熔沸点高低的规律小结熔点是固体将其物态由固态转变(熔化)为液态的温度。
熔点是一种物质的一个物理性质,物质的熔点并不是固定不变的,有两个因素对熔点影响很大,一是压强,平时所说的物质的熔点,通常是指一个大气压时的情况,如果压强变化,熔点也要发生变化;另一个就是物质中的杂质,我们平时所说的物质的熔点,通常是指纯净的物质。
沸点指液体饱和蒸气压与外界压强相同时的温度。
外压力为标准压(1.01×105Pa)时,称正常沸点。
外界压强越低,沸点也越低,因此减压可降低沸点。
沸点时呈气、液平衡状态。
在近年的高考试题及高考模拟题中我们常遇到这样的题目:下列物质按熔沸点由低到高的顺序排列的是,A、二氧化硅,氢氧化钠,萘B、钠、钾、铯C、干冰,氧化镁,磷酸D、C2H6,C(CH3)4,CH3(CH2)3CH3 在我们现行的教科书中并没有完整总结物质的熔沸点的文字,在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下:根据物质在相同条件下的状态不同一般熔、沸点:固>液>气,如:碘单质>汞>CO2 2.由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
高中化学知识点总结:第三章晶体结构与性质

第三章晶体结构与性质课标要求1.了解化学键和分子间作用力的区别。
2.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
3.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
5.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
要点精讲一.晶体常识1.晶体与非晶体比较2.获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3.晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4.晶胞中微粒数的计算方法——均摊法如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立方晶胞立方晶胞中微粒数的计算方法如下:注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状二.四种晶体的比较2.晶体熔、沸点高低的比较方法(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
三.几种典型的晶体模型。
四种晶体熔沸点高低比较方法

四种晶体熔沸点高低比较方法
1晶体比较熔沸点的特点
晶体的熔沸点比较是一种常见的实验,通过对比不同的晶体的熔沸点,可以识别出它们的化学成分和结构特征。
有一些物质的熔沸点可以比较,如无机晶体,碳水素等,这些熔沸点的差别可以用来反映晶体的构成上的不同。
2熔沸点比较的方法
熔沸点比较是基于热能转化原理完成的,一般会利用中心温度计或定熔沸点仪精确测量来完成。
具体的做法包括:
①首先测量准备比较的晶体的熔沸点,一旦达到一定的温度时,晶体就会被液化,这时可以记录温度;
②这时可以在熔融的晶体之间进行温度的比较,例如,两者之间的温度差就可以提供一个大致表征晶体熔沸点的数值;
③在此基础上,通过温度和晶体结构的分析,可以发现多种不同的晶体熔沸点的比较方法;
3四种晶体的熔沸点比较
下面来看看具体四种晶体的熔沸点比较:
(1)依据晶体构造特性:比较不同的晶体的结构特征,对比它们的熔沸点。
例如,晶体的结构会影响电磁性能,而晶体熔沸点也会随之变化;
(2)依据晶体温度特性:通过测量不同晶体的汞温度,确定它们熔沸点的不同;
(3)依据电磁特性:通过电磁算法测量晶体的熔沸点,可以得出精确的数值;
(4)依据分子弛豫:这是晶体分子由冻结状态转变为液态状态过程中弛豫过程所造成的,比较起来,这一类的方法要比前三种更精确,因为它能从晶体液态之间的小尺度变化中得到更精确的晶体分析结果。
4结论
熔沸点比较是一种衡量晶体构造和电磁性能的有效手段,它通过对比不同的晶体的熔沸点特性、温度特性、电磁特性和分子弛豫来揭示晶体的构造细节和电磁性能。
比较物质溶沸点高低的规律比较物质溶

比较物质溶、沸点高低的规律比较物质溶、沸点高低的规律一. 规律小结(1)原子晶体:原子晶体间键长越短、键能越大,共价键越稳定,物质熔、沸点越高,反之越低。
如:金刚石>金刚砂(SiC)>晶体硅(2)离子晶体:离子晶体中阴、阳离子半径越小,电荷数越多,则离子键越强,溶、沸点越高,反之越低。
(3)金属晶体:金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔、沸点越高,反之越低。
合金的熔、沸点一般来说比它各成分的熔、沸点低。
如:铝硅合金<铝(或纯硅)。
(4)分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。
(具有氢键的分子晶体,熔、沸点反常地高)①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。
②组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔、沸点就越高。
③在高级脂肪酸形成的油脂中,不饱和程度越大,熔、沸点越低。
如:硬脂酸油酸硬脂酸甘油脂油酸甘油酯④烃、卤代烃、醇、醛、羧酸等有机物一般随着分子中碳原子数增加,熔、沸点升高。
⑤同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔、沸点降低。
如:。
芳香烃的苯环上有两个取代基时,熔点按对、邻、间位降低,沸点按邻、间、对位降低。
⑥相同碳原子数的有机物,分子中官能团不同,一般随着相对分子质量增大,熔、沸点升高;官能团相同时,官能团数越多,熔、沸点越高。
(5)元素周期表中第VIIA族卤素的单质(分子晶体)的熔、沸点随着原子序数递增而升高;第IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。
(6)不同类型晶体的熔、沸点高低的一般规律为:原子晶体>离子晶体>金属晶体>分子晶体。
应当指出,有的分子晶体的熔、沸点比金属晶体的高,如S常温有固态,Hg却为液态;有的金属晶体的熔、沸点比原子晶体高,如钨比硅的熔点高。
实用文库汇编之晶体熔沸点比较
**实用文库汇编之一般来说(就是在一般的情况下比较,没说“一定”)原子晶体,分子晶体,离子晶体,金属晶体,非金属晶体,的熔沸点高低比较一下排成队列应该是:原子晶体>离子晶体>分子晶体.各种金属晶体之间熔点相差大,不容易比较.你写的"非金属晶体",在化学的"晶体"中,没有这个分类.化学中的晶体总共有:原子晶体,离子晶体,金属晶体,分子晶体,混合晶体(如:石墨)①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。
HF、H2O、NH3等物质分子间存在氢键。
③原子晶体:键长越小、键能越大,则熔沸点越高。
(3)常温常压下状态①熔点:固态物质>液态物质②沸点:液态物质>气态物质定义:把分子聚集在一起的作用力分子间作用力(范德瓦尔斯力):影响因素:大小与相对分子质量有关。
作用:对物质的熔点、沸点等有影响。
①、定义:分子之间的一种比较强的相互作用。
分子间相互作用②、形成条件:第二周期的吸引电子能力强的N、O、F与H之间(NH3、H2O)③、对物质性质的影响:使物质熔沸点升高。
④、氢键的形成及表示方式:F-—H•••F-—H•••F-—H•••←代表氢键。
⑤、说明:氢键是一种分子间静电作用;它比化学键弱得多,但比分子间作用力稍强;是一种较强的分子间作用力。
定义:从整个分子看,分子里电荷分布是对称的(正负电荷中心能重合)的分子。
非极性分子双原子分子:只含非极性键的双原子分子如:O2、H2、Cl2等。
举例:只含非极性键的多原子分子如:O3、P4等分子极性多原子分子:含极性键的多原子分子若几何结构对称则为非极性分子如:CO2、CS2(直线型)、CH4、CCl4(正四面体型)极性分子:定义:从整个分子看,分子里电荷分布是不对称的(正负电荷中心不能重合)的。
举例双原子分子:含极性键的双原子分子如:HCl、NO、CO等多原子分子:含极性键的多原子分子若几何结构不对称则为极性分子如:NH3(三角锥型)、H2O(折线型或V型)、H2O2。
高中化学第3章微专题3晶体熔沸点的比较鲁科版选择性必修2
2.下列物质的熔、沸点高低比较,顺序正确的是( C ) A.CH4>C2H6>C3H8>C4H10 B.CBr4>CI4>CCl4>CF4 C.MgO>H2O>O2>N2 D.H2Se>H2S>H2O 解析 组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,则熔、 沸点为CH4<C2H6<C3H8<C4H10,CI4>CBr4>CCl4>CF4,故A、B错误;离子晶体 的熔、沸点高于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的高,则 熔、沸点为MgO>H2O>O2>N2,故C正确;水分子间存在氢键,所以水的沸点 最高,则熔、沸点为H2O>H2Se>H2S,故D错误。
4.下列分子晶体中,关于熔、沸点高低的排序正确的是( B ) A.H2>N2>O2 B.H2O>H2Se>H2S C.CH4>SiH4>GeH4 D.C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
解析 结构相似的分子晶体的熔点随相对分子质量的增大而升高,熔、沸 点:H2<N2<O2,CH4<SiH4<GeH4,故A、C错误;水分子间存在氢键,熔、沸点 反常升高,熔、沸点:H2O>H2Se>H2S,故B正确;相对分子质量相同的烃,支链 越多熔、沸点越低,C(CH3)4<(CH3)2CHCH2CH3<CH3CH2CH2CH2CH3,故D 错误。
解析 干冰为分子晶体,NaCl为离子晶体,金刚石为共价晶体,一般熔、沸点: 共价晶体>离子晶体>分子晶体,故三种晶体熔、沸点由低到高的顺序:干 冰<NaCl<金刚石。
熔沸点的比较
熔沸点的比较作者: 日期:物质熔沸点高低的比较及应用沸点的高低,首先分析物质所属的晶体类型 ,其次抓住同一类型晶体熔、沸点高低的决定因素 ,现总结如下供同学们参考一、不同类型晶体熔沸点高低的比较般来说,原子晶体〉离子晶体〉分子晶体; 金属晶体(除少数外)>分子晶体。
例如:SiO 2>NaC L>C O 2 (干冰)金属晶体的熔沸点有的很高,如钨、铂等 ;有的则很低,如汞、镓、铯等。
二、同类型晶体熔沸点高低的比较同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大 高。
影响分子晶体熔沸点的是晶体分子中分子间的作用力1.同属分子晶体①组成和结构相似的分子晶体 ,一般来说相对分子质量越大,分子间作用力越强,熔沸点 越高。
例如:12>B r 2>C |2>F 2。
②组成和结构相似的分子晶体, 如果分子之间存在氢键, 则分子之间作用力增大, 熔沸 点出现反常。
有氢键的熔沸点较高。
例如,熔点:HI > HBr > HF>H C l;沸点:HF>HI> HBr> H Cl 。
H g>02。
2.同属原子晶体短,键能就越大,晶体的熔沸点也就越高。
例如 :金刚石(C —C ) >二氧化硅(Si-O ) >碳化硅(S i —C )晶体硅(Si-Si )。
3 .同属离子晶体离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高。
例如: M gO > Mg C I 2, NaCI>CsCI 。
4•同属金属晶体金属阳离子所带的电荷越多,离子半径越小,则金属键越强,高沸点越高。
例如:A 1> M g> Na 。
三、例题分析例题1 .下列各组物质熔点高低的比较,正确的是:河北省宣化县第一中学 栾春武如何比较物质的熔、 ,熔沸点越 ,包括范德华力和氢键。
③相对分子质量相同的同分异构体,一般是支链越多,熔沸点越低。
判断物质熔、沸点高低的几种方法
1、不同晶体类型物质的熔沸点的判断:
原子晶体>离子晶体>分子晶体(一般情况)。
金属晶体熔沸点范围广、跨度大。
有的比原子晶体高,如W熔点3410℃,大于Si。
有的比分子晶体低,如Hg常温下是液态。
2、同一晶体类型的物质:
原子晶体:比较共价键强弱。
原子半径越小,共价键越短,键能越大,熔沸点超高。
如金刚石>碳化硅>晶体硅。
离子晶体:比较离子键强弱。
阴阳离子所带电荷越多、离子半径越小,离子键越强,熔沸点越高。
如MgO>NaCl。
分子晶体:
(1)组成、结构相似的分子晶体,看分子间作用力。
相对分子质量越大,分子间作用力越大,熔沸点越高。
如HI>HBr>HCl。
(2)组成、结构不相似的分子晶体,也看分子间作用力。
一般比较相同条件下的状态。
常温下,I2、H2O、O2的熔沸点。
固体I2大于液体水大于气体氧。
金属晶体:
金属阳离子的半径和自由电子的多少。
金属阳离子半径越小、自由电子越多,熔沸点越高。
如:Li>Na>K>Rb>Cs,
Al>Mg>Na。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.下列变化规律正确的是
()
A.KCl、MgCl2、MgO 的熔点由低到高 B.H2O、H2S、H2Se 的分解温度及沸点都由高到低 C.O2、I2、Hg、NaCl、SiO2 的熔点由低到高 D.碳化硅、晶体硅、金刚石、石墨的熔点由低到高
解析: B 项中沸点 H2Se>H2S,C 项中很明显熔点 I2>Hg, D 项中熔点晶体硅<碳化硅。
小
专
专题技法指导
题
大
智
慧
(
专题专项训练
五)
小专题 大智慧(五) 晶体熔、沸点高低的比较
1.不同晶体类型的熔、沸点高低规律 一般为:原子晶体>离子晶体>分子晶体。金属晶体的熔、 沸点有的很高(如钨),有的很低(如汞)。 2.同属于原子晶体 一般组成晶体的原子半径越小,熔、沸点越高。如熔点: 金 刚 石 (C—C)> 二 氧 化 硅 (Si—O)> 碳 化 硅 (Si—C)> 晶 体 硅 (Si—Si)。
故熔点应是 Li 最高,Rb 最低,C 项不正确;D 项石墨、金刚石 和 SiO2 均为原子晶体,原子晶体的熔点取决于共价键的键能, 而共价键的键能与键长成反比,石墨中 C—C 键键长比金刚石中 C—C 键的键长更短些,所以石墨熔点比金刚石略高,金刚石熔 点又比 SiO2 高。
[答案] D
1.比较下列几组晶体熔、沸点的高低: (1)金刚石、氯化钠、晶体硅、干冰_____________________; (2)石英晶体、铝硅合金、冰_____________________; (3)CaO、KI、KCl_______________________; (4)F2、Cl2、Br2、I2________________________。
()
解析: A 中为分子晶体,但由于 HF 分子间存在氢键,故 HF 的熔点出现反常,排序应为 HI>HF>HBr>HCl;B 中也 为分子晶体,按相对分子质量由大到小排列,正确;C 中为 离子晶体,离子半径 r(Cl-)<r(Br-),故熔点 NaCl>NaBr, 而阳离子 r(Na+)<r(K+),故熔点 NaBr>KBr,正确;D 中为 原子晶体,按键长可知正确。
答案:A
解析:金刚石、晶体硅都属于原子晶体,C 原子半径比 Si 原子半 径小,键能大,金刚石熔点比晶体硅的高;因熔点的高低规律: 原子晶体>离子晶体>分子晶体,故金刚石>晶体硅>氯化钠>干冰。 石英为原子晶体,熔点较高,并且合金的熔点比任一组分熔点都 低,故冰<铝硅合金<金属铝<石英晶体。CaO、KCl、KI 为离子 晶体,熔点:CaO>KCl>KI。F2、Cl2、Br2、I2 为分子晶体,熔 点高低与相对分子质量大小有关,相对分子质量越大,熔点越高, 故熔点高低顺序为:I2>Br2>Cl2>F2。
答案:A
3.下列物质的熔、沸点高低顺序中,正确的是
①金刚石>晶体硅>二氧化硅>碳化硅
②CI4>CBr4>CCl4>CH4 ③MgO>H2O>O2>N2 ④金刚石>生铁>纯铁>钠
A.①②
B.②③
C.③④
D.①④
()
解析:①同属于原子晶体,熔、沸点高低主要看共价键的强弱, 显然对键能而言,晶体硅<碳化硅,错误;②为组成、结构相似 的分子晶体,熔、沸点高低要看相对分子质量的大小,正确;③ 对于不同类型晶体,熔、沸点高低一般为:原子晶体>离子晶体 >分子晶体,MgO>(H2O、O2、H2),H2O>O2>N2,正确;④ 生铁为铁合金,熔点要低于纯铁,错误。 答案: B
答案:(1)金刚石>晶体硅>氯化钠>干冰 (2)石英晶体>铝硅合金>冰 (3)CaO>KCl>KI (4)I2>Br2>Cl2>F2
2.下列关于物质熔点的排列顺序,不正确的是 A.HI>HBr>HCl>HF B.CI4>CBr4>CCl4>CF4 C.NaCl>NaBr>KBr D.金刚石>碳化硅>晶体硅
[例证] 下列各物质中,按熔点由高到低的顺序排列正确
的是
()
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.石墨金刚石>SiO2
[解析] 分子晶体熔点的高低取决于构成该晶体的结构和粒 子间作用力的大小。A 项物质为结构相似的分子晶体,其熔点高 低取决于分子间作用力的大小,一般来说,结构相似的分子晶体, 相对分子质量越大,分子间作用力越大,熔点越高,A 项不正确; B 项物质为离子晶体,离子晶体熔点高低取决于晶格能的大小, 一般来说,离子的半径越小,电荷数越多,晶格能越大,熔点越 高,B 项不正确;C 项物质为同主族的金属晶体,其熔点高低取 决于金属键的强弱,而金属键的键能由金属原子的半径、价电子 数决定,金属原子半径依 Li~Rb 的顺序增大,价电子数相同,
3.同属于离子晶体 离子所带电荷越多,离子半径越小,则离子键越强,熔、沸 点越高。如熔点:MgO>NaCl>CsCl。 4.同属于金属晶体 金属原子的价电子数越多,半径越小,金属键越强,熔、沸 点越高。如熔点:Al>Mg>Na。 5.同属于分子晶体 分子间作用力越强,熔、沸点越高。 (1)组成和结构相似的分子晶体,一般相对分子质量越大,分 子间作用力越强,熔、沸点越高。如熔点:I2>Br2>Cl2>F2。
(2)相对分子质量相同或相近的物质,分子的极性越大,熔、 沸点越高。如沸点:CO>N2。
(3)同分异构体之间: ①一般是支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷 >新戊烷。 ②结构越对称,熔、沸点越低。如沸点:邻二甲苯>间二甲苯 >对二甲苯。 (4)若分子间有氢键,则分子间作用力比结构相似的同类晶体 大,故熔、沸点较高,如沸点:HF>HI>HBr>HCl。 (5)状态不同的物质在相同条件下,熔、沸点:固体>液体>气 体。例如:S>Hg>O2。
