2009-2013年高考化学试题分类汇编:电解质溶液
11-13年最新高考化学二轮分类精编精析 专题9 电解质溶液.

������ ������������������������������������������������������������������������������������������������������������������������������������������������������������
2.关于电离平衡常数的简单计算,属于高考中的高 频 考 点。 2013年高考试题中,天津第8题,山 东 第 13、29 题,广 东 第 6 题, 上 海第14、19题,江苏第11题,安徽第21题等,考查了弱电解质 的电离平衡及其影响因素。
3.中和滴定操作 和 溶 液 pH 计 算 的 方 法,并 能 运 用 数 学 工
CO2 通 入 苯 酚钠 溶 液 中,出 现 浑 浊。 说 明 酸 性:H2CO3 > OH ������ 。
������
3.浓度与 pH 的 关 系,如 0.1mol·L-1CH3COOH,其 pH >1,则可证明 CH3COOH 是弱电解质。
4.测定对应强碱盐的酸碱性。如 CH3COONa溶液呈碱性, 则证明醋酸是弱酸。
2. (2013·天津 理 综 ·5,6 分)下 列 有 关 电 解 质 溶 液 的 说
法正确的是( )。 A.在 蒸 馏 水 中 滴 加 浓 H2SO4,KW 不 变 B.CaCO3 难溶于稀硫酸,也难溶于醋酸 C.在 Na2S 稀 溶 液 中,c(H+ )=c(OH- )-2c(H2S)-
HS- ) D.NaCl溶 液 和 CH3COONH4 溶 液 均 显 中 性,两 溶 液 中 水
5.溶液的酸碱性 与 pH 的 关 系 及 有 关 pH 计 算:会 计 算 溶 液混合后的 pH 值。
2013年高考化学试题分类解析 ——选择题部分(15套word解析)

2013年高考化学试题分类解析——选择题部分(15套word解析)备注:2013年高考化学或者理科综合(化学)试题统计及顺序(共15套,31地区)1、(1套)大纲版全国卷(广西)2、(1套,9地区)新课标全国卷I(内蒙古、宁夏;黑龙江、吉林、河南、河北、山西、陕西、湖南、江西)3、(1套,7地区)新课标全国卷II(西藏,新疆;青海、甘肃、贵州、云南、辽宁)4、(4套,4地区)4个直辖市各一套:北京、天津、上海、重庆5、(8套,8地区)独立命题省份:安徽,山东,四川,江苏,浙江,福建,广东,海南。
6、下面有关发泡塑料饭盒的叙述,不正确的是A.主要材质是高分子材料B.价廉、质轻、保温性能好C.适用于微波炉加热食品D.不适于盛放含油较多的食品【答案】C【解析】本题结合生活,考察学生的有机基础知识,有机物的通性。
【试源】2013高考全国大纲版(广西)理综综合化学7、反应X(g)+Y(g)2Z(g);△H<0,达到平衡时,下列说法正确的是A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大【答案】D【解析】根据方程式系数和△H,分析可得压强增大,平衡不移动;温度升高,平衡逆向移动。
【试源】2013高考全国大纲版(广西)理综综合化学8、下列关于同温同压下的两种气体12C18O和14N2的判断正确的是A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等【答案】C【解析】两者相同的量有,“三同导一同”同体积时,同物质的量;相同物质的量的时候,有相同的原子数,每种分子的电子数均为14,C正确;分子数相同质子数相等,D错误。
中子数前者为16,后者为14,B 错误。
因为M不同,设各有1mol,可得A错误。
【试源】2013高考全国大纲版(广西)理综综合化学9、电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是A.阳极反应为Fe-2e-Fe2+B.电解过程中溶液pH不会变化C.过程中有Fe(OH)3沉淀生成D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原【答案】B【解析】根据总方程式可得酸性减弱,B错误。
2009-2012年高考化学试题分类汇编 电解质溶液.pdf

2009—2012年高考化学试题分类汇编—电解质溶液 2012年高考化学试题 ?7)水中加入下列溶液对水的电离平衡不产生影响的是 A. NaHSO4溶液B. KF溶液 C. KAl(SO4)2溶液D.NaI溶液 答案:D .(2012上海?21)常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是 A.若c(OH-)>c(H+),a=bB.若c(K+)>c(CH3COO-),a>b C.若c(OH-)=c(H+),a>bD.若c(K+)<c(CH3COO-),ab C.c(A-)=c(Na+)D.c(A-) c(HCO3?) > c(CO32?) > c(H2CO3) CpH=11的氨水与pH=3的盐酸等体积混合:c(Cl?)=c(NH4+) > c(OH?)=c(H+) D0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: 2c(H+) 2c(OH?)=c(CH3COO?) c(CH3COOH) .(2012江苏?15)25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。
下列有关离子浓度关系叙述正确的是 A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) BW点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) CpH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1 D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) 答案BC .(2012天津?5)下列电解质溶液的有关叙述正确的是( ) A同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 B在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 C含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO3-) D在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) 答案:D ?11)已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol?L?1的一元酸HA与b mol?L?1的一元碱BOH等体积混合·可判定该溶液呈中性的依据是 A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)=mol?L?1 D.混台溶液中,c(H+)+ c(B+)=c(OH-)+ c(A-) 答案:C .(2012浙江?12)下列说法正确的是: A在100 、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)H2O(l) 的ΔH=40.69 kJ·mol-1 B已知MgCO3的Ksp=6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+) ·c(CO32-)=6.82 × 10-6 C已知: 共价键C-CC=CC-HH-H键能/ kJ·mol-1348610413436则可以计算出反应的ΔH为-384 kJ·mol-1 D常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 答案:D ?10)下列叙述正确的是 A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵 B.稀醋酸加水稀释,醋酸电力程度增大,溶液的pH减小 C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 答案:C 11.(2012重庆?11)向10mL 0.1mol·L?1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是 A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+) B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-) C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)c(HSO3-)>c(SO32-)>c(H+)=c(OH-) c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-) (4)当吸收液的pH降至约为6时,满送至电解槽再生。
2014届高考化学二轮《基本原理》权威课件:专题八 电解质溶液(含13年高考题,52张ppt)

专题八
高 频 考 点 探 究
电解质溶液
B
[解析] pH=2的酸液中c(H+)和pH=12的碱液中
c(OH-)相等,若酸为强酸、碱为强碱,二者等体积混合 时溶液呈中性,故①⑥⑦⑧所得溶液pH一定等于7; ④⑤所得溶液pH可能等于7;②中醋酸过量,所得溶液 pH小于7;③中氨水过量,所得溶液pH大于7。
返回目录
专题八
高 频 考 点 探 究
电解质溶液
变式2 的是( )
对于体积相同的三种溶液[①(NH4)2SO4溶
液、②NH4HSO4溶液、③H2SO4溶液],下列说法正确 A.溶液的pH相同时,3种溶液物质的量浓度大小 顺序是③>②>① B.溶液的pH相同时,将3种溶液稀释相同倍数, pH变化最大的是① C.溶液的pH相同时,由水电离出c(H )的大小顺 序是③>②>① D.若3种溶液的物质的量浓度都相同,则溶液的 pH大小顺序是①>②>③
-14
,故热水的 pH<7,但仍呈中性,D 项正确。
返回目录
专题八
高 频 考 点(H+)=c(OH-)的溶液,只 有在常温下其pH才等于7。
返回目录
专题八
高 频 考 点 探 究
电解质溶液
变式1
常温时,将两种溶液等体积混合,其中溶 )
液pH一定或可能等于7的情况共有(
返回目录
高考纵览
考点 2011
溶液的酸碱性及pH 江苏卷T10, 天津卷T5,山 东卷T14 山东卷T29, 江苏卷T14, 天津卷T4,安 徽卷T13,广 东卷T11 新课标全国卷 T10,江苏卷 T16,浙江卷 T12,福建卷 T10,福建卷 T24
考题 2012 2013
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡
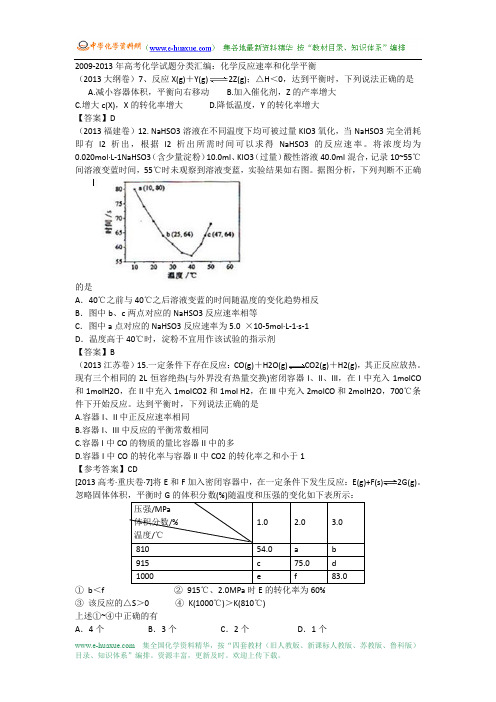
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡(2013大纲卷)7、反应X(g)+Y(g)2Z(g);△H<0,达到平衡时,下列说法正确的是A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大【答案】D(2013福建卷)12. NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。
将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。
据图分析,下列判断不正确的是A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反B.图中b、c两点对应的NaHSO3反应速率相等C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1D.温度高于40℃时,淀粉不宜用作该试验的指示剂【答案】B(2013江苏卷)15.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。
现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO 和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是A.容器I、II中正反应速率相同B.容器I、III中反应的平衡常数相同C.容器I中CO的物质的量比容器II中的多D.容器I中CO的转化率与容器II中CO2的转化率之和小于1【参考答案】CD。
[2013高考∙重庆卷∙7]将E和F加入密闭容器中,在一定条件下发生反应:忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:①b<f③该反应的△S>0 ④K(1000℃)>K(810℃)上述①~④中正确的有A.4个B.3个C.2个D.1个答案:A【解析】同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>75.0>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0,所以①正确;在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得2ax/(a-ax+2ax)=75%,解得x=0.6,②正确;该题是气体体积增大的反应,因此为熵增反应,③正确;结合前面分析知升温平衡正向移动,则平衡常数增大,④正确,故正确答案为:A。
2009年高考各地化学试题分类汇编和解析(无答案修正版)

一、离子反应离子方程式1.(09全国卷Ⅰ.6)下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是A.Ba2+、NO3-、NH4+、Cl-B. Ca2+、HCO3-、NH4+、AlO2-C.K+、Ba2+、Cl-、HSO3-D. Mg2+、NH4+、SO42-、K+2.(09安徽卷10)在溶液中能大量共存的一组离子或分子是A. NH4+、H+、NO3-、HCO3-B. K+ 、Al3+、SO42-、NH3·H2OC. Na+、K+、SO32-、Cl2D. Na+ 、CH3COO-、CO32-、OH-3.(09江苏卷7)在下列各溶液中,离子一定能大量共存的是A.强碱性溶液中:K+、Al3+、Cl-、SO42-B. 含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-C. 含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl-D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-4.(09江苏卷11)下列离子方程式与所述事实相符且正确的是A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2↑+2H2O C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+5.(09广东理科基础32)下列离子方程式正确的是A.铁与稀HNO3反应:Fe+2H+=Fe2++H2↑B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2OC.氯化钙与碳酸氢钾溶液混合:Ca2++CO32-=CaCO3↓D. CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓6.(09广东理科基础33)下列说法正确的是A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中C.乙醇和乙酸都能溶于水,都是电解质D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同7.(09广东化学12)下列离子方程式正确的是A. 向盐酸中滴加氨水:H+ + OH- = H2OB. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2OC. 铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2++ 2 NO ↑+ 4H2OD. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+8.(09四川卷8)在下列给定条件的溶液中,一定能大量共存的离子组是A.无色溶液:Ca 2+、H +、Cl -、HSO 3-B.能使pH 试纸呈红色的溶液:Na +、NH +4、I -、NO 3-C.FeCl 2溶液:K +、、Na +、、SO 42-、AlO 2-、 D.()Kw c H +=0.1 mol/L 的溶液:Na +、K +、SiO 32-、NO 3- 9.(09上海卷18)下列离子方程式正确的是A .24H SO 与2Ba(OH)溶液反应: 2++2-442B a +O H +H +S O B aS O +H O -→↓ B .4CuSO 溶液吸收2H S 气体: 2++2Cu +H S CuS +2H →↓C .3AlCl 溶液中加入过量的浓氨水: 3+-+32242A l +4N H H O A 1O +4N H +2H O∙→ D .等体积、等浓度的2Ba(OH)稀溶液与43NH HCO 稀溶液混合:2+-+-433322Ba +2OH NH +HCO BaCO +NH H O+H O +→↓∙10.(09重庆卷8)下列各组离子,能在溶液中大量共存的是A .+2+--2Na Mg AlO Br 、、、 B. +2+2--43H Fe SO NO 、、、C .++2--43K NH CO OH 、、、 D. 2+3+--3Ca Al NO Cl 、、、11.(09海南卷9)在室温时,下列各组中的物质分别与过量NaOH 溶液反应,能生成5种盐的是:A .A12O 3、SO 2、CO 2、SO 3B .C12、A12O 3、N 2O 5、SO 3C .CO 2、C12、CaO 、SO 3D .SiO 2、N 2O 5、CO 、C1212.(09宁夏卷12)能正确表示下列反应的离子方程式是A. 向次氯酸钙溶液通入过量CO 2:Ca 2++2ClO -+CO 2+H 2O =CaCO 3↓+2HClOB. 向次氯酸钙溶液通入SO 2:Ca 2++2ClO -+SO 2+H 2O= CaSO 3↓+2HClOC. 氢氧化钙溶液与碳酸氢镁溶液反应:HCO 3-+Ca 2++OH -=CaCO 3↓+H 2OD. 在氯化亚铁溶液中加入稀硝酸:3Fe 2++4H ++NO 3-=3Fe 3++NO↑+2H 2O13.(09安徽卷27)(12分)某厂废水中含5.00×10-3mol·L -1的Cr 2O 72-,其毒性较大。
2012年高考化学试题分类解析汇编:电解质溶液(附答案)

2012年高考化学试题分类解析汇编:电解质溶液1.[2012·江苏化学卷10]下列有关说法正确的是A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈C.N2(g)+3H2(g)2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应B 解析:本题是化学反应与热效应、电化学等的简单综合题,着力考查学生对熵变、焓变,水解反应、原电池电解池、化学反应速率的影响因素等方面的能力。
A.分解反应一般是常识吸热反应,熵变、焓变都大于零,仅在高温下自发。
内容来源于《选修四》P34-P36中化学方向的判断。
B.铁比铜活泼,组成的原电池中铁为负极,更易被氧化。
C.据平衡移动原理,升高温度平衡向逆反应方向移动,平衡转化率减小。
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应,越热越电离,水的离子积常数Kw随着温度的升高而增大。
2.[2012·江苏化学卷13]下列根据实验操作和现象所得出的结论正确的是D 解析:本题属于常规实验与基本实验考查范畴。
A.向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,虽然实验现象均有固体析出,但一是盐析,一是变性;一是可逆变化,一是不可逆变化。
B.向溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀就得出溶液X中一定含有SO42-是不合理的,若溶液中有SO32-也出现白色沉淀。
C.向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,结论应为H2CO3的酸性比H2SiO3强。
D.向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明沉淀向着溶解度更小的方向转化,结论应该是Ksp(AgCl)>Ksp(AgI)。
2009-2013年高考化学试题分类解析汇编:电化学基础

世纪金榜圆您梦想 2009-2013年高考化学试题分类解析汇编:电化学基础(2013大纲卷)9、电解法处理酸性含铬废水(主要含有Cr2O72—)时,以铁板作阴、阳极,处理过程中存在反应C「2O72+ 6Fe2+ + 14H +----- 2Cr3++ 6Fe3+ + 7出0,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是A. 阳极反应为Fe—2e「^= Fe2+B.电解过程中溶液pH不会变化C.过程中有Fe(OH)3沉淀生成D.电路中每转移12 mol电子,最多有1 mol Cr2O72—被还原【答案】B【解析】根据总方程式可得酸性减弱,B错误。
阳-yang-氧,f失氧,A正确;Fe—2e—= Fe2+〜〜〜〜2e —,贝U 6mol的铁发生变化时候转移电子数12mol,又据能够处理的关系式,得6Fe~ 12e —6Fe2+Cr2O72—,所以D正确。
在阴极,发生还原反应,J得还,溶液中的氢离子得到电子减少,同时生成氢氧根,C正确。
(2013江苏卷)9.Mg-H2Q电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如下。
该电池工作时,下列说法正确的是A. Mg电极是该电池的正极B. H2Q在石墨电极上发生氧化反应C. 石墨电极附近溶液的pH增大D. 溶液中Cl —向正极移动【参考答案】C着力考查学生对原电池基础知识的理解能力。
【解析】本题是电化学基础的一条简单综合题,A. 组成的原电池的负极被氧化,镁为负极,而非正极。
B、C.双氧水作为氧化剂,在石墨上被还原变为水,溶液PH值增大。
D.溶液中Cl —移动方向同外电路电子移动方向一致,应向负极方向移动。
(2013海南卷)4. Mg-AgCI电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCI+ Mg = Mg 2++ 2Ag +2Cl -。
有关该电池的说法正确的是A . Mg为电池的正极B .负极反应为AgCI+e-=Ag+CI -C •不能被KCI 溶液激活D •可用于海上应急照明供电 [答案]D[解析]:根据氧化还原判断, Mg 为还原剂是负极、失电子,所以 A 、B 都错,C 是指电解质溶液可用KCI 溶液代替。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2009-2013年高考化学试题分类汇编:电解质溶液(2013福建卷)8.室温下,对于0.10 mol·L-1的氨水,下列判断正确的是()A.与AlCl3溶液反应发生的离子方程式为Al3++3OH—=Al(OH)3↓B.加水稀释后,溶液中c(NH4+)c(OH—)变大C.用HNO3溶液完全中和后,溶液不显中性D.其溶液的pH=13【答案】C(2013大纲卷)12、右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是A.两条曲线间任意点均有c(H+)×c(OH-)=KwB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7【答案】D(2013江苏卷)11.下列有关说法正确的是A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极C.CH3COOH 溶液加水稀释后,溶液中c(CH3COOH)c(CH3COO-)的值减小D.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小【参考答案】AC(2013江苏卷)14.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。
下列说法正确的是A.MgCO3、CaCO3、MnCO3 的Ksp依次增大B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)D.c点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-)【参考答案】BD(2013海南)8.0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是A.c(H+)> c(F-) B.c(H+)> c(HF)C.c(OH-)> c(HF) D.c(HF) > c(F-)[答案]BC[2013高考∙重庆卷∙2]下列说法正确的是A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质B.25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOHC.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成D.AgCl易转化为AgI沉淀且K(AgX)=c(Ag+)∙ c(X—),故K(AgI)<K(AgCl)答案:D(2013四川卷)5. 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),下列判断不正确的是()A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)B. 实验①反应后的溶液中:c(OH—) = c(K+) —c(A—) = mol/LC.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/LD.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)【答案】B(2013上海卷)5.374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水A.显中性,pH等于7B.表现出非极性溶剂的特性C.显酸性,pH小于7D.表现出极性溶剂的特性答案:B(2013上海卷)11.H2S水溶液中存在电离平衡H2S H++HS-和HS-H++S2-。
若向H2S 溶液中A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH值增大C.滴加新制氯水,平衡向左移动,溶液pH值减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小答案:C(2013上海卷)19.部分弱酸的电离平衡常数如下表:A.2CN-+H2O+CO2→2HCN+CO32-B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者答案:AD(2013山东卷)13.某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH 溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则A.M点所示溶液导电能力强于Q点B .N 点所示溶液中c(CH3COO-)>c(Na+)C .M 点和N 点所示溶液中水的电离程度相同D .Q 点消耗NaOH 溶液的体积等于醋酸溶液的体积 答案:C(2013浙江卷)12、25℃时,用浓度为0.1000 mol/L 的NaOH 溶液滴定20.00 mL 浓度均为0.1000 mol/L 的三种酸HX 、HY 、HZ ,滴定曲线如图所示。
下列说法正确的是A .在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ <HY <HXB .根据滴定曲线,可得Ka(HY)≈10—5C .将上述HX 、HY 溶液等体积混合后,用NaOH 溶液滴定至HX 恰好完全反应时:c(X —)>c(Y —)>c(OH —)>c(H+)D .HY 与HZ 混合,达到平衡时:c(H+)=+ c(Z —) +c(OH —)答案:B(2013广东卷)12.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是 A .pH=4的醋酸中:c (H+)=4.0mol·L-1B .饱和小苏打溶液中:c (Na+)= c (HCO3-)C .饱和食盐水中:c (Na+)+ c (H+)= c (Cl-)+c (OH-)D .pH=12的纯碱溶液中:c (OH-)=1.0×10-2mol·L-1 答案:C命题意图:水溶液中的离子平衡(2013全国新课标卷2)13.室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a ;c(M2+)=b mol·L-1时,溶液的pH 等于A.11()2bg aB.11()2ag b C.14+11()2ag bD.14+11()2bg a 答案:C(2013安徽卷)12.我省盛产矿盐(主要成分是NaCl ,还好有SO42-等其他可溶性杂质的离子)。
下列有关说法正确的是A .有矿盐生成食盐,除去SO42- 最合适的实际是Ba(NO3)2B .工业上通过电解氯化钠溶液制备金属钠和氯气C .室温下,AgCl 在水中的溶解度小于在食盐中的溶解度D .用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液Ka(HY)·c(HY)c(Y —)【答案】D(2013天津卷)5、下列有关电解质溶液的说法正确的是A、在蒸馏水中滴加浓H2SO4,KW不变B、CaCO3难溶于稀硫酸,也难溶于醋酸C、在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同答案:C(2013北京卷)10.实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是浊液a 中存在沉淀溶解平衡:滤液b中不含有Ag+③中颜色变化说明AgCI 转化为AgI实验可以证明AgI比AgCI更难溶【答案】B(2013全国新课标卷1)11、已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp (Ag2CrO4)=9×10-11。
某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为A、Cl-、Br-、CrO42-B、CrO42-、Br、Cl-C、Br-、Cl-、CrO42-D、Br、CrO42-、Cl-答案:C(2013安徽卷)13.已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3- + H2O H2SO3 + OH- ①HSO3-H+ + SO32- ②向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大B.加入少量Na2SO3固体,则c(H+) + c(Na+)=c(HSO3-) + c(OH-) +12c(SO32-)C.加入少量NaOH溶液,233(SO)(HSO)cc--、(OH)(H)cc-+的值均增大D.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)【答案】C(2013山东卷)29.(15分)化学反应原理在科研和生产中有广泛应用(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g)△H>0 (I)反应(I)的平衡常数表达式K=。
若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“>”“<”或“=”)。
上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。
做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3HSO3-+H+的电离常数Ka =1×10-2mol/L ,则该温度下NaHSO3的水解平衡常数Kh= mol/L 。
若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3) c(HSO3—)将 (填“增大”“减小”或“不变”)。
答案:(1)c(TaI4) c(S2) c2(I2);66.7%(2)<;I2(3)淀粉;H2SO3+I2+H2O =4H++SO42-+2I- (4)1.0×10-12;增大 2012年高考化学试题1.(2012上海∙7)水中加入下列溶液对水的电离平衡不产生影响的是 A . NaHSO4溶液 B . KF 溶液 C . KAl(SO4)2溶液 D .NaI 溶液 答案:D2.(2012上海∙21)常温下a mol ·L -1 CH3COOH 稀溶液和bmol ·L -1KOH 稀溶液等体积混合,下列判断一定错误的是A .若c(OH -)>c(H +),a=bB .若c(K +)>c(CH3COO -),a>bC .若c(OH -)=c(H +),a>bD .若c(K +)<c(CH3COO -),a<b 答案:D3.(2012安徽∙12)氢氟酸是一种弱酸,可用来刻蚀玻璃。
