电荷守恒,物料守恒,质子守恒综述
化学电荷守恒物料守恒、质子守恒

对于溶液中微粒浓度(或数目)的比较,要遵循两条: 一是电荷守恒,即溶液中阳离子所带正电荷总数等于阴离子所带总数;二是物料守恒,即溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。
(物料守恒实际属于个数守恒和。
)★电荷守恒1. 化合物中元素正负代数和为零2.溶液呈电中性:所有阳离子所带正电荷总数等于阴离子所带负电荷总数3.除六大,四大外都,部分水解。
产物中有部分水解时产物4.这个离子所带的电荷数是多少,离子前写几。
例如:NaHCO 3:c(Na +)+c(H +)=c(OH -)+c(HCO 3-)+2c(CO 32-) ★物料守恒物料守恒可以理解为原子守恒的另一种说法,即“任一化学反应前后原子种类(指原子核中相等的原子,就是)和数量分别保持不变”。
⒈ 含特定元素的微粒(离子或分子)守恒⒉ 不同元素间形成的特定微粒比守恒⒊ 特定微粒的来源关系守恒【例1】在LNa3PO4溶液中:根据P 元素形成微粒总量守恒有:c[PO 43-]+c[HPO 42-]+c[H 2PO 4-]+c[H 3PO 4]=L根据Na 与P 形成微粒的关系有:c[Na +]=3c[PO 43-]+3c[HPO 42-]+3c[H 2PO 4-]+3c[H 3PO 4]根据H2O 电离出的H+与OH-守恒有:c[OH -]=c[HPO 42-]+2c[H 2PO 4-]+3c[H 3PO 4]+c[H +]【例2】以NaHCO 3溶液为例若HCO 3-没有和水解,则c (Na +)=c (HCO 3-)现在HCO 3-会水解成为H 2CO 3,电离为CO 32-(都是1:1反应,也就是消耗一个HCO 3-,就产生一个H 2CO 3或者CO 32-),那么守恒式中把Na +浓度和HCO 3-及其产物的浓度和画等号(或直接看作钠与碳的守恒): 即c(Na +) == c(HCO 3-) + c(CO 32-) + c(H 2CO 3)【例3】在L 的H 2S 溶液中存在如下过程:(均为)H 2S=(H +) +(HS -)(HS -)=(H +)+(S 2-)H 2O=(H +)+(OH -)可得物料守恒式c(S 2-)+c(HS -)+c(H 2S)==L, (在这里物料守恒就是S--描述出有S 元素的和分子即可)【例4】Na 2CO 3溶液的电荷守恒、物料守恒、质子守恒·电荷守恒c(Na+)+c(H+)=2c(CO 32-)+c(HCO 3-)+c(OH-)上式中,阴阳总要相等,由于1mol 电荷量是2mol 负电荷,所以碳酸根所带电荷量是其的2倍。
重点高中化学电荷守恒、物料守恒、质子守恒

重点高中化学电荷守恒、物料守恒、质子守恒电荷守恒定律
电荷守恒定律是有效描述电子流动和物质组成变化的有用理论之一。
它声明,在化学反应中,总电荷不会丢失,也就是电荷守恒。
电荷守恒定律强调,物质可以转换为其它物质,在一次化学反应中,质子数可以变大或变小,但总电荷量不会发生任何变化,即物质在原子与分子中的电荷保持守恒。
电荷守恒原理的作用特别是在多个反应的混合中非常有用。
物质守恒定律是一条基本的科学定律,它强调,任何化学反应的质量(物质的总量)总是不变的,并且在化学反应过程中无论什么物质在何种程度上发生反应,最终反应物的质量(物质的总量)必定等于反应前物质的质量;即物质在反应中保持守恒,也就是物质守恒定律。
因此,在化学反应中,细微的物质可以变换而不会改变整个反应体系的质量,也就是物质守恒定律所强调的道理。
质子守恒定律是一条基本的化学定律,它强调,除非物质发生核反应伴随的外,否则在任何化学反应中,物质中的质子数总是保持守恒的。
这就是所谓的质子数守恒定律,它让我们应用化学反应直接求得含有不同元素组成原子、分子数时,其中质子数量总是相同的。
由于在某种物质间的化学变化中只涉及原子中电子和质子的变化,由此可以得出质子守恒,也称为质子数守恒定律。
电荷守恒、物料守恒、质子守恒ppt课件

⒊特定微粒的来源关系守恒
nNa:nC=1:1,如果HCO3- 没有电离和水解, 那么Na+和HCO3- 浓度相等。
HCO3- +H2O⇋ H2CO3 +OH-; HCO3- ⇋ CO32- +H+; HCO3- 会水解成为H2CO3,电离为CO32-, 那么守恒式中
c(Na+) = c(HCO3-) + c(CO32-) + c(3溶液. 电荷守恒 物料守恒 质子守恒
3.NH4Cl溶液, 电荷守恒 物料守恒 质子守恒
2.NaHCO3 溶液 电荷守恒 物料守恒 质子守恒
4.Na3PO4溶液 电荷守恒 物料守恒 质子守恒
15
在碳酸钠水溶液中水电离出的氢离子以(H+,
HCO3-,H2CO3)三种形式存在,其中1mol碳酸 分子中有2mol水电离出的氢离子.所以
c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
11
例2 : NaHCO3溶液 方法一:可以由电荷守恒和物料守恒关系联立得到
NaHCO3 溶液中存在下列等式 C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-) {电荷守恒} C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3) {物料守恒}
H2S物料守恒式c(S2-)+c(HS-)+c(H2S)=0.1mol/L, 在这里物料守恒就是S元素守恒, 描述出有S
元素的离子和分子即可
9
4:在0.1mol/L Na3PO4溶液中:
根据P元素形成微粒总量守恒有:
c[PO43-]+c[HPO42-]+c[H2PO4-]+c [H3PO4]=0.1mol/L
电荷守恒、物料守恒、质子守恒知识
精心整理电荷守恒、物料守恒、质子守恒知识
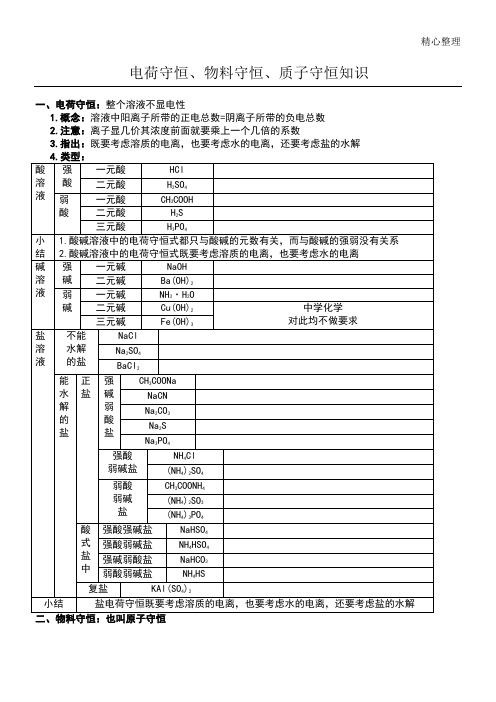
一、电荷守恒:整个溶液不显电性
1.概念:溶液中阳离子所带的正电总数=阴离子所带的负电总数
2.注意:离子显几价其浓度前面就要乘上一个几倍的系数
3.指出:既要考虑溶质的电离,也要考虑水的电离,还要考虑盐的水解
在电解质溶液中,某些离子能够发生水解或者电离,变成其它离子或分子等,这虽然可使离子的种类增多,但却不能使离子或分子中某种特定元素的原子的数目发生变化,因此应该始终遵循原子守恒。
1.某一种原子(团)的数目守恒:
若已知以下各电解质的浓度均为0.1mol/L
1.概念:。
电荷守恒物料守恒质子守恒

电荷守恒介绍电荷守恒和物料守恒,质子守恒一样同为溶液中的三大守恒关系。
1.化合物中元素正负化合价代数和为零2.指溶液必须保持电中性,即溶液中所有阳离子所带的电荷数等于所有阴离子所带的电荷数3.除六大强酸,四大强碱外都水解,多元弱酸部分水解。
产物中有部分水解时产物4.这个离子所带的电荷数是多少,离子前写几。
例如:NaHCO3: c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO3 2-)因为碳酸根为带两个单位的负电荷,所以碳酸根前有一个2。
例如:在 0.1mol/L 下列溶液中Ⅰ.CH3COONa:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)Ⅱ.Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32- )Ⅲ.NaHCO3:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)Ⅳ.Na3PO4:c(Na+)+c(H+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-)+c(OH-)物料守恒⒈含特定元素的微粒(离子或分子)守恒⒉不同元素间形成的特定微粒比守恒⒊特定微粒的来源关系守恒例1:在0.1mol/LNa3PO4溶液中:根据P元素形成微粒总量守恒有:c[PO43-]+c[HPO42-]+c[H2PO4-]+c[H3PO4]=0.1mol/L根据Na与P形成微粒的关系有:c[Na+]=3c[PO43-]+3c[HPO42-]+3c[H2PO4-]+3c[H3PO4]根据H2O电离出的H+与OH-守恒有:c[OH-]=c[HPO42-]+2c[H2PO4-]+3c[H3PO4]+c[H+]例2:NaHCO3 溶液中c(Na+)等于碳酸氢根离子的浓度,电离水解后,碳酸氢根以三种形式存在所以C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3) 这个式子叫物料守恒再例如,Na2CO3溶液中,c(Na+)等于碳酸根离子的浓度2倍,电离水解后,碳酸根以三种形式存在所以有 C(Na+)= 2【C(CO32-)+C(HCO3-)+C(H2CO3)】质子守恒也可以由电荷守恒和物料守恒关系联立得到例如:Na2CO3溶液①电荷守恒: C(Na+) +C(H+)===C(OH-) +2C(CO32-) +C(HCO3-) 正电荷=负电荷②物料守恒: C(Na+)= 2C(CO32-) +2C(HCO3-) +2C(H2CO3)①-②得质子守恒: C(OH-) =C(H+) +C(HCO3-) +2C(H2CO3) 水电离出的H+ =OH-NaHCO3 溶液中存在下列等式① c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)② c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3){物料守恒}方法一:两式相减①-②得c(H+)= c(OH-)-c(H2CO3)+c(CO32-)这个式子叫质子守恒。
电解质溶液中的三个守恒

电解质溶液中的三个守恒一、电荷守恒电解质溶液中不论存在多少种离子,溶液总是呈电中性的,就是说阳离子所带的正电荷总数一定等于阴离子所带负电荷的总数,这就是电荷守恒规律。
在应用这个定律时,要明确溶液呈电中性和溶液呈中性是两个不同的概念,因为只有当c(H+)=c(OH-)时,溶液才呈中性(相对于酸碱性)。
例如:NaHCO3溶液中存在着:c(Na+)+c(H+)= c(HCO3-)+c(OH-)+2c(CO32—)解析:溶液中存在有以下电离:NaHCO 3=Na++ HCO3-、HCO3- H++ CO32—、H 2O H++ OH-和水解:HCO3-+H2O H2CO3 +OH-,所以溶液中存在Na+、H+、HCO3--、CO32—、OH-这些离子,阳离子所带正电荷总数为:c(Na+) +c(H+),由于CO32—带两个单位负电荷,故阴离子所带电荷总数为 c(HCO3-) +c(OH-)+ 2c(CO32—)。
根据电荷守恒,必然有如下关系:c(Na+)+c(H+) =c(HCO3-)+c(OH-)+2c(CO32—)例题1.某地的雨水呈酸性,取其少量进行检测,其中含各离子的物质的量浓度分别为:c (Na+)=5.0×10-5mol·L-1,c(Cl-)=7.1×10-5mol·L-1, c(SO42-)=4.5×10-6mol·L -1,c (NH4+)=1.0×10-6mol·L-1,则雨水pH约是多少?判断正误:c(Na+)+c (NH4+)+ c (H+)=c (OH-)+c(Cl-)+c (SO42-)解析:该题可采用电荷守恒法:c (Na+) + c (NH4+)+ c (H+)= c (OH-)+ c(Cl-) +2c (SO42-),由于溶液显酸性,c (OH-)水很小,即由水电离出来氢氧根离子可以略去不计。
溶液中的三大守恒
溶液中的三大守恒关系(一)溶液中的守恒关系1、电荷守恒规律:电解质溶液中,电解质总是呈电中性,即阴离子所带负电荷总数=阳离子所带正电荷总数如NaHCO3 溶液中存在着Na+、HCO3- 、H+、CO32-、OH-存在如下关系c(H+)+c (Na+)=c(HCO3-)+2c(CO32-)+c(OH-) 这个式子叫电荷守恒2、物料守恒规律:某元素的原始浓度等于它在溶液中各种存在形式的浓度之和如Na2S溶液中,S2-能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:1/2c(Na+)=c(S2-)+ c(HS-)+c(H2S) 这个式子叫物料守恒如Na2CO3溶液中,CO32-离子存在形式有HCO3-、CO32-、H2CO3则1/2c(Na+)=c(HCO3-)+ c(HS-)+c(H2S)3、质子守恒:由水电离产生的H+、OH-浓度相等如Na2CO3溶液中,由水电离产生的OH-以游离态存在,而H+因CO32-水解有三种存在形式H+、HCO3-、H2CO3,则有c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)同理在Na3PO4溶液中有:c (OH-)=c(H+)+ c(HPO42-)+2c(H2PO4-)+3c(H3PO4)练习:写出下列溶液中三大守恒关系①Na2S溶液电荷守恒:c(Na+)+c(H+)=2c(S2-)+ c(HS-)+c(OH-)物料守恒:1/2c(Na+)=c(S2-)+ c(HS-)+c(H2S)质子守恒:c (OH-)=c(H+)+ c(HS-)+2c(H2S)②NaHCO3溶液电荷守恒:c(H+)+c (Na+)=c(HCO3-)+2c(CO32-)+c(OH-)物料守恒:c (Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)质子守恒:c (OH-)=c(H+)+ c(H2CO3)-c(CO32-)----电荷守恒-物料守恒=质子守恒溶液中离子浓度大小比较一、单一溶质1、多元弱酸溶液,根据多步电离规律,前一步电离产生的离子浓度大于后一步电离产生的离子,如在H3PO4溶液中,c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)2、多元弱酸的正盐,根据弱酸根的多步水解规律,前一步水解远远大于后一步水解,如在Na2CO3溶液中(Na+)>c(CO32-)>c(OH-)>c(HCO3-)+ c(H2CO3)3、不同溶液中,同一离子浓度大小的比较,要看其它离子对其影响因素练习:1、写出下列溶液中离子浓度大小的关系NH4CL溶液中:c(CL-) >c(NH4+) >c(H+) >c(OH-)CH3COONa溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)2、物质的量浓度相同的下列各溶液,①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3⑤NH4HCO3 ,c(CO32-)由小到大排列顺序为二、混合溶液混合溶液中各离子浓度的比较,要进行综合分析,如离子间的反应、电离因素、水解因素等。
化学电荷守恒物料守恒质子守恒
化学电荷守恒物料守恒质子守恒TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】对于溶液中微粒浓度(或数目)的比较,要遵循两条:一是电荷守恒,即溶液中阳离子所带正电荷总数等于阴离子所带总数;二是物料守恒,即溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。
(物料守恒实际属于个数守恒和。
)★电荷守恒1. 化合物中元素正负代数和为零2.溶液呈电中性:所有阳离子所带正电荷总数等于阴离子所带负电荷总数3.除六大,四大外都,部分水解。
产物中有部分水解时产物4.这个离子所带的电荷数是多少,离子前写几。
例如:NaHCO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)★物料守恒物料守恒可以理解为原子守恒的另一种说法,即“任一化学反应前后原子种类(指原子核中相等的原子,就是)和数量分别保持不变”。
⒈含特定元素的微粒(离子或分子)守恒⒉不同元素间形成的特定微粒比守恒⒊特定微粒的来源关系守恒【例1】在LNa3PO4溶液中:根据P元素形成微粒总量守恒有:c[PO43-]+c[HPO42-]+c[H2PO4-]+c[H3PO4]=L根据Na与P形成微粒的关系有:c[Na+]=3c[PO43-]+3c[HPO42-]+3c[H2PO4-]+3c[H3PO4]根据H2O电离出的H+与OH-守恒有:c[OH-]=c[HPO42-]+2c[H2PO4-]+3c[H3PO4]+c[H+] 【例2】以NaHCO3溶液为例若HCO3-没有和水解,则c(Na+)=c(HCO3-)现在HCO3-会水解成为H2CO3,电离为CO32-(都是1:1反应,也就是消耗一个HCO3-,就产生一个H2CO3或者CO32-),那么守恒式中把Na+浓度和HCO3-及其产物的浓度和画等号(或直接看作钠与碳的守恒):即c(Na+) == c(HCO3-) + c(CO32-) + c(H2CO3)【例3】在L的H2S溶液中存在如下过程:(均为)H2S=(H+) +(HS-)(HS-)=(H+)+(S2-)H2O=(H+)+(OH-)可得物料守恒式c(S2-)+c(HS-)+c(H2S)==L, (在这里物料守恒就是S--描述出有S元素的和分子即可)【例4】Na2CO3溶液的电荷守恒、物料守恒、质子守恒·电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)上式中,阴阳总要相等,由于1mol电荷量是2mol负电荷,所以碳酸根所带电荷量是其的2倍。
三大守恒
电荷守恒和物料守恒1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)3.导出式——质子守恒:如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消掉可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
如醋酸钠溶液中由电荷守恒和物料守恒将钠离子消掉可:c(OH-)=c(H+)+c(CH3COOH)。
[规律总结]正确的思路:一、溶质单一型※※关注三个守恒1.弱酸溶液:【例1】在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L分析:由于H2S溶液中存在下列平衡:H2S H++HS-,HS-H++S2-,H2O H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。
(注意:解答这类题目主要抓住弱酸的电离平衡。
)2.弱碱溶液:【例2】室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是()A. c(OH-)>c(H+)B.c(NH3·H2O)+c(NH4+)=0.1mol/LC.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)D.c(OH-)=c(NH4+)+c(H+)分析:由于氨水溶液中存在一水合氨的电离平衡和水的电离平衡,所以所得溶液呈碱性,根据电荷守恒和物料守恒知BD正确,而一水合氨的电离是微量的,所以C项错误,即答案为C项。
电荷守恒、物料守恒、质子守恒ppt课件
个式子叫物料守恒
8
练习
1.Na2CO3溶液
c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
2.NH4Cl溶液
c[NH4+]+ c[NH3.H2O]= c[ Cl-]
3.在0.1mol/L的H2S溶液中存在如下电离过程:
H2S ⇋ H+ +HS- HS- ⇋ H++S2- H2O ⇋ H++OH-
H2S物料守恒式c(S2-)+c(HS-)+c(H2S)=0.1mol/L, 在这里物料守恒就是S元素守恒, 描述出有S
元素的离子和分子即可
9
4:在0.1mol/L Na3PO4溶液中:
根据P元素形成微粒总量守恒有:
c[PO43-]+c[HPO42-]+c[H2PO4-]+c [H3PO4]=0.1mol/L
电荷守恒、物料守恒、质子守恒
盐类水解第三课时
1
教学目标
• 1. 掌握电荷守恒,物料守恒,质子守恒同 为溶液中的三大守恒关系。
• 2. 学会用这三个守恒判断溶液中粒子 浓度的大小,或它们之间的关系等式。
2
一、电荷守恒
是指溶液中所有阳离子所带的正 电荷总数与所有阴离子所带的负 电荷总数相等。即溶液永远是电 中性的,所以阳离子带的正电荷 总量=阴离子带的负电荷总量
12
练习
NaH2PO4溶液
原始物种:H2PO4-,H2O 消耗质子产物:H3PO4 产生质子产物:HPO42-(产生一个质子),
PO43-(产生二个质子),OHc(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电荷守恒、物料守恒、质子守恒综述电荷守恒,物料守恒,质子守恒同为溶液中的三大守恒关系。
这三个守恒的最大应用是判断溶液中粒子浓度的大小,或它们之间的关系等式。
电荷守恒:是指溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等。
即溶液永远是电中性的,所以阳离子带的正电荷总量=阴离子带的负电荷总量1.溶液必须保持电中性,即溶液中所有阳离子所带的电荷数等于所有阴离子所带的的电荷数2.除六大强酸,四大强碱外都水解,多元弱酸部分水解。
产物中有分步水解产物。
3.这个离子所带的电荷数是多少,离子前就写几。
例如:Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO3 2-)因为碳酸根为带两个单位负电荷,所以碳酸根前有一个2。
在下列物质的溶液中CH3COONa:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)NaHCO3:c(Na+)+c(H+)=c(HCO3-)+2(CO32-)+c(OH-)Na3PO4:c(Na+)+c(H+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-)+c(OH-) 电荷守恒定律:物理学的基本定律之一。
它指出,对于一个孤立系统,不论发生什么变化,其中所有电荷的代数和永远保持不变。
电荷守恒定律表明,如果某一区域中的电荷增加或减少了,那么必定有等量的电荷进入或离开该区域;如果在一个物理过程中产生或消失了某种符号的电荷,那么必定有等量的异号电荷同时产生或消失。
注意:1.正确分析溶液中存在的阴、阳离子是书写电荷守恒式的关键,需要结合电解质电离及盐类的水解知识,尤其是对多级电离或多级水解,不能有所遗漏。
如Na2CO3溶液中存在如下电离和水解平衡:Na2CO3 2 Na+ +CO32-;CO32-+ H2O HCO3-+OH-;HCO3- +H2O H2CO3 +OH-;H2O H++OH-。
所以溶液中阳离子有:Na+、H+,阴离子有:CO32-、HCO3-、OH-。
2.结合阴阳离子的数目及其所带的电荷可以写出:N(Na+) +N(H+) = 2N(CO32-) + N( HCO3-) + N(OH-)3.将上式两边同时除以NA得:n(Na+)+n(H+)=2n(CO32-)+ n(HCO3-) + n(OH-);再同时除以溶液体积V得:C(Na+) +C(H+) = 2C(CO32-) + C( HCO3-) + C(OH-),这就是Na2CO3溶液的电荷守恒式。
电荷守恒式即溶液中所有阳离子的物质的量浓度与其所带电荷乘积之和等于所有阴离子的物质的量浓度与其所带电荷的绝对值乘积之和。
写等式注意2点:1、要判断准确溶液中存在的所有离子,不能漏掉。
2、注意离子自身带的电荷数目。
如:Na2CO3溶液:C(Na+)+ C(H+)= 2 C(CO32-)+ C(HCO3-)+ C(OH-)NaHCO3溶液:C(Na+)+ C(H+)= 2 C(CO32-)+ C(HCO3-)+ C(OH-)Na3PO4溶液:C(Na+)+ C(H+)= 3 C(PO43-)+ 2 C(HPO42-)+ C(H2PO4-)+ C(OH-)NH4Cl溶液:C(NH4+)+ C(H+)=C( Cl-)+ C(OH-)NaOH溶液:C(Na+)+C( H+)= C(OH-)物料守恒:溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和。
也就是元素守恒,即变化前后某种元素的原子个数守恒。
物料守恒实际属于原子个数守恒和质量守恒。
即加入的溶质组成中存在的某些元素之间的特定比例关系,由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
物料守恒可以理解为原子守恒的另一种说法。
“任一化学反应前后原子种类和数量分别保持不变”,可以微观地应用到具体反应方程式,就是左边带电代数和等于右边。
也就是左边(反应物)元素原子(核)个数种类与总数对应相等于右边(生成物)。
⒈含特定元素的微粒(离子或分子)守恒⒉不同元素间形成的特定微粒比守恒⒊特定微粒的来源关系守恒例1 :NaHCO3溶液n Na:nC=1:1,如果HCO3- 没有电离和水解,那么Na+和HCO3- 浓度相等。
HCO3- 会水解成为H2CO3,电离为CO32-(都是1:1反应,也就是消耗一个HCO3-,就产生一个H2CO3或者CO32-),那么守恒式中把Na+浓度和HCO3- 及其产物的浓度和画等号(或直接看作钠与碳的守恒):即c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3) 这个式子叫物料守恒例2 :Na2CO3溶液电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)上式中,阴阳离子总电荷量要相等,由于1mol碳酸根电荷量是2mol负电荷,所以碳酸根所带电荷量是其物质的量的2倍。
物料守恒n Na:nC=2:1,c(Na+)是碳酸根离子物质的量的2倍,电离.水解后,碳酸根以三种形式存在,所以:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] 例3:在0.1mol/L的H2S溶液中存在如下电离过程:H2S H+ +HS-HS-H++S2-H2O H++OH-H2S物料守恒式c(S2-)+c(HS-)+c(H2S)=0.1mol/L,在这里物料守恒就是S元素守恒, 描述出有S元素的离子和分子即可例4:在0.1mol/L Na3PO4溶液中:根据P元素形成微粒总量守恒有:c[PO43-]+c[HPO42-]+c[H2PO4-]+c[H3PO4]=0.1mol/L根据Na与P形成微粒的关系有:c[Na+]=3c[PO43-]+3c[HPO42-]+3c[H2PO4-]+3c[H3PO4]根据H2O电离出的H+与OH- 守恒有:c[OH-]=c[HPO42-]+2c[H2PO4-]+3c[H3PO4]+c[H+]例5:NH4Cl溶液,化学式中nN:nCl=1:1,得到c[NH4+]+ c[NH3.H2O ]= c[ Cl-]写等式要注意,把所有含这种元素的粒子都要考虑在内,可以是离子,也可以是分子。
质子守恒:质子守恒就是酸失去的质子和碱得到的质子数目相同。
例1 :Na2CO3溶液水电离出的c(H+)=c(OH-). 在碳酸钠水溶液中水电离出的氢离子以(H+,HCO3-,H2CO3)三种形式存在,其中1mol碳酸分子中有2mol水电离出的氢离子.所以c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)例2 :NaHCO3溶液方法一:可以由电荷守恒和物料守恒关系联立得到NaHCO3溶液中存在下列等式C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-) {电荷守恒}C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3) {物料守恒}两式相减得C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 这个式子叫质子守恒。
方法二:由酸碱质子理论例1 :NaHCO3溶液原始物种:HCO3-,H2O消耗质子产物H2CO3,产生质子产物CO32-,OH-C(H+)=C(CO32-)+C(OH-) -C(H2CO3)即C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 关系:剩余的质子数目等于产生质子的产物数目-消耗质子的产物数目直接用酸碱质子理论求质子平衡关系比较简单,但要细心;如果用电荷守恒和物料守恒关系联立得到则比较麻烦,但比较保险例2 :NaH2PO4溶液原始物种:H2PO4-,H2O消耗质子产物:H3PO4,产生质子产物:HPO42-(产生一个质子),PO43-(产生二个质子),OH-所以:c(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4)快速书写质子守恒的方法:第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
具体方法是,判断溶液能直接电离出的离子是什么。
然后选择能电离产生氢离子或者水解结合氢离子的离子为基准,用它和它电离或者水解之后的离子(这里称为对比离子)做比较,是多氢还是少氢,多N个氢,就减去N倍的该离子(对比离子)浓度。
少N个氢离子,就减去N倍的该离子(对比离子)。
如碳酸氢钠溶液(NaHCO3):溶液显碱性,所以把氢氧根离子浓度写在左边,其次。
判断出该溶液直接电离出的离子是钠离子和碳酸氢根,而能结合氢离子或电离氢离子的是碳酸氢根。
其次以碳酸氢根为基准离子(因为碳酸氢钠直接电离产生碳酸根和钠离子,而钠离子不电离也不水解。
)减去它电离之后的离子浓度,加上它水解生成的离子浓度。
便是:C(OH-)=C(H2CO3)-C(CO32-)+C(H+)例1:NH4Cl溶液,电荷守恒,NH4+ + H+ = Cl- + OH-物料守恒,C(NH4+)+ C(NH3.H2O) = C(Cl-)质子守恒,处理一下,约去无关的Cl-,得到,C(H+)= C(OH- )+ C(NH3.H2O),分析, 水电离H+ = OH-,但是部分OH-被NH4+结合成NH3.H2O,而且是1:1结合,而H+不变,所以得到,H+ = 原来的总OH- = 剩余OH- + NH3.H2O例2:Na2CO3溶液,电荷守恒,Na+ + H+ = 2CO32- + HCO3- + OH-物料守恒,Na+ = 2(CO32- + HCO3- + H2CO3) 质子守恒,处理一下,约去无关的Na+,得到,HCO3- + 2H2CO3 + H+ = OH-,分析,水电离H+ = OH-,但是部分H+被CO32-结合成HCO3-,而且是1:1结合,还有部分继续被HCO3-结合成H2CO3,相当于被CO32-以1:2结合,而OH-不变,所以得到,OH- = 原来总H+ = HCO3- + 2H2CO3 + 剩余H+若能清楚三个守恒,解题会更快,若质子守恒不能熟悉,只要掌握前两个也足够了。
归纳:1. Na2CO3溶液.电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)物料守恒,c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]质子守恒,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)2.NaHCO3溶液电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2(CO32-)+c(OH-)物料守恒,c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)质子守恒,C(H+)=C(CO32-)+C(OH-) -C(H2CO3)即C(H+)+C(H2CO3)=C(CO32-)+C(OH-)3.NH4Cl溶液,电荷守恒,C(NH4+)+ C(H+)=C( Cl-)+ C(OH-)物料守恒,C(NH4+)+ C(NH3.H2O) = C(Cl-)质子守恒,C(H+)= C(OH- )+ C(NH3.H2O)4.Na3PO4溶液电荷守恒:c(Na+)+c(H+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-)+c(OH-)物料守恒,c[Na+]=3c[PO43-]+3c[HPO42-]+3c[H2PO4-]+3c[H3PO4]在0.1mol/L Na3PO4溶液中,根据P元素形成微粒总量守恒有:c[PO43-]+c[HPO42-]+c[H2PO4-]+c[H3PO4]=0.1mol/L质子守恒,c[OH-]=c[HPO42-]+2c[H2PO4-]+3c[H3PO4]+c[H+]5.Na2S溶液电荷守恒,c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)物料守恒,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]质子守恒,c(OH-)=c(H+)+c(HS-)+2c(H2S)6.电荷守恒,NaOH溶液,C(Na+)+C( H+)= C(OH-)CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)物料守恒,H2S物料守恒式:c(S2-)+c(HS-)+c(H2S)=0.1mol/L,质子守恒,NaH2PO4溶液:c(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4)。
