大肠杆菌
大肠杆菌培养

大肠杆菌培养引言大肠杆菌(Escherichia coli)是一种广泛存在于自然界中的革兰氏阴性细菌。
它是一种常见的微生物实验室模型生物,在分子生物学研究、基因工程、生物技术等领域发挥着重要作用。
本文将介绍大肠杆菌的培养方法,包括培养基的配制、接种方法、培养条件的控制等。
培养基配制大肠杆菌培养基的配制是培养大肠杆菌的重要前提,不同的菌株和研究目的需要使用不同的培养基。
下面介绍两种常用的培养基配方:Luria-Bertani(LB)培养基LB培养基是最常用的大肠杆菌培养基之一,它是一种富含营养物质的培养基,适用于一般的大肠杆菌培养。
配方:•水:800 ml•Bacto-tryptone:10 g•Yeast extract:5 g•NaCl:10 g•琼脂:15 g将上述成分加入水中,搅拌均匀,然后加热至溶解,最后将pH调节至7.0 ± 0.2。
M9盐基培养基M9盐基培养基是一种缺乏有机碳源和氮源的无营养培养基,适用于研究大肠杆菌的生理特性或用于表达外源蛋白。
配方:•水:700 ml•Na2HPO4:12.8 g•KH2PO4:3 g•NH4Cl:1 g•NaCl:0.5 g•CaCl2:0.1 g•MgSO4:0.2 g•葡萄糖:2 g•琼脂:15 g将上述成分加入水中,搅拌均匀,然后加热至溶解,最后将pH调节至7.0 ± 0.2。
接种方法大肠杆菌的接种方法有多种,常见的有无菌接种环和无菌注射器接种法。
下面分别介绍这两种接种方法:无菌接种环接种法步骤:1.用火焰将无菌接种环烧红,冷却至适宜温度。
2.打开培养基瓶盖,用无菌接种环蘸取待接种的大肠杆菌菌株。
3.快速将无菌接种环插入含有培养基的琼脂平板(或试管)中,并迅速转动接种环1-2圈,使菌体均匀分布在琼脂平板(或液体培养基)表面。
4.关闭琼脂平板(或试管)盖子,使琼脂凝固后,将琼脂平板(或试管)置于适宜的培养条件下。
无菌注射器接种法步骤:1.用火焰将无菌注射器的针头烧红,冷却至适宜温度。
大肠杆菌培养基

大肠杆菌培养基大肠杆菌(Escherichia coli)是一种革兰氏阴性杆菌,是一种常见的肠道细菌,也是一种重要的实验室模式生物。
大肠杆菌培养基是一种用于培养和繁殖大肠杆菌的营养培养基,它提供了大肠杆菌所需的营养物质和生长条件,使其能够在实验室中进行研究和应用。
大肠杆菌培养基的组成。
大肠杆菌培养基的组成通常包括以下成分:1. 碳源,大肠杆菌需要碳源来进行能量代谢和生长。
常见的碳源包括葡萄糖、蔗糖、乳糖等。
2. 氮源,氮源是大肠杆菌合成蛋白质和核酸的重要原料。
常见的氮源包括氨基酸、氨基酸盐、蛋白胨等。
3. 矿物盐,矿物盐是细胞生长和代谢所必需的微量元素,如钙、镁、钾、磷等。
4. 生长因子,大肠杆菌培养基中通常还添加了一些生长因子,如维生素、核酸、辅酶等,以促进大肠杆菌的生长和繁殖。
5. pH调节剂,培养基的pH值对大肠杆菌的生长有重要影响,通常需要添加pH调节剂来保持培养基的适宜pH范围。
根据不同的研究目的和实验条件,大肠杆菌培养基的配方会有所不同,可以根据实际需要进行调整和优化。
大肠杆菌培养基的制备方法。
大肠杆菌培养基的制备方法相对简单,一般包括以下步骤:1. 称取适量的葡萄糖、蛋白胨、氯化钠等成分,加入适量的蒸馏水中,搅拌均匀。
2. 调节pH值至适宜范围,通常大肠杆菌培养基的pH范围为7.0-7.4。
3. 加热蒸馏水,使培养基成分充分溶解。
4. 经过高温高压灭菌,使培养基无菌。
5. 分装培养基到适量的培养皿或试管中,待凝固后即可使用。
根据实验需求,可以添加抗生素、染色剂等成分,以实现对大肠杆菌的选择性培养。
大肠杆菌培养基的应用。
大肠杆菌培养基在科研和实验室应用中具有广泛的用途,主要包括以下几个方面:1. 细菌学研究,大肠杆菌培养基常用于大肠杆菌的分离、鉴定和培养,用于研究其生长特性、代谢途径、致病机制等。
2. 分子生物学实验,大肠杆菌是常用的重组DNA宿主细胞,大肠杆菌培养基可用于大肠杆菌的转化、表达、筛选等实验。
大肠杆菌的作用

大肠杆菌的作用
大肠杆菌(Escherichia coli)是一种常见的肠道菌,它在人和
动物的胃肠道内广泛存在。
尽管大肠杆菌在一些情况下会引起疾病,但它在自然界中也扮演着一些重要的角色。
1.帮助消化:大肠杆菌参与人体对复杂碳水化合物的消化和吸收。
它可以分解蔬菜、纤维素和其他植物成分,产生有益人体的脂肪酸。
2.合成维生素:大肠杆菌合成人体所需的维生素K和维生素
B12。
这些维生素对于血液的凝固和细胞新陈代谢至关重要。
3.竞争性抑制其他病原菌:大肠杆菌在肠道内形成一种竞争优势,通过占据位置和营养资源,抑制其他致病菌的生长和繁殖。
4.促进免疫系统发育:大肠杆菌可以促进免疫系统的成熟和正
常功能。
它产生的抗菌物质可以抵抗其他病原菌的侵袭,并激活机体的免疫反应。
5.参与肠道生态平衡:大肠杆菌与其他肠道细菌共同维持着肠
道的生态平衡。
它们通过相互作用和能量交换,保持肠道健康和稳定。
总的来说,大肠杆菌在人体内发挥着多种重要的作用,包括帮助消化、合成维生素、竞争性抑制其他病原菌、促进免疫系统发育以及参与肠道生态平衡。
大肠杆菌科普文章

大肠杆菌科普文章大肠杆菌是一种常见的细菌,属于革兰氏阴性菌,是一种杆状细菌。
大肠杆菌的学名为Escherichia coli,简称E. coli。
它广泛存在于自然界中,同时也是人和动物的肠道中的正常菌群之一。
大肠杆菌的形态特征是革兰氏阴性杆菌,每个细胞直径约为2微米,长度约为6微米。
大肠杆菌的细胞壁主要由外膜、中间层和内膜组成。
外膜主要由脂多糖构成,可以提供细菌对抗宿主的免疫攻击能力。
中间层是一层薄而柔软的层,内膜则是由蛋白质和磷脂构成的。
大肠杆菌是一种好氧菌,也可在缺氧条件下生长。
它能够利用葡萄糖等多种碳源进行代谢。
大肠杆菌的代谢产物主要有二氧化碳、水和能量。
大肠杆菌在人和动物的肠道中起着重要的生理功能。
它能够帮助消化食物,分解蛋白质、碳水化合物和脂肪,产生一些对人体有益的物质,如维生素K和维生素B12。
同时,大肠杆菌还能够抑制一些有害菌的生长,维持肠道的微生态平衡。
然而,某些大肠杆菌菌株也可以引起人体的疾病。
例如,致病性大肠杆菌可以引起食物中毒,导致腹泻、呕吐和腹痛等症状。
此外,大肠杆菌还可以引起尿路感染、肺炎和败血症等严重感染。
大肠杆菌的传播途径多样,主要通过食物和水传播。
食用受污染的食物或饮用受污染的水可能会导致感染。
此外,人与人之间的接触也可能传播大肠杆菌。
为了预防大肠杆菌感染,我们需要采取一些措施。
首先,要注意食品安全,尽量避免食用生的或未煮熟的食物。
其次,要保持个人卫生,勤洗手,避免接触污染物。
此外,还应该注意饮水卫生,尽量饮用煮沸过的水。
总结起来,大肠杆菌是一种常见的细菌,广泛存在于自然界和人和动物的肠道中。
它在人体中起着重要的生理功能,帮助消化食物和维持肠道微生态平衡。
然而,某些大肠杆菌菌株也可以引起人体的疾病。
为了预防感染,我们应该注意食品安全和个人卫生,并饮用煮沸过的水。
大肠杆菌

检测方法
食品中的大肠杆菌进行快速准确的检测已成为了人们经常**的问题。下面阐述食品中的大肠杆菌检测的方法 及分析 。
这种方法主要是在44.5℃下的培养基上进行大肠杆菌的培养,该培养基含有荧光底物,需要培养24h。然后 对荧光底物进行释放,需要采用葡萄糖醛酸进行,让培养基能够在紫外光的照射下发出荧光。采用这样的方式方 法,还可以进行统计学估计原来样品中的菌落。主要步骤包括发酵、分离培养、二次发酵、显微镜观察等 。
目前国际公认的分类,主要有六个种类的大肠杆菌,即能够致使胃肠道感染的肠道致病性的大肠杆菌 (EPEC)、肠道产毒素性的大肠杆菌(ETEC)、肠道侵袭性的大肠杆菌(EIEC)、肠道出血性的大肠杆菌 (EHEC)、肠集聚性的大肠杆菌(EAEC)以及近年来发现的肠产志贺样毒素同时具有一定侵袭力的大肠杆菌 (ESIES),另外,还有能够致使尿道感染的尿道致病性的大肠杆菌(UPEC),以及最新命名的肠道集聚性的黏 附大肠杆菌(EAggEC) 。
用无菌吸管吸取稀释度样品1mL,该样品与乳糖胆盐发酵类似,然后将其放入无菌培养皿中,再加入温度于 45℃下的CDLJJD显色培养基中10mL的量,并进行培养皿中溶液均匀混合,可以通过快速转动培养皿的方式,等溶 液凝固以后,加入5mL左右 ,然后快速摇晃培养基,使其可以均匀覆盖平板表面,等其凝固以后,翻转培养基, 在温度37℃中培养24h左右,然后观察其形态,颜色等变化。
大肠杆菌

大肠杆菌(Escherichia coil)是我们了解得最清楚的原核生物,它为分子生物学的发展做出了巨大的贡献。
本文简要介绍大肠杆菌的细胞壁、细胞膜、细胞核、质粒、核糖体、鞭毛等结构与功能以及大肠杆菌的产能方式和生化反应。
大肠杆菌(Escherichia coli)在自然界分布很广,是人和动物肠道中的正常菌群。
正常情况下一般不致病,但它是条件致病菌。
大肠杆菌是单细胞原核生物,具有原核生物的主要特征:细胞核为拟核,无核膜,细胞质中缺乏象高等动植物细胞中的线粒体、叶绿体等具膜结构的细胞器,核糖体为70S,以二分分裂繁殖。
大肠杆菌为革兰氏阴性、两端钝圆的短杆菌。
其大小为:0.5~0.8μm×1.0~3.0μm。
周身鞭毛,能运动,具致育因子的菌株还具性菌毛。
1.形态结构1.1 细胞壁位于大肠杆菌的最外层,厚约11um,分为两层,即外膜和肽聚糖层。
外膜是大肠杆菌细胞壁的主要成分,占细胞壁于重的80%,厚约8nm,位于肽聚糖层的外侧,主要由磷脂、蛋白质和脂多糖组成。
脂多糖是革兰氏阴性细菌的内毒素,也是革兰氏阴性细菌细胞壁的特有成分,主要和其抗原性、致病性及对噬菌体的敏感性有关。
肽聚糖层由1~2层网状的肽聚糖组成,占细胞壁干重的10%,厚约2~3nm,是细菌等原核生物所特有的成分。
大肠杆菌的肽聚糖由聚糖链、短肽和肽桥三部分组成。
聚糖链由N-乙酸葡糖胺和N-乙酚胞壁酸分子通过β-1,4糖苷键连接而成,短肽由L-丙氨酸→D-谷氨酸→内消旋二氨基庚二酸→D-丙氨酸组成,并由L-丙氨酸与胞壁酸相连。
一条聚糖链短肽的D-丙氨酸与另一条聚糖链短肽的内消旋二氨基庚二酸直接形成肽键(肽桥),从而使肽聚糖形成网状的整体结构。
由脂蛋白将外膜和肽聚糖层连接起来,从而使大肠杆菌的细胞壁形成一个整体结构。
1.2 细胞膜大肠杆菌细胞膜的结构和其它生物细胞膜的结构相似。
但其细胞膜中蛋白质的含量高且种类多。
其细胞膜具选择透性,从而可控制营养物质进出细胞。
大肠杆菌
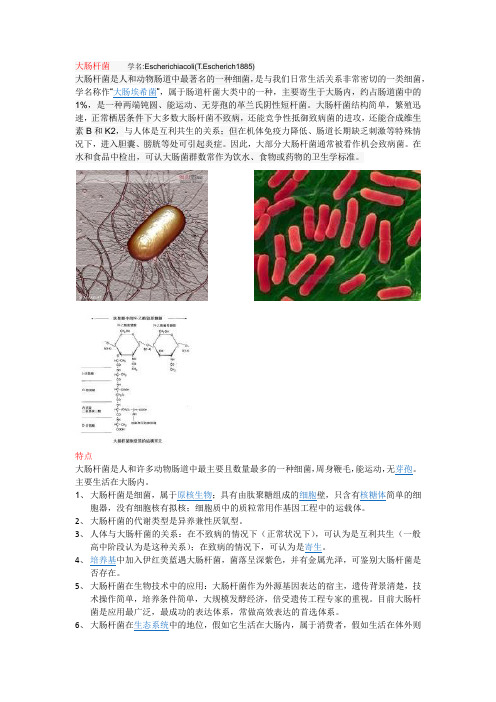
大肠杆菌学名:Escherichiacoli(T.Escherich1885)大肠杆菌是人和动物肠道中最著名的一种细菌,是与我们日常生活关系非常密切的一类细菌,学名称作“大肠埃希菌”,属于肠道杆菌大类中的一种,主要寄生于大肠内,约占肠道菌中的1%,是一种两端钝圆、能运动、无芽孢的革兰氏阴性短杆菌。
大肠杆菌结构简单,繁殖迅速,正常栖居条件下大多数大肠杆菌不致病,还能竞争性抵御致病菌的进攻,还能合成维生素B和K2,与人体是互利共生的关系;但在机体免疫力降低、肠道长期缺乏刺激等特殊情况下,进入胆囊、膀胱等处可引起炎症。
因此,大部分大肠杆菌通常被看作机会致病菌。
在水和食品中检出,可认大肠菌群数常作为饮水、食物或药物的卫生学标准。
特点大肠杆菌是人和许多动物肠道中最主要且数量最多的一种细菌,周身鞭毛,能运动,无芽孢。
主要生活在大肠内。
1、大肠杆菌是细菌,属于原核生物;具有由肽聚糖组成的细胞壁,只含有核糖体简单的细胞器,没有细胞核有拟核;细胞质中的质粒常用作基因工程中的运载体。
2、大肠杆菌的代谢类型是异养兼性厌氧型。
3、人体与大肠杆菌的关系:在不致病的情况下(正常状况下),可认为是互利共生(一般高中阶段认为是这种关系);在致病的情况下,可认为是寄生。
4、培养基中加入伊红美蓝遇大肠杆菌,菌落呈深紫色,并有金属光泽,可鉴别大肠杆菌是否存在。
5、大肠杆菌在生物技术中的应用:大肠杆菌作为外源基因表达的宿主,遗传背景清楚,技术操作简单,培养条件简单,大规模发酵经济,倍受遗传工程专家的重视。
目前大肠杆菌是应用最广泛,最成功的表达体系,常做高效表达的首选体系。
6、大肠杆菌在生态系统中的地位,假如它生活在大肠内,属于消费者,假如生活在体外则属于分解者。
7、它的基因组DNA为拟核中的一个环状分子。
同时可以有多个环状质粒DNA。
8、大肠杆菌细胞的拟核有1个DNA分子,长度约为4 700 000个碱基对,在DNA分子上分布着大约4 400个基因,每个基因的平均长度约为1 000个碱基对。
大肠杆菌标准

大肠杆菌标准大肠杆菌(Escherichia coli)是一种革兰氏阴性杆菌,是人和动物肠道内的正常菌群之一。
它在自然界中广泛分布,同时也是一种重要的微生物资源。
大肠杆菌在食品安全和环境卫生中起着重要作用,因此对其进行标准化管理至关重要。
首先,大肠杆菌的检测标准是食品安全的重要环节。
食品中的大肠杆菌检测是保障食品安全的重要手段之一。
根据相关标准,食品中大肠杆菌的检测方法主要包括培养法和分子生物学方法。
培养法是将食品样品在特定的培养基上进行培养,然后根据形态、生理特性进行鉴定。
而分子生物学方法则是通过PCR、实时荧光定量PCR等技术进行检测,具有快速、准确的特点。
食品中大肠杆菌的检测标准对于保障食品安全、预防食源性疾病具有重要意义。
其次,大肠杆菌在环境卫生中的标准管理也是至关重要的。
大肠杆菌是一种常见的致病菌,其在环境中的存在往往意味着污染和卫生问题。
因此,对于水质、土壤、空气等环境中大肠杆菌的监测和管理至关重要。
相关的环境标准和监测方法能够有效地评估环境卫生状况,预防疾病的传播和环境污染的发生。
此外,大肠杆菌在医药领域中的标准化管理也是非常重要的。
大肠杆菌在医药领域中既是一种重要的微生物资源,又是一种常见的致病菌。
因此,对于医药原料、药品、医疗器械等的生产过程中,对大肠杆菌的监测和管理是必不可少的。
相关的标准和管理措施能够有效地保障医药产品的质量和安全,防止交叉感染和医院感染的发生。
综上所述,大肠杆菌的标准管理涉及食品安全、环境卫生、医药领域等多个方面,对于保障公众健康和社会稳定具有重要意义。
相关的标准和管理措施能够有效地预防疾病的传播、保障食品安全、维护环境卫生,是现代社会发展的重要保障之一。
因此,各个领域的相关部门和机构应加强对大肠杆菌的标准化管理,不断完善相关标准和监测方法,提高对大肠杆菌的检测和管理水平,为公众健康和社会稳定作出更大的贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用大肠杆菌快速检测植物功能基因的研究北京五中分校李思佳指导教师韩竹戴毅新【摘要】大肠杆菌是基因工程研究中最常用的原核表达宿主系统。
大肠杆菌表达体系与植物表达体系相比具有培养条件简单,生长周期短,操作简便等优点。
将植物基因分别转化大肠杆菌表达体系和植物表达体系,并在胁迫培养基中进行功能验证,分析结果表明大肠杆菌表达体系具有与植物表达体系相似的作用。
【关键词】大肠杆菌、基因分离鉴定、基因表达、功能验证、胁迫【前言】一、问题的提出生物课上老师讲到细菌的用途和危害时,同学们自己归纳出了很多细菌的危害,如可以引发人和动物的肺炎、腹泻、败血症、霍乱和肺结核等疾病;植物的叶斑病和萎蔫等。
细菌的益处是可以制酒、酱油、醋,还可以利用细菌发电。
老师引导我们说:细菌(如大肠杆菌)还有很多用途,同学们课下可以查找一些资料,做一些实验探究。
于是,我就查找了相关资料,了解到大肠杆菌是基因工程研究中最常用的原核表达宿主系统。
国内有研究人员利用这个原核表达体系筛选出了植物的抗旱基因。
那么这个体系除此之外还有哪些作用呢?这个体系与植物表达体系相比较具有哪些特点?带着这些疑问,在老师和家长的帮助鼓励下,我翻阅了相关书籍,从大肠杆菌的胁迫培养条件及体系开始进行了研究。
二、研究背景及目前国内外研究和应用现状大肠杆菌属原核生物。
细胞呈杆状,直径约1微米,长约2微米,两端钝圆,周身具鞭毛,可运动。
革兰氏染色为阴性,不形成芽孢。
在固体培养基生长的菌落为圆形,白色或黄白色,光滑而具闪光,低平或微凸起,边缘整齐。
最适条件下培养20分钟可繁殖1代。
大肠杆菌是人和温血动物肠道内普遍存在的细菌,是粪便中的主要菌种。
一般生活在人的大肠中并不致病,但偶尔侵入到阑尾、胆囊、腹腔或泌尿系统时,可发生炎症。
在工业生产中,大肠杆菌可用以制备L-门冬酰胺酶,此酶是治疗白血病效果较好的一种药物。
在水质监测方面,根据其有无及其数量多少,可作为检测水质状况和污染程度的重要指标。
大肠杆菌是现代生物学中研究最多的一种细菌,作为一种模式生物,其基因组序列已全部测出。
大肠杆菌是微生物遗传学研究的材料和基因工程中最常用的宿主细胞。
植物功能基因组学是一个崭新的研究领域。
其研究方法正在不断发展和完善。
植物功能基因组学的研究将不仅会使我们全面、客观地了解基因的功能,而且将有助于我们更好的利用这些研究结果有目的地改造植物性状,使其更好地服务于人类社会。
但由于植物生长周期长,植物转化技术一直是植物功能基因组学研究的瓶颈,因此,寻找、提供一种简单快速的基因功能研究方法将大大促进植物功能基因组学研究的飞速发展。
大肠杆菌具有生长周期短、操作技术简单和容易培养的特征,经常被选用为高效表达外源基因的首选体系。
Yamada等人在大肠杆菌中应用功能筛选法研究了红树植物CCTα基因的抗盐和渗透胁迫功能,又在大肠杆菌、酵母及烟草细胞中表达红树AOC基因,分析了AOC基因的耐盐机制。
近年来,深圳大学郑易之研究组也利用大肠杆菌功能筛选法分离出大豆耐盐基因,但利用大肠杆菌快速检测植物功能基因的研究未见报道。
三、创新突破1、应用软件分析并结合大量实验结果,为植物功能基因组学研究提供了一种简便快捷的研究方法。
2、以植物PM11基因为例,验证了其在大肠杆菌体系及在植物体系中显示出相似的作用。
3、结合其他研究人员的研究成果(深圳大学余玉雯等利用此大肠杆菌表达体系,已分离鉴定出一些耐盐基因)。
分析归纳出此体系具有:生长周期短,操作简便、高效,易于培养等特点。
4、此体系可适用于不同的研究目的(功能基因分离鉴定、外源基因高效表达、基因功能的验证),是一种简便快捷的值得推广运用的大肠杆菌功能验证系统。
【研究过程】一、材料与方法1、实验材料和仪器大肠杆菌:Escherichia coli JM109,DH5α,TOP10,BL21 star;根癌农杆菌:LBA4404;载体及重组质粒:pET28a-PM11,pBI 121;抗生素及试剂:氨苄青霉素,卡那霉素、链霉素(Sm)、羧苄青霉素(Cb)、利福平,IPTG,X-gal;植物激素:6-BA、NAA。
仪器:超净工作台、离心机、可见紫外分光光度计、光照培养箱、摇床、加液器等2、培养基及溶液配制(1)常用培养基LB培养基(1升):蛋白胨10g,酵母提取物5g,NaCl 10g,pH7.0(固体培养基每升加15g琼脂粉),高压灭菌;YEB培养基(1升):酵母提取物1g,牛肉膏5g,蛋白胨5g,蔗糖5g,MgSO4·7H2O 0.5g,pH7.0(固体培养基每升加15g琼脂粉),高压灭菌;YEP固体培养基(1升):蛋白胨10g,酵母10g,牛肉浸膏5g,pH7.0琼脂粉15g,高压灭菌;MS基本培养基:MS大量元素、微量元素、有机物,30g蔗糖,8g琼脂,pH5.8;高压灭菌;烟草分化培养基:MS培养基+0.2mg/L 6-BA + 0.1mg/L NAA,pH5.8;高压灭菌;烟草选择培养基:MS培养基+0.2mg/L6-BA+0.1mg/L NAA+100 mg/L kana+500 mg/LCb,pH5.8;高压灭菌;烟草生根培养基:MS培养基+0.05mg/L NAA+100 mg/L kana+500 mg/LCb,pH5.8;高压灭菌。
(2)常用溶液的配制氨苄青霉素(Amp)贮液(100mg/ml):100mg Amp溶于1ml蒸馏水中,0.22μm 滤膜过滤,-20℃保存。
卡那霉素(50mg/ml):500mg 卡那霉素溶于10ml蒸馏水中,0.22μm 滤膜过滤,-20℃保存。
利福平(5g/L):500mg利福平溶于约20ml甲醇中,溶解后加蒸馏水至总体积为100ml。
羧苄青霉素(500mg/ml):5g羧苄青霉素溶于10ml蒸馏水中,0.22μm 滤膜过滤,-20℃保存。
二、试验方案及实施过程为比较大肠杆菌异源表达体系与植物表达体系是否具有类似的验证植物基因功能的作用,我们将含有大豆LEA基因的重组质粒分别转化大肠杆菌表达体系和植物表达体系,并在干旱胁迫和渗透胁迫条件下进行诱导,记录并观察实验现象,分析大肠杆菌表达体系的优点及可能的应用推广价值。
1、配制胁迫培养基(1)胁迫固体培养基(每升加琼脂15g)1000 mM NaCl LB固体培养基: 蛋白胨10g,酵母5g,NaCl 58.44g800 mM KCl LB固体培养基: 蛋白胨10g,酵母5g,KCl 59.64g1500 mM Sorbitol LB固体培养基: 蛋白胨10g,酵母5g,Sobitol 22.33g.(2)胁迫液体培养基800mM NaCl LB液体培养基(1L):蛋白胨10g,酵母5g,NaCl 46.75g700 mM KCl LB液体培养基(1L): 蛋白胨10g,酵母5g,KCl 52.185;1200mM Sorbitol LB液体培养基: 蛋白胨10g,酵母5g,Sobitol 218.5g.2、重组质粒在大肠杆菌中的表达及胁迫处理将重组质粒转化E.coli BL21 Star(DE3),经IPTG(终浓度1mM,34℃180rpm)诱导4h后,进行全蛋白的SDS-PAGE(结果略)。
将重组质粒转化菌和空载体转化菌培养过夜。
次日以1%比例扩培至OD600=0.6,加IPTG(1mM)诱导4小时后,调整菌液的OD600值至0.8,作为基本培养物。
将基本培养物稀释100倍,取50μl分别涂布于含有1000 mM NaCl、800 mM KCl的固体培养基平板上。
37℃培养箱中培养48小时后记录菌斑数目。
取基本培养物分别移入含800 mM NaCl、700 mM KCl的液体培养基中诱导培养,每隔一定时间用紫外可见分光光度计测OD600值。
所有实验结果均为三次重复。
3、植物转化及胁迫处理无菌的烟草叶盘在含有PM11基因的根癌农杆菌农杆菌工程菌菌液中浸泡10min后,转入上铺一层滤纸的MS基本培养基中;28℃暗培养三天后,将材料转到含有抗生素的分化培养基中在16 h白天、8 h黑夜的光周期和25℃条件下进行培养;待抗性芽长至2-3cm 高时,切下小芽转入生根培养基中诱导生根。
经分子生物学检测为转基因植株的茎段插入到含1.5%NaCl的固体生根培养基中进行培养。
培养25-30天,观察和记录转基因烟草植株的生长状况。
三、数据记录及结果分析1、对照菌及重组菌在几种固体培养基上的生长状况将同样量的对照菌和三种重组菌(pET28-PM11、pET28-PM30和pET28-ZLDE-2)菌液分别涂布于1000 mM NaCl 和800 mM KCl固体培养基上。
经过一段时间培养,未见到对照菌生长,而pET28-PM11和pET28-PM30重组菌落的数目分别在500或1000个左右,pET28-ZLDE-2的菌落数目均在0~50个之间。
在1500mM山梨醇固体培养基中只有pET28-PM30重组菌有1000个左右菌落生长,未见对照菌和其余两个重组菌株pET28-PM11 和pET28-ZLDE-2生长(表1)。
表1 对照菌和重组菌在胁迫固体培养基上生长状况2我们将对照菌和三种重组菌分别接种于正常液体培养基中培养。
经过1小时的延迟期后,均开始生长,并很快进入对数生长期,8小时后对照菌和重组菌的生长进入稳定期(结果未给出)。
可见LEA 基因在大肠杆菌中的过量表达并没有对其生长产生显著影响。
在800 mM NaCl 的液体培养基中,对照菌的生长延迟期达48小时左右,之后进入对数期,75小时左右时进入稳定期。
与对照菌相比,三种重组菌的延迟期较短,pET28-PM11、pET28-PM30和pET28-ZLDE-2的延迟期分别为32小时、35小时和42小时;75小时左右达到稳定期(图1)。
在含700 mM KCl 的液体培养基中,对照菌经过35小时的延迟期后,其生长进入对数期,58小时左右达到稳定期。
与之相比,pET28-PM11和pET28-PM30重组菌的延迟期分别提前到17小时和21小时,在45小时左右达到稳定期,且pET28-PM30菌比对照菌和pET28-PM11重组菌还显示出较高的生长量。
然而,pET28-ZLDE-2菌的生长状况不及对照,迟滞期为40小时,60小时左右达到稳定期(图2)。
综合上述结果可以看出,在大肠杆菌中PM11和PM30基因的表达,使重组子菌株对高NaCl 和高KCl 胁迫有较好的抗性。
ZLDE-2基因的表达赋予重组子对高NaCl 有较好抗性,而对高KCl 抗性提高无明显效果。
因此,三种不同的LEA 基因的表达对重组菌抗性提高的作用效果不同,其抗逆机制也可能不同。
菌株 1000mM NaCl 800mM KCl 1500mM Sorbiol pET28对照菌 pET28-PM11 pET28-PM30 pET28-ZLDE-2 - ++ ++ - - ++++ +++ - - - ++++ -O D 600T(hour)图1 对照菌和重组菌在800 mM NaCl 液体培养基中的生长曲线O D 600T(hour)图2 对照菌和三种重组菌在700 mM KCl 液体培养基中的生长曲线3、利用植物表达体系验证PM11基因功能(1)PM11基因转化烟草 采用叶盘法将含PM11基因的农杆菌转化烟草叶片(图3),并经分子生物学手段检测出22株转基因植株。
