具有不相合熔点化合物系统的熔点~组成图
三元系统相图

三元系统相图
一、三元系统相图概述
三元凝聚系统相律: F=C-P+1=4-P
1、三元系统组成表示方法
——浓度(组成)三角形 应用: 1)已知点 的位置, 确定其组成; 2)已知组成,确定 点的位置;
双线法:
2、浓度三角形规则
(1)等含量规则 等含量规则:平行于浓度 三角形一边的直线上的各点, 其第三组分的含量不变,即: MN线上C%相等。
在在mn外mpn二三元系统相图基本类型一具有一个低共熔点的简单三元系统相图二生成一个一致熔融二元化合物的三元系统相图三具有一个一致熔融三元化合物的三元系统相图四生成一个不一致熔融二元化合物的三元系统相图五具有一个不一致熔融三元化合物的三元系统相图六生成一个固相分解的二元化合物的三元系统相图七具有多晶转变的三元系统相图八形成一个二元连续固溶体的三元系统相图九具有液相分层的三元系统相图一具有一个低共熔点的简单三元系统相图1立体相图2平面投影图投影图上温度表示法
T转 > Te3 、 T转 < Te2——多晶转变点P
T转 < Te2 、Te3——多晶转变点P1、P2
(八)形成一个二元连续固溶体的三元系统相图
(九)具有液相分层的三元系统相图
总结:
分析实际三元系统(复杂三元系统)相图的步骤
一、判断化合物的性质;
二、划分副三角形; 三、判断界线上温度变化——连(结)线规则; 四、判断界线性质——切线规则; 五、确定三元无变量点的性质——重心原理;
(三) 具有一个一致熔融三元化合物的三元系统相图
(四) 生成一个不一致熔融二元化合物的三元系统相图 1、相图组成
(1)不一致熔融化合物S不在自己的相区内; (2)化合物S性质的改变,导致CS连线、无变 量点P、界线的性质改变。 (a)CS连线 (b)无变量点:P点
工大复杂相图复习_大工
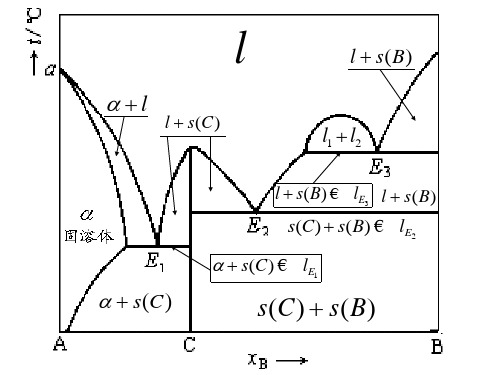
l
l s (C )
l s(B )
l1 l 2
l s(B) l E3 l s ( B )
s (C ) s ( B )
l E2
s (C )
Hale Waihona Puke l E1 s (C )s (C ) s ( B )
(1) OA线为石墨和金刚石的晶型转换时压力随 温度的变化曲线;OB线为石墨的熔化曲线; OC线为金刚石的熔化曲线。 (2) O点是石墨、金刚石、液态碳三相的平衡 共存点。
(3)∆trsG< 0 ,故石墨稳定。 (4) 金刚石的密度比石墨大,故石墨的 摩尔体积大。 (5) 由图可见,p ≈。
下图是SiO2-Al2O3体系在高温区间的相图,本相图在耐 火材料工业上具有重要意义,在高温下,SiO2有白硅石 和鳞石英两种变体,AB是这两种变体的转晶线,AB线之 上为白硅石(R),之下为鳞石英。 (1)指出各相区有哪些相 组成; (2)图中三条水平线分别 代表哪些相平衡共存; (3)画出从x,y,z点冷 却的步冷曲线。 (莫莱石的组成为 2Al2O33SiO2)
AB线代表A(鳞石英)、R(白硅石)、N(莫莱石)三相平衡共存。 CD线代表R(白硅石)、N(莫莱石)、l(熔化物)三相平衡共存。 EF线代表N(莫莱石)、B(Al2O3)、l(熔化物)三相平衡共存。
• SiO2(A)
莫莱石(N) Al2O3(B)
t(时间)
对FeO-MnO二组分体系,已知FeO和MnO的熔点分别为1370 ℃和1785 ℃,在1430 ℃、 分别含有30%和60%的MnO(质量)的二固体溶液相发生转熔变化,其平衡的液相组成为 15%的MnO。在1200 ℃时,二固熔体的组成为26%和64%的MnO,试依据上述数据 (1)绘制FeO-MnO二元相图;(2)指出各相平衡区的相态; (3)画出28% MnO的二组分系由1600 C缓慢冷却至1200 C的步冷曲线和路径的 相变化。
某二组分凝聚系统相图如右图(与“系统”有关文档共5张)
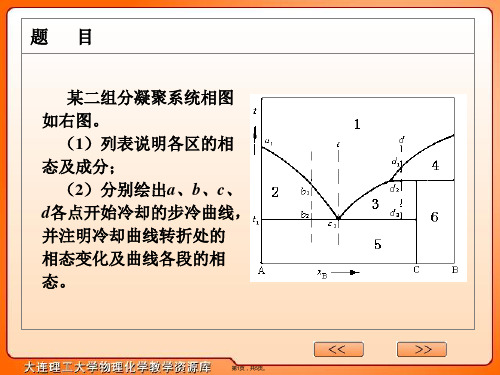
某二组分凝聚系统相图 如右图。
(1)列表说明各区的相 态及成分;
(2)分别绘出a、b、c、
d各点开始冷却的步冷曲线, 并注明冷却曲线转折处的 相态变化及曲线各段的相 态。
第1页,共5页。
分析
本题为二组分凝聚系统中形成不相源自熔点化合物系统 的相图。第2页,共5页。
答案
(1)各区的相态及成分见下表:
第4页,共5页。
相关知识重点简介
➢掌握二组分形成不相合熔点化合物系统的相图特征; ➢会绘制步冷曲线,并描述系统状态改变时系统状态的变化情 况。
第5页,共5页。
相区 1 2 3 4 5
相态及成分 l(A+B)
s(A) + l(A+B) s(C) + l(A+B) s(B) + l(A+B)
s(A) + s(C)
6
s(C) + s(B)
第3页,共5页。
答案
(2) 由 a、b、c、d 各点开始冷却的步冷曲线如下:
(2) 由 a、b、c、d 各点开始冷却的步冷曲线如下: (s掌s掌掌 某s掌sss(s(sss(掌((掌(掌s(22(((((((((((ACCCAAABAAA))握握握二握111握1握1握1由 )))))))由 ))))) ) ) ) ) )二 二 二组 二 二 二 二+++++++++++列列列列列列aaslssllss组组组 分组组组组sll(((((、、((((((AAA表表表表表表AACCCCCB分分分 凝分分分分+++++bb))))))说说说说说说BBBBB、、形形形 聚形形形形)))))明明明明明明cc成成成 系成成成成、、各各各各各各不不不 统不不不不dd区区区区区区相相相 相相相相相各各的的的的的的合合合 图合合合合点 点相 相 相 相 相 相熔熔熔如熔熔熔熔开开态态态态态态点点点 右点点点点始始及及及及及及化化化 图化化化化冷冷成成成成成成合合合 。合合合合却却分分分分分分物物物 物物物物的的;;;;;;系系系 系系系系步步统统统 统统统统冷冷的的的 的的的的曲曲相相相 相相相相线线图图图 图图图图如如特特特 特特特特下下征征征 征征征征::;;; ;;;; (1)各区的相态及成分见下表:
相图3
6~16%
68~82%
CaO
SiO2
由相图可知,配料组成点在平行四边形虚线内。
作业:P250-252 6.2、6.6、6.10、6.12、6.13、6.15、6.16
S
Q
2 [B , (B)]
S B L→B p=2 f=2
L → C +B
p=3 f=1
L+B → S+C P [O ,B+(S)+C]
P(L消失)[2 ,B+S+C]
p=4 f=0
C D C e4 A A e1 E S Q S P
分析:3点在C的初晶区内, 开始析出的晶相为C, 在ASC内,析晶终点 e3 在E点,结晶终产物是A、S、 C。途中经过P点,P点是转 B B L→C p=2 f=2 L+B → S+C P(B消失)[F ,S+C] 熔点,同时也是过渡点。 L+B → S+C m[C , C+(B)] L → C +B p=3 f=1 L → C +S p=3 f=1
.5
S
B B L +B→ S
5 [B , (B)]
L→ S p=2 f=2
Q L→B p=2 f=2
H[B , B+(S)]
p=3 f=1
L → S+C+A E[S ,S+(C+A)] p=4 f=0 E(L消失)[5 ,A+S+C]
C
总结
1、无变量点性质 P点:L+B → S+C E点:L → A+S+C 2、界线性质PQ是转熔线 L+B → S 其它为共熔线。 3、组成点 在 ASC内,E点是析晶终点, e4 A A e1 E S Q S C P m e3
物理化学:5-4-2 二组分液态完全不互溶系统的平衡相图

M xB
NB
液相有转沸点的部分互溶系统相图
相平衡
5.4.2 二组分液态完全不互溶系统的平衡相图
1.相图特征
水和非极性液体, t M 性质相差极大,相互溶
N g
解度很小,可认为液态 部分完全不互溶。
A(l)+g C
g+B(l)
O
D
A(l)+B(l)
总压 p = pA*+ pB* 与组成无关
H2O(A)
与气-液相图中液相完全互溶(形成溶液)、 部分互溶和完全不互溶的相图完全相似。 相态相应作如下替换:l s ,g l
(2) 复杂相图:固态形成稳定或不稳定化合物的相图 相当于A和C及B和C两个相图的组合
(3) 液相为多相: 系统较复杂, 形状为简单相图组合
高等教育出版社 高等教育电子音像出版社
相平衡
H2O(A)
xB C6H6(B)
液相组成(纯A ) C 点, 液相组成(纯B ) D 点。
液相完全不互溶系统相图
注意:因p = pA*+ pB* ,
故tC<纯A或B的沸点
高等教育出版社 高等教育电子音像出版社
相平衡
继续升温时:
(3) 温度继续升高时,出现 纯A 液相+气相
或纯B 液相+气相两相区
(4) 温度更高时, 以单一气相存在
温度变化会出现不连续(折点)。
注意
(1) 高温时陡(散热快) 温 (2) 相变时变平些(放热) 度
(3) F=0 时平台。温度不 变,称为共熔点或熔点。 出现三相(二组分)或两 相(单组分)平衡
高等教育出版社 高等教育电子音像出版社
开始凝固
F=0
十二、三元相图

45
生成一个稳定的二元化合物的三元相图
该体系如图所示可以分割 ΔABD和ΔADC二个副(亚) 三角形, 有两个低共熔点 (E1、E2),可应用共晶 体系的冷却规律处理。 在E1点发生 L = A + B + D; 在E2点发生 L = A + C + D 组成点连线A-D与相界线 E1E2的交点eAD是界线上的 最高点,温度向两侧下降。
线 面
区
18
(1)相图的点:熔点及低共熔 点 • 液相面上的A、B、C三点分 别为纯物质A B C的熔点 别为纯物质A、B、C的熔点; • e1、e2、e3分别为AB、AC、 BC二元体系的二元低共熔点 系 低 熔点 (三相共存) • E1为ABC三元低共熔点,此 点上四相共存,在此点的温 度以下,体系全为固相
4
浓度三角形:垂直线
E 成分三角形中特殊的点和线 ( ) 个顶点 代表 个 (1)三个顶点:代表三个 纯组元; (2)三个边上的点:二元 体系的成分点;
吉布斯三角形,由M点读出体系组成 cA = a, cB = b, cC = c
5
(1)已知点确定成分; (2)已知成分确定点
由体系组成画出M点
6
在一定温度下,三元体系 达到三相平衡时 体系的成 达到三相平衡时,体系的成 分点为三个平衡相的成分点 组成的三角形的质量重心。
DEF M M DEF MD W D ME W E MF W F 0
12
平衡相含量的计算:所计算相的 平衡相含量的计算 所计算相的 成分点、合金成分点和二者连线 ቤተ መጻሕፍቲ ባይዱ延长线与对边的交点组成 个 的延长线与对边的交点组成一个 杠杆,合金成分点为支点,计算相 的计算方法同杠杆定律。
三元相图-1
C
C
P2 1 E
S
P1
S A
B B
A 四个初晶区,六条相区界限(包含转熔线),三个 无变量点,其中有转熔点,三个副三角形
6 具有一个低温稳定高温分解的二元化合 物的三元系 • 体系特征:体系中存在一个二元低温稳 定高温分解的化合物,组分间液相完全 互溶,固相完全不互溶; • 相图特征:四个初晶区,六条相区界限 (包含转熔线),三个无变量点,两个 副三角形。
B
o
D
三元化合物:不一致熔 B
A
AmBn
C
C U U V V
A
W W 1
o
D
B
A
B
A
C
B
A S B
C A
C
D
B
C
A
GS
B
C
C
S A
C
B A
S
B
A
S
B
二、在固相中完全不互溶的三元相图基本 类型 1、具有一个低共熔点的不生成化合物的 三元相图 体系特征:液相完全互溶,固相完全不 互溶
相图特征: 三个初晶区, 三条相区界 线,一个无变 量点。
C A E
B
B A
C
2 具有低共熔点的生成二元化合物的三元相 图 • 体系的特征:化合物为稳定化合物,每种 组分都有确定的熔点,组分间液相完全互 溶,固相完全不互溶; • 相图的特征:多于一个无变量点,四个初 晶区,五个相区界限(均为低共熔线), 两个无变量点(均为低共熔点),两个副 三角形。
C
R为双降点形式的过渡点
C P S A A S R B B E
7 具有在高温稳定低温分解的二元化合物的 三元系 • 体系特征:体系中存在一个二元高温稳 定,低温不稳定化合物,组分间液相完全 互溶,固相完全不互溶; • 相图特征:四个初晶区,五条相区界限 (包含转熔线),两个无变量点,其中有 一个转熔点,两个副三角形。
物化第六章 - 答案
第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x呈线性关系。
()B3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于 K;(2)必高于 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种; (2) 2种; (3) 1种; (4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
物理化学(上)_武汉大学中国大学mooc课后章节答案期末考试题库2023年
物理化学(上)_武汉大学中国大学mooc课后章节答案期末考试题库2023年1.因K =f(T),所以对于理想气体的化学反应,当温度一定时,其平衡组成也一定。
答案:错误2.一封闭体系的绝热循环过程必为一可逆循环过程。
答案:正确3.理想气体反应N2O5(g)== N2O4(g)+1/2O2(g)的DrHm为41.84kJ/mol。
要增加N2O4(g)的产率可以( )答案:提高温度4.理想气体反应【图片】的【图片】与温度T 的关系为:\Delta _rG_m^\ominus【图片】 (in J/mol),若要使反应的平衡常数【图片】>1,则应控制的反应温度( )答案:必须低于409.3K5.下列相变过程属于不可逆过程的是()答案:25 ℃、101325 Pa下水变为蒸汽6.关于热力学可逆过程,下列表述正确的是()答案:可逆过程中不一定无其他功7.298 K、2 mol理想气体,体积为15 dm3经恒温对抗外压1.013×105 Pa膨胀到50 dm3,则膨胀功(单位:J)为()答案:-35468.理想气体向真空容器膨胀,当一部分气体进入真空容器后,余下的气体继续膨胀所做的体积功为()答案:W = 09.对于恒沸混合物,下列说法中错误的是()答案:恒沸混合物与化合物一样具有确定的组成10. 2 mol双原子理想气体,由300 kPa、20 dm3恒温可逆压缩到15 dm3,此过程的W(单位:J)为()答案:172611.A、B两液体混合物在t-x图上出现最高点,则该混合物对拉乌尔定律产生的偏差为()答案:负偏差12.不能用化学平衡移动原理说明的事实是()答案:使用催化剂能使合成氨速率加快13.影响任意一个化学反应的标准平衡常数值的因素为()答案:温度14.某化学反应300K、标准压力下恒温在试管中进行时放热60kJ,若在相同条件下通过可逆电池吸热6kJ,反应在试管中进行时其环境的熵变(单位J/K)为()。
6.4.6生成一个不一致熔融二元化合物的三元系统相图
材料科学基础第 6 章6.4.6生成一个不一致熔融二元化合物的三元系统相图具有一个不一致熔融二元化合物不一致熔融二元化合物 S 组成点 S(AB n)在AB边上m初晶区SS组成点不在初晶区内有缘学习更多驾卫星ygd3076或关注桃报:奉献教育(店铺)2个三元无变量5条界线4个初晶区连接CS不能划分分系统S(A m B n)E 点低共熔相图局部放大组成点在B初晶区开始析出的晶相为B 组成点在 BSC内结晶结束点 P点析晶产物 B+S+C液相点固相点组成点在B初晶区开始析出的晶相为B组成点在 ASC内结晶结束点 E点析晶产物 C+S+A 液相点固相点组成点在B初晶区开始析出的晶相为B 组成点在 ASC内结晶结束点 E点析晶产物 C+S+A 液相点固相点穿相区:固相组成点移动到S时,从转熔线Pp开始组成点在S的初晶区开始析出的晶相为S 组成点在 ASC内结晶结束点 E点析晶产物 S+A+C液相点固相点析晶结束点是熔体组成点所在副∆相应的无变量点,与其是否在∆内无关。
低共熔点一定是析晶结束点,转熔点可以是析晶结束点,也可不是。
组成在△BSC内(1点)L先消失,B有剩余,析晶过程在P点结束,析晶产物B、S、C三种晶体。
组成在△PSC内(2点)B先消失,L有剩余,转熔结束,析晶未结束,L组成点继续沿界线降低温度,析出晶体。
组成在CS连线上L和B同时消失,转熔过程与结晶过程同时结束, 产物S、C两种晶体。
组成点在PpS区域内(3点)转熔线上的析晶过程,回吸的晶相被回吸完时会出现“穿相区”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
dnB= v B dξ的关系,或dξ=
2018/9/22
1 dnB vB
12
——定义
反应进度随时间的变化率为反应速率(更改下式的为v)
●说明
dξ 1 dn B v dt B dt
def
——目的 反应速率与所选取的物质无关 ——反应多恒容,V为常数。反应速率可用某组分的浓度随时间的 变化率来表示。因dCB=dnB/V,上式变为 ——定义
3.掌握阿伦尼乌斯方程及其应用,明确活化能及指前因子的定 义和物理意义;了解简单碰撞理论的基本思想和结果,并对过渡状 态理论有初步的了解;
4.明确对行反应、连串反应和平行反应的动力学特征;明确由 反应机理建立速率方程的近似方法(控制步骤法、稳态近似法、平 衡近似法);明确链反应机理的特点及支链反应与爆炸的关系;
边三角形表示
——三角形的三顶点分别代表三
种纯物质,AB、BC和CA三边上 的点代表相应二组分A~B、B~C 和C~A系统组成。如AB边上的点M表示组成为B%=30%的A~B二 组分系统。三角形内任一点均代表A、B、C三组分系统的一个系 统点,其组成确定的方法是:通过系统点分别作平行于三条边的 平行线,在各边上所截取的组成a、b和c即为A、B和C的组成。例 如,图中的N点,A、B、C的组成分别为20%、60%和20%。
2018/9/22 6
9.标出下列各系统中各相区的相态、相数和自由度数;绘制a、 b步冷曲线,指明步冷曲经上转折点或停歇点处系统的相态变化
2018/9/22
7
第十一章 化学动力学
本章要求
1.掌握化学反应速率、反应速率常数及反应级数、基元反应及 反应分子数的概念; 2.掌握零级、一级和二级反应的速率方程及其应用;明确通过 实验建立速率方程的基本原理和方法;
2018/9/22
2
10.4.3 二组分固态完全互溶和部分互溶固液平衡图
●概况 由热分析法绘制,相图的形式与二组分液态完全互溶和 部分互溶气液系统相似
2018/9/22
3
●相图分析
——二组分固态互熔部分,称固体熔液或固熔体,φ=1 ,f=2,二 组分完全互熔时,用S(A+B)表示,图中(Ⅲ)区。二组分部分 互熔,互熔部分用α、β、γ表示。(Ⅱ)区为熔液与固体熔液两相 平衡。(α+β)区为两个不同浓度的固体熔液或固制备低熔点合金应选择的比例。 例,Ge~Si,温度降低1210℃以下,Ge与Si可以任意比例混匀; Sn~Pb的合金制备范围较窄,一般Sn%<20%,温度控制在 150℃250℃之间;Ag~Pt合金,一般Pt%<50%,温度t<900℃
2018/9/22
4
10.5 三组分系统相图简介 10.5.1 三组分系统的相律分析
2018/9/22
5.对溶液中反应、光化学反应、催化反应的特征有初步的了解
8
●化学动力学与化学热力学的关系
——化学热力学 方向与限度:可能性 ——化学动力学 速率与机理:现实性
●化学动力学的研究对象
——各类化学反应的速率(rate of reaction)以及各种因素(T, p,c,催化剂,光,电)对反应速率的影响 ——反应机理(mechanism of reaction) 反应物转化为产物的实际 途径或步骤
由相律:f=3-φ+2=5-φ 可知三组分系统最多可五相共存,最大自 由度为4,分别是T、p和两个组分的浓度。三组分系统的完整相图 是四维相图,一般情况下,讨论定温定压时的二维平面相图
2018/9/22
5
10.5.2 三组分系统相图的等边三角形表示法
——A、B、C三组分系统,组成为
xA、xB和xC。三组分浓度,可用等
——分析点a降温过程:a点熔液降温至K点,开始析出固体Na, K→M区间系统呈两相平衡,至M点,固体化合物开始析出,三相平 衡,f=0,发生逆转晶反应,Na(s)+ 熔液 = Na2K(s),降温至M 点以下,固体Na和固体化合物两相共存
2018/9/22 —— 具有不相合熔点的系统的相图特征是“T”字型 1
2018/9/22
11
§11.1 化学反应的速率 ●反应速率的定义
——基本概念 对反应
1A1 2A2 jA j j1A j1
可以表达为:
B
B
B0
式中, v B 是物质B的化学计量系数(生成物取正,反应物取负),发 生一个单位反应,反应进度ξ=1;反应进度为dξ时, A1,A2, …Aj,Aj+1……的变化量分别为: v1 dξ摩尔, v 2 dξ摩尔,
2018/9/22
9
●化学动力学的研究方法
宏观方法与微观方法并用
——宏观方法 例,实验测定反应系统的浓度、温度、时间等宏 观量间的关系,再把这些宏观量用经验公式关联起来,构成宏观反 应动力学。本课程重点 ——微观方法 例,用激光、分子束技术考察某特定能态下的反 应物分子通过单次碰撞转变成另一特定能态下生成物分子的速率, 得到微观反应速率常数,把反应动力学的研究推向分子水平,构成 微观反应动力学,也称分子反应动态学
李远哲 交叉分子束技术,对微观反应动力学研究作出重要贡献, 1986年诺贝尔奖
2018/9/22
10
●研究化学动力学的意义
——通过化学动力学的研究,可给人们提供选择加快所希望反应的 速率、降低或抑制不希望的副反应发生的条件。对化工、材料、环 保等领域的重要性是不言而喻的 ——通过反应机理(mechanism of reaction)的研究可揭示反应物的结 构与反应能力的关系,了解物质变化的内部原因,以便更好地控制 和调节化学反应的速率。由于反应机理能够反映出物质结构上的某 些特性,所以,可以加深我们对于物质形态的认识。反过来,从已 知的有关物质结构的知识也可以推测一些反应的机理
2. 具有不相合熔点化合物系统的熔点~组成图 ●示例 Na~K定压熔点~组成图,形成不稳定化合物Na2K ●相图分析
——有一低共熔温度-12℃和一转晶温度7℃。Na2K热到7℃分解 Na2K(s)= Na(s)+ 熔液
三相平衡。分解反应又称Na2K(s)转晶反应(transition crystal reaction),熔液组成与固体Na2K不同
