单电子原子轨道
原子轨道的方向

原子轨道的方向原子轨道是描述电子在原子中运动的概念,它的方向可以根据其主要特征进行分类。
下面将从不同的角度介绍几种原子轨道的方向。
1. s轨道s轨道是最基本的原子轨道,也是最简单的一种。
它的形状呈现为球对称,电子在这种轨道中的运动是均匀分布在空间中的。
s轨道的方向并没有明显的偏倚,可以看作是均匀分布在各个方向上。
2. p轨道p轨道是比较常见的原子轨道,它的形状呈现为两个互相垂直的球面。
根据p轨道的形状,可以将其分为三个不同的方向,分别是x 轴方向、y轴方向和z轴方向。
在每个方向上,电子的分布呈现出两个互相对称的区域,形状类似于一个沿着该轴的双叶风车。
3. d轨道d轨道是一种复杂的原子轨道,它的形状更加多样化。
根据d轨道的形状,可以将其分为五个不同的方向,分别是xy平面内的两个方向、xz平面内的两个方向和yz平面内的一个方向。
在每个方向上,电子的分布呈现出不同的形状,如四叶风车、八叶风车等。
4. f轨道f轨道是最复杂的原子轨道,它的形状更加多样且难以描述。
根据f轨道的形状,可以将其分为七个不同的方向,包括xyz三个平面内的方向以及斜对角线方向等。
在每个方向上,电子的分布呈现出复杂的形状,难以用简单的几何形状来描述。
总结起来,原子轨道的方向可以根据其形状和特征进行分类。
s轨道的方向是均匀分布在各个方向上;p轨道的方向可以分为x轴、y 轴和z轴三个方向;d轨道的方向可以分为xy平面内的两个方向、xz平面内的两个方向和yz平面内的一个方向;f轨道的方向更加复杂,可以分为xyz三个平面内的方向以及斜对角线方向等。
这些方向的不同反映了电子在原子中的运动轨迹和分布情况,对于理解原子的结构和性质具有重要的意义。
cr六个成单电子的四个量子数

cr六个成单电子的四个量子数Cr元素是一种族17的元素,它的原子核由24个质子和24个中子构成。
它有6个成单电子,这些电子绕原子核自由运动,每个轨道有四个量子数。
本文将详细阐述Cr六个成单电子的四个量子数。
Cr元素的第一个电子轨道是1s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=1,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第二个电子轨道是2s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=2,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第三个电子轨道是2p6,该轨道有六个电子。
其四个量子数分别为:n(轨道量子数)=2,l(角量子数)=1,m(磁量子数)=+1,m(磁量子数)=0, m(磁量子数)=+1/2,m(磁量子数)=-1/2。
第四个电子轨道是3s2,该轨道有两个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=0,m(磁量子数)=+1/2和m(磁量子数)=-1/2。
第五个电子轨道是3p6,该轨道有六个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=1,m(磁量子数)=-1,m(磁量子数)=0, m(磁量子数)=+1/2,m(磁量子数)=-1/2。
最后一个电子轨道是3d10,该轨道有十个电子。
其四个量子数分别为:n(轨道量子数)=3,l(角量子数)=2,m(磁量子数)=-2,m(磁量子数)=-1,m (磁量子数)=-1,m(磁量子数)=0,m(磁量子数)=+1,m(磁量子数)=+1/2,m(磁量子数)=-1/2和m(磁量子数)=-1/2。
从上述可见,Cr六个成单电子的四个量子数主要分为n-轨道量子数、l-角量子数、m-磁量子数和m-磁量子数。
n表示当前电子位于第几个能级;l表示当前电子位于哪一类轨道,它可以是s轨道,p 轨道,d轨道或f轨道;m和m表示当前电子位于轨道轴上的正负磁量子数。
原子排列轨道

原子排列轨道原子排列轨道I. 前言随着科技的发展,人类对于自然界和宇宙中的奥秘有了更深入的探索和理解。
其中,原子结构是一个重要的研究领域之一。
本文将主要介绍原子排列轨道的相关知识。
II. 原子结构原子是构成物质的基本单位,由核和电子组成。
核心是由质子和中子组成,而电子绕核心运动。
原子的电子数目决定其化学性质,而电子轨道结构则决定其物理性质。
电子轨道是电子在原子核周围运动的区域,原子的不同能级对应着不同的轨道。
如图1所示,一般情况下,原子有四种不同的轨道,即:s轨道、p轨道、d轨道和f轨道。
III. s轨道s轨道是最接近原子核的轨道,对应着原子的基态能级。
在周期表中,第一周期的元素只有一个电子,它就在s轨道中。
如图2所示,s轨道是球形对称的,其形状呈现出圆形,原子中只会有一个s轨道。
因为电子在s轨道内运动的通量为零,所以s轨道内永远只有一个电子。
IV. p轨道p轨道则是第二个原子层及以后的轨道,图3展示了p轨道的形状。
p轨道有三种不同的取向,分别沿着x轴、y轴、z轴延伸,与s轨道不同的是,p轨道内最多可以容纳6个电子。
V. d轨道和f轨道在第三个原子层及更高的层次中,d轨道和f轨道也开始出现。
d轨道有5种不同的取向,最多可以容纳10个电子;f轨道有7种不同的取向,最多可以容纳14个电子。
但由于这些元素的外层电子的包容量已经达到饱和,因此他们的电子不太可能在这些轨道中,而主要在外层轨道中运动。
VI. 总结本文简要介绍了原子排列轨道的相关知识。
它们的形状和数量决定了原子的物理性质,这些性质又影响了原子的化学性质。
深入理解原子结构,对于我们探索物质世界和应用科技都有非常重要的意义。
原子物理轨道知识

原子轨道原子轨道(Atomic orbital)是单电子薛定谔方程的合理解ψ(x,y,z)。
若用球坐标来描述这组解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),这里R(r)是与径向分布有关的函数,称为径向分布函数,用图形描述就是原子轨道的径向分布函数;Y(θ,φ)是与角度分布有关的函数,用图形描述就是角度分布函数。
1简介原子轨道(英语:atomic orbital),又称轨态,是以数学函数描述原子中电子似波行为[1][2]。
此波函数可用来计算在原子核外的特定空间中,找到原子中电子的机率,并指出电子在三维空间中的可能位置[1][3]。
“轨道”便是指在波函数界定下,电子在原子核外空间出现机率较大的区域。
具体而言,原子轨道是在环绕着一个原子的许多电子(电子云)中,个别电子可能的量子态,并以轨道波函数描述。
电子的原子与分子轨道,依照能阶排序现今普遍公认的原子结构是波耳氢原子模型:电子像行星,绕着原子核(太阳)运行。
然而,电子不能被视为形状固定的固体粒子,原子轨道也不像行星的椭圆形轨道。
更精确的比喻应是,大范围且形状特殊的“大气”(电子),分布于极小的星球(原子核)四周。
只有原子中存在唯一电子时,原子轨道才能精准符合“大气”的形状。
当原子中有越来越多电子时,电子越倾向均匀分布在原子核四周的空间体积中,因此“电子云”[4]越倾向分布在特定球形区域内(区域内电子出现机率较高)。
早在1904年,日本物理学家长冈半太郎首度发表电子以类似环绕轨道的方式在原子内运转的想法[5]。
1913年,丹麦物理学家尼尔斯·波耳提出理论,主张电子以固定的角动量环绕着体积极小的原子核运行[6]。
然而,一直到1926年、量子力学发展后,薛定谔方程式才解释了原子中的电子波动,定下关于新概念“轨道”的函数[1][7]。
由于这个新概念不同于古典物理学中的轨道想法,1932年美国化学家罗伯特·马利肯提出以“轨道”(orbital)取代“轨道”(orbit)一词[8]。
1-36号元素轨道图
dz2
价键法(VB法)价键理论一: 1、要点: ⑴、共价键的形成条件:①、先决条件: 原子具有未成对电子;②、配对电子参与 成键的原子轨道要满足对称匹配、能量相 近以及最大重叠的原则;③、两原子具有 成单的自旋相反的电子配对,服从保里不 相容原理。 ⑵、共价键的本质:是由于原子相互接近 时轨道重叠,原子间通过共用自旋相反的 电子使能量降低而成键。 ⑶、共价键的特征:①、饱和性,一个原 子有几个未成对电子(包括激发后形成的 未成对电子),便和几个自旋相反的电子 配对成键;而未成对电子数是有限的,故 形成化学键的数目是有限的。②、根据原 子轨道最大重叠原理,原子轨道沿其角度 分布最大值方向重叠,即共价键具有一定 的方向性。 ⑷、共价键的类型:单键、双键和叁键。
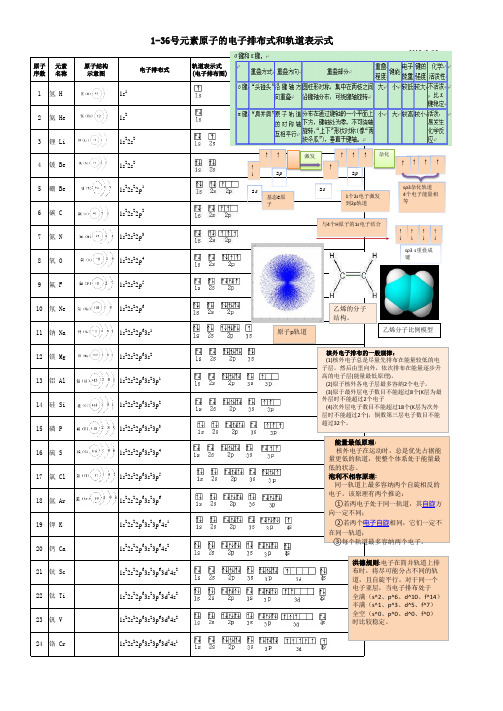
1-36号元素原子的电子排布式和轨道表示式
原子 元素 序数 名称
1 氢H
原子结构 示意图
电子排布式
1s1
轨道表示式 (电子排布图)
2013/9/12
2 氦 He
1s2
3 锂 Li 4 铍 Be 5 硼 Be 6 碳C 7 氮N 8 氧O
1s22s2 1s22s2 1s22s22p1 1s22s22p2 1s22s22p3 1s22s22p4
电离能:气态电中性基态原子失 去一个电子,转化为气态基态正离
子所需要的最低能量叫第一电离能。 符号:“I1”,单位:Kj/mol^-1。 “气态”、“电中性”、“基态” 是保证最低能量的条件。
[规律] 1.总体上金属元素第一电离能较 小非金属元素第一电离能较大. 2.同周期元素第一电离能从左到 右有增大的趋势 3.同主族元素第一电离能从上到 下逐渐减小
35 溴 Br
1s22s22p63s23p63d104s24p5
结构化学

电子排布规则与全波函数的 Slater 行列式表示
1. Pauli 原理:一个原子轨道最多只能容纳自旋相反 (α,β) 的两个电子 2. 能量最低原理:电子优先占据低能级。基态能量最低 3. Hund 规则:在简并轨道中,电子尽可能占据不同的轨道且自旋平行
He (1s2) 的全波函数
or
不能满足 Fermi 子波函数的反对称特征:
例:Slater 法计算 Li 原子单电子原子轨道能、基态能量、电离能、电子结合能
基态能量
电离能
可由实验测得
2s 轨道的电子结合能
1s 轨道的电子
(电子互斥能所致)
从 Li 原子中拔掉一个 2s 电子比
单纯从 2s 轨道拔掉一个电子容易得多,
其差值便是电子互斥能的贡献
虽然 (1s,1s) 互斥能大于 (1s,2s) 互斥能, 但 1s 轨道能远低于 2s 轨道能, 因此 Li+(1s22s0) 能量低于 Li+(1s12s1)
氢原子光谱
光谱项
跃迁选律:Δn 任意
高分辨光谱可 以观察到双线
多电子原子中的角动量耦合
p2 组态的自旋角动量耦合
总自旋角量子数 单重态 (singlet) 三重态 (triplet)
总自旋磁量子数
p2 组态的轨道角动量耦合
总轨道角量子数 L = 2, 1, 0 (S, P, D) 总轨道磁量子数 ML = L, L−1, …, −L
须线性组合:
Slater 行列式
常见化学反应性指标
电离能 (ionization energy) 电子亲和势 (electron affinity)
vacuum
I
Ae
LUAO
原子轨道电子云的轮廓图

↑
↑
↑
1S
2S
2P
不 同 时 刻 电 子 出 现 的 位 置
. .
. .
. .
. .
.
..电子云和原子轨道来自原子轨道(电子云的轮廓图)
常把电子出 现的概率约 为90%的空 间圈出来
球形 轮廓图
P能级的原子轨道
z
z
z
y x
x
y
x
y
P能级的原子轨道是哑铃形的,
每个P能级有3个原子轨道,它们相 互垂直,分别以P x 、Py 、PZ表示.
【探究2】
成键原子之间形成 共价单键是σ键还是π键; 共价双键中有___个σ键,____个π键; 共价三键中有___个σ键,____个π键
键类型
重叠方式 对称方式 重叠程度
σ键
头碰头 轴对称 较大 σ 键强度大, 不易断裂,不活泼
π键
肩并肩 镜面对称 较小 π 键强度较小, 容易断裂,活泼
牢固程度
氢原子和氯原子形成HCl的过程
H•
••• •Cl • ••
H
H-Cl
Cl
↑ 1S
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑
1S 2S
2P
3S
3P
氯原子形成氯分子的过程
• • • •Cl • ••
Cl Cl Cl
••• •Cl • ••
Cl
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓
↑↓ ↑↓ ↑
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓
↑
↑
↑
1S 2S
2P
两个原子的p轨道“肩并肩”重叠形成共价键的过程
第1章 原子结构与性质-高中化学全册必背章节知识清单(新人教版选择性必修2)(教师版)

第一章原子结构与性质第一节原子结构一、能层与能级1、能层(1)含义:根据核外电子的能量不同,将核外电子分为不同的能层(电子层)。
(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用K、L、M、N、O、P、Q……表示,其中每层所容纳的电子数最多为2n2 个。
(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为E(K)<E(L)<E(M) <E(N)<E(O)<E(P)<E(Q)。
2、能级(1)含义:根据多电子原子的同一能层的电子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为n s、n p、n d、n f等。
3、能层、能级与最多容纳的电子数能层(n)一二三四五六七……符号K L M N O P Q……能级1s2s2p3s3p3d4s4p4d4f5s……………………最多电子数22626102610142……………………281832………………2n2(1)能层序数等于该能层所包含的能级数,如第三能层有 3 个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为 1 、3、5、7 的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是2n2 (n为能层的序数)。
二、基态与激发态原子光谱1、基态原子与激发态原子(1)基态原子:处于最低能量状态的原子。
(2)激发态原子:基态原子吸收能量,它的电子会跃迁到较高能级,变成激发态原子。
2、光谱(1)光谱的成因及分类(2)光谱分析:在现代化学中,常利用原子光谱上的 特征谱线 来鉴定元素,称为光谱分析。
三、构造原理与电子排布式 1、构造原理 (1)含义以 光谱学 事实为基础,从氢开始,随核电荷数递增,新增电子填入 能级 的顺序称为构造原理。
(2)示意图2、电子排布式将 能级 上所容纳的电子数标在该能级符号 右上角 ,并按照能层从左到右的顺序排列的式子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应化0904 杨旭明
天体、小球和电子
小球
?
星球 电子
诡异的波粒二象性
星球抽象为小球,似乎是理所应该,无 可厚非,而电子抽象为小球,似乎也是理 所应该,无可厚非。 似乎终归是似乎,不是确定。而已经确 定的是,电子既有波动性,又有粒子性, 而经典物理学中,没有粒子性的波,也没 有波性的粒子。 好吧,我们脑海中想象的电子运动都 是扯淡。
原子轨道图
原子轨道图像的形状,主要由其角度分布图决定,而原子 轨道图像的大小,主要是由其径向分布图决定。为方便起 见,通常采用原子轨道的角度界面图近似代替原子轨道图 像。 苹果,我们还是那样画! 注意:等值面的绘制不同于此!
原子轨道图之庐山面目
Pyz之花瓣形
3Pz之娅玲形
4fxyz之XX形
角度分布图 1. 根据薛定谔方程解得 s、p和d轨道的角度分 布函数。 2. 径向分布,主要决定 原子轨道的大小,角度 分布主要决定原子轨道 的形状。 3. 这一切都是服务于原 子轨道图的绘制。
4. 隐藏玄机!
s、p和d轨道角度分布
玄机:球谐函数的加法定理
m -l
Y θ,φ
lm
l
原子轨道之奇妙苹果
薛定谔方程的解能够变数分离!
在半径一定的情况下,苹果营养成分的分布相对大小 取向是相同的。 薛定谔有只让人抓狂的猫,也有让人释然的苹果。
原子轨道之普通苹果Ⅱ
大家一看就知道这是苹果,即便是乔帮主咬过的。
看山是山,看水是水,到看山不是山,看水不是水,再到看山 还是山,看水还是水。这算不算是收获呢?
Ψ2-r图
黑白棋除了简单,还 有神秘,1+1=2除 了简单,还有深邃, 有深度的人这么说来 着。 Ψ2-r图除了简单,容 易得到外,还是简单, 抛弃了θ和Φ,意味着 不能表征θ和φ的信息, 因此只用于表示S态的 分布。
径向分布图
为了计算半径为r的球面半径 和r+dr的球面之间薄壳层内电 子出现的概率,引入了径向分布 函数(D)
谢谢观赏
WPS Office
Make Presentation much more fun
@WPS官方微博 @kingsoftwps
单电子原子定态薛定谔方程的解
r, , Rr
于是,顺其自然的变数分离,于是 有了球谐函数和径向函数,接着有 了径向分布函数和角度分布函数, 有了电子云分布图,有了原子轨道 轮廓图。
矮子看戏的开心
他们看的这 么开心,我 也要高兴高 兴。
个中精彩,还是自己亲眼瞧瞧的好!
D
0 2
2
0 2
r sin dd
2 2
r R
பைடு நூலகம்
径向分布图
上图是3p电子的径向分 布图。由计算出的径向分布 函数表达式或者画出的一系 列径向分布图,容易知道, 主量子数为n、角量子数为l 的状态,径向分布图中有( n-l)个极大值峰和(n-l-1) 个为0值的点,主峰位置随l 增加而向核靠近。
2
2l 1 4π
这一关系称为球谐函数的加法定理,它表明任一 亚层上各个轨道电子云的角度分布总和各个方向是 相同的,为球形分布,与θ和φ无关。
原子轨道之普通苹果
1.以上三个都是苹果,大家一看都能明白,即便是被乔帮主咬 过。 2. 这不过是苹果的轮廓图或切面图,通过它们,我们不 能知道苹果皮下1cm处的营养成分,不能定位糖分含量最 大的区域。 3. 我们面临了四维图难以表征的困难。
伟大的薛定谔方程
h Ze 2 - 2 E 4 0 r 8π μ
2 2
之所以伟大
哦大 家 都 很 有 爱 有爱才有奇迹, 有爱才伟大!
薛定谔方程的含义
h Ze 2 - 2 E 4 0 r 8π μ
2 2
波函数ψ决定了电子在空间的概 率密度分布。 看似简单,实则复杂。这个华丽 丽的方程如何求解呢?
横看成岭侧成峰,即便我们做了这么多努力,其实看到的也 不过是某个侧面的特征, 不能完全表示原子轨道。表征信息量再丰富的苹果,也不及 一个真正可以吃的苹果。
留给大家的问题
1. 本征函数的正交性是由它们的对称性决定的。原子轨 道的正交性你是怎么理解的? 2. 氢原子的巴尔默谱线系的谱线(可见光段)是n=3, 4,5,6的能态跃迁到n=2的能态发出的谱线,而n=3, 4,5,6的轨道都有相应的亚层轨道,也就是说不应该只 是4条分立的谱线,如何解释? 3.多电子原子的薛定谔方程不能变量分离,变分法的处理 手段你能接受吗?线性自轭算符和线性变分法是不是假设 与现实的统一?
