动物脾脏单个核细胞分离液试剂盒使用说明
脾脏单个核细胞的制备

脾脏单个核细胞的制备脾脏单个核细胞的制备: 将5 只小鼠断颈椎处死, 无菌取出脾脏, 分别剪碎, 置200 目无菌尼龙网上, 分次滴入4~ 5 ml RPMI1640 培养液, 轻轻研磨脾脏, 直到脾脏变白;收集细胞悬液( 由于红细胞所占比例很低且对实验影响不大, 故无需作红细胞裂解处理) , 1 000 r/ min( 离心半径17. 5 cm) 离心5 min, 弃上清; 加入2 ml pH7. 4 的PBS, 混匀后1 000 r/ min( 离心半径17. 5 cm) 离心5min, 弃上清; 加入4 ml RPMI1640 培养液, 混匀, 用RPMI1640 培养液稀释200 倍后滴加在细胞计数板上进行细胞计数, 根据计数结果用RPMI1640 将细胞悬液调成2 × 10 / 300 µl 的浓度。
《流式细胞术检测小鼠脾细胞内细胞因子刺激方案的筛选》单细胞悬液的制备:将大鼠颈椎脱位处死后, 置70%乙醇中浸泡5 m in, 无菌取出脾脏和胸腺置于平皿中, 除掉结缔组织, 用生理盐水清洗3次。
加入2 mL RPM I- 1640完全培养液, 用剪刀分别将脾和胸腺剪成1 mm 1 mm 1 mm 碎块后, 用毛玻片轻柔研磨组织碎片, 经8层纱布过滤制成单细胞悬液, 经H anks液离心洗涤后, 将细胞悬浮于含10%小牛血清的RPM I- 1640 培养液。
台盼蓝染色, 计数活细胞在95%以上, 调整细胞数至5×10 cells /L。
《粗江蓠多糖对大鼠淋巴细胞周期的影响》610制备脾细胞悬液脾淋巴细胞的获取:手术刀、解剖剪、解剖镊、止血钳等手术器械,300 目尼龙网等须经消毒处理; 以颈椎脱臼法处死小鼠, 用7 5 % 乙醇浸泡小鼠10-15min 。
沿腹腔中线剪开小鼠胸腔, 取出脾脏置于培养皿中, 剪去脂肪和筋膜组织, 用R PMI-1640培养液漂洗。
粗剪成小块, 用注射器芯轻轻挤压, 加人基础培养液, 混悬, 用300目尼龙网过滤到玻璃离心管中, 再加人基础培养液冲洗网上剩余组织细胞。
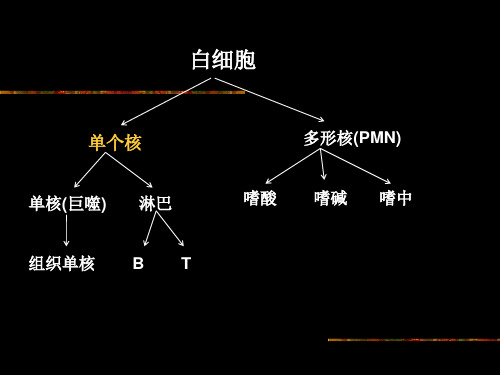
小鼠单个核细胞分离

小鼠单个核细胞分离
第2页
操作步骤:
1. 将2ml小鼠脾脏细胞悬液混匀,然后用 滴管沿盛有2ml淋巴细胞分离液试管壁 轻轻铺于分离液面上。
2. 将该试管置水平式离心机中1800rpm离 心15min。
3. 用滴管小心直接插入白色絮状细胞层, 吸出界面层细胞,移入另一试管中。
小鼠单个核细胞分离
第3页
操作步骤:
小鼠单个核细胞分离
第7页
原理:
依据物理学颗粒沉降原理,不一样密度颗粒在其沉降 运动中可因其比重差异而处于不一样分布位置。利用 此原理可设计一定比重液体界面,将小鼠脾脏中各种 不一样比重细胞经过离心沉降而到达使其彼此分离目 标。
小鼠单个核细胞分离
第1页
原理:
已知小鼠淋巴细胞和单核细胞比重为1.088左右,而 红细胞与粒细胞比重均大于1.088。所以,若用比重 为1.088±0.001分离液则可经过密度梯度离心方法, 在分离液界面上搜集得到脾单个核细胞。
2. 分离时所取离心速度与时间,因各台离 心机离心半径而异,需事先经过预试验 决定。
3. 加入稀释血时应十分小心,注意保护试 管内界面,勿使混同影响分离效果。
4.
小鼠单个核细胞分离
做细胞活力检验时,锥兰染色后应尽快
计数完成,时间过长则细胞活力可能降 低。
第6页
试验结果统计与分析
经过前后两次细胞计数:
取细胞悬液一滴加入等量白细胞稀释液于另一 试管中充分混匀,用计数板在显微镜下计数, 计算出淋巴细胞浓度(个/ml)。
检验细胞活力:取细胞悬液一滴,加入等量锥 兰溶液于另一试管中,充分混匀后马上滴一滴 细胞悬液于载玻片上,在显微镜下计数 100~200个淋巴细胞中着色死细胞数。
五年制免疫实验课 小鼠脾脏单个核细胞分离-新

E花环分离法
(纯化T细胞)
T细胞表面的CD2分子-绵羊红细胞受体(E受体)
尼龙纤维分离法
B细胞和单核细 胞具有易粘附特性, 将淋巴细胞悬液加 到尼龙纤维上, 37℃作用1-2小时 后,洗脱的为非粘 附性T细胞。
PBMC
B细胞 单核细胞
尼龙纤维 毛柱
T细胞
流式细胞术
(Flow Cytometry,FCM)
一 、 T细 胞 增 殖 试 验
1. 形态学检查
T细胞增殖试验 原毒的行正理刺分常素激裂:)人后的T、转细能淋非化胞转巴率特体化为母异(外为细7性形0受体%胞有态特积左,丝学异较右以分示性大。此裂意抗、测原原图代定(物)谢T如质细旺P(胞盛HA的如、、功细且C能菌能on类进。A) 4P8H~A72刺小激时
NOTE:尽量少吸分层液;
6、每管加 PBS 到1ml,重悬细胞,3000转离心5分钟。
7、计数:吸弃上清,用100ml PBS重悬细胞,取出20ml加入新 的EP管中,再加入20ml细胞计数液,混匀后取出10ml,加到 计数板内,显微镜下计数。
细胞计数方法
4
查出四个大方格的总细胞数(X) 算出每个大方格的平均细胞数:Y=X/4 每个大方格的体积为V=1mm×1mm×0.1mm=0.1mm3=10-4ml 制备的细胞悬液的细胞浓度(/ml)=Y×104×稀释倍数
2.
3 H-TdR掺 入 法 T细胞增殖试验 原激胞养腺DD淋素NN活巴经进理液嘧AAβ后入细:中中啶的,胞-S淋加,液核原期进对巴入根体苷,料入刺细据闪3H细(被(细激T胞同烁标胞d摄胞物3位仪被RH记合入)周的素检-有,的T成期应细掺测d丝则DDR进答入胞。N分N掺3H行水A细A,裂入合-明有平胞T原掺法成d显丝。的RC入)原分掺增量o新n作料加裂入则A合为或脱,的,可成合P当同在氧推H细位的培成测胸A
小鼠脾脏单个核细胞分离
-
特异性 敏感性
优点
缺点
细胞生物 低 学方法 免疫学方 高 法
分子生物 高 学方法
高
可确定活 性
易操作, 可大量检 测 既可定量 又可定位
繁琐费时 不能确定是 否有活性
不能反映浓 度和活性
较高
高
小鼠脾单个核细胞的分离—密度梯度离心法
原理 根据物理学中颗粒沉降原理,不同密度的物质颗 粒在其沉降运动中可因其比重的差别而处于不同 的分布位置。利用此原理可设计一定密度的液体 界面,将各种不同密度的细胞通过离心沉降而达 到使其彼此分离的目的。已知小鼠淋巴细胞和单 核细胞的密度大约在1.088之间,而红细胞与粒细 胞 的 密 度 均 大 于 1.088 。 因 此 , 若 用 密 度 为 1.088±0.001 的分离液则可通过密度梯度离心方 法,在分离液界面上收集单个核细胞。
T:表达CD2(SRBC受体) B:不表达CD2
免疫细胞功能检测
淋巴细胞转化试验
细胞毒试验
细胞因子检测 溶血空斑实验
T
PHA, ConA,PWM
或Ag
形态学观察Lc 与淋巴母细胞 的比值
3H-TdR掺入法测cpm值
细胞因子检测
细胞生物学方法: CK细胞敏感株
密度梯度离心法
聚蔗糖—泛影葡胺 Ficoll-Hypaque: 1.088±0.001
LC, M :1.088 RBC, 粒细胞:>1.092
在1ml小鼠脾脏细胞悬液混匀,然后用滴管沿盛有 2ml淋巴 细胞分离液的试管壁轻轻铺于分离液面上。 将该试管置水平式离心机中离心(1800rpm)15分钟。 用滴管小心地直接插入白色絮状的细胞层(含单个核细 胞),吸出界面层细胞,移入另一试管内。 在该细胞收集管内加入生理盐水,用滴管轻轻上下冲洗混 匀,然后在离心(1000rpm)10分钟,弃去上清液,将沉 淀细胞充分摇匀,再用生理盐水离心洗涤1次。 用0.3ml生理盐水(约6滴)将沉淀细胞稀释,摇匀。 取细胞悬液一滴加入等量白细胞稀释液于另一试管中充分 混匀,用计数板在显微镜下计数,计算单个核细胞浓度 (个/ml)。 检查细胞活力:取细胞悬液一滴加入等量锥兰溶液于另一 试管中充分混匀,用载玻片在显微镜下计数100~200个单 个核细胞中着色的死细胞数
复旦大学免疫实验小鼠脾脏单个核细胞分离及细胞计数

小鼠脾脏单个核细胞分离及细胞计数实验时间:实验地点:实验人:1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70%乙醇4)PBS缓冲液、红细胞裂解液(ACK)5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏●将小鼠颈椎脱位处死,用酒精消毒。
●用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液●将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
●吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min,弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
●弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324×104×10=3.24×107/ml3.4计算细胞活力在总计为324个细胞中计数,死亡细胞有16个,计算细胞活力为:324-16/324×100%=95.1%在理论范围之内4实验结果4.1研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
实验中,我们发现尼龙指套不能滤去所有结缔组织,操作中会有结为絮状团块的结缔组织。
4 脾脏单个核细胞分离及流式细胞术染色(1)(1)

• 3.急性大失血法:用粗针头一次采取大量心脏血液,可使动物致死。 • 4.吸入麻醉致死法:应用乙醚吸入麻醉的方法处死。大、小鼠在20~30秒
3.清洗:加500ulPBS,吹打混匀后, 5000rpm, 4℃,5min
4.检测:小心用枪去除上清,再加入500ul PBS吹打混匀,置于冰上, 流式细胞仪检测
CD3: T cell CD4+ T cell; CD8+ T cell
补充知识
通常分离细胞是为了下一步实验。有些实验如需要对细 胞作进一步培养,则在分离细胞时一定要严格无菌操作。
在用ACK破坏红细胞时,不要时间过长,以免破坏其他 细胞。
计数完毕后请立即清洗细胞计数板!
思考题
1.实验过程中注意问题有哪些?
实验小鼠处死方法
• 1.颈椎脱臼法:是大、小鼠最常用的处死方法。用拇指和食指用力往下按住 鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱日,造成脊髓 与脑髓断离,动物立即死亡。
实验四
小鼠脾脏单个核细胞分离及 流式细胞术染色
钱国军 邹本坤 2016-03-31
解剖图
小鼠脾脏位于上腹部左后侧, 体积较大,长条形,属于外 周免疫器官。外周血中淋巴 细胞可经再循环驻入脾脏等 外周免疫器官的特定区域, 所以富含各类免疫细胞。
实验原理
细胞计数
3mm
W1
W2
W3
4 脾脏单个核细胞分离及流式细胞术染色(1)

lived dead
实验材料:
小鼠 手术器械(剪刀、镊子)、酒精喷壶 平皿,尼龙膜指套、研磨棒
PBS缓冲液、红细胞裂解液(ACK)
细胞计数板 0.2%台盼蓝染液 显微镜(关掉之前,请把光度调到最小!!)
实验步骤
(一)取小鼠脾脏:
小鼠颈椎脱位处死(注意安全); 用75%酒精喷小鼠腹部,使其皮毛沾湿。用剪刀,剪开皮肤 暴露腹腔,再找到脾脏,劲量剪除脾脏周围组织;
• • • •
实验小鼠处死方法
• 1.颈椎脱臼法:是大、小鼠最常用的处死方法。用拇指和食指用力往下按住 鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱日,造成脊髓 与脑髓断离,动物立即死亡。
注意: 细胞总数和细胞活力可以一起做 细胞总数=视野内活细胞数+死细胞数 细胞活力=活细胞数/总数x100%
1.颈椎脱臼处死小鼠:用拇指和食指用力往下按住鼠头,另一只手抓住 鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离 2.摘取脾脏:用75%酒精喷小鼠腹部,使其皮毛沾湿。用剪刀,剪开皮 肤暴露腹腔,再找到脾脏,尽量剪除脾脏周围组织 3.研磨脾脏:在培养皿中加入3mlPBS,将脾脏放入过滤网制成的指套中, 再放入培养皿中,用注射器的活塞棒或研棒将脾脏研碎。将含有脾脏细 胞的PBS移入15ml离心管。再取3mlPBS冲洗培养皿后移入15ml离心管。
(三)计算细胞浓度
将上述细胞悬液做一定倍数(10倍左右)的稀释(小鼠脾 脏细胞一般为1x107-2x108); 混匀稀释后,取10uL加至细胞计数板中(不要有气泡),计 数细胞计数板中4大方格细胞总数; 计算细胞总数:
细胞浓度=4个大方格细胞总数/4*104*稀释倍数。
细胞总数=细胞浓度x细胞悬液的体积
复旦大学免疫实验小鼠脾脏单个核细胞分离及细胞计数

小鼠脾脏单个核细胞分离及细胞计数实验时间:实验地点:实验人:1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70%乙醇4)PBS缓冲液、红细胞裂解液(ACK)5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏●将小鼠颈椎脱位处死,用酒精消毒。
●用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液●将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
●吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min,弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
●弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324×104×10=3.24×107/ml3.4计算细胞活力在总计为324个细胞中计数,死亡细胞有16个,计算细胞活力为:324-16/324×100%=95.1%在理论范围之内4实验结果4.1研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
实验中,我们发现尼龙指套不能滤去所有结缔组织,操作中会有结为絮状团块的结缔组织。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
动物脾脏单个核细胞分离液试剂盒使用说明
规格:3×200mL/kit
保存:动物脾脏单个核细胞分离液试剂盒对光敏感,应该室温避光储存,保质期2年。
无菌开封后,保存于室温。
组成:
各种动物脾脏单个核细胞分离液200mL
全血及组织稀释液200mL
细胞洗涤液200mL
单个核细胞分离方法
1.制备脾脏的单细胞悬液。
2.取一支适当的离心管,加入与脾脏单细胞悬液等量的分离液(分离液最少不得少于3mL,
总体积不能超过离心管的三分之二,否则会影响分离效果)。
3.小心吸取单细胞悬液加于分离液液面上,注意保持两液面界面清晰。
(可以使用巴氏德
吸管吸取单细胞悬液,然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。
)
4.室温,500~900g,离心20~30min。
(根据脾脏单细胞悬液的量确定离心条件,单细胞悬
液量越大,离心力越大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离效果)。
5.离心后,此时离心管中由上至下细胞分四层。
第一层为稀释液层;第二层为环状乳白色
单个核细胞层;第三层为透明分离液层;第四层为红细胞层。
6.用吸管小心吸取第二层环状乳白色单个核细胞层至另一洁净的15mL离心管中,向离心管
中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离心10min。
7.弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。
8.重复步骤7
9.弃上清,细胞重悬备用。
分层示意图
脾脏单细胞悬液的制备方法
脾脏研磨的方法:
1.无菌条件下摘取脾脏,撕去脾脏被膜,用眼科剪将脾脏剪成小块。
2.将尼龙筛网或者是细胞过滤筛放置于平皿上,加入少量全血及组织稀释液(保证脾脏及
获得的细胞处于液体环境中)。
3.将脾脏放置于筛网上,使用注射器活塞或者是无菌镊子来研磨脾脏(尽量控制研磨力度,
保持筛网悬空,避免在皿底上直接研磨而造成大批细胞死亡)
4.研磨完全后使用全血及组织稀释液冲洗筛网,收集细胞悬液,再经滤网过滤。
注:
A.可用酶消化法,使用胶原酶对脾脏组织进行消化,得到单细胞悬液。
B.如果最终得到的细胞需要培养,那全过程所需试剂与器材均要求无菌。
C.根据脾脏的体积控制单细胞悬液的浓度在108~109个/mL。
注意事项:
A.开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,
避免微生物污染。
B.分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。
4℃
或者是温度较低的条件下离心,可能会导致白膜层中红细胞污染加重。
C.待分离的组织要求新鲜,避免冷冻和冷藏。
D.部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁影响分离效果。
E.如果要进一步对分离的细胞进行培养,那在制备单细胞悬液和分离过程中,注意无菌操
作,避免微生物污染。
参考文献:
1.Boyum A.Separation of leucocytes from blood and bone marrow.Scand J Clin Lab
Invest Suppl.1968;97:7.
2.Ting A,Morris PJ.A technique for lymphocyte preparation from stored
heparinized blood.Vox Sang.1971Jun;20(6):561-3.
3.Boyum A.Separation of Blood Leucocytes,Granulocytes and Lymphocytes Tissue
Antigens.1974;4(4):269-74.
4.Weisbart RH,Webb WF,Bluestone R,Goldberg LS.
A simplified method for lymphocyte separation.Vox Sang.1972;23(5):
478-80.
相关试剂:
200目细胞过滤筛YA0949
200目尼龙筛网YA0961
全血及组织稀释液R1017
一次性巴氏德吸管YA0902
细胞洗涤液R1018
各种其他动物及其他细胞的分离液及试剂盒。
