淋巴细胞分离的实验方法
外周血淋巴细胞分离方法

实验 18 外周血淋巴细胞分离方法目的了解密度梯度离心法分离淋巴细胞的原理及其操作过程。
原理淋巴细胞分离掖是由60%的聚蔗糖2份和34%的泛影葡胺1份混合制成。
它具有分子量大、无化学活性、20℃时比重为1.077士0.001的特性。
血液中各种细胞的比重不同,淋巴细胞与单核细胞的比重约为1.070,而粒细胞和红细胞的比重为1.092左右。
将血液加至分离液上,通过离心,可使一定比重的细胞按相应密度梯度进行分布,从而将淋巴细胞与其它血细胞分离开。
材料1. 淋巴细胞分离液(比重1.077土0.001)。
2. 肝素。
3. 无Ca2+、Mg2+的Hanks溶液,pH7.2~7.6。
4. RPMI-1640培养液(含10%小牛血清)。
5. 其它:注射器、吸管、滴管(均为无菌),血球计数板,水平离心机,显微镜等。
方法1. 无菌抽取静脉血2ml,去掉针头注人含有肝素的无菌试管中摇匀,加入2ml Hanks溶液进行对倍稀释,混匀。
2. 用吸管吸取稀释血液沿试管壁缓缓加到含有2ml淋巴细胞分离液的试管中(血液:Hanks液:淋巴细胞分离液的比例为1:1:1),沿管壁流下的稀释血液叠加在分离液之上,并与分离液形成明显的界面。
3. 经水平式离心2000r/min×20min,小心取出试管。
4. 用平口吸管小心吸取中层呈白色雾状的淋巴细胞层,用Hanks溶液洗涤两次,每次离心1500r/min ×10min。
5. 弃上清,加RPMI-1640培养液1ml混匀,取少许进行细胞计数及活力测定。
(1)细胞计数: 取1滴细胞悬液置血球计数板上,静置片刻,显微镜下计数四角四个大方格内的细胞数(见图15),按下列公式计算出细胞总数。
四个大方格细胞总数×稀释倍数×细胞悬液毫升数×104细胞总数= 4(2)台盼蓝拒染法测定细胞活力: 取4份0.2%台盼蓝与1份4.25%生理盐水混合,将台盼蓝生理盐水溶液与细胞悬液等量混合,在3分钟之内压片,在光学显微镜下计数未染色的细胞(为活细胞)与染色细胞(染成兰色,为死细胞),计算活细胞占细胞总数的百分数。
详细的淋巴细胞的分离、计数图文教程

<交界液面:一定不要打乱 >
离心 〔200lt;1000rpm,5min> 重复2次
血浆
分层液 红细胞 粒细胞
淋巴细胞与 单核细胞层
用Hank’s液重悬细胞 取10ul细胞悬液与90ul白细胞 计数液或台盼兰计数液混合
取10ul于细胞计数板上
细胞计数
细胞计数
本实验:淋巴细胞
实验方案
抽取外周血 分离淋巴细胞 细胞计数
实验材料
1. 肝素抗凝血 2. Hank’s液 3. 淋巴细胞分离液 4. 水平离心机 5. 显微镜 6. 细胞计数板
实验步骤
肝素抗凝静脉血1.5ml 加1.5mlHank’s液稀释
置于2ml淋巴细胞分离液上
稀释后的 抗凝血
淋巴细胞 分离液
数上不数下,数左不数右.
细胞计数板
实验结果
细胞数量:
单个核细胞浓度〔细胞数/ml>
= 2个大方格内细胞总数
×104×10 <稀释倍数
2
细胞活力检测:〔死细胞被染成蓝色,活细胞不着色
活细胞数
活细胞百分率 =
细胞总数
× 100%
密度梯度离心法分离外周血单个核细胞:
纯度在90%以上 淋巴细胞约占90-95% 细胞收获率可达80-90% 活细胞百分率在95%以上
注意事项
稀释的肝素抗凝血,沿管壁轻轻叠加于分离液上, 使两者形成一个清晰地界面.
细胞经离心分层后,缓慢小心吸取,切勿打破形成 的细胞层.
细胞计数的仪器
血细胞分析仪,临床常用
装有自动显微镜观察系统
自动细胞计数仪
知识回顾 Knowledge Review
T淋巴细胞的分离、计数
XX医学院免疫学教研室
淋巴细胞的分离及鉴定

淋巴细胞的分离及鉴定离⼼分离技术与淋巴细胞分离及鉴定【实验⽬的】1.了解离⼼分离技术的原理与分类。
2.掌握应⽤密度梯度离⼼法分离单个核细胞及B淋巴细胞鉴定的⽅法。
【实验原理】1.利⽤离⼼⼒将悬浮液中的悬浮微粒快速沉降,借以分离⽐重不同的各种物质成分。
因此⽤⽐重与被分离细胞⽐重相近的细胞分离液则可通过密度梯度离⼼⽅法,在分离液界⾯上收集到所需要的单个核细胞。
2.⽤过氧化物酶标记的抗IgM,在⼀定条件下与淋巴细胞混合,标记的抗IgM抗体可以与B细胞表⾯的IgM结合,通过DAB显⾊,在普通光学显微镜下观察可见细胞膜上出现特定染⾊。
【实验步骤】⼀.细胞分离1.将⼩⿏⽤颈椎脱⾅法处死,解剖左侧腹腔靠上部位,将腹膜剪开,找到并取出脾脏。
2.将脾脏置于培养⽫内100⽬筛⽹上,加⼊8ml的⽣理盐⽔,⽤磨棒磨碎脾脏后过滤,即获得脾细胞混合悬液。
3.1500rpm,5min,离⼼细胞混合悬液,弃部分上清,调整体积⾄4ml,重悬细胞。
4.取盛有3ml细胞离⼼液(⽐重1.088)的试管⼀⽀,⽤移液器加⼊细胞混合液4ml。
5.将试管离⼼1800rpm,(上升和下降率为2)20℃30min。
6.离⼼后取出试管,观察细胞分层,底层为红⾊的红细胞,依次向上为细胞分离液和⽣理盐⽔,在此之间可见⼀层淡淡地⽩⾊细胞层。
7.⽤尖吸管⼩⼼取出中层间的细胞到另⼀洁净离⼼管,并加2ml PBS洗涤⼀次,1500rpm离⼼5min后去上清。
8.再将细胞均匀悬浮于0.1ml PBS中,取出10µl滴于黏附剂处理的载玻⽚上,⾃然⼲燥后,可进⾏细胞类型鉴定。
⼆.细胞鉴定1.分离出单个核细胞并取出10µl滴于黏附剂处理的载玻⽚左右各⼀滴涂⽚,⾃然⼲⽚2.在室温条件下,⽤甲醇固定细胞,⾃然⼲燥后⽤蜡笔标出细胞范围,蒸馏⽔洗三次。
3.配制封闭液。
室温浸泡30分钟,PBS洗3次。
4.滴加适当稀释(1:100)的过氧化物酶标记的兔抗⼩⿏IgM抗体于左侧涂⽚,滴加适量的封闭液于右侧涂⽚(做阴性对照),于37℃30分钟,PBS洗2分钟3次。
淋巴细胞提取
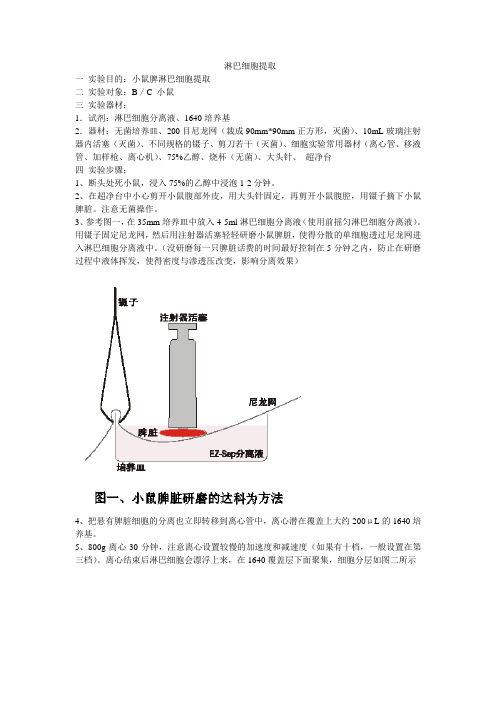
淋巴细胞提取一实验目的:小鼠脾淋巴细胞提取二实验对象:B/C 小鼠三实验器材:1.试剂:淋巴细胞分离液、1640培养基2.器材:无菌培养皿、200目尼龙网(裁成90mm*90mm正方形,灭菌)、10mL玻璃注射器内活塞(灭菌)、不同规格的镊子、剪刀若干(灭菌)、细胞实验常用器材(离心管、移液管、加样枪、离心机)、75%乙醇、烧杯(无菌)、大头针、超净台四实验步骤:1、断头处死小鼠,浸入75%的乙醇中浸泡1-2分钟。
2、在超净台中小心剪开小鼠腹部外皮,用大头针固定,再剪开小鼠腹腔,用镊子摘下小鼠脾脏。
注意无菌操作。
3、参考图一,在35mm培养皿中放入4-5ml淋巴细胞分离液(使用前摇匀淋巴细胞分离液)。
用镊子固定尼龙网,然后用注射器活塞轻轻研磨小鼠脾脏,使得分散的单细胞透过尼龙网进入淋巴细胞分离液中。
(没研磨每一只脾脏话费的时间最好控制在5分钟之内,防止在研磨过程中液体挥发,使得密度与渗透压改变,影响分离效果)4、把悬有脾脏细胞的分离也立即转移到离心管中,离心潜在覆盖上大约200μL的1640培养基。
5、800g离心30分钟,注意离心设置较慢的加速度和减速度(如果有十档,一般设置在第三档)。
离心结束后淋巴细胞会漂浮上来,在1640覆盖层下面聚集,细胞分层如图二所示6、析出淋巴细胞层,再加入10mL1640培养基,250g离心10分钟。
倾倒上清液,加入3-5mL Lympho-SpotTM无血清培养基重悬,细胞计数。
五、注意事项:①离心前在细胞悬液上面加盖一层1640培养基,既有利于漂浮上来的淋巴细胞的聚集,又有利于下一步的吸取操作。
覆盖层不必太厚,2Μl足矣。
②如果实验者一次实验要处理很多只小鼠,需要注意两点:其一,每研磨一只小鼠,立即把脾细胞悬液从培养皿转入离心管中,注意盖严管盖,切不可敞口放在超净台中。
否则,液体挥发,密度与渗透压都会改变,严重影响分离效果。
其二,在所有的小鼠脾脏处理完后,统一再加1640覆盖层。
淋巴细胞的分离方法[整理]
![淋巴细胞的分离方法[整理]](https://img.taocdn.com/s3/m/c6b23f1f773231126edb6f1aff00bed5b9f373c2.png)
1、淋巴细胞的来源:人淋巴细胞的方便来源是外周血分离的原则是收率较高、纯度较好、失活较低。
根据不同试验有相对纯度,无论采用哪种方法,应尽最大可能保持细胞应有活性。
分离的技术可由细胞的物理性状和表面标志设计,根据不同实验目的可采用密度梯度离心法、吸附分离法和其它特殊分离法。
2、密度梯度离心法:外周血各种血细胞的密度不尽相同,利用淋巴细胞分层液(Ficoll)作密度梯度离心,使一定比重的细胞群按相应密度梯度分布,从而将各种血细胞加以分离。
为此利用一种密度介于1.075~1.092之间而近于等渗的溶液(分层液)做密度梯度离心,使一定密度的细胞按相应密度梯度分布,从而将各种血细胞加以分离。
常用的分层液有Ficoll和Percoll两种。
3、实验方法:1.采血,稀释(外周血:稀释液=1:2)2.在离心管中加入Ficoll,沿倾斜的管壁缓缓加入稀释的外周血(Ficoll:稀释血=1:2)3、20℃,1500r/min,离心30min从上一次至下稀释的血浆、血小板PBMCFicoll红细胞、粒细胞4.沿管壁周缘轻轻吸取PBMC层移入另一试管中。
5.加足量稀释液充分洗涤,1800 r/min离心10min ,弃上清。
6.重复洗涤一次,1400r/min离心10min,弃上清。
7.适量的培养基重悬细胞,计数。
分离单个核细胞纯度为95%淋巴细胞约占90%~95%4、淋巴细胞高纯度化(一)红细胞的去除一般采用无菌蒸馏水低渗裂解法或0.83%氯化铵处理法。
(二)血小板的去除将PBMC悬液通过离心洗涤2~3次,常可去除PBMC中绝大部分混杂的血小板。
在某些疾病状态下,若外周血中血小板数量异常增多,可采用胎牛血清(FCS)梯度离心法去除PBMC中混杂的血小板。
(三)单核细胞和粒细胞的去除1.粘附去除法原理:单核细胞和粒细胞在37℃和Ca离子存在条件下能主动粘附在玻璃、塑料、尼龙毛、棉花纤维或葡聚糖凝胶。
采集的非粘附细胞即为淋巴细胞。
脾脏分离淋巴细胞

从小鼠脾脏中分离淋巴细胞
方法一:
1用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液。
2另取无菌试管,先加入淋巴细胞分离液,然后将试管倾斜,略放平,吸取刚刚制备的细胞悬液缓慢的加入试管中,一般分离液和细胞悬液的体积比为1:2,要轻要慢,不要冲破了淋巴细胞分离液和细胞悬液的界面。
室温水平离心2000转/分钟,30分钟。
3离心后取出试管,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。
吸走上层非细胞层弃之,吸出单个核层在另外无菌试管中,因为淋巴细胞分离液对细胞有毒性作用,加入PBS离心洗两遍(1000转/分钟,10分钟)。
4倾倒上清,用RPMI-1640重悬细胞。
方法二:
用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液,2000r/min离心3min,弃上清。
加红细胞裂解液8mL,混匀脾细胞,静置5-6min,待红细胞完全破碎,2000r/min离心3min,弃上清去除红细胞,Hank’s液洗1-2遍,用RPMI-1640(含10%胎牛血清)重悬细胞。
临床分离外周血淋巴细胞的意义
临床分离外周血淋巴细胞的意义一、前言淋巴细胞是免疫系统中的重要组成部分,它们在人体内起着非常重要的作用。
外周血淋巴细胞是指存在于人体血液中的淋巴细胞,它们可以通过临床分离技术来获取。
那么,临床分离外周血淋巴细胞对于医学研究和诊断有什么意义呢?二、临床分离外周血淋巴细胞的方法1. 离心法:将外周血样本加入到抗凝剂管中,静置一段时间后进行离心,将上清液中的白细胞取出并进行淋巴细胞分离。
2. 密度梯度法:将外周血样本加入到密度梯度液中,经过离心后不同密度层次中的白细胞会沉积到不同位置,从而实现淋巴细胞的分离。
3. 磁珠法:利用表面标记了特定抗原或抗体的磁珠来捕获目标淋巴细胞,并通过磁场进行分离。
三、临床分离外周血淋巴细胞的意义1. 免疫功能评估:通过分离外周血淋巴细胞,可以对人体免疫系统进行全面的评估。
例如,可以通过检测T细胞、B细胞和NK细胞等淋巴细胞亚群的数量和功能来判断人体免疫系统的状态是否正常。
2. 疾病诊断:外周血淋巴细胞可以为许多疾病的诊断提供非常重要的信息。
例如,白血病患者的外周血中会存在异常增生或恶性增殖的淋巴细胞;自身免疫性疾病患者则可能存在特定淋巴细胞亚群数量异常等情况。
3. 新药开发:临床分离外周血淋巴细胞也可以为新药开发提供帮助。
例如,在肿瘤治疗中,新药对于肿瘤特定亚群T细胞的影响需要在体外进行测试,而这就需要先将外周血中的T细胞分离出来。
4. 科学研究:临床分离外周血淋巴细胞也是科学研究的重要手段。
例如,在研究淋巴细胞分化、功能和相互作用等方面,需要大量的淋巴细胞样本。
四、临床分离外周血淋巴细胞的注意事项1. 操作规范:临床分离外周血淋巴细胞需要遵循一定的操作规范,以确保样本质量和准确性。
2. 样本保存:外周血样本在采集后应尽快进行处理,以免影响淋巴细胞的数量和功能。
如果无法立即处理,可以将样本冷藏保存。
3. 检测方法:不同检测方法对于淋巴细胞的数量和功能有不同的要求,因此在选择检测方法时需要考虑到具体应用场景。
淋巴细胞分离.
淋巴细胞分离与计数淋巴细胞分离原理:外周血各种血细胞的密度不尽相同,利用淋巴细胞分层液(Ficoll)作密度梯度离心,使一定比重的细胞群按相应密度梯度分布,从而将各种血细胞加以分离。
实验材料:淋巴细胞分离液肝素稀释液(生理盐水)RPMI1640粉末实验设备:1ml移液器、移液管、 5ml注射器、刻度吸管、EP管、离心机、显微镜操作流程:1. 在离心管中加入适量淋巴细胞分离液。
2. 无菌采集静脉血若干毫升,注入盛有肝素的无菌小瓶中,(每1ml全血加0.1ml 125-250U/ml肝素溶液),加盖后立即轻轻摇匀,使血液抗凝3. 稀释(外周血:稀释液=1:2 取肝素抗凝血与等量生理盐水充分混匀)4. 用刻度吸管沿倾斜的管壁,把稀释血缓慢叠加于分层液面上,注意保持清楚的界面(Ficoll:稀释血=1:2)5. 放入离心机1500r/min 离心20min(注:缓慢加速1-4档个3分钟)6. 用吸管插到云雾层,吸取单个核细胞。
置入另一离心管中,加入5倍以上体积的稀释液(生理盐水),1500rpm×10分钟离心,洗涤细胞。
7. 重复洗涤一次,1500rpm×10分钟离心。
8. 末次离心后,弃上清,加入含有10%小牛血清的RPMI1640,重悬细胞9. 计数细胞后再调整细胞置所需浓度.10. 取一滴细胞悬液与一滴0.2%台盼兰染液混合,于血球计数板上,计数四个大方格内的细胞总数。
单个核细胞浓度(细胞数/1毫升细胞悬液)=4个大方格内细胞总数────────── × 104×2(稀释倍数)411. 分离出的淋巴细胞置于培养瓶中二氧化碳培养箱培养。
注意事项:1. 每毫升外周血液大约可获1×106单个核细胞2. Ficoll应适量,外周血应充分稀释3. 温度直接影响到Ficoll的比重和分离效果4. 在Ficoll上加入稀释外周血时,应缓慢加,以免冲散界面5. 吸取单个核细胞层时,应避免吸出过多的上清液或分层液而导致血小板污染淋巴细胞计数:实验流程:1. 准备计数板:2. 制备细胞悬液:收集细胞,制成单个细胞悬液3. 加样:用吸管轻轻吹打细胞悬液,取少许细胞悬液,在计数板上盖玻片的一侧加微量细胞悬液,4. 计数:在显微镜下,用10×物镜观察计数板四角大方格中的细胞数5. 计算:将结果代入下式,得出细胞密度胞数/毫升原=(4大格细胞数之和/4)×104注意事项:1. 取样计数前,应充分混匀细胞悬液2. 加样量不要溢出盖玻片,也不要过少或带气泡3. 细胞压中线时,数上不数下,数左不数右4. 本法要求细胞密度不低于104细胞/ml5. 镜下计数时,细胞数过少或过多,说明稀释不当,需重新制备细胞悬液、计数。
淋巴细胞分离实验报告
淋巴细胞分离实验报告淋巴细胞分离实验报告引言:淋巴细胞是免疫系统中的重要组成部分,具有免疫应答和免疫调节的功能。
淋巴细胞分离实验是研究淋巴细胞功能的重要手段之一。
本实验旨在通过离心法和梯度离心法分离和纯化淋巴细胞,并验证其纯度和活力。
实验材料:- 血液样本- PBS缓冲液- 淋巴细胞分离液- Ficoll梯度离心液- 离心管- 移液管- 显微镜- 细胞计数板- 无菌培养皿- 37℃恒温培养箱实验步骤:1. 血液预处理:将新鲜的血液样本加入无菌离心管中,加入等体积的PBS缓冲液,轻轻混合。
注意避免气泡的产生。
2. 离心分层:将离心管放入离心机中,以2000rpm的速度离心10分钟。
离心后,可观察到血液分为三个层次:上层为血浆,中层为白细胞和淋巴细胞,下层为红细胞。
3. 分离淋巴细胞:将中间层的白细胞和淋巴细胞转移至新的离心管中,加入等体积的PBS缓冲液。
轻轻混合后,以1000rpm的速度离心10分钟。
此步骤的目的是去除红细胞和血浆。
4. 梯度离心:将混合后的细胞悬液加入离心管中,并缓慢滴加Ficoll梯度离心液。
注意避免两种液体混合。
离心管中的液体应该形成明显的两层。
5. 离心分层:将离心管放入离心机中,以1500rpm的速度离心30分钟。
离心后,可观察到淋巴细胞在上层梯度液中形成一个白色的浑浊环。
6. 分离淋巴细胞:使用移液管将上层梯度液中的淋巴细胞转移至新的离心管中。
加入等体积的PBS缓冲液,轻轻混合。
以1000rpm的速度离心10分钟,去除梯度液。
7. 洗涤淋巴细胞:将淋巴细胞沉淀用PBS缓冲液洗涤三次,以去除梯度液和离心液中的残留物。
8. 细胞计数和活力检测:取适量的淋巴细胞悬液,用细胞计数板进行细胞计数,并观察细胞形态。
同时,使用显微镜观察细胞的活力和完整性。
结果与讨论:通过以上实验步骤,我们成功地分离和纯化了淋巴细胞。
在离心分层和梯度离心的过程中,红细胞和血浆被有效地去除,从而得到了较为纯净的淋巴细胞。
小鼠淋巴细胞的分离培养
小鼠淋巴细胞的分离培养
一、血液中淋巴细胞的分离:
1在1.5ML离心管中加入淋巴细胞分离液0.7ML;
2眼部采集小鼠的抗凝血,抗凝剂20%.。
3轻轻将血液加入淋巴细胞分离液的表面,立即以2000—2500转/分离心10MIN。
4小心吸取上层细胞,转移至另一1.5ML离心管中,再用HANK’S 悬浮至1.5ML,再离心,去上清,再悬浮,等待分型用。
二、鼠脾脏中淋巴细胞的分离:
1无菌采集鼠的脾脏,且灭菌注射器的弯针头轻轻扎取,尽可能使单个细胞分离,再分别用4层灭菌纱布过滤2次。
2将滤液小心加入淋巴细胞分离液中。
离心。
3 吸取上层淋巴细胞,HANK‘S液洗涤2次(尽可能去除淋巴
细胞分离液)。
4加入1640培养液进行培养。
、
*淋巴细胞分离液不低于全部液体的50%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肝脏免疫学实验室淋巴细胞分离技术
肝脏淋巴细胞分离
1.小鼠摘眼球放血后,剪开颈动脉处死,摘取肝脏。
2.将肝脏放在200目钢丝网上自边缘开始研磨,转至15ml离心管中。
3.650rpm×1min离心,将上层液体转至15ml离心管中。
4.1500prm×5min离心后弃上清,重复洗两次。
5.6ml 40% Percoll 溶液重悬沉淀,将3ml 70% Percoll溶液加于其底层,2000rpm×20min,升6降2。
6.吸取两层Percoll溶液之间的白细胞层至15ml离心管中,加满PBS后2000rpm×5min 离心收集细胞。
7.1ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
脾脏淋巴细胞分离
1.小鼠摘眼球放血后剪开颈动脉处死,摘取脾脏。
2.用载玻片的粗糙面将脾脏一点一点磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.8ml PBS重悬细胞沉淀,在底层加入3ml Ficoll , 2000rpm×20min,升6降2。
4.吸取两层溶液之间的白细胞层至15ml离心管,加满PBS后2000rpm×5min离心收集细胞。
5.6-8 ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
胸腺淋巴细胞分离
1.小鼠摘眼球放血后,剪开颈动脉处死,摘取胸腺。
2.将胸腺放在200目钢丝网上研磨,将收集的研磨悬液通过尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.6-8ml PBS 重悬细胞沉淀,再次通过200目尼龙网过滤后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
淋巴结淋巴细胞分离
1.小鼠摘眼球放血后脱臼处死,摘取淋巴结。
2.用载玻片的粗糙面将淋巴结磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml 离心管中,1500rpm×5min离心收集细胞。
3.6-8ml PBS (按照细胞团的大小凭经验确定)重悬细胞沉淀,通过200目尼龙网过滤后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
骨髓淋巴细胞分离
1.小鼠摘眼球放血后,剪开颈动脉处死。
2.将脚踝处皮肤剪开至大腿根部,暴露腿部肌肉,清理肌肉后将腿骨从大腿关节和脚踝处剪断,用纱布捏住腿骨,脚踝一端向上,剔除肌肉和软骨,将两段腿骨分开。
3.用注射器将骨髓从腿骨较粗一头吹打出,将液体通过尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
4.8ml PBS重悬细胞沉淀,在底层加入3ml Ficoll, 2000rpm×20min,升6降2。
5.吸取两层溶液之间的白细胞层至15ml离心管中,加满PBS后1260g×5min离心收集细胞。
6.1ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
第一版补充说明:
✧这里的离心速度做了一些修改:本来700rpm 应该对应99g,这里改为100g;本来
2000rpm对应805g,这里下调到800g,这可以根据后来的需要修改;2500rpm一律对应为1260g。
✧实验室的离心机型号为Eppendorf 5810R,离心程序说明:
2 800g 5min ~ ~
3 1260g 20min ↗6 ↘2
4 1260g 5min ~ ~
✧Percoll原液(9V)加10×PBS(1V)配制为Percoll贮存液(Stock Percoll)
70% 3 7
第二版补充说明:
✧这里的离心速度做了一些修改:这里的离心速度做了较大的修改,红色标注
✧
✧实验中离心程序的改变致力于解决肝脏细胞总是分离不到106 的量级,选择小的离心速
度取得了不错的效果。
✧离心机的编程Programming:
Storing a fixed program (only possible when the device is at a standstill):
It is possible to save a maximum of 35 fixed programs (1...9, A...Z)..
Enter the program data to be used first by pressing the parameter keys and the arrow keys or use the data from the last run. The "at set rpm" functions and the set deceleration ramp can also be saved in a program if necessary.
Press the key PROG twice ➔the first free program no., indicated
by "P...", appears in the display and flashes.
Use ↑ OR ↓to select the desired free program number (1...9, A...Z)
can be selected.
Hold down the key PROG for two seconds until OK appears in the display. The previously set parameters of Temp., Speed, Time, etc.
are now saved as a data set.
If parameters are modified during the run with a fixed program, "0" appears in the PROG field and the user exits program without it being modified.
To exit the fixed program, call up program "0" or modify the parameters.
✧选择已有的程序进行离心Preset program:
Programs can only be preselected when the device is at a standstill.
Press the key PROG once ➔the program no. that has been set flashes.
⏹0 indicates data from last run.
⏹ 1...9, A...Z indicate fixed programs.
Use ↑ OR ↓to select further program numbers.
Returns to program 0 or leaves the programming mode when the lid is open. In order to start the selected program immediately, the
centrifuge lid must be closed prior to pressing the START/STOP
key.
✧对已有的程序进行删除操作Write protection:
In order to avoid accidental deletion of an existing fixed program, the old data set must be deleted while the lid is open prior to renewed assignment of a program number.
Press the key PROG once ➔the program NO. display flashes.
Use ↑ OR ↓to select the program no. which is to be deleted.
Press START/STOP within 10 seconds, keep depressed for 2 seconds
until cleared appears in the display.。
