完全互溶双液系相图-精选.
二组分完全互溶双液系气-液平衡相图

课程名称:大学化学实验(P)指导老师:成绩:_______________实验名称:二组分完全互溶双液系气-液平衡相图实验类型:物性测试同组学生姓名:【实验目的】1.学习测定气-液平衡数据及绘制二组分系统相图的方法,加深理解相律和相图等概念。
2.掌握正确测量纯液体和液体混合物沸点的方法。
3.熟悉阿贝折光仪的原理及操作,熟练掌握超级恒温超的使用和液体折射率的测定。
4.了解运用物理化学性质确定混合物组成的方法。
【实验原理】两种液态物质若能以任意比例混合,则称为二组分完全互溶液态混合物系统。
当纯液体或液态混合物的蒸气压与外压相等时就会沸腾,此时的温度就是沸点。
在一定外压下,纯液体的沸点有确定值,通常说的液体沸点指101.3kPa下的沸点。
对于完全互溶的混合物系统,沸点不仅与外压有关,还与系统的组成有关。
在一定压力下,二组分完全互溶液态混合物系统的沸点与组成的关系可分为三类:(1)液态混合物的沸点介于两纯组分的沸点之间,如苯-甲苯系统;(2)液态混合物有沸点极大值,如丙酮-氯仿系统;(3)液态混合物有沸点极小值,如水-乙醇系统、苯-乙醇系统。
对于第(1)类,在系统处于沸点时,气液两相的组成不相同,可以通过精馏使系统的两个组分完全分离。
第(2)、(3)类是由实际系统与拉乌尔定律产生严重偏差导致。
正偏差很大的系统,如第(3)类,在T-x图上呈现极小值,负偏差很大时,如第(2)类,则会出现极大值。
相图中出现极致的那一点,称为恒沸点,恒沸点温度和组成都是非常重要的平衡数据。
具有恒沸点组成的二组分混合物,在蒸馏时的气相组成和液相组成完全一样,整个蒸馏过程中沸点恒定不变,因此称为恒沸混合物,如要获得两纯组分,则需采取其他方法。
液态混合物组成的分析是相平衡实验的关键。
组分分析常采用折射率法、密度法等物理方法和色谱分析法等。
本实验采用折射率法。
在一定温度下的折射率是物质的一个特征参数,液态混合物的折射率与组成有关,一般呈简单的函数关系。
4.3完全互溶双液系统讲解

T x1
x2
x3 x4
A
xB
B
一、理想的完全互溶的双液系统
T-p-x图
T
液 pA*
TA*
液
A
xB
pB* 气
气 气
TB* B
一、理想的完全互溶的双液系统
T-p-x图
二、杠杆规则
T g
TB*
DC E
l TA*
B
x1
xA x2
A
xA
物系点:系统物质的总组成点(不管相的存在状态)
二、杠杆规则
假设某压力下液态混合物沸腾时气液平衡的物系点为C点,那 么有: n总 nA nB nl ng
三、非理想的完全互溶双液系统
1. 正负偏差不大的体系
气液相图与理想液态混合物气液相图基本类似
p
p
T
A
xB
(a) p-x图
BA
xB
BA
xB
B
(b) p-x-y图
(c) T-x-y图
三、非理想的完全互溶双液系统
2. 正偏差很大的体系 有最高点
p-液相组成线
p
p
p-气相组成线
A
xB
B
(a) p-x图
A
xB
B
(b) p-x-y图
pA、pB偏离拉乌尔定律都很大,p-x图上形成最高点。
三、非理想的完全互溶双液系统
2. 正偏差很大的体系
g
T lg lg
(c) T-x-y图
l
l
A
x1
B
xB
在p-x图上有最高点,在T-x图上就有最低点,称最低恒沸点。 最低恒沸点对应的组成称最低恒沸组成。在此组成下蒸馏双 液系:yA = xA , yB= xB,A与B达不到分离目的,类似蒸馏 具有恒定沸点的纯物质,所以此点上混合物称恒沸混合物。
互溶双液系的相图及应用

精馏的原理:经过多次蒸馏达到提纯的目的。
定压
馏出液 Tb
馏出液 组成
二次蒸
g 馏馏出
液组成
l
A
xB
B
Tb - xB图
二、精馏的原理
馏出液
实验室的蒸馏装置
化工厂的精馏塔
二、精馏的原理
气相从塔顶蒸出
沸点高的物质留在塔底
液相留在 塔底
沸点低的 物质蒸出
塔顶
二、精馏的原理
1 精馏是经过多次蒸馏,达到提纯的目的。
A
Tb - xB图 B
自学 其他非理想完全互溶双液系相图及应用
预习 相图的绘制
谢谢大家!
定压
g
馏出液 组成
l
如果是理想完全互溶双液系,通过精馏 可以纯A和纯B。
Tb
沸点低的纯B被蒸馏出来 3 沸点高的纯A留在塔底被分离出来。
A
xB
B
Tb - xB图
三、 非理想互溶双液系的相图(具有最低恒沸点)
最低恒沸点:M点
xB=yB
恒沸物:混合物
组成随压强改变
注意:不能同时得到两种纯组分,
一定能得到恒沸物。
思考
思考
100 ℃ 78.13 ℃
pθ
g 78.3 ℃ l
95.57%
H2O 15%
C2H5OH
Tb - xB图
思考
酒厂的酒度计坏了,你 如何利用所学知识帮助酒 厂确定酒精度数?
预习相图的准确绘制 写出具体方案 抽签讲解
小结
小结 精馏的原理及应用
定压
g
Tb l
定压
g
Tb
l
A
B
Tb - xB图
完全互溶双液系的平衡相图

7-目镜;
8-望远镜筒;
9-示值调节螺钉;
10-阿米西棱镜手轮;
11-色散值刻度圈;
12-棱镜锁紧扳手;
13-棱镜组;
14-温度计座;
15-恒温器接头;
16-保护罩;
17-主轴;
18-反光镜
阿贝折射仪是一种精密的
光学仪器,使用时注意以下几点:
☻使用时要注意保护棱镜,清洗时只能用擦镜纸而不 能用滤纸等。加 试样时不能将滴管口触及镜面。对于酸碱等腐蚀性液体不得用阿贝折射 仪。 ☻每次测定时,试样不可加地太多,一般加需加2-3滴即可。
在每一份样品的蒸馏过程中,正常回流1~2min后,即可 取样测定,不宜等待时间过长。
每次取样量不宜过多,取样时毛细滴管一定要干燥,不能 留有上次的残液,并且气相部分的样品要取干净。
使用阿贝折光仪时,棱镜上不能触及硬物(如滴管)。
六 数据处理
1. 将测得的折射率-组成数据列表,并绘 制成工作曲线。
恒温槽1台;阿贝折射仪1台;沸点仪1 套; 移液管(1mL2支、10mL1支);具塞小 试管9支。 环己烷(A.R.);无水乙醇(A.R.)
沸点仪原理图
1-温度计; 2-进样口; 3-加热丝; 4-气相冷凝液取样口 5-气相冷凝液
四 实验步骤
1. 调节恒温槽温度比室温高5℃,通恒温水于阿贝折射仪中。 2. 测定折射率与组成的关系,绘制工作曲线。
二组分凝聚系统相图.

T
' c
等压
c'
两相
T/K
453
413
373
Tc
c
0.2 0.4 0.6
单相
0.8 1.0
0
水
质量分数 水-烟碱的溶解度图
烟碱
6.4 二组分凝聚系统相图 一、二组分固态完全不互溶系统液固平衡相图
1. 热分析法
基本原理:二组分系统 C=2,指定压力不变,
f * = C +1 -F =3 -F
F = 1
f f 1 ** f f 2
*
相点 表示某个相状态(如相态、组成、温度等)的 点称为相点。 物系点 相图中表示系统总状态的点称为物系点。在T-x 图上,物系点可以沿着与温度坐标平行的垂线上、 下移动;在水盐相图上,随着含水量的变化,物系 点可沿着与组成坐标平行的直线左右移动。
单相区,物系点与相点重合;两相区中,只有 物系点,它对应的两个相的组成由对应的相点表示
B
3. 全部变为固体Bi后
f * C 1 Φ 1
t /s
温度又可以下降 纯Cd步冷曲线与之相同
Cd-Bi二元相图的绘制
w(Cd) 0.2
的步冷曲线
b
T /K
f* 2
C
D
f * 1
1. 加热到b点,Bi-Cd全部熔化 Φ 1 f * 2 1 Φ 2 温度可以下降,组成也可变 2. 冷至C点,固体Bi开始析出 Φ 2 f * 2 1 Φ 1 温度可以下降 3.D点固体Bi、Cd同时析出
Φ 3
f* 0 温度不能改变 f * 1 4.熔液消失,Bi和Cd共存
f 2 1 Φ 0
*
5.3完全互溶双液系统

四、蒸馏、分馏与精馏
从图可看出:
Tn+1
Tn
y0 > y1 > y2 > y3 > y4 > y5 > y 6 > y7 > y8 反复将气相部分冷凝, 气相组成沿气相线下降,最 后得到的蒸气组成可接近纯B。
x8 < x7 < x6 < x5 < x4 < x3 < x2 < x1< x0 液相组成沿液相线 上升,xB下降,xA上升,最 后可得纯A。
三、非理想的完全互溶双液系统
2. 正偏差很大的体系
三、非理想的完全互溶双液系统
2. 正偏差很大的体系 具有最低恒沸点的相图可以看作 由两个简单的T-x(y)图的组合。 在组成处于恒沸点之左,精馏结果 只能得到纯B和恒沸混合物。组成 处于恒沸点之右,精馏结果只能得 到恒沸混合物和纯A 。
对于 H2 O - C2 H5OH 体系,若乙醇的含量小于95.57,无 论如何精馏,都得不到无水乙醇。只有加入 CaCl 2 ,分子筛 等吸水剂,使乙醇含量超过95.57,再精馏可得无水乙醇。
气相部分沿分馏柱上升,在刺形 物上实现多次蒸馏。气相部分在上升 过程中组成不断变化,沸点亦逐渐降 低。柱身在无外界热源情况下温度会 降低,若降的太多,起完全回流作用, 所以应注意柱身保温,控制回流比。
四、蒸馏、分馏与精馏
精馏塔
四、蒸馏、分馏与精馏
精馏塔
四、蒸馏、分馏与精馏
四、蒸馏、分馏与精馏
三、非理想的完全互溶双液系统
3. 负偏差很大的体系
三、非理想的完全互溶双液系统
3. 负偏差很大的体系 例:1atm下,H2O-HCl体系 Tb最高=108.5C 恒沸物组成 HCl% =20.24%
完全互溶双液系的气-液平衡相图
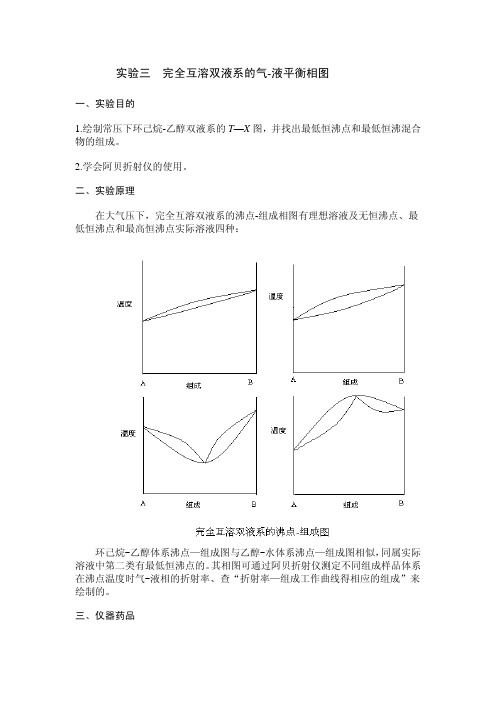
实验三完全互溶双液系的气-液平衡相图一、实验目的1.绘制常压下环己烷-乙醇双液系的T—X图,并找出最低恒沸点和最低恒沸混合物的组成。
2.学会阿贝折射仪的使用。
二、实验原理在大气压下,完全互溶双液系的沸点-组成相图有理想溶液及无恒沸点、最低恒沸点和最高恒沸点实际溶液四种:环己烷-乙醇体系沸点—组成图与乙醇-水体系沸点—组成图相似,同属实际溶液中第二类有最低恒沸点的。
其相图可通过阿贝折射仪测定不同组成样品体系在沸点温度时气-液相的折射率、查“折射率—组成工作曲线得相应的组成”来绘制的。
三、仪器药品1、仪器阿贝折射仪1台; 沸点仪1套; 恒温槽1台;0.1刻度水银温度计(0-100℃)2支;带磨口塞子的小样品管(2mL)16支;移液管(2mL)2支;胶头滴管2个; 50mL 烧杯10只(公用);50mL量筒10只(公用)。
2、药品(1)无水乙醇(AR);环己烷(AR); 二次蒸馏水。
(2)在样品瓶中依次加入环己烷10mL、20mL、30mL、40mL、50mL、60mL、70mL、80mL、90mL和乙醇90mL、80mL、70mL、60mL、50mL、40mL、30mL、20mL、20mL已知浓度的标准溶液(按纯样品的密度,换算成物质的量分数)9份。
(3)环己烷物质的量分数约为0.05、0.15、0.30、0.45、0.55、0.65、0.80、0.95的环己烷-乙醇溶液样品。
四、实验步骤1、测已知浓度的标准的折射率,作环己烷-乙醇的折射率-组成工作曲线(1)调节超级恒温槽水浴温度,使阿贝折射仪上的温度为250.1±℃左右。
(2)依次测已知浓度的标准溶液及纯乙醇和环己烷的的折射率(棱镜不能触及硬物如滴管,擦拭棱镜用擦镜纸)。
2、按图安装好沸点仪-沸点仪将一干燥、洁净的磁子放入已洗涤、干燥的沸点仪内,按图安装在实验室特制的磁力加热电热套内(250mL、只可覆盖圆底烧瓶底部1/5);一支温度计离圆底烧瓶约0.5cm,另一支温度计水银球上沿与支管口下沿相齐。
双液系相图.

TA*
气相, f=2
pH LG来自nlHL=ngHG——杠杆规则
l+g, f=1
TB*
液相, f=2
xBl
xB
xBg
xB
理想溶液的T-x相图
T
理想溶液的p-x相图
p
TA*
气相, f=2
单相区,液相
l+g
l+g, f=1
pB*
L
H
G
L
H
G
TB*
液相, f=2
pA*
单相区,气相
xBl
xB
xBg
xB
0
xBl xB xBg
一. 完全互溶理想溶液的p-x图 • (一)液相线的绘制 • p-x图:
•
• • •
pA= pA*xA pB= pB*xB= pB*(1-xA) p = pA+ pB = pA*xA + pB*(1-xA)
• 体系的总压为:
•
p = pB*+(pA*-pB*)xA
(二)气相组成与液相组成的关系 由于A、B二组分蒸汽压不同,故与溶液 平衡的气相组成和液相组成并不相同,有:
气相
x4 x3 x2
y4 y3 y2 x1
T1
y1
液相
A
x
B
完全互溶双液系的p-x图
虚线:理想溶液 红色: A的蒸汽压曲线; 蓝色: B的蒸汽压曲线; 紫色: 实际溶液的总压 此类非理想溶液相图与 理想溶液的相图有偏差. 但其偏离的程度不至于 使体系的相图发生明显 的变化.
pA* p
(产生正负偏差不大的体系)
从相图可以求出: ( xB-xBl)=HL ( xBg-xB)=HG 有: nlHL=ngHG
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.3 完全互溶的双夜系相图
4.3.1 二组分系统的相律的应用
最多可有四相平衡共存,是无变量系统。
最多可有三个自由度-T ,p ,x 均可变,属三变量系统。
因此,要完整的描述二组分系统相平衡状态,需要三维坐标的立体图。
但为了方便,往往指定一个变量固定不变,观察另外两个变量之间的关系,这样就得到一个平面图。
如: 保持温度不变,得 p-x 图 较常用 保持压力不变,得 T-x 图 常用 保持组成不变,得 T-p 图 不常用。
若保持一个变量为常量,从立体图上得到平面图。
相律 单相,两个自由度。
最多三相共存。
二组分系统相图种类很多,以物态来区分,大致分为: 完全互溶双液系 气-液平衡相图 部分互溶双液系 完全不互溶双液系
具有简单低共熔混合物 稳定化合物
有化合物生成 不稳定化合物 固-液平衡相图 固相完全互溶 固相部分互溶
固相部分互溶 等
C 2C 24= f Φ+=Φ
=--min max 1 3Φf ==min max 0 4
f Φ==213f ΦΦ
*=-+=-*min max
1 2Φf ==*max min 3 0
Φf ==
4.3.2 理想的完全互溶双液系相图
若A 、B 两种液体均能以任意比例相互混容形成均匀单一的液相,则该系统称为完全互溶双液系。
根据相似相容原理,它可以分为:理想的完全互溶双液系 和非理想的完全互溶双液系。
首先学习理想液态混合物的相图。
4.3.2.1. 理想溶液p-x 图
设A 、B 形成理想溶液,其饱和蒸气压分别为P A * 和P B *,P 为体系的总蒸气压。
以x A 为横坐标,以P 蒸气压为纵坐标,在p-x 图上分别表示出P A 、P B 、P 与x A l 的关系。
p-x-y 图 同压下 , 之间的关系
若知道一定温度下的P A *、P B *,就可据液相组成(x A /x B )求其气相组成(y A /y B )
p
x p p p y A A A A *==
B
A
B A B A x x p p y y *
*=
若 则 此时 即蒸气压大的组分在气相中浓度更大。
若 ,此时 , 即蒸气压小的组分气相中浓度更小。
l-液相区 f * =2;g-l-气液平衡区 f * =1;g-气相区 f * =2。
*
A A A
p p x =*
B B B
p p x =()A B
l l A A B B
**l B A B A
(1)
l l
A A
B A p p p p x p x p x p x p p p x *****=+=+=+-=+-~A p y 线:
A y A x ()A A
B A A
A B A p x p p y x p p p *
*
**
+-==**A B p p >A A y x >,
B B y x <,**A B
p p <A A y x <B 1A
y y =-
4.3.2.2. 理想溶液的 T ~x 图
以T 对 及 作图,得两条不重合的线。
绘制方法:
(1) 配制一系列不同浓度的溶液,测各溶液的沸点,
做图即可得T ~
线,T ~ 线不是线性。
(2) 将与每一溶液相平衡的气相取出分析,即可得
T ~ 曲线(易挥发组分在气相中含量高, T ~ 在T ~ 线上方)。
T A *和
T B * 分别为甲苯和苯的沸点。
显然P* 越大,T b 越低。
在T-x 图上,气相线在上,液相线在下,上面是气相区,下面是液相区,梭形区是气-液两相区。
介绍线、面意义、自由度。
物系点、相点、结线、露点、泡点等。
4.5.3.杠杆规则
气-液平衡区,气液相组成(相点)通过物系点做水平线分别同气、液相线相交。
在T-x 图的两相区,物系点C 代表了体系总的组成和温度。
通过C 点作平行于横坐标的等温线,与液相和气相线分别交于D 点和E 点。
DE 线称为等温连结线。
落在DE 线上所有物系点的对应的液相和气相组成,都由D 点和E 点的组成表示。
上式为杠杆规则表达式
适用范围:任何两相平衡区。
作用:可以用来计算两相的相对量(总量未知)或绝对量(总量已知)。
2.5.4.非理想的完全互溶双液系
对完全互溶双液系,理想溶液也总是少数,大部分是非理想溶液,前已述及,其 产生偏差的原因有:
g i x l i
x l i x l
i x **A B
p p >若,
*
bmax bB
T T =则*
b min bA
T T =g
i x g i
x l
i x A l 1g 2
n x n x n x =+总()l
g
A
l 1g 2
n n x
n x n x +=+()()l A 1g 2A n x x n x x -=-l g CD CE
n n =l g CD CE
w w =
若 增大,正偏差。
若 减小,负偏差。
若发生解缔,则P 增大,Q >0,V 也增大,正偏差。
若 A 、B 化合或缔合,则P 减小,Q <0,V 也减小, 负偏差。
偏差程度与两液体的性质和温度有关。
二组分非理想溶液根据偏差程度大致分为三种类型:
1. 正(负)偏差不大( )
p ~x ,T ~x 图与理想溶液偏差不大,这时液相线已不再是直线。
2.正偏差很大,在p -x 图上有最高点
由于A ,B 二组分对拉乌尔定律的正偏差很大,在p-x 图上形成最高点,如图 (a)。
求出对应的气相的组成,分别画出p-x (y )和T-x (y )图,如(b),(c)所示。
在p-x 图上有最高点者,在T-x 图上就有最低点,这个最低点称为最低恒沸点。
T 1 为最低恒沸点。
处在最低恒沸点的溶液,称为最低恒沸混合物。
AB
AA
BB
f f f p <或,则
AB AA BB f f f p >或,则**A B
p p p p p **
max A B
p p p ≠
≠
若进行分馏时,在A 边只能得到纯A 和最低恒沸物。
在B 边只能得到纯B 和最低恒沸物。
在A 区如何得到纯B ?先得恒沸物,然后破坏后,再蒸馏分离。
注意:恒沸混合物是混合物而不是化合物,它的组成在定压
下有定值。
改变压力,最低恒沸点的温度也改变,它的组成也随之改变。
属于此类的系统有: 等。
在标准压力下,
的最低恒沸点温度为351.28K ,含乙醇95.57% 。
3.负偏差很大,在p-x 图上有最低点
在p-x 图上有最低点,在T-x 图上就有最高点,这最高点称为最高恒沸点。
最高点所对应的溶液是最高恒非混合物。
若进行分馏,结果如何?
4.5.5 蒸馏或精馏原理 (1).蒸馏
简单蒸馏只能把双液系中的A 和B 粗略分开。
在A 和B 的T-x 图上,纯A 的沸点高于纯B 的沸点,说明蒸馏时气相中B 组分的含量较高,液相中A 组分的含量较高。
一次简单蒸馏,馏出物中B 含量会显著增加,剩余液体中A 组分会增多。
如有一组成为x 1的A 、B 二组分溶液,加热到T 1时开始沸腾,与之平衡的气相组成
225366H O-C H OH, CH OH-C H ,2566C H OH-C H 225H O-C H
OH **
min A B
p p p ≠≠
为y1,显然含B量显著增加。
液相中含高沸点的组分比增多,组成沿OA线上升,沸点也升至T2,这时对应的气相组成为y2。
接收T1-T2间的馏出物,组成在y1与y2之间,剩余液组成为x2,A含量增加。
这样,将A与B粗略分开。
(2).精馏
精馏是多次简单蒸馏的组合。
精馏塔底部是加热区,温度最高;塔顶温度最低。
精馏结果:塔顶冷凝收集的是纯低沸点组分,纯高沸点组分则留在塔底。
精馏塔有多种类型,如图所示是泡罩式塔板状精馏塔的示意图。
最新文件仅供参考已改成word文本。
方便更改。
