紫甘薯色素检测方法技术标准
参考教案-紫甘薯花青素提取纯化及鉴定

参考教案:紫甘薯花青素提取、纯化及鉴定食品都有一定的颜色特征,色泽的好坏直接影着消费者对食品的可接受性以及对其品质的评在食品加工业中常用的食用色素有合成色素和然色素两大类。
合成色素是由人工合成方法所制的有机色素,具有较好的稳定性,着色强度高、经使用方便等优点。
然而,随着医学毒理学和生物究的不断深人,发现曾允许使用的人工合成食用素中,大多数对人体都有不同程度的伤害,有的甚有致畸致癌致突变作用,在使用上逐渐受到限制。
天然食用色素即是源于天然资源的食用色素是从果蔬、动物及矿物质中提取得到或天然存在色素的合成复制品。
如:类胡萝卜素、花青素、醌类色素、藻蓝素等,大多数天然色素对人体无毒无害,具有维生素活性,富含人体所需的营养物质,有些还对人体有医疗保健的作用。
同时,绝大部分的天然色素着色自然,能更好地模仿天然物颜色,并具有特殊的芳香气味,添加到食品中会带来愉快的感觉,更能引起消费者的注意。
因此,研究与开发无毒的天然食用色素已成为食用色素发展的总、趋势。
花青素(Anthocyanidins)属酚类化合物中的类黄酮类,是一种水溶性色素,一般存在于植物花瓣、果实的组织中及茎叶的表面细胞与下表皮层。
其色泽随 pH不同而改变,由此赋予了自然界许多植物明亮而鲜艳的颜色。
在自然状态下,花青素在植物体内常与一个或多个葡萄糖、鼠李糖、半乳糖、阿拉伯糖、木糖等形成糖苷,称为花色苷(Anthocyanin )。
现有资料表明花青素有二十余种,在植物中常见的有六种,即天竺葵色素(Pg)、矢车菊色素(Cy)、飞燕草色素(Dp)、芍药色素(Pn)、牵牛花色素(Pt)和锦葵色素(My)。
它是由一定数量的儿茶素、表儿茶素缩合而成的聚合体,其分子结构中由于含有不对称碳原子(2位或 2,3位),因此具有旋光性。
花青素具有很强的极性,可溶于水,易溶于甲醇、乙醇、乙酸乙酯、丙酮,但不溶于乙醚、氯仿、苯等。
另外,由于分子中有大量的酚羟基存在,因此具有弱酸性,可溶于碱性水溶液。
微波辅助法提取紫甘薯中的原花青素及含量的测定

微波辅助法提取紫甘薯中的原花青素及含量的测定蔡吉清;李秀玲【摘要】研究了以紫甘薯为原料,利用微波辅助法提取原花青素时提取剂浓度、料液比、微波处理时间等因素对提取率的影响.结果表明,在此最佳实验条件下,即以盐酸的乙醇溶液为提取液,在乙醇的体积分数为50%,料液比(g:mL)为1:70,微波处理70 s,所得的原花青素浸提量为0.96 mg/g.【期刊名称】《浙江化工》【年(卷),期】2011(042)002【总页数】3页(P29-30,26)【关键词】紫甘薯;原花青素含量;微波辅助法【作者】蔡吉清;李秀玲【作者单位】浙江大学化学系,浙江,杭州,310058;浙江大学化学系,浙江,杭州,310058【正文语种】中文食用色素是用于食品工业,以改善色泽,促进食欲,提高商品价值的一类食品添加剂。
近年来,随着人们对人工合成色素危害性的认识,许可使用的人工合成色素种类趋于减少。
与合成色素相比,天然色素一般从植物组织中提取出来的,因而它比较安全,色泽浅淡。
植物食用天然色素分为脂溶性和非脂溶性两类,其中仅植物非脂溶性天然色素就达10余种。
紫甘薯中所含有的紫甘薯色素是一种天然食用非脂溶性红色素。
[1~3]许多天然色素本身就是人体需要的物质并兼有营养的效果,有的还有一定的药理作用。
国外研究表明,原花青素有强抗氧化能力,对心血管疾病疗效显著。
原花青素还具有预防高血压、防止动脉粥样硬化、抗血栓、抗菌、抗炎、抗肿瘤、抗突变,保护肾脏及皮肤保健及美容等功能,对糖尿病及视网膜病也有一定疗效,是一种颇具开发前景的保健品[4~5]。
微波提取具有设备简单、适用范围广、萃取效率高、重现性好、节省时间、节省试剂、污染小等特点。
而用微波辅助法提取的紫甘薯花青素作为一种天然食用色素,安全、无毒、无异味、色彩鲜艳、资源丰富,与其它同类色素相比性质较稳定,而且具有一定的营养和药理作用,在食品、饮料、化妆品、医药方面有着较大的应用潜力[5]。
本实验采取微波辅助法提取紫甘薯中的原花青素,并对其含量进行了测定。
紫薯中花青素的测定

可见分光光度法测定紫甘薯总花青素含量花青素的作用:花青素是一类在自然界广泛存在的水溶性天然色素,不但可作为食用色素,还具有多种保健和医药功能.紫甘薯色素具有清除自由基、抗氧化、抗突变、降血压,改善肝机能等多种生理功能,在食品、化妆品及医药等行业有着广阔的应用前景
花青素的结构式:
常见的花青素:
目前紫薯花青素的检测方法大都仅是定性分析,主要有色谱法和紫外可见分光光度法。
花青素的测定---以紫薯中花青素之一矢车菊素为标准品绘制标准曲线
一:材料与试剂:
1,材料:市面上买的紫薯
2,试剂:(按两人做一次计算)
仪器:
操作方法:
1.式样的处理:
紫薯干粉的处理(提前)→称取2g干粉→锥形瓶→加进100ml0.1mol柠檬酸水溶液→超声30min(待定) →取澄清滤液
2.操作步骤:
弱光下称取1.35g矢车菊样品→用0.1mol柠檬酸分次定容到25ml容量瓶→移取
5ml、2ml、0ml标准溶液→在波长518nm处测定吸光值→绘制标准曲线→计算→分析结果。
可见分光光度法测定紫甘薯总花青素含量

De e m i a i n o t lAn h c a i i si u p e S e o a o b t r n to fTo a t o y n d n P r l we tP t t y n Vi p c r p o o t y s S e t o h t me r
d i 1. 6  ̄i n17 — 0 X2 1.2 0 6 o: 03 9 .s.64 56 . 0 — 2 9 s 0 0
花青 素是 一类在 自然界 广 泛存 在 的水溶 性 天然
少 有游 离花 青素 ,大 多 以糖 苷化 和 酰基化 的形 式存 在, 统称 花 色苷 。 已知紫 色甘薯 花青 素 的主要 成分是 矢 车菊 素 和芍药 素及 极少 量 的天 竺葵 色 素 ,以糖苷 化 后 的酰基 化 衍生 物形 式 存在【 由于 酰 基化 有利 1 。 于 花青 素 的稳 定 ,紫 薯 中花 色苷 比同类 天 然色 素更
d tr ie y U V s s e t p o me y u ig c a i n a s n ad c mbn i h l c ig o a 0 . y ndn eem n d b V— i p c o h t t s y nd s t d r o ig w t te be h fN 2 3 C a i r o r n i a h a n S i
me h d i c l n c u a e w ih s o l e a l o g i e t e c l v t g a d pa t g o u p e s e o ao t o sf i a d a c r t , h c h u d b b et u d ut ai n ln i f r l we t t t. a e h i n n p p Ke r s u l w e oa o a t o y n d n ; n h c a is c a i i ; s s e t p oo t y wo d :p r e s e t tt ; n h e a i is a t o y n n ; y n dn Vi p cr h tmer p p o y
紫薯色素提取与抗氧化研究实验方案
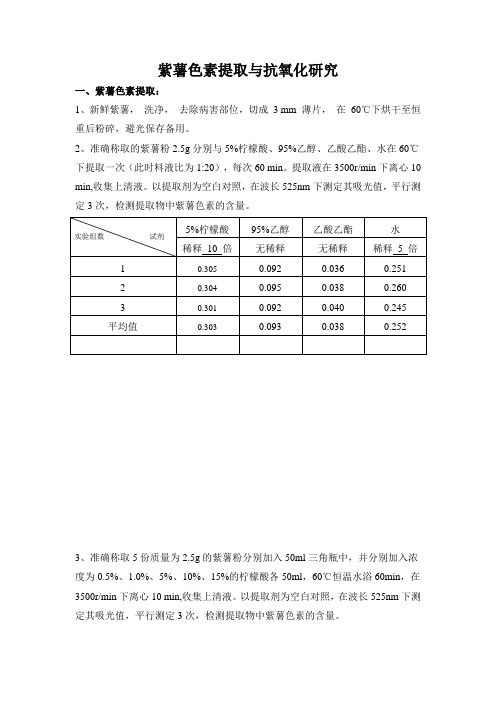
紫薯色素提取与抗氧化研究一、紫薯色素提取:1、新鲜紫薯, 洗净, 去除病害部位,切成 3 mm 薄片, 在 60℃下烘干至恒重后粉碎,避光保存备用。
2、准确称取的紫薯粉2.5g 分别与5%柠檬酸、95%乙醇、乙酸乙酯、水在60℃下提取一次(此时料液比为1:20),每次60 min 。
提取液在3500r/min 下离心10 min,收集上清液。
以提取剂为空白对照,在波长525nm 下测定其吸光值,平行测定3次,检测提取物中紫薯色素的含量。
3、准确称取5份质量为2.5g 的紫薯粉分别加入50ml 三角瓶中,并分别加入浓度为0.5%、1.0%、5%、10%、15%的柠檬酸各50ml ,60℃恒温水浴60min ,在3500r/min 下离心10 min,收集上清液。
以提取剂为空白对照,在波长525nm 下测定其吸光值,平行测定3次,检测提取物中紫薯色素的含量。
实验组数 试剂5%柠檬酸 95%乙醇 乙酸乙酯 水 稀释 10 倍无稀释 无稀释 稀释 5 倍 1 0.305 0.092 0.036 0.251 2 0.304 0.095 0.038 0.260 3 0.301 0.092 0.040 0.245 平均值0.303 0.093 0.038 0.252实验组数 温度0.5%1.0%5%10%15%稀释 10倍稀释 10倍稀释 10 倍稀释 10 倍稀释10 倍1 0.141 0.211 0.273 0.354 0.4102 0.143 0.212 0.280 0.357 0.407 3 0.149 0.209 0.279 0.357 0.409 平均值 0.144 0.211 0.277 0.356 0.4094、准确称取的紫薯粉0.5、1g 、2.5g 、5g 、7.5g 、10g 分别至于三角瓶中,各加入50ml 提取液,在60℃下提取60min ,提取液后在3500r/min 下离心10 min,收集上清液。
紫甘薯中花青素的提取及含量的测定

紫甘薯中花青素的提取及含量的测定山东农业大学化学学院09级材化2班赵林静152********山东农业大学化学学院09级材化2班李新152********摘要用乙醇酸溶液从紫甘薯中提取花青素。
用PH示差法对提取液中花青素含量进行测定。
关键字:紫甘薯花青素PH示差法1前言:花青素又称花色素,是一种广泛存在于植物中的水溶性天然色素。
属黄酮类化合物,多以糖苷的形式存在,也称花色苷。
花色苷是一种以黄酮核为基础的一类糖苷,天然花色苷配糖体的基本结构为3、5、7-三羟基-2-苯基并呋喃。
最早且最丰富的花青素的花青素是从后葡萄渣中提取的葡萄皮红,花青素作为一种天然食用色素,安全,无毒,资源丰富,而且具有一定的营养和药用价值,在视屏、化妆、医药等方面有着巨大的应用潜力。
有实验证明,花青素是迄今为止所发展的最强效的自由基清除剂。
目前对花青素的定量没有较好的方法,常用的方法是以色价或吸光度表示其相对含量,也有用花青素纯品配置不同浓度梯度制作标准曲线测定色素的含量但由于花青素的标准品很不稳定,限制了这种方法的使用。
本实验用PH示差法对紫甘薯中花青素的提取液中花青素的含量进行测定。
2 实验目的2.1掌握花青素的提取方法及其PH示差法测量花青素含量的原理2.2熟练掌握分离提纯操作方法步骤。
3 实验原理紫甘薯中含有花青素,用乙醇的酸溶液作为提取液在离心机的作用下即可得到粗的花青素提取液。
PH示差法的原理为花青素的色调和色度随PH值的不同而发生改变。
PH为1.0时,花青素以红色的2-苯基并呋喃的形式存在。
结合朗伯比尔定律可得出在两个不同PH值下,花青素溶液的吸光度差值与花青素含量成正比。
4实验仪器及试剂仪器:电子天平;钥匙;精密PH试纸;PH计;表面皿、玻璃棒;烧杯;干燥的带塞子的锥形瓶250ml(4支);100ml容量瓶(4支);胶头滴管;500ml试剂瓶(3支);高速离心机、离心管(6支);分光光度计;10ml小量筒(3支);摇床;烧杯3支试剂:粉末状紫甘薯30g(自备);分析纯的乙醇试剂500 ml 氯化钾20g 醋酸钠30g 去离子水1000ml 分析纯的盐酸50ml5 实验步骤5.1乙醇的酸溶液按85:15的比例将分析纯的乙醇溶液与去离子水混合,再用浓盐酸调节PH至1.0左右。
紫甘薯红色素检验方法的探讨

·190 ·
预防医学论坛 2005 年 3 月第 11 卷第 2 期 Prev Med Trib Vol . 11 ,No . 2 ,Mar. 2005
紫甘薯红色素检验方法的探讨
【实验研究】
衣秀娟1 ,陈伟1 ,陈明珍2 ,刘卫华1 (11 山东省烟台经济技术开发区卫生防疫站 ,山东 烟台 264006 ; 21 山东省烟台海洋渔业技工学校 ,山东 烟台 264000)
高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量

紫甘薯是甘薯特有品种类型,它不仅营养丰富,而且还富含具有显著生理功能作用的花青素类物质。
花青素,又称花色素,是自然界一类广泛存在于植物中的水溶性天然色素,属多酚类黄酮化合物[1]。
花青素的基本结构单元是2-苯基苯并吡喃型阳离子,即花色基元。
现已知的花青素有20多种,主要存在于植物中的有:天竺葵色素(Pelargonidin)、矢车菊色素或芙蓉花色素(Cyanidin)、翠雀素或飞燕草色素(Delphindin)、甲基花青素或芍药色素(Peonidin)、牵牛花色素(Petunidin)及锦葵色素(Malvidin)。
它具有抗氧化性[2],清除自由基[3],抗突变及抗肿瘤[4],减轻肝机能障碍[5,6],预防心血管疾病和Ⅱ型糖尿病[7]等功能。
高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量*刘超,王征,李鑫,贺炜(湖南农业大学生物科学技术学院,长沙410128)摘要:利用高效液相色谱法分析不同品种紫甘薯中花青素组分及其含量。
结果表明,除川山紫不含C、E、F三种组分外,其它品种紫甘薯均含十种花青素组分;在各个品种紫甘薯中,紫A4,浙紫及京薯6号花青素产率相对较高,川山紫和鄂紫花青素产率较低,紫A1居中。
花青素总含量中,E、F、G、H、I、J六个组分的含量占89%以上,对花青素总含量起主导作用。
关键词:紫甘薯;花青素;高效液相色谱*项目资助:湖南省教育厅青年基金(07B035)和湖南农业大学稳定人才基金(05WD11)资助课题。
作者简介:刘超(1982~),男,湖南长沙人,在校硕士研究生,研究方向为天然产物开发与应用。
通讯作者:王征中国食物与营养Food and Nutrition in ChinaNo.8,20082008年第8期法进行油脂氧化的评价是不全面和不可靠的。
因此,常常采用多种方法检测、分析,从不同的角度进行油脂氧化程度的评价。
◇参考文献[1]姚妙爱.油脂的饲用价值及其氧化酸败的防止措施.粮食加工,2004,1: 68-71.[2]王宪青,余善鸣,刘妍妍.油脂的氧化稳定性与抗氧化剂.肉类研究,2003,3:18-21.[3]中华人民共和国国家标准,GB2716-88,GB9848-88,GB9849-88,GB9850—88,GB8937-88.[4]刘一军,俞晔.进口油脂游离脂肪酸产生及影响测定因素分析.粮食与油脂,2001,12:43-415.[5]孙丽芹,董新伟,刘玉鹏.脂类自动氧化机理.中国油脂,1998,23(5):56-57.[6]谢守华.油脂的自动氧化和氧化稳定性及检测方法.四川粮油科技,1998,4:53-55.[7]周华龙,等.不饱和油脂氧化机理的研究与技术开发(II).中国皮革,2003,32(13):4-8.[8]韩玉莲.油脂氧化常用检测方法及其评价.中国食品卫生杂志,1994,6(1):57-60.[9]Isbell TA.Oxidatie stability index of vegetable oilsin binary mixture with meadow foamoil.Industrialcrops and products,1999,9:115-123.[10]王新芳,朱沛华,孙同山,等.差示扫描量热法测定食用油脂的热氧化稳定性及氧化寿命.化学分析与计量,2001,10(4):17-19.[11]李久盛,王大璞,杜上鉴.油脂氧化安定性几种分析方法的比较.分析测试学报,1999,18(5):24-27.目前对Ⅱ型糖尿病的治疗研究也引起了世界各国的广泛关注。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品添加剂
紫甘薯色素
一、紫甘薯色素
英文名称:Purple Sweet Potato Color
功能:着色剂
(一)使用范围和使用量
(二)质量规格要求
1.生产工艺
以番薯属植物紫甘薯(Ipomoea batatas Poiret)的块根为原料,用柠檬酸水溶液或含柠檬酸的乙醇水溶液抽提、纯化及大孔吸附树脂进一步纯化的液体紫甘薯色素,经喷雾干燥制得粉状紫甘薯色素。
2.性状
红至紫红色液体、粉末或颗粒状固体,无肉眼可见杂质。
3.技术要求:应符合表1的规定。
表1 理化指标
附录 A
检验方法
A.1 一般规定
除非另有说明,在分析中仅使用确认为分析纯的试剂和GB/T 6682中规定的三级水。
试验方法中所用标准滴定溶液、杂质测定用标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T 601、GB/T 602和GB/T 603之规定制备。
A.2 色价的测定
A.2.1 pH 3.0柠檬酸-磷酸氢二钠缓冲溶液配制
A.2.1.1 0.2 mol/L 磷酸氢二钠溶液:精确称取磷酸氢二钠(Na2HPO4·2H2O)35.60 g,用蒸馏水定容至1000 mL。
A.2.1.2 0.1 mol/L 柠檬酸溶液:精确称取柠檬酸(C6H8O7·H2O)21.0140 g,用蒸馏水定容至1000 mL。
A.2.1.3 pH 3.0 柠檬酸-磷酸氢二钠缓冲溶液:取0.2 mol/L 磷酸氢二钠溶液4.11 mL与0.1 mol/L 柠檬酸溶液15.89 mL混合。
用pH计测pH值有误差时,应将pH值准确调整至3.00。
A.2.2 测定
精确称取样品0.1 g~0.2 g,用pH 3.0 柠檬酸-磷酸氢二钠缓冲溶液稀释至100 mL(吸光度应控制在0.3~0.7之间),用1cm比色皿以缓冲溶液作空白,在530 nm±5 nm下测定吸光度。
A.2.3 结果计算
(530±5) nm = A/m
E%1
cm
1
式中:
A——吸光度;
m——样品的质量,g;
——色价,即在被测样品浓度为1 %、1 cm比色皿、在530 nm±5 nm 范围内的最大E%1
1
cm
吸收峰的吸光度。
A.3 pH的测定
称取1g样品,用100mL容量瓶以去离子水定容至刻度,摇匀,此液为待测样液。
用精度为0.01pH的酸度计测定样液pH值。
A.4 矢车菊—3—葡萄糖苷的测定
A.4.1 测试液制备
准确称取一定量的液体或固体样品,用水溶解后,稀释定容至50 mL,此为待测样品的储备液。
吸取两份等量的储备液,分别用pH 1.0的缓冲溶液和pH 4.5的缓冲溶液稀释定容至50mL,此为试样液。
储备液的最大取样量应不超过10 mL,以保证不超出缓冲溶液的缓冲能
力。
用pH 1.0的缓冲溶液对储备液进行适当稀释,直到520 nm 下的吸光度值在分光光度计的线性范围内。
采用这个稀释倍数,制备两份试样液,一个用pH 1.0的缓冲溶液稀释,另一个用pH 4.5的缓冲溶液稀释。
A.4.2 pH 1.0 氯化钾缓冲溶液和pH 4.5 乙酸钠缓冲溶液配制
A.4.2.1 pH1.0缓冲溶液(氯化钾,0.025 M ):称取1.86 g KCl 放入烧杯中,加入约980 mL 蒸馏水。
测量pH 值,用HCl (约6.3 mL)调pH 至1.0。
转移到1 L 的容量瓶中,用蒸馏水稀释至刻度。
A.4.2.2 pH4.5缓冲溶液(乙酸钠,0.4 M ):称取54.43 g CH 3CO 2Na·3H 2O 放入烧杯中,加入约960 mL 水。
测量pH 值,用HCl (约20 mL)调pH 至4.5 (± 0.05)。
转移到1 L 的容量瓶中,用蒸馏水稀释至刻度。
A.4.3 测定
测定分别经过pH 1.0和pH 4.5的缓冲溶液稀释的样品在520 nm 和700 nm 波长下的吸光度值,以水做空白。
样品制备完毕后要求在20 min ~50 min 的时间以内测定吸光度值。
注:在700 nm 波长下测定吸光度值是为了校正混浊对测定结果的干扰。
如果稀释后的样品过于混浊,测定前采用离心或过滤的方法进行澄清处理。
采用的过滤器不能吸收花青素。
A.4.4 结果计算
矢车菊-3-葡萄糖苷,%=
%10010110003
m
V DF MW A 式中,
A ——(A 520nm -A 700nm )pH 1.0-(A 520nm -A 700nm )pH 4.5;
MW(分子量) ——449.2 g/mol ,矢车菊-3-葡萄糖苷的分子量;
DF ——样品储备液的稀释倍数,按A.4.1中方法计算; 1——光路长,cm ;
ε——26900,矢车菊-3-葡萄糖苷的摩尔消光系数,L ×mol -1×cm -1; 1000——由g 换算成mg 的转换系数。
V ——储备液的体积(50),单位mL ; m ——样品的重量,单位mg。
