软硬酸碱原理与两可反应
软硬酸碱理论

软硬酸碱理论
软硬酸碱理论是一种贴切的衡量物质性质的重要理论,它可以帮助我们更好地理解物质的性质,以及它们如何在实际应用中发挥作用。
软硬酸碱理论是建立在pH值的基础上的。
pH值是一个衡量溶液是碱性还是酸性的重要参数,它代表了溶液中H+的活性程度。
溶液的pH值越小,说明它的酸性越强,反之则是碱性越强。
接下来,软硬酸碱理论将物质分成了软离子和硬离子两类。
这两类离子具有不同的性质,因此它们在溶液中具有不同的行为。
软离子是指可以更容易被水分解的离子,它们受溶液的pH值影响较大,容易受到离子化的影响,而硬离子则指那些不能被水分解的离子,它们不受溶液的pH值影响,不容易被离子化。
软硬酸碱理论也可以用来帮助我们更好地理解物质的溶解度。
当溶液中的离子类型与溶液的pH值相符时,离子的溶解度会更高,而当离子类型与溶液的pH值不相符时,离子的溶解度会相对较低。
软硬酸碱理论可以帮助我们更好地理解物质的性质,以及它们如何在实际应用中发挥作用。
它可以帮助我们预测物质在溶液中的行为,并有效地控制物质的性质。
软硬酸碱理论

软硬酸碱理论软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
the theory of hard and soft acids and bases概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
将电负性高,极化性低难被氧化的配位原子称为硬碱,反之为软碱。
硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。
将酸和碱根据性质不同分为软硬两类的理论。
1963年由R.G. 皮尔孙提出。
1958 年 S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与 Ag+、Hg2+、Pt2+ 配位;软硬酸碱理论另一些则易与Al3+、Ti4+配位,将金属离子分为两类。
a类金属离子包括碱金属、碱土金属 Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。
皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子:硬酸包括a类金属离子(碱金属、碱土金属 Ti4+、Fe3+、 Cr3+、H+)硬碱包括F-、OH-、H2O、NH3、O2-、CH3COO-、PO43-、SO42-、CO32-、ClO4-、NO3-、ROH等软酸包括b类金属离子Cu+、Ag+、Hg2+、Pt2+ Au+;Cd软硬酸碱理论2+; Pd2+、Hg22+及M0等软碱包括I-、SCN-、CN-、CO、H-、S2O32-、C2H4、RS-、S2-等交界酸包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,交界碱包括N3-、Br- 、NO2-、N2 、SO32-等表:软硬酸碱分类“硬酸优先与硬碱结合,软酸优先与软碱结合软硬酸碱理论。
”这虽然是一条经验规律,但应用颇广:①取代反应都倾向于形成硬 - 硬、软 - 软的化合物。
两可试剂的区域选择性-软硬酸碱理论及应用

两可试剂的区域选择性-软硬酸碱理论及应用一.两可亲核试剂两可亲核试剂是指亲核试剂的亲核基团中存在两个或多个带有一对孤对电子的亲核质点。
亲核性高的称为“主亲核质点”,活性低的称为“副亲核质点”。
主亲核质点进攻亲电质点生成主产物,副亲核质点进攻亲电质点生成副产物。
若两可亲核试剂在主反应进行时,副反应同时进行,则属于问题亲核试剂。
二.区域选择性的影响因素01在Lewis酸碱理论基础之上提出了广义酸碱的概念,进而提出了软硬亲核试剂或亲电试剂的概念,对于正确理解亲电质点的属性和二者之间的关系有很大帮助,有助于预测两可亲核试剂的区域选择性。
广义酸:具有空轨道,是外来电子对的受体,亲电试剂;广义碱:电子对的给予体,亲核试剂。
酸碱的软硬程度就是原子对外层价电子束缚松紧的程度。
①软碱给体原子电负性低,可极化性大,易被氧化,对外层价电子束缚松散,负电荷高度分散;②硬碱给体原子电负性高,可极化性小,难以氧化,对外层价电子束缚牢固,负电荷高度集中;③软酸受体原子较大,有较少正电荷,正电荷高度分散,价电子层包含易于激发的未成对的P电子或d电子,对外层电子束缚松散,具有高度的可极化性和低电负性;④硬酸受体原子较小,有较多正电荷,正电荷高度集中,价电子层无未成对电子,具有较低的可极化性和高电负性,对外层价电子束缚牢固。
软亲核质点包括有机铜,有机钯,烯,碳负离子,酰胺氮原子,烯醇盐碳原子;硬亲核质点包括羰基氧原子,格式试剂,酰胺氧原子,酚氧负离子,软亲电质点包括具有高度极化度的后过渡金属(Mn,Fe,Ni,Cu,Zn,Ru,Rh,Pd), 不饱和双键碳原子,缺电子烯,烷基碘化物,Sn2反应中的碳原子。
硬亲电质点包括前过渡金属(Sc,Ti,Zr,Cr),三氟甲磺酸烷基酯,甲磺酸烷基酯,烷基硫酸酯,三烷基氧鎓盐,缺电子卡宾,烷氧基鏻盐中间体,羰基碳,Sn1反应中的碳正离子。
同一周期,原子序数越大,离子半径越小,硬度越来越高,硬度:O->N->C-硬碱倾向于与硬酸反应,软碱倾向于与软酸反应,二者反应速率高,产物非常稳定。
HSAB 理论

HSAB 理论简介软硬酸碱理论:将酸和碱根据性质的不同各分为软硬两类的理论。
the theory of hard and soft acids and bases概念:体积小,正电荷数高,可极化性低的中心原子称作硬酸,体积大,正电荷数低,可极化性高的中心原子称作软酸。
将电负性高,极化性低难被氧化的配位原子称为硬碱,反之为软碱。
硬酸和硬碱以库仑力作为主要的作用力;软酸和软碱以共价键力作为主要的相互作用力。
分类将酸和碱根据性质不同分为软硬两类的理论。
1963年由R.G. 皮尔孙提出。
1958 年 S.阿尔兰德、J.查特和N.R.戴维斯根据某些配位原子易与 Ag+、Hg2+、Pt2+ 配位;另一些则易与Al3+、Ti4+配位,将金属离子分为两类。
a类金属离子包括碱金属、碱土金属 Ti4+、Fe3+、Cr3+、H+;b 类金属离子包括Cu+、Ag+、Hg2+、Pt2+。
皮尔孙在前人工作的基础上提出以软硬酸碱来区分金属离子和配位原子:硬酸包括a类金属离子(碱金属、碱土金属 Ti4+、Fe3+、 Cr3+、H+)硬碱包括F-、OH-、H2O、NH3、O2-、CH3COO-、PO43-、SO42-、CO32-、ClO4-、NO3-、ROH等软酸包括b类金属离子Cu+、Ag+、Hg2+、Pt2+ Au+;Cd2+; Pd2+、Hg2+及M0等软碱包括I-、SCN-、CN-、CO、H-、S2O32-、C2H4、RS-、S2-等交界酸包括Fe2+、Co2+、Ni2+; Zn2+、Pb2+、Sn2+、Sb3+、Cr2+、Bi3+ 、Cu2+等,交界碱包括N3-、Br- 、NO2-、N2 、SO32-等皮尔孙提出的酸碱反应规律为:“硬酸优先与硬碱结合,软酸优先与软碱结合。
”这虽然是一条经验规律,但应用颇广:①取代反应都倾向于形成硬 - 硬、软 - 软的化合物。
②软-软、硬-硬化合物较为稳定,软 - 硬化合物不够稳定。
③硬溶剂优先溶解硬溶质,软溶剂优先溶解软溶质,许多有机化合物不易溶于水,就是因为水是硬碱。
分析化学中硬软酸碱原则

光谱分析技术如红外光谱、核磁共振谱和紫外光谱等可用于研究分子结构和化学键。硬软酸碱原则在 这些技术中的应用有助于理解光谱峰值的位移、强度和形状,从而推断出分子中的硬度和电子密度分 布情况。
硬软酸碱原则在色谱分析中的应用
总结词
而提高分离效果和 检测灵敏度。
原理
硬软酸碱原则认为,在酸碱反应中,硬酸与硬碱反应生成稳 定的络合物,而软酸与软碱反应生成不稳定的络合物。此外 ,硬酸和软碱、软酸和硬碱之间的反应则介于两者之间。
02
硬软酸碱原则在分析化学中的重要性
区分和预测物质的性质
硬酸
具有紧密的电子云,倾向于形成稳定的正离子或 共价键,表现出强烈的正电性。常见的硬酸包括 金属离子(如钠、钾、铜、银等)和某些非金属 离子(如氢离子)。
硬碱
具有稳定的负离子或电子,倾向于与硬酸形成稳 定的配位键。常见的硬碱包括氧、硫、卤素等负 离子和某些电子给予性的共轭碱。
软酸
具有松散的电子云,倾向于形成不稳定的正离子 或共价键,表现出较弱的正电性。常见的软酸包 括非金属离子(如氯、硫、磷等)和某些金属离 子(如汞、铅、锡等)。
软碱
具有不稳定的负离子或电子,倾向于与软酸形成 较弱的配位键。常见的软碱包括某些电子给予性 的共轭碱和中性分子。
详细描述
在色谱分析中,固定相和流动相的选择对于分离效果至关重要。了解样品的硬度和酸碱 性质后,可以针对性地选择具有相反性质的固定相和流动相,从而实现更好的分离效果。 此外,了解样品与固定相之间的相互作用也有助于优化色谱条件,提高检测灵敏度和准
确性。
04
硬软酸碱原则的局限性与发展方向
当前研究的不足之处
详细描述
硬酸和硬碱之间的相互作用通常比较直接和强烈,而软酸和软碱之间的相互作 用则比较微弱和间接。在化学分析中,了解物质的硬度和酸性或碱性强度有助 于预测它们之间的反应性、反应速度和产物性质。
软硬酸碱理论在有机化学中的应用
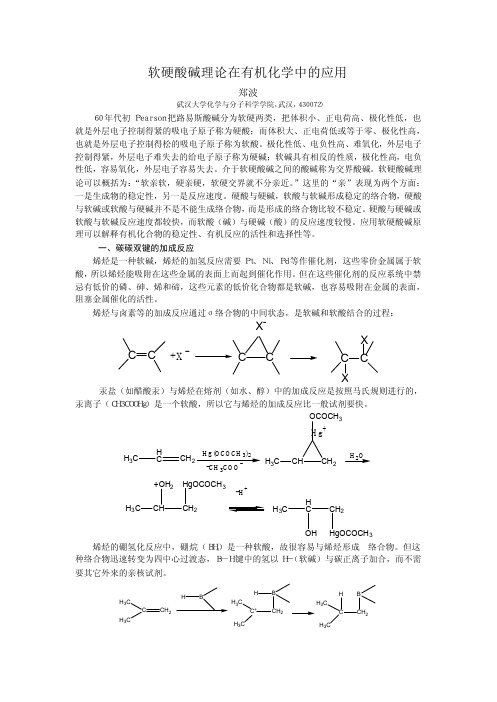
控制得紧,外层电子难失去的给电子原子称为硬碱;软碱具有相反的性质,极化性高,电负
性低,容易氧化,外层电子容易失去。介于软硬酸碱之间的酸碱称为交界酸碱。软硬酸碱理
论可以概括为:“软亲软,硬亲硬,软硬交界就不分亲近。”这里的“亲”表现为两个方面:
一是生成物的稳定性,另一是反应速度。硬酸与硬碱,软酸与软碱形成稳定的络合物,硬酸
CH3
O
CH3
O
H3C
H CC
sa
C
CH3+CN-
sb
H2 H3C C C C CH3
CN
在亲核试剂与α,β-不饱和羰基化合物的加成中,随试剂的软硬度不同,得到的 1,
2 和 1,4 加成产物的比例也不同。例如,不同的 Grignard 试剂的硬度顺序为:
CH3
CH3
CH3MgX
CH3CH2MgX
REFERENCES:
胡宏纹 有机化学 北京 高等教育出版社 1990
任友达 酸硷理论及其在有机化学中的应用 北京 人民教育出版社,1997.178~242
史达清 马飙 软硬酸硷原理在有机化学中的应用 徐州师范大学学报(自然科学版)V01.16,N0.1,1998 30~35
李改枝,红霞 软硬酸碱原理与两可反应 大学化学 V0115,N01,2000,45~47
利水解。因为 HO-是硬碱,酰基碳是硬酸,反应时 HO-易进攻酰基碳而 RS-是软碱,酯分子中
的烷基碳原子是较软的酸,所以 RS-易进攻烷基碳经烷氧键断裂后,生成羧基负离子和硫醚。
R
C
OCH2R'+RS -
R
C
O-+RSCH 2R'
O
O
第七章 硬软酸碱原理
(四) 电子理论-路易斯(Lewis)
1923年,Lewis提出了更为广义的酸碱电子论:凡是能接受电子对的任何分
子、离子或原子团统称为酸,又称为电子对受体;凡是含有可给出电子对的分子、
离子或原子团统称为碱,又称为电子对给体。Lewis酸碱反应,实质上是形成配位 键,产生加合物。
Me H
BMe3 + NH3
Me B N H
Me H
BF3 + OEt2
F FB
F
Et O
Et
常见的Lewis酸有 SO3、 BF3、 AlCl3、 SnCl4、 FeCl3、 ZnCl2、 H+、 Ag+、 Ca2+、 Cu2+等等。
常见的Lewis碱有C5H5N、(C2H5)2O、NH3、(CH3)3N、C6H5NH2、OH-、 CO32-、HCO3-、SH-、CH3CO2-等。
缺点:(1) 把酸的性质局限于水溶液中,从而对当时已知的化学事实产生了一系列的问 题,如纯净的氯化氢气体是不是酸?熔融的碱是不是碱?
(2) 从理论和实践上看,质子(即氢正离子)在水溶液中难以独立存在,需与水 分子发生相互作用,生成水化离子。
(二)溶剂理论-富兰克林( Franklin )
1905年,英国化学家富兰克林提出了著名的酸碱溶剂理论。
这两种理论在有机化学中一直是兼容的,而且往往用于不同的场合。
重要性及优点:能说明不含质子的物质的酸碱性,如金属阳离子、缺电子化合 物、极性双键分子(典型的羰基分子)、价层可扩展原子化合物(某些P区元素的配 合物)、具有孤对电子的中性分子、含有C=C键分子(典型的蔡斯盐);应用最为广 泛。
软硬酸碱的概念简介与应用发展
软硬酸碱的概念简介与应用发展梁晓进(西北大学化学系05级材料化学专业 西安 710069)摘要:对软硬酸碱的概念, 以及一个重要规则—SHAB规则进行简述,并就SHAB规则对化学研究和实际应用方面的重要作用加以探讨。
关键词:软硬酸碱应用规则发展一软硬酸碱的概念简介实际上,酸碱本身就是一个十分普遍的东西,而酸碱的定义,则由阿仑尼乌斯酸碱发展到了Lwies酸碱再到了后来的布郎斯特酸碱。
可以明显看出,定义的范围变的越来越大了,进而对酸碱的理解也越来越深刻了。
事实上,广义的酸碱包括的种类极为广泛,绝大多数化合物皆可以看作是酸碱的加合物,而所有的化学反应中,除了氧化还原反应外,皆属酸碱反应。
当然,在酸碱这么大的一个范围中,我们可对其进行一定的分类。
根据Lwies 酸碱电子论的定义,认为在反应中能给出电子对的物质是碱,能接受电子对的物质是酸。
在配合物中,中心离子是电子对的接受体是Lwies酸,配位体是电子对给予体是Lwies碱。
1963年皮尔逊(pearson)提出了软硬酸碱(soft and herd acids and bases,简称SHAB概念),即根据酸碱对外层电子对的控制程度,应用了“软”与“硬”对其进行了分类,把接受孤对电子能力强,对外层电子对吸引紧,没有易极化的电子轨道,电荷半径比较大的金属离子叫硬酸,把接受电子能力弱,对外层电子抓地松,易极化,电荷半径比较小的叫软酸,介于二者之间的离子叫“交界酸”。
按同样的道理也可以把配体分为软、硬、交界三类。
给出电子对的原子电负性大,对外层电子吸引力强,不易失去电子,变形性小的叫做“硬碱”,给出电子对的原子电负性小,对外层电子吸引力弱,易给出电子,变形性大的叫做软碱,介于二者之间的就称作交界碱。
这些定义下面给予详细说明:硬碱:电负性大(吸引电子能力强)、半径小,难氧化(不易失去电子),不易变形(难被极化)的原子,以这类原子为配位原子的碱,称为硬碱,如:N、O、F 等。
软硬酸碱原理
软硬酸碱原理展开全文名称软硬酸碱原理又称软硬酸碱原则或规则,是估计金属离子与配位体形成络合物趋势及其稳定性定性判断的原则。
由皮尔逊(R.G.Pearson)于1963年提出的。
原理原理为:硬酸倾向与硬碱结合,软酸倾向与软碱结合。
交界酸与软、硬碱虽能结合,但较前两者的倾向要小,较不稳定,且反应较慢。
原理解释:所谓硬酸指正电荷高、体积小、极性低、不易变形和失去电子,即对外层电子吸引力强的路易斯酸。
包括H+、周期系中A 类金属离子(如Li+、Na+、Be2+、Mg2+等)、某些过渡金属离子(如Mn2+、Cr2+、Fe3+等)和BF2、AlCl3、Cl7+、l5+等。
所谓硬碱指不易失去电子、电负性高、难变形、不易被氧化,即对外层电子吸引力强的路易斯碱。
包括H2O、OH-、O2-、F-、CO32-、NO3-、SO42-、RO、R2O、F2、O2、N2等。
所谓软酸指正电荷少或为零、体积大、积化性高、易变形,即对外层电子的吸引力弱的路易斯酸。
包括Cu+、Ag+、Au+、Hg+及I2、Br2、O、Cl、三硝基苯等。
所谓软碱指易失去电子、电负性低、易极化变形、易被氧化,即对外层电子吸引力弱的路易丝碱。
包括H-、I-、S2-、CN-、CO、C2H4、C6H6、烯烃、芳烃等。
应用这原理可预断形成络合物的稳定性及化学反应的可能性。
在无机、有机化学及水环境化学中均有应用。
入水体中的OH-将优先于Fe3+、Mn2+等硬酸作为中心离子络合而成羟基络离子或氢氧化物沉淀。
S2-则易与Hg2+、Cd2+等形成多硫络离子或硫化物沉淀。
在自然界中矿物存在的形式,硬金属(如Ca、Mg、Ba、Al等)多以氧化物、氟化物、碳酸盐、硫酸盐等形式存在,这是由于O2-、F-、CO32-、SO42-都是硬碱;而软金属Cu、Ag、Au、Zn、Pb、Hg、Co、Ni等多以硫化物形式存在,这是因S2-是软碱之故。
其它如软金属Pt、Ni等催化剂易与那些气体反应而中毒等问题也可根据这一原理加以解释与预断。
软硬酸碱理论及在合成中应用
软硬酸碱理论及在合成中应用科学家在研究亲核反应时发现某些亲电中心如RCO+、H+等很容易和某些不易极化的试剂如F-、OH-等反应,而另一些亲电中心如R+、Br+等很容易和一些易极化的试剂如I-、CN-等反应,故提出了酸碱的硬度和软度的概念。
因为有机物也是可以被作为酸碱两部分来处理,一旦将酸碱分为软硬两部分,便出现了一条简单的规则:既硬酸优先和硬碱结合,软酸优先和软碱结合。
酸碱的硬度或软度的特点可定性的表述如下:硬酸:具有较高的正电荷,亲电中心原子较小,一般外层没有孤电子对,用分子轨道理论描述是最低未占轨道(LUMO的能量高。
常见的硬酸如RCO+、H+、碱金属和碱土金属正离子、Al3+、Fe3+、BF3等。
软酸:具有较低的正电荷,亲电中心原子较大,一般外层有孤电子对,LUMO的能量较低。
常见的软酸如过度金属离子Cu+、Ag+、I2、Br2、RC+、BF3和卡宾等。
硬碱:亲核中心电负性强,极化度低,难被氧化,吸附外层电子的能力较强;用分子轨道理论描述是最高已占轨道(HOMO)的能量较低。
常见的硬碱如F-、OH-、AcO-、Cl-、CO32-、SO42-、NO3-、RO-、ROH、RNH2、NH3等。
软碱:亲核中心电负性弱,极化度大,易被氧化,吸附外层电子的能力较弱;HOMO的能量较高。
常见的软碱如I-、CN-、SR-、H-、R2S、CO、(RO)3P 等。
但软度和硬度划分并不严格,不少酸碱可以纳入交界类型。
一般同周期中的元素从左到右如CH3-、NH2-、OH-、F-硬度增加;同族元素从上到下F-、Cl-、Br-、I-硬度减小;同一试剂一般讲电负性较大的原子为硬端,如-CN中N 端为硬端而C端为软端。
对亲电中心,中心部位的电正性越强越硬,RCO+比RC+硬;不同的卤代烃中,卤素电负性越大,它连接的碳越硬;此外同一原子软硬度也不是固定不变的,随其电荷数改变而改变如SO42-为硬碱,S2O42-为软碱,SO32-为交界碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
参考文献
l任友达.酸碱理论及其在有机化学中的应用.北京:人民教育出版社,1982.192—193,216 2张黯.有机化学选论.第二辑.北京:高等教育出版社,1987.133—137 3曾绍琼.有机化学.第三版.北京:高等教育出版社,1996.430
4何子乐.有机化学中的硬软酸碱原理.北京:科学出版社,1987.30
m+SCN一——+RSCN
0 0
而scN一与R.ocl反应时,酰氯是硬亲电试剂,易与SCN一中较硬的部分N原子结合:
O
0
砖一I C_一Cl+SCN一——+I卜el —NCS
即软一软结合,硬一硬结合,生成各自稳定的化合物。 总之,在两可反应中,反应物或试剂有两个反应部位,其中一端较硬,另一端较软,只要确
2烯醇化合物的C.烷基化和。烷基化
烯醇化合物有两个反应中心,即碳负离子的碳和烯醇负离子中的氧。在不同的反应条件 下,反应可以主要发生在碳上,也可以发生在氧上。
.
例如乙酰乙酸乙酯负离子具有两个反应活性中心,即碳负离子的碳和烯醇负离子的氧,是 一种两可离子,当它在碱性乙醇溶液中与伯卤代烷反应,主要得到C一烷基化产物;与卤代醚反 应,主要得到O一烷基化产物:
另外,格氏试剂与卤氰反应也符合软亲软、硬亲硬的原则:
ClCN
广—一RcN+Mg)(a RM薛—1 I州
。———1。Rl+MgXl:N
烷基负离子(R一)为软碱,当格氏试剂与ClCN反应时,软的CN+与R一结合成腈,而格氏试剂与
ICN反应时,软的I+与R一结合成碘代烷。
5硫氰酸根负离子的反应
在硫氰酸根负离子中,硫原子一端是较软的,氮原子一端是较硬的,当SCN一与m反应时, 由于RI是软亲电试剂,易与两可离子SCN一中软的部分S原子结合:
0
0
0
0
cH3一9(’—_C}}一8 C—OQH5—c}—hI cH厂C—8C}}一(}0一0c2H5
CH3 十 0
c}一
9
9cH20cH3
l
ClcH,00H;
cH3一C—C盱一C一0QH5——二—j CH3一c—C廿一e—OQH5
0
得到的C.烷基化和0.烷基化产物符合软亲软、硬亲硬的原则,即乙酰乙酸乙酯负离子中,C一端
两可反应物或试剂有两个不同的反应中心,因此,在进行化学反应时,具有一定的选择性, 其反应选择性遵循软硬酸碱原理。
1酯的酰氧键和烷氧键断裂反应
酯的碱性水解大多数按以下历程进行:
0一
忙C<R+一。H当卜}伽些归C<R+R,。一卫垡髓。。一州伽
0R’
OH
在反应过程中,HO一进攻酰基碳形成四面体结构,然后酯分子发生酰氧键断裂。如果酰基碳上
\
/
N02
N02
碱,与苯环相连,使苯环碳原子软化,故2,4.二硝基氯苯中与氯原子相接的碳较2,4.二硝基碘
苯中与碘原子相接的碳硬,因此它们分别与亚硝酸根反应时,前者与较硬的O一端结合,生成亚 硝酸酯;后者与较软的N一端结合,生成硝基化合物:
46
万方数据
◇№一一命m
由Q
南Q
№+N02一——
4+卤氰的反应
卜C0 _∞耻‘ _盼——R_C_0I 。+蹴娜’‘
0
0
又如,13一丙内酯与以下三种负离子的反应:
GH2一O CH2一e一0
RO一(1lb)
ROOCC№CH20—
NCC啦C啦C00一
RSc№C啦C00—
45
万方数据
由于试剂的软硬度不同,显然与酯作用的位置也不同,从而得到不同的产物。R0一为硬碱,与 硬酸酰基碳作用;而CN一和RS一为软碱,易与软酸烷基碳作用,其中CN一又是两可负离子,C 端较N端软,因此C端比N端更易与酯中烷基碳作用,得到产物腈,而不是异腈。
第15卷第1期
火予片乞乎
2000年2月
软硬酸碱原理与两可反应
李改枝 红霞
(内蒙古师范大学化学系 呼和浩特010022)
摘要在有机反应中,两可反应物或两可试剂的反应符合软硬酸碱原理。它们具有两个不同 的反应中心,只要确定了各自的软硬部位,反应按照软亲软,硬亲硬的原则进行。
有机物的化学反应与其分子结构密切相关,在某些有机分子中,同时具有两个反应部位, 这些反应部位往往可以通过互变异构或中介现象而互相联系,我们称这种反应物或试剂是两 可的。它们与含有简单双官能团的化合物有本质的区别。
为软碱,O.端为硬碱;而CH3I为软酸,CH30CH2Cl为硬酸,因此,前者生成C一烷基化产物,后者 生成0一烷基化产物。
3亚硝酸盐的烃化
亚硝酸根负离子也有两个反应中心,即O和N,当它与卤代烃反应,若以N原子作为亲核 原子时,生成硝基化合物,以O原子作为亲核原子时,得到亚硝酸酯:
0
0
O
0 :N一0一
连有体积较大的基团,如三异丙基乙酸酯:(c旷车峨C_C_oR,,在一般条件下,它难于进行碱
0
CH3
O
性水解,而硫醇盐却能通过烷氧键断裂使其顺利水解。因为HO一是硬碱,酰基碳是硬酸,反应
时HO一易进攻酰基碳I卜c_oC№R,;而RS一是软碱,酯分子中的烷基碳原子是较软的酸,所以 Iha)
O
RS一易进攻烷基碳R.C_萨蹴,,经烷氧键断裂后,生成羧基负离子和硫醚。 0 0
下载时间:2011年3月10日
卤氰可与烯胺发生反应:
O
C妞q
№0
oo
旦◇班
氯化氰与烯胺得到a.氰基酮,溴化氰则得到a一溴代酮,根据软硬酸碱原理可知试剂的软度顺序
几科燃 为:Br+>cN+>cl+,而烯胺分子中与Br+或eN+结合的碳为软碱,6
\>,烯胺与
\
/
\/
ClCN反应时,软的CN+与碳结合;同样,烯胺与BrCN反应时,也是较软的Br+与碳结合。
.
47
ቤተ መጻሕፍቲ ባይዱ
万方数据
软硬酸碱原理与两可反应
作者: 作者单位: 刊名:
英文刊名: 年,卷(期): 被引用次数:
李改枝, 红霞, Li Gaizhi, Hong Xia 内蒙古师范大学化学系,呼和浩特,010022
大学化学 UNIVERSITY CHEMISTRY 2000,15(1) 2次
参考文献(4条) 1.任友达 酸碱理论及其在有机化学中的应用 1982 2.张黯 有机化学选论 1987 3.曾绍琼 有机化学 1996 4.何子乐 有机化学中的硬软酸碱原理 1987
0 II
所以仲卤代烷较伯卤代烷硬,结果仲卤代烷与*o一中的0.端结合,生成亚硝酸酯;伯卤代烷
较软,与软的N一端结合,生成硝基化合物。
另外,一个原子的软硬度还与它所连接的原子或原子团有关。例如:
厂—_、厂—_、
c“o卜N02和“o卜N02,cl一是硬碱,与苯环相连后,增强了碳原子的硬度,而I一是软
\
/
+RCH2X——+RCH2一N一0 0一
+
I|
RC}i厂O—N:
实验证明,伯卤代烷主要得到硝基化合物;仲卤代烷主要得到亚硝酸酯。例如:
CH3(CH2)6CH2I+越一03——+cH3(cH2)6cH2N02
R2CHx+AgN03—+R2CI{0NO
由于亚硝酸根负离子中氧端较硬,氮端较软,而卤代烃随烃基的增加,中心碳原子的硬度增加,
引证文献(2条)
1.崔玉民 两可亲核试剂在亲核取代反应中的作用[期刊论文]-阜阳师范学院学报(自然科学版) 2005(4) 2.王晓兰 浅析"硬软酸碱原理"在有机化学教学中的运用[期刊论文]-陕西教育学院学报 2002(3)
本文链接:/Periodical_dxhx200001014.aspx 授权使用:四川大学(scdx),授权号:8c04647d-8518-4557-8248-9ea201609925
