美国新药申请手续
美国FDA新药注册申报NDA流程简介

美国FDA新药注册申报NDA流程简介
美国FDA(Food and Drug Administration)是负责监管药品的安全性和有效性的机构。
NDA(New Drug Application)是制药公司向FDA提交的新药注册申报文件,它是提交给FDA以申请新药上市的必要步骤。
NDA的流程可以大致分为以下几个步骤:
1.前期研究:制药公司在研发新药之前通常会进行多个阶段的临床试验,以评估新药的安全性和有效性。
这些临床试验的结果将用于NDA中。
2.提交申请:在完成所有必要的研究和试验后,制药公司将准备并提交NDA申请给FDA。
这个申请包括新药的所有相关信息,如药物成分、制造过程、稳定性、临床试验结果、药品标签等。
3.文件审查:FDA会对提交的NDA进行审查,确保申请文件的完整性和合规性。
如果发现不完整或有疑问的地方,FDA可能会请求补充信息或进一步解释。
4.审查评估:FDA的药品审评员会对申请进行详细评估,根据临床试验数据、药物的安全性和有效性等因素,来判断是否批准新药上市。
审评员可能会与制药公司进行沟通,提出问题或寻求进一步资料。
5.决策:基于审评员的评估和建议,FDA会做出决策,即批准或拒绝新药的上市申请。
如果批准,FDA会制定药品标签和使用说明等要求。
需要注意的是,整个NDA流程可能需要一段时间,通常需要
几年的时间来完成。
此外,FDA还有一些快速审评程序,如加速审评、优先审评等,可以加快某些重要新药的审批速度。
【医疗药品管理】FDA新药申请指南
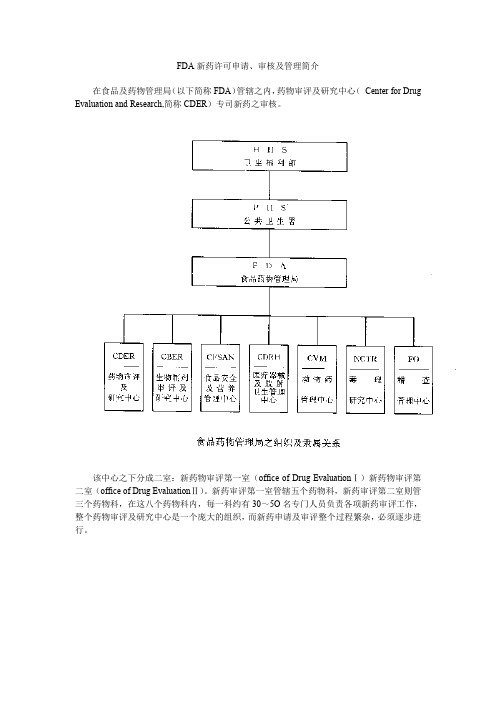
FDA新药许可申请、审核及管理简介在食品及药物管理局(以下简称FDA)管辖之内,药物审评及研究中心(Center for Drug Evaluation and Research,简称CDER)专司新药之审核。
该中心之下分成二室:新药物审评第一室(office of Drug EvaluationⅠ)新药物审评第二室(office of Drug EvaluationⅡ)。
新药审评第一室管辖五个药物科,新药审评第二室则管三个药物科,在这八个药物科内,每一科约有30~5O名专门人员负责各项新药审评工作,整个药物审评及研究中心是一个庞大的组织,而新药申请及审评整个过程繁杂,必须逐步进行。
药物审评及研究中心(Center for Drug Evalution and Research,CDER)之组织说明如下:1.秘书室(Executive Secretariant Staff)2.总务室(Office of Management)(l)药物资记中心(Drug Information Resource)(2)医学图书馆(Medical Library)(3)总务及王计(Management and Budget)(4)资讯系统设计(Information System Design)3.专业进修室(Professional Development)4.顾问团(Advisors and Consultants Staff)5·前导性新药审评(Pilot Drug Evaluation)6.非处方药审评室(office of OTC Drug Evaluation)(1)单篇非处方药审评室(MonograPh Review Staff)(2)非处方药政策性科(OTC Drug Policy Staff)(3)医学审评科(Medical Review Staff)7.非专利处方药室(office of Generic Drugs)(1)化学第一科(ChemistryⅠ)(2)化学第二科(ChemistryⅡ)(3)生体相等性科(Bioequivalence)8.研究发展室(Office of Research Resources)(1)研究及试验科(Research and Testing)(2)药品分析科(Drug Analysis)(3)生体药学科(Biopharmaceutics)(4)临床药理科(Clinical pharmacology)9.新药标准室(Office of Drug Standards)(l)新药市场广告及信息科(Drug Marketing,Advertising and Communications)10.新药合法性室(Office of Compliance)(1)新药信息科(Drug Labeling Compliance)(2)新药品质审核科(Drug Quality Evaluation)(3)新药产品及制造品质科(Mahufacturing and Product Quality)(4)科学性侦查科(Scientific Investigations)(5)新药管理科(Regulatory Affairs)11.新药流行学及统计生物学室(Office of Epidemiology and Biostatistics)(1)流行学及监视科(Epidemiology and Surveillances)(2)生物统计科(Biometrics)12.新药审评第一室(Office of Drug EvaluationⅠ,ODEI)(1)心脏药物科(Division of Cardio-Renal Drug Products)(2)神经药物科(Division of Neuropharmacological Drug Products)(3)肿瘤肺药物科(Division of Oncology and Pulmonary Drug Products)(4)影像、手术及牙药物科(Division of Medical Imaging Surgical and Dental Drug Products)(5)胃肠及凝血药物科(Division of Gastrointestinal and Coagulation Drug Products)13.新药审评第二室(Office of Drug Evaluation Ⅱ, ODE Ⅱ)(1)新陈代谢及内分泌药物科(Division of Metabolism and Endocrine Drug ProductS)(2)抗传染药物科(Division of Anti-Infective Drug Products )(3)抗病毒药物科(Division of Anti—Viral Drug ProductS)二、新药申请(一)药物的定义依据联邦食品药物及化妆品法第二章第201节,药物的定义如下:l.美国药典,同种治疗法药典,或者国家处方集(National Formulary)中所列的物质。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)负责监管并审批新药的上市。
下面将对FDA新药审批流程进行简述。
1.阶段Ⅰ临床试验:新药首先在健康志愿者身上进行,评估药物的安全性和耐受性,并确定药物的剂量范围。
2.阶段Ⅱ临床试验:新药在患者身上进行,评估药物的疗效和副作用。
试验时间较长,研究人员需要收集更多的数据,以确定新药的安全性和效力。
3.阶段Ⅲ临床试验:新药在大规模患者群体身上进行,以证明其疗效和安全性是否持久有效,并与现有的治疗方法进行比较。
4.新药申请:药企将试验结果提交给FDA,并申请新药上市批准。
包括药物的数据和试验结果,使用方法等。
FDA会评估申请材料。
5.NDA审批:NDA(新药申请)包括对药物研究的细节、试验结果等的描述。
FDA对NDA进行评估,确定药物是否符合上市标准。
此过程可能需要数月或数年。
6.审查:FDA将药物进行详细审查,并与药企进行沟通,以充分了解药物的性质和潜在的风险。
7.审查会议:FDA可能会召开药物审查会议,邀请专家、学者和公众就药物的疗效和风险发表意见。
8.确认上市:如果FDA认为新药符合上市标准,将发出批准通知,允许药企将新药投入市场销售。
以上是FDA新药审批流程的简要概述。
在流程中,FDA扮演着保障公众健康和安全的角色,确保新上市的药物是安全有效的。
FDA New Drug Approval Process OverviewThe FDA (U.S. Food and Drug Administration) is responsible for regulating and approving new drugs for market. The following is an overview of the FDA's new drug approval process.1. Phase I Clinical Trials: The new drug is first tested on healthy volunteers to assess its safety and tolerability and determine the dosage range.5. NDA Approval: The NDA (New Drug Application) includes a detailed description of the drug's research, trial results, etc. The FDA evaluates the NDA to determine if the drug meets the approval standards. This process can take months or years.7. Review Meetings: The FDA may hold drug review meetings where experts, scholars, and the public are invited to provide opinions on the drug's efficacy and risks.9. Post-Market Surveillance: The FDA continues to monitor the drug's safety and effectiveness, collects feedback from the market, and takes necessary actions, including further research and updating warning labels.The above is a brief overview of the FDA's new drug approval process. Throughout the process, the FDA plays a crucial role insafeguarding public health and safety, ensuring that newly marketed drugs are safe and effective.。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)是负责监督和管理美国食品和药品安全的联邦机构。
它负责确保市场上的药品是安全有效的,并且符合严格的审批标准。
新药审批是FDA的主要职责之一,它是一个复杂且漫长的过程,通常包括以下几个步骤:1.提交新药申请(NDA)首先,药物制造商需要通过NDA向FDA提交有关新药的完整资料。
这些资料通常包括药物的化学成分、制造工艺、药理学研究、临床试验数据以及用于治疗的适应症等信息。
此外,还需要提供药物的质量、安全和有效性的证据。
2.评估申请文件一旦FDA收到NDA,会对申请文件进行评估。
这个过程通常包括对文件的完整性和合规性的审查,例如核实所有必需的资料是否齐全。
如果缺少必要的信息,FDA可能会要求制造商提供补充材料。
3.优先审批对于一些药物,FDA可能会给予优先审批待遇。
例如,对于治疗一些严重疾病的新药,FDA可能会加快审批速度,以符合患者的迫切需求。
4.临床试验阶段一旦FDA确认NDA文件完整无误,药物制造商可以开展临床试验。
临床试验是评估药物疗效和安全性的关键步骤,通常分为三个阶段(I、II、III)。
这些试验需要遵守严格的方案和伦理规定,以确保患者的安全和药物的有效性。
5.申请审核委员会的审查在临床试验结束后,药物制造商将向FDA提交试验结果,并要求FDA审核审查委员会对其进行审查。
审查委员会是由FDA专家组成的独立机构,他们会仔细评估试验结果以及相关数据和文献,并发表意见。
这些意见对于FDA的最终决策具有重要影响。
6.申请批准在经过临床试验和审查后,FDA将根据收集到的数据和顾问委员会的意见,决定是否批准新药上市。
如果FDA认为药物的风险和益处之间的平衡是积极的,它将批准新药,并颁发批准证书。
7.监督上市后安全性一旦新药获得批准,FDA对其进行监督,以确保其安全性和真实性。
制造商需要持续向FDA提供有关药物的安全性和有效性的信息。
此外,FDA还通过药物安全盛会进行监测,并与制造商和医疗专业人员合作,收集和分析有关药物的副作用和其他安全问题的信息。
fda申请流程

fda申请流程
美国食品药品监督管理局(FDA)的药品审批流程如下:
1. 新药仿制品开发阶段:研发人员在进行药物开发过程后,把研发成果提交给FDA审核。
2. 预申请(Pre-IND)阶段:申请者向FDA提交一份详细的文件,描述了要研究的药物,提供了初步的安全性和效力证据,以及可支持药物的基本药学特性。
FDA将回复申请者,要求其提供有关clincial trials的资料及其他额外信息。
3. 申请阶段(IND):申请者向FDA提交IND文件,包括临床前及临床试验的原始资料及数据,以证明药品安全性和有效性。
4.研究人员在FDA获得批准后,可以正式开展药物临床试验,在各个阶段进行临床研究,收集临床数据,并分析和评估药物的安全性和有效性。
5. 提交表决材料:在数据收集和临床试验阶段结束后,申请者可以向FDA提交申请文件,提供有关临床研究的报告和数据,并解释其研究结果及证据。
6. FDA审查:FDA将审查申请所提供的所有文件及数据,进行详尽的评估,确保药物质量满足有关标准,药物安全有保障,和效果可满足期望。
7. FDA作出批准或拒绝决定:根据审核结果,FDA将向申请者发出相关文件,批准或者拒绝其新药仿制品的申请。
欧美新药注册介绍和案例

欧美新药注册介绍和案例欧美新药注册是指将新的药物推向市场之前,必须经过一系列严格的审查和验证程序,确保其安全性、有效性和质量。
在欧美,新药注册通常需要进行临床试验、获得批准、监测和报告等步骤。
本文将介绍欧美新药注册的整体流程,并通过案例分析其具体应用情况。
欧美新药注册流程通常分为以下几个主要阶段:1.预临床阶段:在试验室和动物模型中评估药物的毒理学、药代动力学、药物相互作用等特性。
这一阶段的目标是确定药物是否具有潜力用于治疗人类疾病,并确定其安全性。
2.临床试验阶段:将药物用于人体进行试验,以确定其安全性和有效性。
临床试验分为三个阶段:(1)第I期试验:在健康志愿者中进行,主要评估药物的药代动力学、毒理学和耐受性。
(2)第II期试验:在患者中进行,主要评估药物的疗效、剂量反应关系和副作用。
(3)第III期试验:在大量患者中进行,用于确认药物的疗效和安全性,并与现有治疗方案进行比较。
3.注册申请:在完成临床试验后,药企可以向监管机构提交注册申请。
这些申请文件通常包括药物的质量控制、制造过程、药代动力学、毒理学和临床数据等。
4.批准和监管:监管机构将对注册申请进行评估,并根据药物的疗效、安全性和质量决定是否批准上市。
注册通过后,监管机构会继续监督药物的安全性和有效性,药企需要定期提交监测和报告。
下面我们通过一个案例来了解具体的欧美新药注册流程。
以美国食品药品监督管理局(FDA)为例,根据其官方网站提供的信息,我们了解到Imfinzi(durvalumab)是一种用于治疗晚期肺癌的免疫治疗药物。
1.预临床阶段:Imfinzi在机体内的药物动力学和毒性特性通过预临床评估得到初步验证,并显示出潜力用于治疗晚期肺癌。
2.临床试验阶段:Imfinzi进行了一系列的临床试验,其中包括:(1)第I期试验:对健康志愿者进行试验,验证药物的安全性和药代动力学。
(2)第II期试验:对晚期肺癌患者进行试验,评估药物的疗效和副作用。
FDA新药审批流程

从FDA新药审批流程来推算HIP成为新药的最快时间大家一直对cureDM公司的HIP很关注,确实,如果基于此原理的新药对人体有效并安全的话,无疑是大家的福音。
不过自从2010年4月cureDM和Sanofi-aventis 公司达成对于HIP全球独占专利许可协议后,该药的研发一直没有消息,论坛中很多人都很失望。
在此,通过简单分析,来看看这个药如果真的研发成功,需要等多久我们才能用到。
FDA新药审批流程如下:临床前试验:由制药公司进行的实验室和动物研究,以观察化合物针对目标疾病的生物活性,同时对化合物进行安全性评估。
这些试验大概需要3.5年的时间。
研发中新药申请(Investigational New Application,IND):在临床前试验完成后,公司要向FDA提请一份IND,之后才能开始进行药物的人体试验。
如果30天内FDA没有发出不予批准的申明,此IND即为有效。
提出的IND需包括以下内容:先期的试验结果,后续研究的方式、地点以及研究对象;化合物的化学结构;在体内的作用机制;动物研究中发现的任何毒副作用以及化合物的生产工艺。
另外,IND 必须得到制度审核部门(the Institutional Review Board)的审核和批准。
同时,后续的临床研究需至少每年向FDA提交一份进展报告并得到准许。
临床试验,I期:此阶段大概需要1年时间,由20~80例正常健康志愿者参加。
这些试验研究了药物的安全性方面,包括安全剂量范围。
此阶段的研究同时确定了药物在体内的吸收、分布、代谢和排泄、以及药物的作用持续时间等项目。
临床试验,II期:此阶段需要约100到300名志愿患者参与进行一些控制研究,以评价药物的疗效。
这个阶段大约需要2年时间。
临床试验,III期:此阶段持续约3年时间,通常需要诊所和医院的1000~300名患者参与。
医师通过对病患的监测以确定疗效和不良反应。
新药申请(New Drug Application,NDA):通过三个阶段的临床试验,公司将分析所有的试验数据。
一文读懂FDA新药注册流程

一文读懂FDA新药注册流程FDA(美国食品药品监督管理局)是一个负责监管和审批新药上市的机构。
其新药注册流程遵循一系列严格的标准和程序,确保新药的安全性和有效性。
以下是一份详细的描述FDA新药注册流程的1200字以上文章。
FDA新药注册流程是一个复杂而严格的过程,旨在保护公众的健康和安全。
该流程通常分为三个主要阶段:实验室研究、临床试验和申请审批。
首先,在实验室研究阶段,新药的发现和开发开始于基础科学研究。
科学家们进行一系列的实验,以验证一些化合物是否具有潜在的治疗效果。
这个阶段的目标是鉴定和筛选出可能的药物候选。
一旦确定了潜在的候选者,科学家会继续开展研究,并了解药物的药动学、药理学和安全性。
接下来,进入临床试验阶段。
在这个阶段,新药候选者将在人体中进行测试。
临床试验是一系列严格控制的研究,其目的是评估药物的安全性和有效性。
临床试验分为三个阶段,每个阶段都有不同的目标和参与人数。
第一阶段的临床试验是对一小群健康志愿者进行的,目的是评估药物的安全性和耐受性,并确定适当的剂量。
这个阶段通常只涉及数十名志愿者,并在医院或临床研究中心进行。
第二阶段的临床试验是在相对较大的患者群体中进行的,通常包括数百名患者。
这个阶段的主要目标是确定药物的疗效,并进一步评估安全性。
经过第二阶段的临床试验,确定了相对安全和有效的药物剂量和用法。
第三阶段的临床试验是最大规模的研究,通常包括数千名患者。
在这个阶段,药物的疗效和安全性将在各种人群中进行全面评估。
这些试验旨在确认药物是否比现有疗法更安全或更有效。
此阶段可能需要数年时间,并需收集大量的数据和信息。
一旦临床试验完成,并证明了药物的安全性和有效性,便可以进入申请审批阶段。
在这一阶段,该药物的制造商将向FDA提交一份申请,申请批准该药物上市。
申请中需要包括所有先前实验室和临床试验的数据和报告。
申请审批是一个详细和复杂的过程。
FDA的专业人员将仔细研究申请中的数据,确保其准确性和可靠性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
美国新药申请手续新药申请可分为两个阶段,即新药临床试验申请(Investigational New Drug Application,简称IND)及新药上市许可申请(New Drug Application,简称NDA)。
1.新药临床试验申请(IND)一般新药试验申请的目的是请求FDA核准进行第一次人体临床试验,不管是否已在美国之外其他各国进行人体试验,只要是在美国申请,需Form FDA1571表。
及Form FDA1572表。
新药试验申请所提出的内容应包括新药的物理化学性质、临床前(pre clinical)或非临床(non clinical),以及健康志愿者(healthy volunteer)或病人使用的经验[若是已在美国以外之国家取得人体试验结果,最重要的资料是第一次在美国进行人体试验的计划书(clinical protocol)]。
进一步说明,新药试验申请至少应包括下列资料:(1)药物的化学名称、分子式、构造、投药方式(口服、注射或其他方法),如无商标名称trade name)亦可先用公司暗码名称(code name)代替。
(2)主要成分及所知之非主要成分(没作用的成分)及所测得之杂物(impurities),并列出成分组成。
(3)供应药物公司的地址。
(4)药物来源,工厂设备(facilities)及质量控制(controls)的资料以说明如何制造、包装等,以确保药物的认定(identity)、效力(strength)、质量(quality)及纯度(purity)。
(5)所有临床前之动物药理实验、毒性试验资料、动物毒性试验,须遵照优良实验室规范(GLP)。
若未遵照是项规定,则应加以说明。
(6)一份依据临床前动物实验的结果—确定该新药物第一次用于人体实验相当安全(reasonably safe)的声明。
(7)一份提供所有相关资料—包括其可能发生副作用之临床研究员手册(Clinical Investigator‘s Brochure)。
(8)一份第一次在美国进行人体试验计划书(Protocol)—该计划书应阐明实验目的、实验手续、药物授予法、参加实验者合格条件及不合格条件(inclusion and exclusion criteria)、处理特别反应或过度反应之方式、实验室血液及尿液检查等。
(9)一份说明书(包括提供学历、经历及医学经验等文件)—证明医生及专业人员有足够能力执行人体试验。
(10)经过研究机构审评委员会(Institutional Review Board)的核准,进行人体试验计划之文件。
(11)一份同意于向FDA提出人体试验申请日起30天开始进行人体试验之声明书。
正如Form FDA1571规定,除非经FDA特准,一般而言,FDA收到新药试验申请日起30天内是不能进行人体试验的。
新药试验申请送达相关的药物审评科评审后,如无问题,FDA也不会通知公司,亦即新药试验公司于30天期限未收到FDA通知有任何异议(objection)时此新药试验申请(IND)即开始生效(in effect)。
换言之食品药物管理局并非“核准”(Approve)IND,而是“反对”而已。
如FDA对该新药申请之临床试验持不同意见,则有临床试验暂缓进行(Clinical hold)之判定,此时公司应充分合作,而补足FDA所要求的资料或实验。
新药试验如无法确定向FDA那一科(Division)申请时,可先以电话查询。
如申请之新药试验有两种药物,一般依具主要疗效(Primary mode function)之药物来决定。
如药物与生物制剂(biologics)或医疗器材(medical device)合并使用时,大致亦依主要疗效(Primary mode function),或经过不同的中心(CDER,CBER或CDRH)讨论而决定管辖权,详细情况请参考,Federal Register,Docket No.91N—0257 V ol 56,No. 225 November 21,1991.2.新药试验进行之阶段(IND phase)(1)当新药试验申请(IND)开始生效后,人体试验即由第一阶段逐步进展到第二阶段、第三阶段。
A.第一阶段(phase1):试验对象一般是健康的志愿者,有时是住院的病人,人数可由数名(5名~10名)到50名左右。
主要目的是试验人体能忍受的剂量及发现可能的副作用(安全性),初期的药物动力学(pharmacokinetics)药物在人体之吸收、分布、代谢、排出等试验也一并进行。
B第二阶段(phase 2):以少数患者(至少100名)为对象,主要目的是为了解该药可能之疗效,亦即临床药理研究以确定药的用途、短期毒性,无反应者(nonresponder),及可一能的药物相互作用(drug interaction)(有效性)。
C.第三阶段(Phase 3):对象是多数的病患,人数在数百人或上千人,此阶段的试验多数需在医学中心(multicenter trials)进行。
这一阶段的试验,可找出适当的疗效剂量(optimal dose range),可与安慰剂(placebo)比较或与有效对照剂(active reference drug)比较,大都需以双盲试验(double-blind test)进行,且较长期服药的副作用、不良作用及与其他药物相互作用等,都可在此阶段中发现。
此第三阶段是整个新药试验主要的试验,因此试验的设计应与FDA协商,通常是在第二阶段完成以后,征求FDA的咨询(end of phase3 meeting)。
(2)新药试验申请(IND)生效后,当人体试验一个又一个阶段进行时,非临床试验(nonclniclstudies)也须同时进行。
因为非临床试验是以动物来评估药物在人体的安全性,听包括的项目及试验的长短应在相关人体试验之前进行:譬如药物对生殖能力及系统的作用须先完成后,才可以进行包括女性健康志愿者或病患之人体试验。
非临床试验可包括以下项目:A.急性毒性试验B.亚急性毒性试验C.长期毒性试验D.致癌性试验E.致突发性试验F.生殖试验a.生殖力影响试验b.致略性试验c.围产期及产后毒性试验G.抗原性试验H.药物依赖性试验I .溶血性试验J.血液共容性试验K.动力学及毒性试验L.其他特别设计之毒性试验除上述的毒性试验外,非临床试验包括下列各项:A.药理实验B.药物动力学实验C.药理/药物动力学实验D.药物之吸收、分布、代谢及排出实验3.新药之申请(New Drug Application,NDA)当人体试验第三阶段完成,所需非临床试验已告结束,则可检具一套资料,向FDA申请新药上市许可之核准,同时需填Form FDA356表。
NDA申请时应具备下列条件:(1)申请信函(cover letter)一份,必须说明申请理由、药物的用途、所附资料内容,并指出临床或非临床方面值得注意的结果。
(2)申请内容目录(index)一份,必须清楚易懂,以利审核。
(3)摘要(summary)一份,说明该药物所有的安全性及有效性(safety and effectiveness)。
(4)化学部分(制造及品质),所提供之有关资料应包括下列各项:A.阐明以下资讯a. 药的本质(drug substance)b.药的产品(drug Product)c.安慰剂(Placebo)d.药品标示(labeling)e.环境影响评估(environmental analysis)B.详述以下项目a.药的认定(drug identity)b.药的效力(drug potency)c.药的品质(drug quality)d.药的纯度(drug purity)(5)化学制造及质量管理方法之确定(methods validation package)(6)药品提示(Labeling)(7)非临床药理及毒理学资料—此一部分中的药理学资料因为不受优良实验室作业规范之管辖并与药的毒性无关,故较易撰写;毒理学方面的试验则需依照优良实验作业规范执行且项声明是否依该规范进行。
毒理实验结果解释很可能因人而易,如有较特殊的发现,应请专家协助撰写特别评估报告。
有关非临床毒性试验包括下列项目:A.急性毒性试验(acute toxicity Studies)B.亚急性毒性试验(subchronic toxicity studies)C.长期毒性试验D.致癌性试验(carcinogenicity Studies)E.致突发性试验(mutagenicity studies)F.生殖试验(reproductive toxicity Studies)a.生殖力影响试验(fertility and general reproductive performance studies;segment1 Study)b.催畸性试验(teratogenicity study;segnent 2 study)c.围产期及产后毒性试验(peri-and post-natal toxicity study)G.抗原性试验(antigenicity Studies)H.药物依赖性试验(dependence studies)I.溶血性试验(hemdytic effect studies)J.血液共容性试验(blood compatibility studies)K.毒理动力学试验(toxicokinetic studies)(8)人体动力学(human Pharmacokinetics)及生体可用率(bioavailability)(9)细菌学研究资料(10)临床试验结果(11)最新药物使用之安全报告(Safety Update Report)(12)个案资料(Case Report Forms)之整理(Tabulations)(13)个案资料(14)专利权之资料因人体试验结果及有关资料颇多,最近有电脑辅助的新药上市许可申请(CANDA,Computer-Assisted New Drug Applications),详情请参照CANDA Computer Guidance.另外一般新药上市许可申请者也须准备一份核准基准摘要(Summary basis of approval),供食品药物管理局参考或修改,以节省审评时间。
三、新药之审评(一)新药试验申请(IND)之审评这阶段的审核是针对第一次用于人体,或是第一次在美国作人体试验。
IND审评申请新药主要的依据来自动物药理及毒理实验结果,以及依据第一次人体试验的结果来判定是否有足够的药理实验及毒性试验资料,另外在化学方面则注重该新药是否具有稳定性(stability),是否渗有其他有害的杂物(impurities),或具不合规定的非有效成分(inactive ingredients)等。
