药品晶型研究
晶型药物的检测方法

吸热或放热峰数目、形状、位置、峰面积,能够直接测量样品在发生物理或
晶型药物的检化测方学法 改变时热效应。Document number
第25页25
二、惯用检测方法
3)差热分析法(DTA)
参比物:在测量温度范围 内不发生任何热效应物 质,如-Al2O3、MgO等。
原理:在温度程序控制下,经过同时测量样品与惰性参比物温 度差来判定物质内在改变。 应用:固体晶型 物质特征量值分析伎俩之一。
测定容器
可盛于玻璃瓶,毛细管中测 定
不能用玻璃容器测定
前处理 相同 不一样
晶型药物的检测方法
固体样品不需处理
需研磨后,KBr压片
同属分子振动(转动)光谱
研究同原子非极性振动 -N-N- , -C-C-
研究不一样原子极性键转动 -OH , -C=O , -C-X
Document number
第32页32
• 溶出速度: 粒子表面积、药品结晶状态与粒径大小 • 溶 解 度: 物质自由能相关 • 生物利用度:亚稳定态晶型生物利用度较高 • 稳 定 性: 稳定型、亚稳型、不稳型
晶型药物的检测方法
Document number
第3页 3
二、药品多晶型
3、晶型质量控制
定义:针对晶型药品设定晶型质量标准和用于晶型检测分析方法 目标:确保药品质量一致性、药品稳定性、临床有效性、药品安全性。 药品质量评价关键指标:临床疗效
程序控温下,测量物与参比物 温差与温度关系ΔT=f(T) 正峰:放热 倒峰:吸热
晶型药物的检测方法
Document number
第26页26
二、惯用检测方法 TG,DTA,DSC曲线
晶型药物的检测方法
Document number
药物晶型研究及晶型质量控制指导原则解析

同⼀⼚家开发,最早报道晶型专利和原研化合物/制剂所有权⼈是否⼀致?同⼀⼚家开发,原研晶型专利⽐较容易确认。
如遇到不是同⼚家开发,请对不同不同所有权⼈之间的关系进⾏说明(收购?合作关系?授权使⽤?),以作为对原研晶型专利确认的依据。
晶型专利:专利号,所有权⼈,到期时间,是否有中国同族,是否已经授权?2)晶型⼀致性①此处主要⽐较⾃制与⽂献报道的区别,有条件可以⽐较⾃制⽚与原研⽚,可根据需要加⼊图表进⾏说明。
②晶型稳定性的初步研究:对湿、热、光照稳定性;空⽓中与密封条件下的稳定性数据的对⽐;粉碎前后的晶型变化等(制剂还要增加处⽅制备前后的晶型对⽐)。
3)多晶型根据⽂献调研情况来介绍可能的多晶型。
4)稳定性研究将测试的多批次稳定性数据进⾏⽐较,可根据需要加⼊图表进⾏说明。
4、申报资料中晶型部分的撰写呈现形式1)3.2.S.2:对于多晶型药物,申请⼈应在⽣产⼯艺开发阶段通过精制⼯艺的优化和筛选制备优势稳态晶型,保证原料药批间晶型⼀致性。
注:应包括结晶条件的考察,如:溶剂体系、降温速率、晶种加⼊考察、保温析晶温度及时间、搅拌⽅式等,提供说明⽬标晶型成为优势晶型的依据。
批间晶型的⼀致性:各阶段代表性批次的检测结果,如⼩中试,试⽣产,⼯艺验证批晶型的XRD,DSC,TG等晶型数据及对应图谱。
2)3.2.S.2、3、7:对药物制剂关键质量属性产⽣影响的多晶型药物,需研究证明批间晶型⼀致性(3.2.S.2)和晶型放置过程稳定性(3.2.S.7)。
共晶药物具有特殊的理化性质、确定的组分和化学计量⽐,可以通过X-射线单晶⾏射、X-射线粉末所射、固相核磁共振波谱、红外吸收光谱、差⽰扫描量热法和/成晶体形态等分析⽅法进⾏结构确证(不要求全部都做)。
3)3.2.S.4:如原料药的晶型和/或粒度分布对制剂质量产⽣影响,应被纳⼊原料药内控标准并制定专属的检测项⽬进⾏控制。
质量标准中晶型描述:⼀般仅对XRD的2θ⾓要求明确即可。
对于晶型质量研究的法规,⽬前为⽌,出台的不过以上⼏个,在吃透当前法规的要求,要结合⼯作⽇常的需求,领悟晶型研究换换相扣的逻辑关系,最后尘埃落地,落实到申报资料上,⼒求清晰完整,逻辑科学,交上⼀份满意的答卷。
9015药品晶型研究及晶型质量控制指导原则

二 、常用载体辅料 载体辅料通常可分为以下三类。 (1)天 然 材 料 在 体 内 生 物 相 容 和 可 生 物 降 解 的 有 明 胶 、 蛋 白 质 (如 白 蛋 白 )、淀 粉 、壳 聚 糖 、海 藻 酸 盐 、磷 脂 、胆固 醇 、脂 肪 油 、植 物 油 等 。 (2)半 合 成 材 料 分 为 在 体 内 可 生 物 降 解 与 不 可 生 物 降 解两 类 。在 体 内 可 生 物 降 解 的 有 氢 化 大 豆 磷 脂 、聚乙 二醇 二 硬 脂 酰 磷 脂 酰 乙 醇 胺 等 ;不 可 生 物 降 解 的 有 甲 基 纤 维 素 、 乙 基纤维 素 、羧 甲 纤 维 素 盐 、羟 丙 甲 纤 维 素 、邻 苯 二 甲 酸 乙 酸 纤维素 等 。 (3)合 成 材 料 分 为 在 体 内 可 生 物 降 解 与 不 可 生 物 降 解 两 类 。可 生 物 降 解 材 料 应 用 较 广 的 有 聚 乳 酸 、聚 氨 基 酸 、聚 羟 基 丁 酸 酯 、乙 交 酯 -丙 交 酯 共 聚 物 等 ;不 可 生 物 降 解 的 材 料 有 聚 酰 胺 、聚 乙 烯 醇 、丙 烯 酸 树 脂 、硅 橡 胶 等 。 此 外 ,在 制 备 微 粒 制 剂 时 ,可 加 入 适 宜 的 润 湿 剂 、乳化 剂 、抗 氧 剂 或 表 面 活 性 剂 等 。 三 、生产与贮藏期间应检査的项目 (一 )有 害 有 机 溶 剂 的 限 度 检 查 在 生 产 过 程 中 引 入 有 害 有 机 溶 剂 时 ,应 按 残 留 溶 剂 测 定 法(通 则 0861)测 定 ,凡 未 规 定 限 度 者 ,可 参 考 I C H ,否则 应制定有害有机溶剂残留量的测定方法与限度。 (二 )形 态 、粒 径 及 其 分 布 的 检 査 (1)形 态 观 察 微 粒 制 剂 可 采 用 光 学 显 微 镜 、扫 描 或 透 射 电 子 显 微 镜 等 观 察 ,均 应 提 供 照 片 。 (2)粒 径 及 其 分 布 应 提 供 粒 径 的 平 均 值 及 其 分 布 的 数 据 或 图 形 。测 定 粒 径 有 多 种 方 法 ,如 光 学 显 微 镜 法 、电感应 法 、光 感 应 法 或 激 光 衍 射 法 等 。 微 粒 制 剂 粒 径 分 布数 据,常用各粒径范围内的粒子数或 百 分 率表 示 ;有 时 也 可 用 跨 距 表 示 ,跨 距 愈 小 分 布 愈 窄 , 即 粒子大小愈均匀。
兽药晶型研究及晶型质量控制指导原则

兽药晶型研究及晶型质量控制指导原则
兽药晶型研究及晶型质量控制指导原则
随着兽药行业的快速发展,晶型研究和晶型质量控制成为了兽药制造过程中非常重要的环节。
晶型研究可以帮助制药企业选择最优的晶型,从而提高药物的溶解度和生物利用度,提高药效,减少副作用。
同时,在兽药制造过程中,晶型的质量控制也是非常关键的,不同的晶型质量会直接影响药品的品质和安全性。
晶型研究的方法主要包括X射线衍射、热分析、核磁共振等。
其中,X射线衍射是最常用的方法,可以通过测量晶体单元的空间排列来确定晶型。
热分析可以测量晶体热稳定性,从而确定晶型的稳定性和热稳定性。
而核磁共振则可以通过测量晶体分子结构来确定晶型的结构和稳定性。
晶型质量控制的关键在于控制晶型的稳定性和纯度。
在制药过程中,应该采取适当的措施,控制晶型的生长速度和形态,从而确保晶型的稳定性。
同时,也需要注意晶型的纯度,避免杂质对晶型的影响。
对于生产中出现的晶型变化,应该及时采取措施,确保药品的稳定性和安全性。
综上所述,晶型研究和晶型质量控制是兽药制造过程中非常重要的环节。
兽药企业应该加强晶型研究和质量控制,提高药品的品质和安全性。
同时,应该根据实际情况制定相应的晶型质量控制指导原则,确保兽药的质量和安全。
- 1 -。
药物分析中的药物结晶研究

药物分析中的药物结晶研究药物结晶是药物分析中的重要研究方向之一,它通过探究药物的晶体结构和性质,为药品的研发和生产提供了重要的理论基础和技术支持。
本文将从药物结晶的基本原理、研究方法和应用角度进行论述。
1. 药物结晶的基本原理药物结晶是在适当的溶剂中,由于药物分子之间的相互作用力而形成具有一定有序性的晶体。
药物结晶的基本原理可归纳为溶剂选择、溶剂温度、溶剂浓度和溶剂pH值等因素的影响。
1.1 溶剂选择溶剂选择是影响药物结晶的重要因素。
药物溶解度与溶剂的极性、键能、饱和度和存在形式等有密切关系。
在选择溶剂时,需要考虑溶剂的亲疏水性和溶剂的溶解能力,以及药物的特点和研究目的。
1.2 溶剂温度溶剂温度对药物结晶过程中的晶体形态和结晶速率有重要影响。
一般来说,温度升高会促进溶液中药物分子的运动,有利于形成较大晶体颗粒。
但是温度过高又会导致晶体粗大、结晶度低、晶型转变等问题。
因此,在药物结晶研究中需要根据具体药物的特性选择合适的结晶温度。
1.3 溶剂浓度溶剂浓度是影响药物结晶的重要因素之一。
过高或过低的溶剂浓度都会对药物的结晶产率和纯度造成影响。
通常来说,合适的溶剂浓度能够提供较好的晶体形态和结晶度。
1.4 溶剂pH值溶剂的pH值对药物结晶也有一定的影响。
药物分子在不同pH值的溶液中,其离子态和非离子态的比例不同,从而影响了溶剂的溶解性和药物分子的相互作用力。
因此,在药物结晶研究中,合适的溶剂pH值也是需要考虑的因素。
2. 药物结晶的研究方法药物结晶研究涉及许多实验技术和分析方法,包括晶体生长动力学研究、晶体形态表征、晶体结构分析等。
2.1 晶体生长动力学研究晶体生长动力学研究是药物结晶研究中的重要方向之一。
通过实验室制备不同条件下的药物晶体,观察晶体的生长形态和速率,分析晶体生长的动力学过程,推测药物结晶的机制和影响因素。
2.2 晶体形态表征晶体形态表征是药物结晶研究中必不可少的内容。
通过显微镜观察药物晶体的外形、尺寸和形态,利用非接触式测量方法如显微照相、光学显微镜、电子显微镜等,对药物晶体形态进行表征和测量。
药品研发中多晶型问题的考虑

药品研发中多晶型问题的考虑药品多晶型问题是药物研发中需要认真考虑的重要问题。
多晶型是指同一种化合物在固态状态下由于分子排列不同而形成的不同晶体形态。
药品的多晶型涉及到药物的物理性质、稳定性、生物利用度等方面,对药物的研发和生产具有重要的影响。
在药物研发中,药物的多晶型问题需要全面考虑,其主要包括以下几个方面:1. 物理性质:不同的多晶型具有不同的物理性质,如晶体形态、熔点、溶解度等。
不同的晶型对药物的物理性质会产生不同的影响,这对于药物的研发和生产具有重要的意义。
2. 稳定性:不同的多晶型之间可能存在稳定性差异,有些多晶型可能更加稳定,而有些可能更加不稳定。
在药物研发中,需要选择稳定性较好的多晶型,以确保药物在储存和使用过程中不会发生意外的变化。
3. 生物利用度:多晶型对药物的生物利用度有重要影响。
不同的晶型在体内的溶解速度和吸收情况可能会不同,从而造成药效的差异。
需要选择对生物利用度影响较小的多晶型作为最终的药物制剂。
4. 制备工艺:不同的多晶型可能对药物的制备工艺有影响。
有些多晶型可能更容易通过现有的工艺方法制备,而有些多晶型可能会导致工艺上的困难。
在药物研发过程中需要考虑多晶型对制备工艺的影响,以便选择适合的工艺方法。
5. 法规要求:在药品开发过程中,药品多晶型的选择还需要考虑法规要求。
一些药品监管机构可能要求对多晶型进行特定的分析和评估,因此需要选择符合法规要求的多晶型进行后续开发。
针对这些考虑因素,药物研发人员需要通过实验研究和数据分析来全面评估不同多晶型的影响,以确定最适合的多晶型。
通常情况下,研发人员会通过晶体学分析、热分析等方法对多晶型进行表征,通过溶解度测定、体外体内评价等方法对多晶型进行评估,从而选择最适合的多晶型进行后续开发。
药品多晶型问题是药物研发中需要认真考虑的重要问题。
通过全面评估多晶型的物理性质、稳定性、生物利用度、制备工艺和法规要求等方面的影响,可以选择最适合的多晶型进行后续开发,确保药物研发的顺利进行和最终产品的质量与疗效符合要求。
药物晶型研究报告分析

晶型药物的生物利用度
由于药物的溶解度会影响口服固体制剂 的溶出度,进而影响生物利用度 。具有多 晶型现象的药物,其表观溶解度的不同是 否会影响制剂的生物利用度,取决于影响 药物吸收速度和程度等多种生理因素,如 胃肠道蠕动、药物的溶出、药物的肠道渗 透性等。
优势晶型药物
1、晶型的稳定性 应具备一定的稳定性:一方面是晶型自身的稳 定性,即在不同的环境条件下能够保持晶型物质 状态的稳定,另一方面要保证其制剂产品中优势 药物晶型和各种药用辅料物质在临床应用过程中 的稳定。 2、不同晶型物质对生物利用度的影响 吸收性质是要用优势药物晶型选择的关键条件。 但是生物利用度的提高并不能作为药用晶型优劣 筛选的单纯条件依据。原因在于生物利用度提高 可能会产生更好的药理作用,也可能会产生更多 的不良反应。
药物晶型的常用制备方法
(一) 溶剂结晶法: 结晶溶剂的选择: (1)不能与结晶物质起化学反应。 (2)在较高温度区域能溶解大量结晶物质, 而在室温或低温区域,只能溶解少量结晶 物质 (3)溶剂对杂质成分的溶解度非常大或非 常小。 (4)溶剂的沸点不宜过高或过低。
具体有: 1、蒸发法:选择溶解度适中的溶剂将样品 溶解,制成过饱和溶液,置于一个合适大 小的干净容器中,再用可透气的滤纸,滤 膜,铝箔等覆盖以防止灰尘落入,将其静 置是溶剂慢慢蒸发。溶剂挥发是溶液过饱 和,晶核开始生长,经过晶体生长过程, 最终获得较大的晶型物质。 2、降温法:有机合成中常用的方法 3、 种晶法:a)纯晶种;b)晶种的晶型
提高无定型药物的稳定性
1、辅料的选择:筛选能够提高无定型药物的辅料。 2、制备工艺:对无定型药物原料进行影响因素实 验,以考察温度、湿度、光照对原料药物的晶型 影响。 总结:并非所有的药物都应该选择自由能最低的 稳定晶型,无定型也有可能成为优势晶型药物。 固体药物的无定型状态往往比稳定的晶态物质局 域更高的溶出速率,更好的生物吸收,更佳的临 床疗效。
医药制剂中的晶型分析
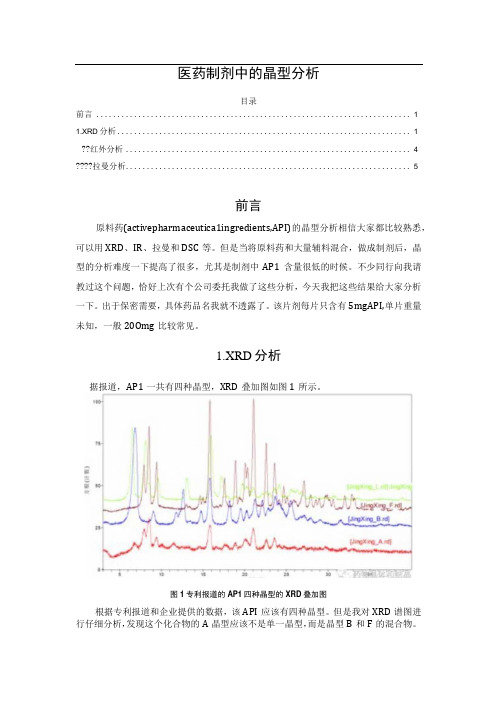
医药制剂中的晶型分析目录前言 (1)1.XRD分析 (1)红外分析 (4)拉曼分析 (5)前言原料药(activepharmaceutica1ingredients,API)的晶型分析相信大家都比较熟悉,可以用XRD、IR、拉曼和DSC等。
但是当将原料药和大量辅料混合,做成制剂后,晶型的分析难度一下提高了很多,尤其是制剂中AP1含量很低的时候。
不少同行向我请教过这个问题,恰好上次有个公司委托我做了这些分析,今天我把这些结果给大家分析一下。
出于保密需要,具体药品名我就不透露了。
该片剂每片只含有5mgAPI,单片重量未知,一般20Omg比较常见。
1.XRD分析据报道,AP1一共有四种晶型,XRD叠加图如图1所示。
图1专利报道的AP1四种晶型的XRD叠加图根据专利报道和企业提供的数据,该API应该有四种晶型。
但是我对XRD谱图进行仔细分析,发现这个化合物的A晶型应该不是单一晶型,而是晶型B和F的混合物。
A晶型的结晶度不高,所有的衍射峰在B和1都能找到对应的峰。
晶型B、F和1三种晶型重叠峰较少,应该是独立的晶型。
对制剂进行晶型的XRD分析时,需要先将每种辅料进行XRD分析,看看制剂的衍射峰里,哪些是辅料的,哪些是原料药的。
因为原料药含量很低,辅料的特征峰往往比原料药高。
参见图2,对比甲厂制剂与辅料的XRD图,发现制剂中的峰主要是乳糖的峰,其次含有少量Mg(OH)2,只有2。
二7.0和8.2处的小峰是辅料中没有的。
I _ ~~I"f1 - ------ ----------- ---⅜⅜⅜f,—- ----- ∣[]WΓθ∣5M>20101Sn111______ ______ _H卜. ___ __ 19∣RuTβra200Mu.101∙S2030V1I v O u it n»tr≡Mrτ2∙(t)图2甲厂制剂与每种固体辅料的XRD叠加图然后我们再将制剂的XRD谱图与原料药的对比进行分析(图3)o根据2θ=7.0和8.2处的峰,可以推测甲厂制剂中原料药的晶型应该主要是B,可能含有少量1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南通诚记化工贸易公司安捷伦柱型:原厂货号:规格柱适用特点单价RMBSB-C18 USP 883975-902 4.6*150 低PH和纯水系 3467SB-C18 USP 880975-902 4.6*250 低PH和纯水系 3860Eclipse XDB-C18 993967-902 4.6*150 同上Eclipse XDB-C18 990967-902 4.6*250 同上RX-C18 883967-902 4.6*150 同上RX-C18 880967-902 4.6*250 同上ZORBAX SB-Aq 883975-914 4.6*150 同上ZORBAX SB-Aq 880975-914 4.6*250 同上4.6*250和4.6*150的单价各是多少?岛津的同类价格呢?如价格(要发票的)适宜,再联系。
FAX:083 1-3322518.色谱柱填料形状与粒径基质:硅胶、二氧化铝、聚合物填料等形状:球形和无定形* 无定形:易制备、价格低;但涡流扩散大,渗透性差,比较难填装出稳定的柱床,一般用来做制备柱。
* 球形:涡流扩散小,渗透性好,可填装出稳定的柱床。
填料粒度大小与柱效、柱压的关系:* 柱效与填料大小成反比* 柱压与填料的二次方成正比* 常规分离柱:5微米;快速分离柱:1.8微米、3.5微米色谱柱化学性质:键合类型、碳覆盖率、封端硅胶的化学性质—键合类型键合类型包括:* 单体键合:键合相分子与基体单点相连* 聚合体键合:键合相分子与基体多点相连键合类型对色谱分离的影响:* 单体键合:提高传质速率,加快色谱柱平衡* 双体键合:增加色谱柱稳定性,增加色谱柱的载样量硅胶的化学性质—封端封端:键合步骤之后,用小分子硅烷将裸露的硅羟基键合,以便获得更大的覆盖率。
封端多用于反相色谱键合中。
封端可消除或减少可能发生的二级反应。
没有封端的反相色谱填料通常比封端的有复杂多样的选择性。
碱性物质在不封端的填料上,容易产生拖尾。
封端基团在酸性条件下易水解,封端填料也不能在pH小于2的条件下使用。
因此,对于不同的被分析物要按实际情况选择封端或不封端的填料。
药品研发:全面考虑多晶型问题多晶型现象在固体化学药品研发过程中比较常见。
近年来,有些企业在药品的多晶型研究上下工夫,挖掘出了一些拥有自主知识产权的产品。
但由于药物的不同晶型可能影响药品的安全有效性和质量可控性,因此在药品研发中应当针对其不同情况采取相应的措施。
本文就药品研发中涉及的多晶型现象及相关问题进行了讨论,指出不同的表观溶解度可使制剂有不同的溶出度,并可能导致生物利用度的不同;不同的光学和机械性质、密度等可能影响制剂的制备工艺;不同的化学反应性可导致药品稳定性的差异。
并据此强调,在药品研发中,应全面考虑药品的多晶型问题。
仅供药品研发和评价工作参考。
药物多晶型是药品研发中的常见现象,是影响药品质量的重要因素。
同一药物的不同晶型在外观、溶解度、熔点、溶出度、生物有效性等方面可能会有显著不同,也会对药物的稳定性、生物利用度及疗效产生不同的影响。
因此,在药品研发中,应全面考虑药品的多晶型问题。
区分不同形态固体药物有结晶型和非结晶型(无定形)之分。
构成药物结晶的基本单元为晶格,在晶格中药物分子以一定的规律排列。
而无定形是分子以无序的方式排列,不具有明确的晶格。
若药物结晶中包含结晶溶剂分子,就称为溶剂化物。
当该溶剂为水时(即含有结晶水),通常称为水合物。
药物的不同晶型是由分子在晶格中排列方式的不同所致。
这里提醒大家要注意的是晶型与结晶形态(晶癖)的区别。
前者由晶格中分子的排列来决定,后者是指形成的结晶的外观形状,如针状结晶、片状结晶等。
同一晶型的药物,可能具有不同的外观形状;反之,外观形状相同的结晶,其晶型也可能不同。
若固体药物存在结晶型与无定形,或存在非溶剂化物与溶剂化物、不含或含有结晶水等现象,就称为该药物存在多晶型现象。
一些方法可用于研究和区分多晶型现象。
单晶X-射线衍射可对晶体结构提供直接的证据,是研究多晶型现象的可靠方法。
需要注意的是,若获取单晶所采用的结晶条件与药物生产中实际采用的结晶条件不同,则单晶X-射线衍射得到的晶体特征并不代表药物实际的晶体特征。
粉末X-射线衍射是常用的研究和区分不同晶型的有效方法,该方法不仅可用于不同晶型的定性区分,在建立特征衍射峰与不同晶型含量之间的定量关系后,粉末X-射线衍射还可用于不同晶型比例的定量控制。
其他方法包括显微观察、热分析(差示扫描量热、热重分析、热台显微镜等)、光谱法(红外光谱、拉曼光谱、固相磁共振)等,均有助于进一步研究多晶型现象。
存在多晶型现象的药物,由于晶格能的不同,其不同晶型可具有不同的化学和物理性质。
如不同的熔点、化学反应性、表观溶解度、溶出速率、光学和机械性质、蒸汽压、密度等。
多晶型药物不同晶型之间理化性质的不同,可能对原料药及制剂的制备、原料药及制剂的稳定性、制剂的溶出度及生物利用度等产生影响。
比如,不同的表观溶解度致使制剂有不同的溶出度,并可能导致生物利用度的不同;不同的光学和机械性质、密度等可能影响制剂的制备工艺;不同的化学反应性可导致药品稳定性的差异。
药品溶出度、生物利用度、稳定性等的差异进而可能影响药品的质量可控性、安全性和有效性。
抓住问题关键一种药物可能存在许多种晶型,但某些晶型可能不易形成或得到,而只有一部分晶型在原料药及其制剂的生产制备过程中能够形成。
因此,研发工作中重点应考虑那些在原料药制备、制剂制备以及原料药和制剂贮藏过程中可能形成的晶型。
对于存在多晶型现象的药物,研发过程中需要考虑多晶型对制剂溶出及生物利用度的影响,对原料药及制剂稳定性的影响,对原料药及制剂制备工艺的影响。
在综合考虑多晶型对制备工艺、生物利用度、稳定性等的影响的基础上,确定是否有必要对药物的晶型进行控制。
如果晶型影响药品的生物利用度或影响稳定性等,就应限定晶型或控制晶型比例。
比如那格列奈临床使用的晶型为H晶型,阿折地平α晶型的生物利用度高于β晶型,供临床使用的为α晶型。
1.多晶型与制备工艺药物的多晶型可呈现不同的物理和机械性质,包括吸湿性、颗粒形状、密度、流动性和可压性等,进而可影响原料药及制剂的制备。
多晶型对制剂制备的影响还取决于处方及采用的工艺。
如对于采用直接压片工艺的片剂,主药的固态性质可能是影响制剂制备工艺的关键因素,特别是当主药占片重比例较大时;而对于采用湿法制粒工艺的片剂,主药的固态性质通常被制粒过程所掩饰,故对制剂制备工艺影响较小。
关于多晶型现象对制备工艺的影响,需要考虑的重点是如何保证药品质量的一致性。
药物的晶型在制备工艺的多种操作过程中可能发生转化,如干燥、粉碎、微粉化、湿法制粒、喷雾干燥、压片等。
暴露的环境条件,如湿度和温度也可能导致晶型转化,转化的程度一般取决于不同晶型的相对稳定性、相转化的动力学屏障、压片使用的压力等。
假如对工艺过程中晶型转化情况进行了充分研究,工艺重现性得到了充分验证,制剂的生物利用度和生物等效性(BA/BE)也得到了证实,则工艺过程中的晶型转化是可以接受的。
2.多晶型与生物利用度由于药物的溶解度会影响口服固体制剂的溶出度,进而影响生物利用度,因此,当固体药物不同晶型的表观溶解度不同时,应当关注其对BA/BE的可能影响。
具有多晶型现象的药物,其表观溶解度的不同是否会影响制剂的生物利用度,取决于影响药物吸收速度和程度的多种生理因素,包括胃肠道蠕动、药物的溶出、药物的肠道渗透性等。
药物的生物药剂学分类(BCS)可作为判断多晶型问题对BA/BE影响程度的重要依据。
例如,对于高渗透性药物,由于其吸收仅受溶出速度限制,不同晶型之间表观溶解度的较大差异很可能影响BA/BE;而对于吸收仅由肠道渗透性限制的低渗透性药物,不同晶型之间表观溶解度的差异对BA/BE发生影响的可能性较小。
此外,对于高溶解性药物,当不同晶型的表观溶解度均足够大,药物的溶出速度快于胃排空速度时,不同晶型之间表观溶解度的差异就不大可能影响BA/BE。
3.多晶型与稳定性多晶型可具有不同的物理性质和化学反应性。
从稳定性方面考虑,其中一种晶型属于热力学最稳定的晶型(稳定型),其他为亚稳定型,在药物开发过程中,为降低转化为另一种晶型的可能性,以及得到更好的化学稳定性,一般选择药物的热力学最稳定晶型作为目标晶型。
不过,对于某些难溶性药物,由于稳定型的生物利用度低,不能满足临床需要,而亚稳定型表观溶解度高,可得到较高的生物利用度,因而选择亚稳定型作为目标晶型。
这种情况下,需要特别关注药品在贮藏期间晶型的稳定性,并采用适当的措施(如适当的处方、工艺、包装及贮藏条件等)避免药品贮藏期间亚稳定型向稳定型的转化。
4.多晶型与药品质量控制标准制定如果各种晶型具有相同的表观溶解度,或者各种晶型都易溶,多晶型问题不大可能对BA/BE具有显著影响,这种情况下一般不需要制定原料药及制剂的晶型控制标准。
按照BCS分类系统对药物的溶解性进行区分,当药物的至少一种晶型属于低溶解性时,应当制定原料药的晶型控制标准。
对于制剂,如果采用的原料药是热力学最稳定晶型,一般不需要在质量标准中制定晶型控制标准;如果原料药为亚稳定晶型,则需要关注制剂制备及贮藏过程中可能发生的晶型转化。
由于制剂中辅料的干扰,直接进行晶型的测定有一定的难度,因此,一般倾向于建立溶出度等制剂质量检查指标与不同晶型之间的相关关系,通过溶出度等指标来间接反映难溶性药物可能影响制剂BA/BE的晶型比例改变。
但在一些特殊情况下(如需要对晶型进行控制,但难以建立制剂其他指标与晶型之间的关系),也需要考虑在制剂质量标准中制定晶型控制标准。
5.多晶型与仿制药研发仿制药应当有足够的稳定性并与原研药生物等效。
对于仿制固体制剂和混悬剂,由于晶型可能影响制剂的稳定性和生物利用度,研发者应当调研药物是否存在多晶型现象,并考虑和评估多晶型问题的重要性和对策。
主要应考虑多晶型对制剂BA/BE的影响,此外还应考虑多晶型对制剂制备和稳定性的影响。
仿制药的活性成分必须与原研药相同。
从晶型方面来说,为避免多晶型问题对生物利用度及稳定性的不利影响,建议仿制药采用的晶型也尽可能与原研药相同,以保证仿制药与原研药生物等效,并具有足够的稳定性。
但是,药物的多晶型之间仅是晶体结构的不同,化学结构是相同的。
因而对于仿制药,如果生物等效性及稳定性得到充分的试验研究证实,主药的晶型也可以与原研药不同。
美国食品药品管理局(FDA)也批准了一些此类的仿制药上市,如美国上市的华法林钠、法莫替丁、雷尼替丁的一些仿制药产品,其主药的晶型与原研产品是不同的。
药物的多晶性对图谱的影响晶体是由原子(或离子、分子)在空间周期地排列构成的固体物质,晶体中最小的立体单元叫做晶胞,按照晶胞三边之长及夹角的不同,可将晶体分为7个晶系,即立方(等轴)、六方、三方、四方、三斜、单斜、正交晶系[1]。
