对氯苯氧乙酸的制备
实验九、4-氯苯氧乙酸的制备new
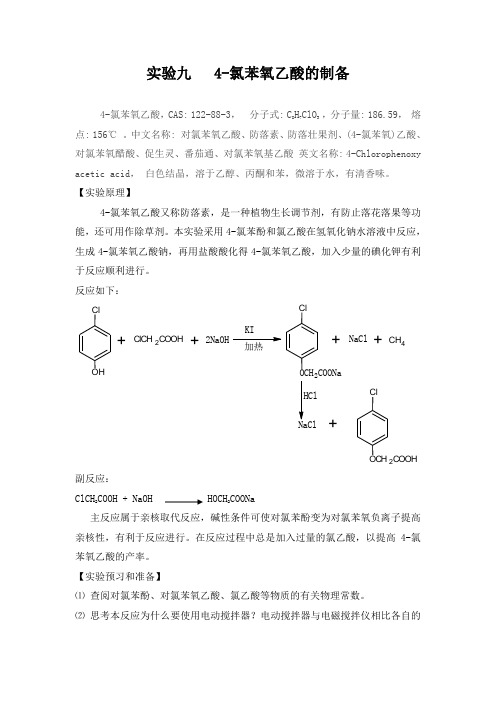
实验九 4-氯苯氧乙酸的制备4-氯苯氧乙酸,CAS: 122-88-3,分子式: C8H7ClO3 ,分子量: 186.59,熔点: 156℃。
中文名称: 对氯苯氧乙酸、防落素、防落壮果剂、(4-氯苯氧)乙酸、对氯苯氧醋酸、促生灵、番茄通、对氯苯氧基乙酸英文名称: 4-Chlorophenoxy acetic acid,白色结晶,溶于乙醇、丙酮和苯,微溶于水,有清香味。
【实验原理】4-氯苯氧乙酸又称防落素,是一种植物生长调节剂,有防止落花落果等功能,还可用作除草剂。
本实验采用4-氯苯酚和氯乙酸在氢氧化钠水溶液中反应,生成4-氯苯氧乙酸钠,再用盐酸酸化得4-氯苯氧乙酸,加入少量的碘化钾有利于反应顺利进行。
反应如下:C lO H +ClCH2COOH+2NaOHKI加热C lOCH2COONa+NaCl+C H4NaCl+C lOCH2COOH副反应:ClCH2COOH + NaOH HOCH2COONa主反应属于亲核取代反应,碱性条件可使对氯苯酚变为对氯苯氧负离子提高亲核性,有利于反应进行。
在反应过程中总是加入过量的氯乙酸,以提高4-氯苯氧乙酸的产率。
【实验预习和准备】⑴查阅对氯苯酚、对氯苯氧乙酸、氯乙酸等物质的有关物理常数。
⑵思考本反应为什么要使用电动搅拌器?电动搅拌器与电磁搅拌仪相比各自的优缺点是什么?⑶本反应加入的碘化钾的作用是什么?试写出其催化的反应机理。
⑷本反应为什么要滴加氯乙酸和氢氧化钠?如果把他们一次性加入反应瓶可能会发生什么?试预测之。
⑸在有机化学教科书中是如何讨论此类反应的?什么样的条件可以加快反应速度?【实验试剂】4-氯苯酚6.4g(0.05mol)、氯乙酸5.3g(0.05mol)、20%氢氧化钠溶液25mL、碘化钾0.5g、浓盐酸适量、pH试纸若干。
【实验步骤】按图9-1安装反应装置,下置电热套。
在100mL三口烧瓶中加入10ml20%的NaOH水溶液和6.4g 4-氯苯酚,搅拌溶解后,再加入0.5g碘化钾。
完成氯苯氧乙酸的合成操作

【相关知识】
8.1.1农药产品介绍
一、农药及其作用
农药是指那些具有杀灭农作物病、虫、草害和鼠害以及其它有毒生物或能凋节 植物或昆虫生长,从而使农业生产达到增产、保产作用的化学物质。它们可来 源于人工合成的化合物,也可来源于自然界的天然产物,它们可以是单一的一 种物质,也可以是几种物质的混合物及其制剂。
8.1.2农药2,4-D的生产方法
一、农药2,4-D概述 2,4-D(又称2,4-滴,2,4-D酸; 2,4-二氯苯氧基乙酸; 2,4-滴酸)是最早 使用的除草剂之一,2,4-D还可作为植物生长调节剂使用。2,4-D 于 1942年由美国Amchem公司开发,1945年后许多国家投入生产,应 用广泛。2,4-D是以钠盐、胺盐或酯的形式应用。在我国最广泛应用 的是其丁酯。常见的2,4-D剂型为80%可湿性粉剂,72%丁酯乳油, 55%、50%胺盐水剂。2,4-D随使用浓度和用量不同,对植物可产生 多种不同的效应:在较低浓度(0.5-1.0mg/L)下是植物组织培养的培 养基成分之一;在中等浓度(1-25mg/L)下可防止落花落果,能有效 刺激生长,诱导无籽果实和果实保鲜等作用;更高浓度(1000mg/L) 下作为除草剂可杀死多种阔叶杂草。因此在对作物施用时一定要注意 所用的量。较高浓度,抑制生长,更高浓度可使植物畸形发育致死。 作为芽后使用的除草剂,单子叶的禾本植物对其一定的耐受力,双子 叶的阔叶植物对其非常敏感,利用这种选择性,可用于水稻、麦类禾 本科作物田间防除阔叶杂草。
8-1世界粮食作物产量及病、虫、草害的损失量 单位:其他谷物 马铃薯
265.5 232.0 218.5 245.1 270.8
潜在产量
355.1 438.8 339.5 338.1 400.0
对氯苯氧乙酸的制备

对氯苯氧乙酸的制备一、实验目的1、复习巩固醚的制备和芳环上的氯化反应2、掌握利用苯酚制备对氯苯氧乙酸的原理及方法。
2、掌握电动搅拌装置的安装及使用。
3、练习并掌握固体酸性产品的纯化方法。
二、实验原理ClCH 2COOH Na 2CO 3ClCH 2COONa2COONa2HCl+H 2O 23OCH 2COOHCl该实验为两步反应:第一步,酚钠和氯乙酸在碱性中通过Williamson 合成法制得苯氧乙酸。
第二步是在三氯化铁的催化下发生苯环上的氯化反应生成对氯苯氧乙酸。
但该实验不是直接通氯气,而是通过双氧水氧化盐酸生成氯,紧接着就发生氯化反应。
最后的产品经重结晶纯化。
对氯苯氧乙酸是一个常用的植物生长调节剂,俗称“防落素”,可以减少农作物或瓜果蔬菜的落花落果,有明显的增产作用。
三、实验药品用量及物理常数四、实验装置图反应装置抽滤装置干燥装置布氏漏斗抽滤瓶五、实验流程图氯乙酸5ml水碳酸钠冷却抽滤六、实验步骤在装有搅拌器、回流冷凝管和滴液漏斗的100ml 三口瓶中,加入3.8克氯乙酸和5毫升水,开动搅拌,慢慢加饱和碳酸钠溶液,至溶液PH=7-8。
然后,加入2.5克苯酚,再慢慢滴加35%氯氧化钠至PH=12,沸水浴加热反应0.5小时,再用氯氧化钠调PH=12,再加热反应15分钟。
移去水浴,用浓盐酸调PH=3-4,析出固体,抽滤,水洗2-3次,在60-65度干燥,稳重,备用。
反应装置同上,加入3克上述制备的对氯苯氧乙酸,和10毫升冰乙酸,升至55度,加入少需三氯化铁和10毫升浓盐酸。
升至60-70度,在10分钟内慢慢滴加3毫升双氧水,保温反应20分钟,升温使固体溶解,慢慢冷却,析出固体,抽滤,粗产品水洗2次,用1:3的乙醇-水重结晶,干燥后称重,计算产率,测熔点。
七、实验注意事项1、安装仪器前,要先检查电动搅拌装置转动是否正常,搅拌棒要垂直安装,安装好仪器后,再检查转动是否正常。
2、从滴加浓硫酸开始,整个反应过程中,一致保持搅拌。
有机设计实验 2,4-D的制备
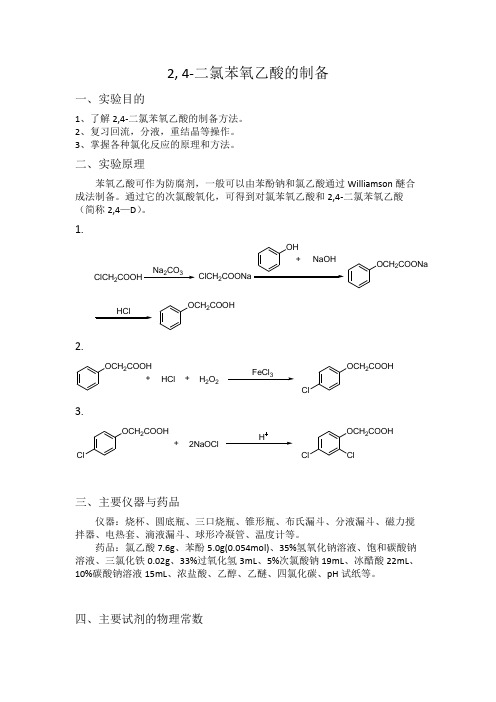
2, 4-二氯苯氧乙酸的制备一、实验目的1、了解2,4-二氯苯氧乙酸的制备方法。
2、复习回流,分液,重结晶等操作。
3、掌握各种氯化反应的原理和方法。
二、实验原理苯氧乙酸可作为防腐剂,一般可以由苯酚钠和氯乙酸通过Williamson 醚合成法制备。
通过它的次氯酸氧化,可得到对氯苯氧乙酸和2,4-二氯苯氧乙酸(简称2,4—D )。
1.2.3.三、主要仪器与药品仪器:烧杯、圆底瓶、三口烧瓶、锥形瓶、布氏漏斗、分液漏斗、磁力搅拌器、电热套、滴液漏斗、球形冷凝管、温度计等。
药品:氯乙酸7.6g 、苯酚5.0g(0.054mol)、35%氢氧化钠溶液、饱和碳酸钠溶液、三氯化铁0.02g 、33%过氧化氢3mL 、5%次氯酸钠19mL 、冰醋酸22mL 、10%碳酸钠溶液15mL 、浓盐酸、乙醇、乙醚、四氯化碳、pH 试纸等。
四、主要试剂的物理常数ClCH 2Na 2CO 3ClCH 2COONa OH+NaOHOCH 2COONaHClOCH 2COOHOCH 2COOH+HCl+H 2O 2FeCl 3OCH 2COOHClOCH 2COOHCl+2NaOClHOCH 2COOHClCl五、实验装置图回流装置图抽滤装置图重结晶装置图分液装置图六、实验步骤1、苯氧乙酸的制备向装有回流冷凝管和温度计的100 mL 三口烧瓶中加入7.6 g 氯乙酸和10mL 水。
启动搅拌,慢慢滴加饱和碳酸钠溶液至PH值为7-8(有气泡产生),使氯乙酸转变为氯乙酸钠。
向溶液中加入5.0g苯酚,慢慢滴加35%NaOH溶液调PH值到12,并加热回流半小时,期间保持pH为12(102℃时开始沸腾回流,溶液变成淡黄色)。
反应完毕后等待反应液冷却,在冰水浴条件下向反应液中滴加浓HCl,调PH值至3-4,此时苯氧乙酸结晶析出(有白色沉淀产生)。
经过抽滤、洗涤、干燥即得苯氧乙酸(白色粉末),称重并测定熔点。
2、对氯苯氧乙酸的制备取3.0g制备的苯氧乙酸和10mL冰醋酸于三口烧瓶中,装温度计、回流冷凝管和滴液漏斗,开动搅拌并加热(苯氧乙酸全部溶解)。
化学实验报告对氯苯氧乙酸的合成

对氯苯氧乙酸的合成一、 实验目的和要求1、 掌握机械搅拌操作;2、 学会对氯苯氧乙酸的合成方法;3、 进一步熟悉亲核合成反应;4、 熟练重结晶操作。
二、 实验内容和原理对氯苯氧乙酸是植物生长调节剂的中间体,有许多合成方法,本实验采用Willamson 法进行合成。
反应方程式如下:副反应:222ClCH COOH + NaOH HOCH COONa+NaCl+H O →碘离子是比氯离子更好的离去基团,能够明显地提高S N 2反应的反应速率和产率,因此,使用催化量的KI 是必要的。
在碱性条件下,苯酚生成苯酚负离子,可以明显提高它的亲核性,但在碱作用下,氯乙酸同样会发生水解反应,即被羟基负离子进攻生成副产物。
本实验采用先将一部分NaOH 与苯酚反应,生成苯酚负离子,再分别滴加剩余的碱和氯乙酸,以减少氯乙酸的水解,提高反应的产率。
主反应机理:副反应机理:三、 主要物料及产物的物理常数OHCl+Na OHH KI−−−→−−→OCH 2COOHCl2ClCH COOH +四、主要仪器设备仪器100mL三口烧瓶;滴液漏斗;电热包(或油浴装置);机械搅拌器(或磁力搅拌器);球形冷凝管;吸滤装置;250mL烧杯;10mL量筒;50mL量筒;胶头滴管。
试剂对氯苯酚;氯乙酸;20%NaOH;碘化钾;1:1盐酸;95%乙醇;pH试纸。
五、操作方法和实验步骤实验装置图:六、 实验结果与分析重结晶前的粗产物质量为11.72g ,粗产率为11.72100%124.2%6.50186.59/128.56/m gm gg molM g molM ⨯==⨯粗产品对氯苯酚对氯苯氧乙酸对氯苯酚粗产率超过100%,显然其中混有大量杂质。
根据实验过程分析,由于未趁热加酸,导致酸化不充分,粗产品抽滤时没有充分洗涤,这两个原因导致产物中混入大量对氯苯氧乙酸盐杂质。
重结晶提纯的产物经干燥后质量为4.76g ,产率为4.76100%50.5%6.50186.59/128.56/m gm gg molM g molM ⨯==⨯产物对氯苯酚对氯苯氧乙酸对氯苯酚提纯干燥产物的熔程两次测量分别为155.6℃~157.0℃,155.7℃~157.2℃,平均为155.6℃~157.1℃,比文献值157℃~159℃偏低,分析其原因可能为混入脱羧产物或(和)乙醇,或者干燥不充分所致。
苯氧乙酸和对氯苯氧乙酸制备审批稿

苯氧乙酸和对氯苯氧乙酸制备YKK standardization office【 YKK5AB- YKK08- YKK2C- YKK18】化学与化学工程学院有机化学实验报告实验项目:苯氧乙酸和对氯苯氧乙酸制备实验日期:实验目的:了解对氯苯氧乙酸和苯氧乙酸的制备方法;:复习机械搅拌,分液漏斗使用,重结晶等操作。
实验原理:先缩合苯氧乙酸的合成,再采用浓盐酸加过氧化氢在酸性介质中的氯化来制备对氯苯氧乙酸。
:反应式第一步是制备酚醚,这是一个亲核取代反应,在碱性条件下易于进行。
第二步是苯环上的亲电取代,FeCl3作催化剂,氯化剂是Cl+,引入第一个Cl。
2HCl + H2O2→ Cl2 + 2H2O Cl2 + FeCl3→ [ FeCl4 ]- + Cl+实验药品:物学常数名称:苯酚 CAS号:108-95-2 分子式:C6H6O分子量: 熔点: 沸点:相对密度:折射率: 价格:元/吨用途:苯酚可作杀菌剂、麻醉剂、防腐剂。
(Lister J)最早将其用于外科手术消毒;但由于苯酚的毒性,这一技术最终被取代。
现在苯酚可用于制备消毒剂,如TCP;或用其稀溶液直接进行消毒。
苯酚是多种化工产品的原料,用来合成阿司匹林等药品,以及一些农药、香料、染料。
亦用来合成树脂,最主要的一种是和甲醛缩合而成的。
尽管苯酚的浓溶液毒性很强,它仍在整形外科手术中充当脱皮剂。
性质:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
名称:氯乙酸 CAS号:79-11-8分子式:C2H3ClO2分子量:熔点:61沸点:188相对密度:折射率 :------- 价格:元/吨用途:用于制和作中间体。
性质:溶于水、乙醇、乙醚、氯仿、二硫化碳。
名称:苯氧乙酸CAS号:122-59-8分子式:C8H8O3分子量:152 熔点:97-99 沸点: 285 相对密度:----折射率-----价格:元/吨用途:苯氧乙酸是重要的化工原料,可以用来生产青霉素V、除草剂、染料杀虫剂、杀菌剂、植物激素和中枢神经兴奋药物的中间体等。
2,4-二氯苯氧乙酸的合成

2,4-二氯苯氧乙酸的合成郑爱强(武汉大学 化学与分子科学学院,湖北 武汉 432001)摘 要 2,4-二氯苯氧乙酸(2,4-D)是目前被广泛使用的植物生长调节剂,是一种有效的除草剂,有防倒伏、促进水稻增产和早熟的功能,还可用作防霉剂。
其制备过程是多步有机合成实验。
关键词 2,4-二氯苯氧乙酸 植物生长调节剂 除草剂 多步有机合成实验原理该物质的合成分多步合成。
遵循先缩合后氯化的合成路线,采用浓盐酸加过氧化氢和次氯酸钠在酸性介质中的分步氯化来制备,避免了使用氯气带来的危险和不便。
第一步是制备酚醚,这是一个亲核取代反应,在碱性条件下易于进行。
第二步是苯环上的亲电取代,FeCl 3作催化剂,氯化剂是Cl +,引入第一个Cl 。
2HCl + H 2O 2 → Cl 2 + 2H 2O Cl 2 + FeCl 3 → [ FeCl 4 ]- + Cl +第三步仍是苯环上的亲电取代,从HOCl 产生的H 2O +Cl 和Cl 2O 作氯化剂,引入第二个Cl 。
实验试剂和规格试剂规格:氯乙酸(8g ),苯酚,饱和碳酸钠溶液,35%氢氧化钠溶液,冰醋酸,浓盐酸,30%过氧化氢,次氯酸钠,乙醇,乙醚,电磁加热搅拌器,电磁炉ClCH 2Na 2CO 3ClCH 2COONa OH +NaOHOCH 2COONaHClOCH 2COOHOCH 2COOH+HCl+H 2O 2FeCl 3OCH 2COOHClHOCl + H +H 2O+ClHOClCl 2O + H 2O OCH 2COOHCl+2NaOClHOCH 2COOHCl主要药品安全数据实验装置图1、三口烧瓶2、温度计3、球形冷凝管1、布式漏洞2、抽滤瓶3、真空磊实验步骤及实验现象记录(一)苯氧乙酸的制备实验流程:苯酚+氢氧化钠酸化冷却过滤洗涤干燥1、成盐8g氯乙酸和12mL水的混合液中慢慢滴加15mL饱和的Na2CO3溶液,调PH值到7-8,使氯乙酸转变为氯乙酸钠.2、取代向氯乙酸钠溶液中加入5.3g苯酚,用35%NaOH溶液调PH值到12,并保持温度90︒C -100︒C 加热半小时。
高三化学二轮复习小课题研究——以“结晶法在分离提纯中的应用”为例

实践分享高三化学二轮复习小课题研究——以“结晶法在分离提纯中的应用”为例■徐益宏摘要:化学实验题历来是高考的热点和难点所在,而实验题的核心环节往往是分离提纯,结晶法又是分离提纯的重要方法之一。
笔者从溶解度随温度变化角度、改变溶剂的极性角度、盐析角度等方面,对结晶法在分离提纯中的应用进行研究,从而提高高三化学二轮复习的有效性。
关键词:结晶法;溶解度;温度;极性化学实验题历来是高考的热点和难点所在,而实验题的核心环节往往是分离提纯,结晶法又是分离提纯的重要方法之一。
而在二轮复习中,学生在这一知识体系中暴露出了很多问题:什么时候用蒸发结晶?什么时候用蒸发浓缩、冷却结晶?什么时候用蒸发浓缩、趁热过滤?等。
为让学生真正理解并熟练应用各种结晶法,笔者从以下几个方面进行研究。
一、从溶解度随温度变化角度研究1.单一溶液结晶问题研究(1)如何从NaCl 溶液中得到NaCl 晶体?方法:蒸发结晶。
程度:蒸发至大量晶体出现,少量水用余热蒸干。
适用类型:适用于溶解度随温度变化不大的晶体类型,同时,此类晶体一般比较稳定,受热不易分解,不易水解,不易被氧化等。
溶解度(g )(℃)4(2)如何从CuSO 4溶液中得到五水硫酸铜晶体?方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
程度:蒸发至溶液表面出现晶膜。
适用类型:适用于溶解度随温度变化比较明显的晶体,此类晶体可以带结晶水、受热易分解、易水解、易氧化等。
2.混合溶液结晶问题研究(1)如何从KNO 3、NaCl (1∶1)混合溶液中分别得到KNO 3、NaCl 晶体?方法:蒸发浓缩,趁热过滤(得到NaCl ),滤液冷却结晶(得到不纯的KNO 3)。
(2)如何除去KNO 3中少量的NaCl 杂质?方法:重结晶,即将固体混合物溶于热水中,形成热饱和溶液,然后冷却结晶,得到的晶体为较纯的KNO 3。
如果依旧含有少量NaCl ,可以再进行一次。
(3)如何除去NaCl 中少量的KNO 3杂质?方法:将固体溶于水形成混合溶液,然后蒸发浓缩,趁热过滤,得到NaCl晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对氯苯氧乙酸的制备
一、实验目的
1、复习巩固醚的制备和芳环上的氯化反应
2、掌握利用苯酚制备对氯苯氧乙酸的原理及方法。
2、掌握电动搅拌装置的安装及使用。
3、练习并掌握固体酸性产品的纯化方法。
二、实验原理
ClCH 2COOH Na 2CO 3ClCH 2
COONa
2COONa
2HCl+H 2O 2
FeCl 3
OCH 2COOH
Cl
该实验为两步反应:第一步,酚钠和氯乙酸在碱性中通过Williamson 合成法制得苯氧乙酸。
第二步是在三氯化铁的催化下发生苯环上的氯化反应生成对氯苯氧乙酸。
但该实验不是直接通氯气,而是通过双氧水氧化盐酸生成氯,紧接着就发生氯化反应。
最后的产品经重结晶纯化。
对氯苯氧乙酸是一个常用的植物生长调节剂,俗称“防落素”,可以减少农作物或瓜果蔬菜的落花落果,有明显的增产作用。
三、实验药品用量及物理常数
四、实验装置图
反应装置抽滤装置
干燥装置
布氏漏斗
抽
滤
瓶
五、实验流程图
氯乙酸
5ml水
碳酸钠
冷却
抽滤
六、实验步骤
在装有搅拌器、回流冷凝管和滴液漏斗的100ml 三口瓶中,加入3.8克氯乙酸和5毫升水,开动搅拌,慢慢加饱和碳酸钠溶液,至溶液PH=7-8。
然后,加入2.5克苯酚,再慢慢滴加35%氯氧化钠至PH=12,沸水浴加热反应0.5小时,再用氯氧化钠调PH=12,再加热反应15分钟。
移去水浴,用浓盐酸调PH=3-4,析出固体,抽滤,水洗2-3次,在60-65度干燥,稳重,备用。
反应装置同上,加入3克上述制备的对氯苯氧乙酸,和10毫升冰乙酸,升至55度,加入少需三氯化铁和10毫升浓盐酸。
升至60-70度,在10分钟内慢慢滴加3毫升双氧水,保温反应20分钟,升温使固体溶解,慢慢冷却,析出固体,抽滤,粗产品水洗2次,用1:3的乙醇-水重结晶,干燥后称重,计算产率,测熔点。
七、实验注意事项
1、安装仪器前,要先检查电动搅拌装置转动是否正常,搅拌棒要垂直安装,安装好仪器后,再检查转动是否正常。
2、从滴加浓硫酸开始,整个反应过程中,一致保持搅拌。
3、滴加浓硫酸时,只搅拌,不加热;加浓硫酸的速度不能太快,否则会引起剧烈反应。
4、转入到40ml冷水中后,可用少量(约10ml)冷水再洗涤烧瓶。
5、碱溶时,可适当温热,但温度不能超过50℃,以防未反应的对硝基甲苯熔化,进入溶液。
6、酸化时,将滤液倒入酸中,不能反过来将酸倒入滤液中。
7、纯化后的产品,用蒸汽浴干燥。
八、教学方法
1、本实验为芳烃侧链的氧化反应。
可组织学生讨论芳环侧链的氧化方法有哪些?氧化的规
律有哪些?试写出下列化合物氧化的产物:(1)对甲异丙苯(2)邻氯甲苯(3)萘(4)对叔丁基甲苯(5)苯
2、本实验为非均相反应,可组织学生讨论提高非均相反应的措施除了电动搅拌外,还有哪
些措施?
3、组织学生讨论滴液漏斗和分液漏斗的区别,直形冷凝管和球形冷凝管的区别。
4、组织学生讨论为什么酸化时,要将滤液倒入酸中,而不能反过来将酸倒入滤液中。
