酵母转化手册(译自Yeastmaker
酵母转化试剂盒使用说明书第二版
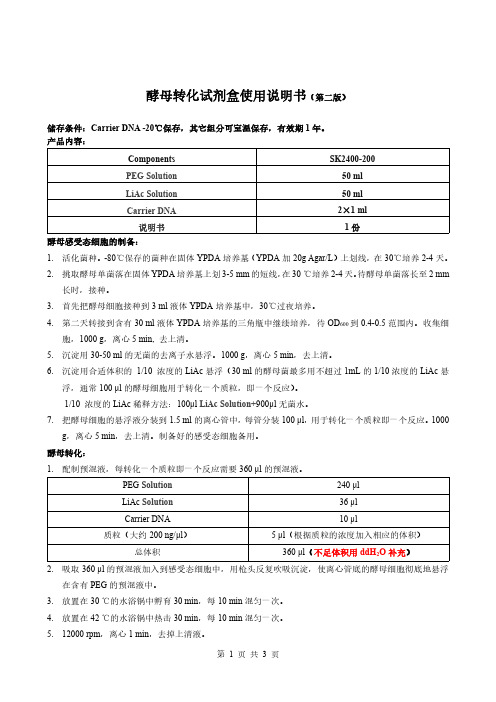
酵母转化试剂盒使用说明书(第二版)储存条件:Carrier DNA-20℃保存,其它组分可室温保存,有效期1年。
产品内容:Components SK2400-200PEG Solution50mlLiAc Solution50mlCarrier DNA2×1ml说明书1份酵母感受态细胞的制备:1.活化菌种。
-80℃保存的菌种在固体YPDA培养基(YPDA加20g Agar/L)上划线,在30℃培养2-4天。
2.挑取酵母单菌落在固体YPDA培养基上划3-5mm的短线,在30℃培养2-4天。
待酵母单菌落长至2mm长时,接种。
3.首先把酵母细胞接种到3ml液体YPDA培养基中,30℃过夜培养。
4.第二天转接到含有30ml液体YPDA培养基的三角瓶中继续培养,待OD600到0.4-0.5范围内。
收集细胞,1000g,离心5min,去上清。
5.沉淀用30-50ml的无菌的去离子水悬浮。
1000g,离心5min,去上清。
6.沉淀用合适体积的1/10浓度的LiAc悬浮(30ml的酵母菌最多用不超过1mL的1/10浓度的LiAc悬浮,通常100μl的酵母细胞用于转化一个质粒,即一个反应)。
1/10浓度的LiAc稀释方法:100μl LiAc Solution+900μl无菌水。
7.把酵母细胞的悬浮液分装到1.5ml的离心管中,每管分装100μl,用于转化一个质粒即一个反应。
1000g,离心5min,去上清。
制备好的感受态细胞备用。
酵母转化:1.配制预混液,每转化一个质粒即一个反应需要360μl的预混液。
PEG Solution240μlLiAc Solution36μlCarrier DNA10μl质粒(大约200ng/μl)5μl(根据质粒的浓度加入相应的体积)总体积360μl(不足体积用ddH2O补充)2.吸取360μl的预混液加入到感受态细胞中,用枪头反复吹吸沉淀,使离心管底的酵母细胞彻底地悬浮在含有PEG的预混液中。
酵母手册

酵母转化

酵母转化(By HMM)1.取50mL YPD液体培养基于100mL已灭菌的三角锥形瓶中,从中吸取1mL培养基于已灭菌的1.5EP管,挑单克隆接种于1mL YPD培养基中,吹吸混匀(可再vortex继续混匀)后转移至50mL的YPD液体培养基中,过夜培养约11h45min;PS: 晚上21:15开始准备,21:30接种完毕开始摇菌。
(30℃ 250rpm)。
2.第二天早上9:15开始准备,取出1mL菌液用于测OD600,用1mL YPD培养基作为Blank. 9:30测完。
PS: a.要求OD600在0.5至0.6之间。
b.测完OD后打冰盒,将ssDNA置于冰上融化。
3.将菌液分装在2支50mL离心管(蓝色,无菌)中(锥形瓶留用),2500Xg常温离心5min.弃上清于之前的锥形瓶中,各用1mL灭菌ddH2O重悬转移至1.5EP管中,共水洗两次,再各用1mL 灭菌ddH2O重悬后转移至同一个5mL无菌EP管中,吹吸混匀置于冰上。
PS:a.离心期间将灭菌水置于65℃烘箱中预热,将所需平板置于30℃培养箱中预热。
b.为避免菌液浓度差异,故将重悬后的菌液混匀,因重悬后体积大于2mL,因此转移至5mLEP管中,也可在2mL EP管中混匀后分装出一部分在一个1.5EP管中。
4.待ssDNA溶化后根据所需量在1.5EP无菌管中分装几管,各100uL(有助于煮沸后迅速冷却)。
PS: a. ssDNA要尽量多出一些,煮沸和转移过程中均有损失。
b.看ssDNA快融化时即可打开水浴锅,中频煮沸(800即可),煮沸ssDNA时用最低频120.5.将ssDNA沸水浴5min, 然后迅速冰浴5min;PS:a.重复沸水浴5min与冰浴5min可提高转化效率。
b.冰浴ssDNA时将50%PEG与1M LiOAc也置于冰上。
6.在超净台中配制mix,vortex混匀。
Component Amount(for 5 transformation)50 % PEG 1.2 ml1 M LiOAc 180 µlSingle-stranded carrier DNA 125 µlPS: 50 % PEG特别粘稠,在分装时容易损失,因此配制mix时要注意量要足够。
酵母转化手册译自Yeastmaker

3. 所需的附加材料 A. Clontech 的 Ready‐to‐Go Media Pouches Clontech 提供提供预先混合好的培养基,以方便使用 表 1 酵母转化实验所需要的培养基组分
本手册仅供学习交流,不做其他用途,如需 word 版本请发送站内信。
B.培养基的配法 配置好的培养基溶于 500mL ddH2O,121℃高压蒸汽灭菌 15min,在使用前要降 至常温,(液体培养基也可以过滤灭菌)。灭菌时间不能过长。
此方法提供如果要筛文就越有可能是因为该方plus液体培法可以获组分内容所需的附加材clont得3的readyto供提供预先混习交流不做其transforma方法适用于所常规转化方的转化效率是稀有的相互个特殊又重酵母细胞10转化子uogomediap混合好的培养酵母转其他用途如ationsyst所有的酵母方法更为高效是必要的条互作用此方重要的步骤
PEG/LiAc 溶液(聚乙二醇 3350/醋酸锂 溶液) 先配置母液:50% PEG 3350、10X TE Buffer 和 1 M LiAc (10X),转化前再配置工作液,
现配现用。
母液
工作液各组分 配置 10mL 工作液所 要求的终浓度 需各组分母液体积
50% PEG 3350
40%
8 ml
质粒 DNA(浓度、纯度高) 变性的**Yeastmaker 宿主 DNA (10 µg/µl)
Small‐Scale (1.5 ml tube) 100Байду номын сангаасng 5 µl
Library‐Scale (15 ml tube) 5–15 µg* 20µl
(* For example, use 5 µg of bait + 10 µg of prey for yeast two‐hybrid library cotransformation. )
酵母转化

酵母转化方法步骤1.YPD固体培养基Yeast Extract:10 g;Peptone:20 g;葡萄糖:20 g;Agar:20 g2.1M LiAcLiAc:10.2 g;加水到100 ml高压蒸汽灭菌,4℃保存。
100 mM的LiAc只需将1M LiAc稀释10倍即可。
3.50% PEG3350(50% W/V)4.鲑鱼精DNA(2 mg/ml)i.鲑鱼精DNA:2 mg;加TE缓冲液至10 mlii.振荡溶解后用注射器剧烈抽吸30-40次,沸水浴20分钟后马上置于冰上降温,分装100 μl到1.5ml离心管中-80℃保存。
5.SD-Trp培养基(1L, pH6.8)无氨基氮源(含硫胺酸):6.7g;葡萄糖:20g;-Trp DO supplement:0.74g。
调节pH,121℃高压灭菌20分钟。
酵母热激转化1.将酵母XK1-35在YPD固体培养基划线活化,3-4天菌落长到直径大约2-3 mm待用(菌落平板可放在4℃冰箱保存2至3周)。
2.将单菌落挑到含有50 ml YPD的100 ml三角瓶中,30℃, 220 rpm摇12 h。
3.用分光光度计测量OD值到1.0(即5×107个/ml),吸取5ml培养液加入到含有45 ml YPD的100 ml三角瓶中,终浓度约为5×106个/ml。
4.置于30℃摇床中,200rpm摇至OD值为0.4-0.6(即2-3×107个/ml),约用时3小时(2.5小时测一次OD值防止浓度摇过)。
5.将OD值为0.4-0.6的培养物转移到预冷的50ml的离心管中,置于冰上冷却15分钟,3000g离心5分钟。
后面用到的试剂和仪器都要预冷,所有操作都要在冰上或者4℃。
6.倒掉上清液,加入30 ml预冷的无菌水并将酵母悬浮,同上步离心。
7.倒掉上清液,将酵母悬浮于1 ml 100 mM的LiAc中并转移到一个预冷2 ml无菌离心管中。
毕赤酵母表达操作手册(PDF精译版)

版权声明:本站几乎所有资源均搜集于网络,仅供学习参考,不得进行任何商业用途,否则产生的一切后 果将由使用者本人承担! 本站仅仅提供一个观摩学习与交流的平台, 将不保证所提供资源的完 整性,也不对任何资源负法律责任。
所有资源请在下载后 24 小时内删除。
如果您觉得满意, 请购买正版,以便更好支持您所喜欢的软件或书籍!☆☆☆☆☆生物秀[]☆☆☆☆☆中国生物科学论坛[/bbs/]☆☆☆☆☆生物秀下载频道[/Soft/]生物秀——倾力打造最大最专业的生物资源下载平台!■■■ 选择生物秀,我秀我精彩!!■■■欢迎到生物秀论坛(中国生物科学论坛)的相关资源、软件版块参与讨论,共享您的资源,获 取更多资源或帮助。
毕赤酵母多拷贝表达载体试剂盒用于在含多拷贝基因的毕赤酵母菌中表达并分离重组蛋白综述:基本特征:作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。
不仅如此,操作时与E.coli及酿酒酵母同样简单。
它比杆状病毒或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。
同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。
这些使得毕赤酵母成为非常有用的蛋白表达系统。
与酿酒酵母相似技术:许多技术可以通用:互补转化基因置换基因破坏另外,在酿酒酵母中应用的术语也可用于毕赤酵母。
例如:HIS4基因都编码组氨酸脱氢酶;两者中基因产物有交叉互补;酿酒酵母中的一些野生型基因与毕赤酵母中的突变基因相互补,如HIS4、LEU2、ARG4、TR11、URA3等基因在毕赤酵母中都有各自相互补的突变基因。
毕赤酵母是甲醇营养型酵母:毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。
甲醇代谢的第一步是:醇氧化酶利用氧分子将甲醇氧化为甲醛,还有过氧化氢。
为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。
说明书-翻译

B 检测bait表达
要确定bait是否在酵母中表达,pGBKT7-bait质粒 p53 57 kD Western blot
C 自激活活性检测
BD-bait质粒转化Y2Hgold感受态细胞,SD/-Trp/X and SD/-Trp/X/A
这种分裂表示2个单倍体的亲本细胞和发育的二倍体细胞,有的像三叶草,clover leaf 有的像米老鼠
8.8 1000 g 离心10 min,收集细胞
8.9 50 ml 0.5*YPDA(50 ug/ml kan)清洗烧瓶2次,用这个悬浮收集的细胞。
8.10 1000 g 离心10 min,弃上清。
This system uses SMART cDNA synthesis technology, which allows you to construct cDNA libraries from any tissue source starting with as little as 100 ng of total RNA.
10.1 材料
感受态细胞、DDO/X,QDO/X/A
10.2 小规模转化Y2Hgold感受态细胞:pGBKT7/Bait + Prey(pGADT7,
Empty pGBKT7 +Prey
10.3 100μl 10倍,100倍稀释液涂板(DDO/X,QDO/X/A),30℃培养3~5 d,
混合,2L 烧瓶;c 加45 ml 2*YPDA液体培养基(50 ug/ml kan);d 用1 ml 2*YPDA 清洗的离心管两次,在加到2 L烧瓶中;
酵母双杂交H2Y和Y187系统protocol

目录(一)介绍 4 (二)试剂盒物品清单 7 (三)额外附加物品列表9 (四)酵母菌株11 (五)酵母载体14 (六)方法简述:单杂交文库的构建和筛选16 方法简述:双杂交文库的构建和筛选17 (七)构建用于酵母单杂交的报告质粒载体18 (八)构建用于酵母双杂交的DNA-BD融合载体19 (九)构建生成cDNA文库21 (十)构建和筛选酵母单杂交和双杂交文库(简述)27 (十一)酵母单杂交文库的构建和筛选28 (十二)酵母双杂交文库的构建和筛选30 方法A:通过酵母配对(Yeast Mating)来筛选目的蛋白30方法B:通过共转化的方法筛选目的蛋白35 (十三)分析阳性相互作用结果38 (十四)问题解决指南44 (十五)参考文献47 (十六)相关产品50 附录A: 双链 cDNA合成的典型结果51 附录B: 酵母感受态的制备—LiAc 法52 附录C:单杂交对照载体信息53 附录D:双杂对照载体信息54 表格列表Table I. BD Matchmaker酵母菌株的基因型11 Table II. BD Matchmaker酵母菌株的表型11 Table III.单杂交系统的载体14 Table IV.双杂交系统的载体15 Table V.各BD-Matchmaker DNA-BD 载体的比较19 Table VI. RNA起始浓度和PCR扩增循环数之间的关系24 Table VII.单杂交共转化的对照实验的设置29 Table VIII.单杂共转化对照实验:期望的结果29 Table IX.双杂交转化的对照实验的设置33 Table X.双杂交配对筛选的对照实验的设置Table XI.双杂交共转化的对照实验的设置Table XII.双杂交共转化的对照实验:期望的结果Table XIII.用于PCR筛选菌落的Assembling Master Mixs图片列表Figure 1.使用BD Matchmaker单杂交系统筛选蛋白-DNA相互作用 4 Figure 2.使用BD Matchmaker单杂交系统筛选蛋白-蛋白相互作用 4 Figure 3.酵母单杂交和双杂交筛选的大致步骤5 Figure 4.构建和筛选BD Matchmaker酵母单杂交和双杂交文库6 Figure 5.酵母菌株AH109和Y187中的报告基因12 Figure 6.BD Matchmaker酵母单杂交文库的构建和筛选16 Figure 7.BD Matchmaker酵母双杂交文库的构建和筛选17 Figure 8.用BD SMART技术合成高质量的ds cDNA 21 Figure 9.BD CHROMA SPIN纯化柱和收集管26 Figure 10.通过酵母重整合作用来构建AD融合文库27 Figure 11.为双杂交筛选AD融合文库32 Figure 12.分析和证明可能的单杂交和双杂交相互作用阳性结果的策略39 Figure 13.通过酵母配对来验证蛋白-蛋白相互作用42 Figure 14.用对照用人胎盘Poly A+ RNA合成双链cDNA 51 Figure 15.p53HIS对照载体的图谱53 Figure 16.pGAD-Rec2-53 AD对照载体的图谱53 Figure 17.pGADT7-RecT AD对照载体的图谱54 Figure 18.pGBKT7-53 DNA-BD 对照载体图谱54 Figure 19.pGBKT7-Lam DNA-BD 对照载体图谱55(一)介绍BD Matchmaker TM Library Construction & Screening试剂盒提供一种简便的方法构建cDNA文库用来进行酵母双杂交和单杂交的筛选,这些试剂盒结合了BD Matchmaker TM Systems和BD SMART TM cDNA Synthesis的技术,只需要用任何组织的1 μg poly A+ RNA 或total RNA就能构建cDNA文库。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 所需的附加材料 A. Clontech 的 Ready‐to‐Go Media Pouches Clontech 提供提供预先混合好的培养基,以方便使用 表 1 酵母转化实验所需要的培养基组分
本手册仅供学习交流,不做其他用途,如需 word 版本请发送站内信。
B.培养基的配法 配置好的培养基溶于 500mL ddH2O,121℃高压蒸汽灭菌 15min,在使用前要降 至常温,(液体培养基也可以过滤灭菌)。灭菌时间不能过长。
PEG/LiAc 溶液(聚乙二醇 3350/醋酸锂 溶液) 先配置母液:50% PEG 3350、10X TE Buffer 和 1 M LiAc (10X),转化前再配置工作液,
现配现用。
母液
工作液各组分 配置 10mL 工作液所 要求的终浓度 需各组分母液体积
50% PEG 3350
40%
8 ml
System 2
User Manual(PT1172‐1)
图表 表 1:酵母转化实验所需要的培养基组分
本手册仅供学习交流,不做其他用途,如需 word 版本请发送站内信。
1. 简介
Yeastmaker™ Yeast Transformation System 2 提供了一种高效的 PEG/醋酸锂 酵母细胞转化法,本方法适用于所有的酵母转化,包括酵母单杂交系统和酵母双 杂交系统。 此方法提供了一种比常规转化方法更为高效,含的克隆数越多,你 就越有可能发现新的、稀有的相互作用,此方法之所以较其他方法转化效率更高, 是因为该方法包含一个特殊又重要的步骤:在加入 DNA 和 DMSO 处理后,加入 YPD Plus 液体培养基培养酵母细胞(帮助酵母细胞摄取更多的质粒 DNA)。使用此方 法,可以获得≥3 X 105 转化子/ug 质粒 DNA。
2. 30℃恒温箱倒置培养 3–5 天,待菌落长至适宜大小 3. 用下列公式计算转化效率
转化效率 = 单菌落数 X 悬浮细胞液总体积(mL) 涂板的菌液体积(mL) X DNA 总量(ug)
(如果是用 10 倍稀释液或 100 倍稀释液涂板,还要乘以相应的倍数)
例如:转化 100 ng pGBT9 空载体(Yeastmaker Yeast Transformation System 2 的阳性对照质粒),将 1 ml 菌液稀释 10 倍,吸取 100 uL 涂板,培养 3 天后,在 SD/Trp 上长出 300 个单菌落,其转化效率为:
质粒 DNA(浓度、纯度高) 变性的**Yeastmaker 宿主 DNA (10 µg/µl)
Small‐Scale (1.5 ml tube) 100 ng 5 µl
Library‐Scale (15 ml tube) 5–15 µg* 20µl
(* For example, use 5 µg of bait + 10 µg of prey for yeast two‐hybrid library cotransformation. )
Biology, by Guthrie & Fink (1991) and Molecular Biology and Genetic Engineering of Yeasts, edited by Heslot & Gailardin (1992).
酵母菌在用封口膜封住的 YPD 或 YPDA 培养皿上,4℃可以保持 2 个月。但是新 鲜的菌种(1‐3 周)接菌到液体培养基上后活力更佳。
Clontech 公司提供的预先混合好的培养基不需要调 pH,但是如果配置使用的 ddH2O 偏酸性,就要将 pH 调到 5.8。
关于培养基配置的更多细节可以查询 Clontech Yeast Media Protocol‐at‐a‐Glance (PT4057‐2)。
4. 酵母转化所需溶液 1.1X TE/LiAc 溶液 先配置母液:10X TE buffer 和 1 M LiAc (10X),转化前再配置工作液,现配现用。 混合 1.1 mL 10X TE buffer 和 1.1 mL 1 M LiAc (10X),再加入 8.8mL 灭过菌的超纯水, 定容至 10mL,混合均匀。
本手册仅供学习交流,不做其他用途,如需 word 版本请发送站内信。
6. 酵母转化方法 A. 方法:酵母感受态细胞的制备 1. 材料 Yeastmaker Yeast Transformation System 2 (Cat. No. 630439) 1.1x TE/LiAc (Section 4) YPDA 固体培养基 YPDA 液体培养基 适宜的 SD 筛选培养基 酵母细胞 (S. cerevisiae)冷冻保存液 无菌(去离子)水(去离子水就是超纯水) 2. 挑酵母菌株(Y1HGold)在 YPDA 固体培养基上划板,30℃倒置培养,待菌生长至 适宜大小(约 3 天)。 注意:此时可以暂停实验,将平板转入暗下,4℃可保持 1 个月,待继续实验时将 平板再放入 30℃,菌落会继续生长。 3. 挑单菌落(直径 2–3 mm,储存时间<4 周),接种于有 3 ml YPDA 液体培养基的三 角瓶(规格:15mL)中。 (温馨提示:同时挑 4 个单菌落,接种到 4 个三角瓶中,最后挑生长速度最快的 菌落继续实验) 4. 在 30℃摇床中,以 250rpm 摇 8–12 小时。 5. 转大瓶:吸取 5uL 菌液转入有 50mL YPDA 液体培养基的三角瓶(规格:250mL)中。 6. 在 30℃摇床中,以 250rpm 继续摇 16–20 小时,期间测 OD,待 OD600 达到 0.15–0.3 时停止摇菌。 注意:一定要持续摇菌至 OD 值合适时停止,但培养时间不能过长。 7. 室温下,700 g 离心 5 min 收集菌体,弃上清,用滤纸吸干残余液体,加入 100mL YPDA 液体重悬菌体。 8. 在 30℃摇床中,以 250rpm 继续摇 3–5 小时至 OD600 达到 0.4–0.5。 注意:一定要持续摇菌至 OD 值合适时停止,但培养时间不能过长。 9. 将菌液分装至 2 个灭过菌的 50mL 离心管中,室温下 700 g 离心 5 min 收集菌体。 弃上清,用滤纸吸干残余液体,2 个离心管中各加入 30mL 灭过菌的超纯水,重悬 菌体。 10. 室温下 700 g 离心 5 min 收集菌体。弃上清,用滤纸吸干残余液体,2 个离心管中 各加入 1.5 ml 1.1xTE/LiAc 重悬菌体, 11. 将菌液分别转至 2 个 1.5mL 离心管中,高速离心 15s。 12. 弃上清,2 个 1.5mL 离心管各加入 600 µl 1.1xTE/LiAc,重悬菌体,酵母感受态细胞 已制备好,可用于转化质粒 DNA。 注意:为了使转化效率尽可能的高,感受态要现配现用,但是此感受态细胞在冰 上储存几个小时并不会明显降低转化效率。
转化效率=
300 x 1 x 10(稀释倍数) 0.1 x 0.1
=3x105 cfu/μg
新转化的酵母菌株的储存 1. 如果要保存新转化的酵母菌株,用接种环(牙签)接种单菌落。 2. 用包含 15–30% 无菌甘油的 0.5 ml YPD 或 YPDA 液体培养基(或者适宜的 SD 培养基)重悬菌体,接入 2mL 离心管 3. 用封口膜封紧盖子,轻轻混匀,速冻后放入‐70℃冰箱保存。 4. 如需使用该菌株,在冰上充分溶解后,挑适量菌液,在 YPD 或 YPDA 固体 培养基(或者适宜的 SD 培养基)上划线培养。(在划线前要充分混匀菌液)
高速离心 15s 700 g 离心 5 min
12. 弃上清,加入 0.9% (w/v) NaCl 溶液重悬菌体
1 ml
15 ml
本手册仅供学习交流,不做其他用途,如需 word 版本请发送站内信。
C. 方法:涂板、判定转化效率 1. 将菌液分别稀释 10 倍、100 倍,分别吸取 100 µl 稀释液,涂布到相应的 SD 筛选 培养基上。例如: pGBKT7 载体用 SD/‐Trp 培养基 pGADT7 载体用 SD/‐Leu 培养基 pGBKT7 和 pGADT7 共转,用 SD/‐Leu/‐Trp 培养基 注意:不要直接用未稀释的菌液涂板。
10X TE Buffer
1X
1 ml
1 M LiAc(10X)
1X
1 ml
0.9% (w/v) NaCl 溶液 称取 0.9g NaCl,溶解于 80mL 超纯水中,用容量瓶定容至 100mL,过滤灭菌。
5. 酵母菌株储存条件 如果想要了解更多关于酵母的知识,推荐去看 Guide to Yeast Genetics and Molecular
(**变性方法: 用 95–100°C 高温处理 5 min,迅速置入冰上数分钟,待温度降至 4℃再重复一次此步骤)
3. 加入感受态细胞,轻柔混匀 4. 加入 PEG/LiAc,轻柔混匀 5. 置于 30℃恒温箱孵化
(注意:期间 Small‐Scale 每隔 10min,Library‐Scale 每隔 15min,轻轻倒混几次)
50 µl 500 µl 30 min
600 µl 2.5 ml 45 min
6. 加入 DMSO,轻柔混匀
20 µl
160 µl
7. 在 42℃水浴锅中温浴
(注意:期间 Small‐Scale 每隔 5 min,Library‐Scale 每隔 10 min,轻轻倒混几次)
15 m习交流,不做其他用途,如需 word 版本请发送站内信。
B. 方法:转化酵母感受态细胞 1. 材料 Yeastmaker Yeast Transformation System 2 酵母感受态细胞(Section 6.A) PEG/LiAc (Section 4) 0.9% (w/v) NaCl DMSO 2. 将下列组分加入到已经预冷的无菌离心管中,混合均匀。
8. 离心收集菌体
