鲁教版2020中考真题汇编6.3海水“制碱”.pdf
【鲁教版】2020中考化学总复习考点梳理:第八单元 海水中的化学习题(含答案)

第八单元 海水中的化学重难点1 海洋化学资源和海水“晒盐”(2017·连云港)海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。
实验室中除去粗盐中不溶性杂质获得精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻地斜靠在__三层滤纸__一边。
蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是__左右移动酒精灯或间歇加热__。
②下列操作可能导致精盐产率偏高的是__b__(填字母)。
a .食盐没有完全溶解即过滤 b .过滤时液面高于滤纸边缘c .器皿上粘有的精盐没有全部转移到称量纸上(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。
下图是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是__MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2__。
②上述过程中试剂A 与沉淀B 发生的是中和反应,则试剂A 是__盐酸__(填名称)。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4·n H 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于__混合物__(填“纯净物”或“混合物”)。
②若某种可燃冰中CH 4与H 2O 的质量比是1∶9,则该可燃冰中n =__8__。
③可燃冰中甲烷完全燃烧的化学方程式是__CH 4+2O 2=====点燃CO 2+2H 2O__。
(2017·青岛)为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。
过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。
实验操作过程如下图所示:下列说法错误的是(C)A .实验操作步骤也可以是①③④②⑤⑥B .操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH 调为7C .在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒D .操作⑤得到的沉淀中共有四种物质 重难点2 海水“制碱”(2017·湘潭)我国制碱工业先驱侯德榜发明了“侯氏制碱法”。
鲁教新版九年级化学第八章第三节海水制碱尖子生题(word有答案)

鲁教新版九年级化学第八章第三节海水制碱尖子生题(word有答案)一.选择题〔共20 小题〕1.以下有关说法中,正确的选项是〔〕①由同种元素组成的物质能够是单质;②用碳酸氢钠可做焙制糕点的发酵粉;③在原子中,核内质子数一定等于核外电子数;④用熟石灰可改良碱性土壤.A.①②④B.①②③C.②③④D.①②③④2.向烧杯中逐滴参与X 溶液至过量〔图甲〕,生成沉淀或气体的质量〔纵坐标〕〕A.A B.B C.C D.D3.向含有稀盐酸和氯化铜的混合溶液中滴加NaOH 溶液,如图曲线中描画正确的是〔〕A.B.C. D .4.将H2SO4,Na2CO3,Ba〔OH〕2 三种溶液,两两混合后,恰恰完全反响,对有沉淀生成的区分停止过滤,所得滤液的酸碱性表达正确的选项是〔〕A.一种滤液显碱性,另一种滤液显酸性B.一种滤液显碱性,另一种滤液显中性C.两种滤液均显碱性D.两种滤液均显酸性5 .已知Na2CO3 受热时稳定,而NaHCO3 受热会分解,2N aHCO3N a2CO3+H2O+CO2↑.现将Na2CO3 与NaHCO3 的混合物mg 溶解在水中,配成100mL 水溶液,测得溶液中钠离子的质量为0.46g,假定将该溶液蒸干灼烧直至质量不变,可得固体的质量为〔〕A.2.55g B.2.12g C.1.86g D.1.06g6.石头纸是一种新型、环保纸张.它与传统的木浆纸不同,是将碳酸钙粉末加上15%的聚乙烯和5%的胶合剂,经特殊工艺处置后制成.以下说法正确的选项是A.石头纸属于纯真物B.应用稀盐酸可以区别石头纸与木浆纸C.石头纸极易溶于水可以回收应用D.石头纸的运用不能增加对树木的砍伐7.碳酸氢钠与人类生活亲密相关,以下图片能反映出碳酸氢钠用途的是〔〕A.急救病人B.人工降雨C.蒸馒头D.抹墙壁8.在探求碳酸钠、碳酸氢钠两种物质时,小明的以下做法中不正确的选项是〔〕A.采用网上查询的方法,查阅两种物质的有关资料B.采用调查的方法,了解这两种物质在家庭生活中的运用状况C.采用实验的方法,研讨碳酸钠溶液和碳酸氢钠溶液的酸碱性D.采用区分与盐酸反响看能否有气泡生成的方法,鉴别这两种物质9.以下各组物质的溶液之间,不能发作复分解反响的是〔〕A.NaCl 和AgNO3 B.HCl 和Na2CO3 C.NaOH 和HCl D.HCl 和KNO310.以下各组物质的溶液相互间能发作中和反响且生成沉淀的是〔〕A.氢氧化钠溶液和稀盐酸B.碳酸钠溶液和稀硫酸C.氢氧化钡溶液和稀硫酸D.氢氧化钠溶液和硝酸钾溶液11.以下各组物质的溶液混合,假设其中酸过量时,仍有沉淀生成的是〔〕A.NaOH、FeCl3、H2SO4 B.HCl、K2CO3、B aCl2C.CuSO4、HCl、KOH D.B aCl2、H N O3、N a2SO412.小明同窗在总结酸、碱、盐之间的相互反响关系时发现,选用适当物质可实现如图中所示的一切反响.假定中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是〔〕A.HCl NaOH BaCl2 Na2SO4 B.H2SO4 Ba〔OH〕2 Na2SO4 B aCl2C.HCl Ba〔OH〕2 Na2SO4 BaCl2 D.H2SO4 NaOH BaCl2 N a2SO413.候德榜是我国著名的化学家,为纯碱和氮肥工业技术的开展作出了出色的贡献。
2020年鲁教版九年级化学下册第八单元第三节 海水“制碱”(II)卷

2020年鲁教版九年级下册第八单元第三节海水“制碱”(II)卷姓名:________ 班级:________ 成绩:________一、单选题1 . 下列实际应用中,利用中和反应原理的是()①用氢氧化钠溶液洗涤石油产品中的残余硫酸②用碳酸氢钠治疗胃酸过多③含有氢氧化铝的药物治疗胃酸过多症④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒.A.①②B.①③④C.②③D.①②③④2 . 下列各组物质的鉴别中,所选的鉴别试剂,不正确的是A.A B.B C.C D.D3 . 发明联合制碱法,为纯碱和氮肥工业技术的发展作出了杰出贡献的科学家是()A.张青莲B.侯德榜C.门捷列夫D.拉瓦锡4 . (2017年广东省)下图为xx泡打粉的标签如图所示,下列说法错误的是A.碳酸氢钠俗称小苏打B.泡打粉可以随意放置C.加入泡打粉制作的蛋糕更松软D.面粉是有机物,碳酸盐是无机物5 . 下列除杂质的方法中,所用试剂及操作方法均正确的是()选项待提纯的物质杂质(少量)选用的试剂及操作A氯化钾氯酸钾加入适量二氧化锰后充分加热B食盐泥沙加入足量水搅拌溶解后过滤C二氧化碳氧气通过盛有足量的澄清石灰水的洗气瓶D木炭粉铁粉用磁铁吸引A.A B.B C.C D.D6 . 下列方程式符合题意,书写正确且属于基本反应类型的是()A.加熟石灰研磨,检验铵态氮肥:NH4NO3+Ca(OH)2=Ca(NO3)2+NH3↑+H2OB.煅烧石灰石制生石灰:CaCO3CaO+CO2↑C.洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑D.用含氢氧化铝的药物治疗胃酸过多:3H2SO4+2Al(OH)3=Al3(SO4)3+3H2O7 . 化学让我们的生活更美好,科学家为此作出了很大的努力,其中在制碱工业作出巨大贡献的是A.拉瓦锡B.门捷列夫C.汤姆生D.侯德榜8 . 无土栽培是利用营养液(多种化合物的水溶液)栽培作物。
下列哪组物质因反应降低了肥效,而不能同时用来配制同一种营养液的是(营养液中其他物质均不与它们反应)()A.KCl和NaNO3B.KOH和(NH4)2CO3C.KCl和Ca(NO3)2D.MgSO4和KNO39 . 下列实验操作中(括号内为杂质)不能达到实验目的的是选项物质目的主要实验操作A CO、H2鉴别点燃,火焰上方罩干冷烧杯,观察现象B Na Cl (泥沙)提纯溶解、过滤、蒸发C H2 (HCl)除杂通过装有碳酸钙悬浊液的洗气瓶,收集D MnO2、KCl分离溶解、过滤、洗涤、烘干、蒸发结晶A.A B.B C.C D.D10 . 下列有关物质用途的说法中错误的是A.活性炭有吸附性,常用它降低水的硬度B.一氧化碳有还原性,常用它冶炼金属C.氮气的化学性质不活泼,可用作保护气D.小苏打可用于治疗胃酸过多症11 . 如图为喷墨打印机工作原理示意图,溶解在打印墨水(pH:7.5-9.0)中的染料,从喷嘴喷到打印纸(pH:4.5-6.5)上,变为不溶于水的固体。
2020年九年级化学下册第八单元海水中的化学第三节海水“制碱”新版鲁教版
第三节海水“制碱”一、单选题(共10题;共20分)1.下列各组物质的溶液不用其他试剂就可鉴别的是()A.NaOH CuSO4 NaNO3 Na2SO4B.FeCl3 HCl CuCl2 Na2SO4C.Na2CO3 Na2SO4 HCl H2SO4D.BaCl2Na2CO3 HCl NaCl2.在无色溶液中,下列离子能大量共存的是()A.Ca2+ Na+ CO32﹣ Cl﹣B.Na+ K+ OH﹣ Cl﹣C.Cu2+ K+ Cl﹣ NO3﹣D.H+ Na+ OH﹣ SO42﹣3.用下列方法能把食醋、食盐水、石灰水一次区别开的是()A.品尝一下B.分别滴加紫色石蕊试液C.分别滴加酚酞试液D.闻一闻气味4.只用水不能区分各组物质(物质均为固体)的是()A.生石灰氯化钠B.碳酸钡硝酸钾C.苏打小苏打D.氯化钠硝酸铵5.下列物质间不能发生复分解反应的是()A.MgCO3+HClB.KNO3+BaSO4C.AgNO3+HClD.NaOH+NH4Cl6.下列离子能在pH=1的水溶液中大量共存的是()A.SO42-、Cl-、Na+、H+B.K+、SO42-、Cu2+、N03-C.Cl-、K+、SO42-、Na+D.Ca2+、Cl-、CO32-、Na+7.物质的用途错误的是()A.食盐溶液:消毒杀菌B.干冰:人工降雨C.稀有气体:制作霓虹灯D.氢氧化钠:除去铁钉上的铁锈8.下列各组离子在水中一定能大量共存,并形成无色透明溶液的是()A.Ba2+, Cu2+, OH﹣B.Na+, Cl﹣, SO42﹣C.Na+, H+, CO32﹣D.Fe3+, Cl﹣, NO3﹣9.下列有关物质用途的描述中,错误的是()10.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液的颜色变化情况是()A.先变红后变紫B.变红后颜色不再改变C.先变无色后变红D.先变蓝后变紫二、填空题(共5题;共17分)11.在硫酸铜溶液中滴加石灰水,可以看到________,发生反应的方程式为________,农业上用此配成________液对农作物有很好的杀虫作用。
精品解析:鲁教版九年级化学全册同步测试:第八单元第三节海水“制碱”(解析版).docx

第三节海水“制碱1.我国化学家侯徳榜改进了i种化工产品的工业生产技术,其产品获得美国费城万国博览会金奖,这种生产技术用于()A.生产烧碱B.生产纯碱C.精制粗盐D.生产尿素【答案】B【解析】侯德榜为我国的制碱工业作出了杰出贡献,这里的“碱"指的是纯碱。
2.下列几类物质屮,一定同时含有氢、氧两种元素的是()A.氧化物B.碱C.盐D.酸【答案】B【解析】试题分析:根据氧化物、酸、碱和盐的概念分析。
A、氧化物是由两种元素组成并且其中一种元素是氧元素的化合物,但氧化物不一定同吋含有蛍、氧两种元素,例如氧化铜屮含有氧元素,不含有氢元素,故错误;B、碱电离时生成的阴离子都是氢氧根离子,所以碱同时含有氢、氧两种元素,故正确;C、盐不一定同吋含有盘、氧两种元素,例如氯化钠是盐,就不含氧元素、蛍元素,故错误;D、酸电离时生成的阳离子都是氢离子,一定含有氢元索,但不一定含有氧元素,例如盐酸屮就不含有氧元素,故错误。
故选B考点:本题考查氧化物、酸、碱和盐的概念点评:解答本题的关键是理解和掌握氧化物、酸、碱和盐的基本概念,只有这样才能做出正确判断。
3.某化工厂通过电解食盐水制取一些化学工业的基本原料,此反应的产物不可能是()A.烧碱B.硫酸C.氢气D.氯气【答案】C【解析】试题分析:根据质量守恒定律分析,电解食盐水的反应屮,反应物的组成元素有钠、氯、氧、氢, 所以生成物的元素组成只能有这四种元素。
A、烧碱屮有钠、氧、氢三种元素,符合质量守恒定律,所以可能是生成物;B、硫酸屮有氢、硫、氧三种元素,而反应物中根本就没有硫元素,不符合质量守恒定律,故硫酸不可能是生成物;C、氢气由氢元素组成,符合质量守恒定律,所以可能是生成物;D、氯气由氯元素组成,符合质量守恒定律,所以可能是生成物。
故选B考点:本题考查质量守恒定律及其应用点评:根据反应物和生成物的元素种类需相同,来判断是否是生成物,如果所给物质中的一种元素,在反应物屮找不到,就不可能是生成物。
鲁教版(五四制)九年级全一册第三单元海水中的化学第三节海水“制碱”同步习题
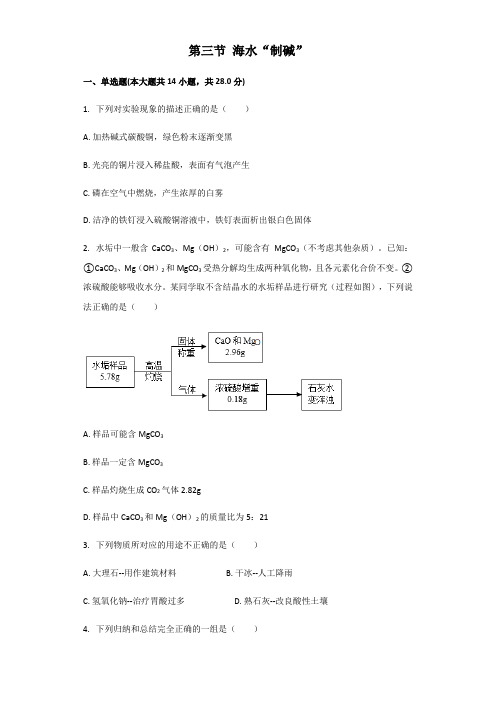
第三节海水“制碱”一、单选题(本大题共14小题,共28.0分)1.下列对实验现象的描述正确的是()A.加热碱式碳酸铜,绿色粉末逐渐变黑B.光亮的铜片浸入稀盐酸,表面有气泡产生C.磷在空气中燃烧,产生浓厚的白雾D.洁净的铁钉浸入硫酸铜溶液中,铁钉表面析出银白色固体2.水垢中一般含CaCO3、Mg(OH)2,可能含有MgCO3(不考虑其他杂质)。
已知:①CaCO3、Mg(OH)2和MgCO3受热分解均生成两种氧化物,且各元素化合价不变。
②浓硫酸能够吸收水分。
某同学取不含结晶水的水垢样品进行研究(过程如图),下列说法正确的是()A.样品可能含MgCO3B.样品一定含MgCO3C.样品灼烧生成CO2气体2.82gD.样品中CaCO3和Mg(OH)2的质量比为5:213.下列物质所对应的用途不正确的是()A.大理石--用作建筑材料B.干冰--人工降雨C.氢氧化钠--治疗胃酸过多D.熟石灰--改良酸性土壤4.下列归纳和总结完全正确的一组是()A.化学与资源B.化学与生活①防止金属腐蚀是保护金属资源的途径之一②煤、石油、天然气乙醇是可再生能源③海洋中蕴藏着丰富的化学资源①用食醋除水垢②小苏打用作发酵粉、治疗胃酸过多③用生石灰作食品干燥剂C.化学与安全D.化学与发现①炒菜锅着火可以用锅盖盖灭②在室内放一盆水能防止煤气中毒③夜间发现液化气泄漏开灯寻找泄漏源①波义耳发现酸碱指示剂②拉瓦锡发现元素周期律并编制元素周期表③门捷列夫发现空气的组成A.AB.BC.CD.D5.化学与生活、生产密切相关,下列说法错误的是()A.食品上常用小苏打作发酵粉B.工业上常用稀盐酸作除锈剂C.医疗上常用BaSO4做“钡餐”D.防腐上用甲醛溶液保存海鲜产品6.由Na、S、O、H中的2种或3种元素组成4种化合物.甲能跟BaCl2反应生成另外两种盐;乙能跟NaOH反应生成盐和水;丙能跟HCl反应生成盐和水;丁呈中性,跟CaO 或CO2化合生成碱或酸.则下列判断错误的是()A.甲可能是Na2SO4B.乙一定是H2SO4C.丙可能是NaOHD.丁一定是H2O7.2008年春节前夕,我国南方遭遇百年不遇冰雪灾害,为确保道路的畅通,有关部门向公路上的积雪撒盐以使冰雪很快融化。
鲁教版中考真题汇编6.3海水“制碱”

6.3 海水“制碱” 41.(海南)由我国化工专家侯德榜探索发明的“侯氏制碱法”,其生产过程涉及的主要化学反应如下:①NH 3+C02+X =NH 4HC03 ②NH 4HC03+NaCI==NH 4Cl+NaHC03 ↓③2NaHC02C03+H 20+C02 ↑请回答:(1)反应①中X 的化学式为 ;(2) NH 4Cl 中N 元素的化合价为 ; 41. (1)H 2O (2)-3 (3)加热 6.(武汉)下列说法中正确的是( )。
A .向某溶液中滴加AgNO 3溶液和稀HNO 3,产生白色沉淀。
该溶液一定是稀盐酸B .可用适量的硝酸钡溶液,除去氯化钠溶液中混有的碳酸钠,得到纯净的氯化钠C .要除去铜粉中混有的少量炭粉,可采用在空气中充分灼烧混合物的方法D .有盐和水生成的反应不一定是中和反应13.(泸州)25℃时,将a g 碳酸钠(化学式为Na 2CO 3)溶解于100g 水中恰好形成饱和溶液。
所得溶液的溶质质量分数为×100% ,此温度下碳酸钠的溶解度为 a g 。
向此溶液中滴入足量稀盐酸,反应的化学方程式为 Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 。
8.(娄底)下列有关物质的化学式、名称、俗名不完全对应.....的是 A .NaOH 氢氧化钠 烧碱 B .CaO 氢氧化钙 生石灰 C .Na 2CO 3 碳酸钠 纯碱 D .NaCl 氯化钠 食盐26.(宜昌)(13分)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。
【知识回放】通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式: ⑴一个中和反应 ;⑵一个有沉淀生成的反应 。
【挖掘实质】⑴图26-1是HCl 和NaOH 在水中解离出离子的示意图,小丽发现HCl 在水中会解离出H +和Cl -,NaOH 在水中会解离出Na +和OH -,以此类推硝酸钡在水中会解离出的离子是 (填离子符号)。
鲁教新版九年级化学第八章第三节海水制碱中档难度提升题(word有答案)

鲁教新版九年级化学第八章第三节海水制碱中档难度提升题(word有答案)中档难度提升题一.选择题〔共20 小题〕1.胃液里含有过量的盐酸可以协助消化,但假定盐酸过多,人就会感到不舒适.有以下几种物质:〔1〕NaOH〔2〕Ca〔OH〕2〔3〕Al〔OH〕3〔4〕NaHCO3 你以为可服用作治疗胃酸过多的药物有〔〕A.〔1〕〔2〕〔3〕〔4〕B.〔1〕〔2〕〔3〕C.〔1〕〔2〕D.〔3〕〔4〕2.物质的性质决议其用途.有关物质的用途不正确的选项是〔〕A.用烧碱溶液吸收处置二氧化硫尾气B.用明矾污染水是用它作水的消毒剂C.用胆矾、生石灰与水来配制农药D.用食盐腌渍食品是用它作食品防腐剂3.以下有关说法正确的选项是〔〕A.硝酸铵溶于水制得的冰袋可用高烧病人降温B.稀释浓硫酸时要将水沿器壁渐渐注入浓硫酸中,并用玻璃棒不时搅拌C.用氢氧化钠可以枯燥二氧化碳气体D.工业上常说的〝三酸两碱〞中的两碱指的是:氢氧化钠和氢氧化钙4.以下有关物质用途说法中,不正确的选项是〔〕A.用稀硫酸肃清钢铁外表的铁锈B.用氢氧化钠中和胃中过多盐酸C.用碳酸氢钠作焙制糕点的发酵粉D.用熟石灰中和消费硫酸的工厂排放的污水5.小明知道蛋壳的主要成分是碳酸钙,哲人节这天决议送妈妈一个〝无壳鸡蛋〞.他从厨房中取来一个鸡蛋及一杯物质,将蛋泡在其中,那么见蛋的外表冒出少量气泡,两天后就失掉一个没有壳的蛋.他应取以下哪一种物质〔〕A.高梁酒B.醋C.酱油D.食盐水6.以下表达中正确的选项是〔〕A.铁丝在空气中熄灭火星四射B.把生石灰放入稀盐酸,发生少量气泡C.将碳酸钠放入滴有酚酞试液的水中,溶液变红D.氯化铁溶液中参与氢氧化钠溶液,生成蓝色沉淀7.发酵粉的主要成份是〔〕A.碳酸氢钠与酒石酸B.碳酸钠与酒石酸C.碳酸钠与硅酸D.碳酸氢钠与硅酸8.碳酸钠是一种重要的化工原料,其俗称为〔〕A.火碱B.小苏打C.苛性钠D.纯碱9.以下图型表达的意义正确的选项是〔〕A.复分解反响模型图B.原子、离子、元素关系模型图C.地壳中元素含量模型图D.物质分类模型图10.某同窗对化学知识的归结正确的选项是〔〕A.pH>7 的溶液一定是碱的溶液B.能分解生成氧气的物质一定含有氧元素C.生成盐和水的反响一定是复分解反响D.同种元素组成的物质一定是单质11.以下各组物质充沛混合后,溶液总质量因发作化学反响而减小的是〔〕A.二氧化碳和烧碱溶液B.氯化铜溶液和石灰水C.稀盐酸和硫酸钠溶液D.氧化铁粉末和稀硫酸12.以下各组物质参与水中充沛搅拌后,同组反响物恰恰完全反响,过滤后,在滤纸上留下两种不溶物质的是〔〕A.Ca〔NO3〕2、BaCl2、AgNO3 B.MgCl2、KOH、NaClC.K2CO3、CuSO4、KCl D.CuSO4、B a〔OH〕2、Cu〔N O3〕213.我国化学家侯德榜创立了著名的〝侯氏制碱法〞〔流程简图如图〕,促进了世界制碱技术的开展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6.3 海水“制碱”
41.(海南)由我国化工专家侯德榜探索发明的“侯氏制碱法”,其生产过程涉及的主要化学反应如下:①NH3+C02+X=NH4HC03 ②NH4HC03+NaCI==NH4Cl+NaHC03↓
③2NaHC03Na2C03+H20+C02↑
请回答:
(1)反应①中X的化学式为;
(2) NH4Cl中N元素的化合价为;
(3)除去混在Na2C03粉末中少量的NaHC03的方法是。
41. (1)H2O(2)-3 (3)加热
6.(武汉)下列说法中正确的是()。
A.向某溶液中滴加AgNO3溶液和稀HNO3,产生白色沉淀。
该溶液一定是稀盐酸
B.可用适量的硝酸钡溶液,除去氯化钠溶液中混有的碳酸钠,得到纯净的氯化钠
C.要除去铜粉中混有的少量炭粉,可采用在空气中充分灼烧混合物的方法
D.有盐和水生成的反应不一定是中和反应
13.(泸州)25℃时,将 a g碳酸钠(化学式为Na2CO3)溶解于100g水中恰好形成饱和溶液。
所得溶液的溶质质量分数为×100% ,此温度下碳酸钠的溶解度为 a g 。
向此溶液中滴入足量稀盐酸,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
8.(娄底)下列有关物质的化学式、名称、俗名不完全对应
.....的是
A.NaOH 氢氧化钠烧碱 B.CaO 氢氧化钙生石灰
C.Na2CO3碳酸钠纯碱 D.NaCl 氯化钠食盐26.(宜昌)(13分)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、
碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究。
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应;
⑵一个有沉淀生成的反应。
【挖掘实质】
图26-1
⑴图26-1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解
图26-2
离出的离子是 (填离子符号)。
⑵图26-2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为
H+ + OH-= H2O
我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体...生成的反应的实质。
【实践运用】
⑴通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
和 (填离子符号,下同)也不能大量共存。
⑵利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无
色溶液。
经测定,该溶液显酸性。
则在该溶液中一定含有的离子是。
为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证。
溶液中可能含有的离子设计实验验证(实验步骤、现象及对应的结论)
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶
液中离子的成分时,应考虑的因素是。
26.(13分)
【知识回放】⑴H2SO4+2NaOH=Na2SO4+2H2O
⑵H2SO4+Ba(NO3)2=BaSO4↓+2HNO3或K2CO3+Ba(NO3)2=BaCO3↓+2KNO3
【挖掘实质】Ba2+和NO3-或Ba2+和2NO3-;2H++CO32-=H2O+CO2↑或2H++CO32-=H2CO3,H2CO3=H2O+CO2↑ (若未配平,生成物未标注箭头,不扣分)
【实践运用】Ba2+和SO42-或Ba2+和CO32-或H+和CO32-;H+、Na+、K+和NO3-(必须答全四种得1分)
溶液中可能含有的离子设计实验验证(实验步骤、现象及对应的结论)
可能性一:Ba2+(同时答两种或两种以上离子的不得分,下同。
)取上述溶液少量于试管中,加入少量硫酸钠溶液。
若出
现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+。
可能性二:SO42-取上述溶液少量于试管中,加入少量硝酸钡溶液。
若出
现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-。
可能性三:Ba2+或SO42-取上述溶液少量于试管中,加入少量硫酸钠溶液。
若出
现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-。
(若没有出现白色沉淀,必须验证SO42-)(其他答案合理给分。
)
【知识升华】
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余。
(意义表达准确,都可给分。
)。
