黄酮提取工艺设计思路
黄酮类化合物的提取工艺与分析方法(郭彭靖)

黄酮类化合物的提取工艺与分析方法作者,单位中英文摘要,关键词黄酮类化合物(flavonoids),又称生物类黄酮(bioflavonoids),是指具有色酮环与苯环为基本结构的一类化合物的总称,是多酚类化合物中最大的一个亚类。
其基本骨架具有C6-C3-C6的特点,即由2个芳香环A和B,通过中央三碳链相互连结而成的一系列化合物。
根据间三碳链的氧化程度、B环(苯基)连接位置(2-或3-位)以及三碳链是否呈环状等特点,黄酮类化合物分为许多不同类型,如黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、异黄酮、二氢异黄酮、查尔酮等(叶文峰,2000)。
自然界中最常见的是黄酮和黄酮醇,在银杏叶、山楂、杜仲、山香圆叶、水芹、竹叶、黄芪、丹参等植物中均有检出。
到目前为止,已经发现有5000多种植物中含有黄酮类和异黄酮类化合物(蔡健等,2003)。
天然来源的生物黄酮分子量小,能被人体迅速吸收,通过血脑屏障,进入脂肪组织,具有调节血脂、消除氧自由基、抗氧化、抗肿瘤、抗辐射、抗衰老、抗过敏、抗菌、抗病毒等生理功能(李楠等,2005)。
许多应用研究表明,黄酮类化合物具有预防心血管疾病、防癌抗癌、防止骨质疏松和改善动物生长及降血脂、止血、抑制血小板聚集等多种药理作用。
例如芦丁、槲皮素等能够增强心脏收缩;杜鹃素具有止咳祛痰作用;黄芩苷具有抗菌消炎、抑制肿瘤细胞作用;水飞蓟素具有保肝作用等(肖常厚,1997)。
此外,黄酮类化合物也是重要的功能食品添加剂、天然抗氧化剂、天然色素、天然甜味剂(王晶等,2006)。
黄酮类化合物在人体不能直接合成,只能从食品中获得。
主要是作为食品添加剂或直接应用于食品中增加其保健作用。
例如茶多酚在功能食品中的应用主要是以茶叶及其提取物的形式添加到食品中。
茶多酚具有抗疲劳、抗辐射、抗衰老等功能特性,茶叶具有独特的色、香、味、形,能使食品增香、调味、着色,因此茶多酚以茶叶的形式在食品中的应用十分广泛。
近年来科学家都积极关注从植物体中提取纯度高、活性强的天然黄酮成分,并进一步将其加工成有特异功能的保健食品和药品等产品。
银杏叶黄酮提取工艺

银杏叶黄酮提取工艺银杏叶黄酮是一种重要的天然药物成分,具有多种药理作用,如抗氧化、抗炎、抗肿瘤等。
因此,银杏叶黄酮的提取工艺备受关注。
下面将介绍银杏叶黄酮的提取工艺。
一、银杏叶黄酮的提取方法1. 溶剂提取法溶剂提取法是目前应用最广泛的提取方法。
其基本原理是利用溶剂对银杏叶中的黄酮类化合物进行提取。
常用的溶剂有乙醇、丙酮、甲醇等。
其中,乙醇提取法是最常用的方法之一。
2. 超声波提取法超声波提取法是一种新型的提取方法,其基本原理是利用超声波的机械作用和热效应,促进银杏叶中黄酮类化合物的溶解和扩散。
相比传统的溶剂提取法,超声波提取法具有提取效率高、提取时间短、操作简便等优点。
3. 超临界流体提取法超临界流体提取法是一种新型的绿色提取技术,其基本原理是利用超临界流体对银杏叶中的黄酮类化合物进行提取。
相比传统的溶剂提取法,超临界流体提取法具有提取效率高、提取时间短、操作简便、无毒无害等优点。
二、银杏叶黄酮的提取工艺1. 溶剂提取法工艺(1)原料准备:将新鲜银杏叶洗净,晾干或烘干至水分含量低于10%。
(2)粉碎:将干燥的银杏叶粉碎成粉末。
(3)提取:将银杏叶粉末与乙醇按一定比例混合,浸泡数小时至数十小时,然后进行过滤、浓缩、干燥等步骤,得到银杏叶黄酮提取物。
2. 超声波提取法工艺(1)原料准备:将新鲜银杏叶洗净,晾干或烘干至水分含量低于10%。
(2)粉碎:将干燥的银杏叶粉碎成粉末。
(3)提取:将银杏叶粉末与适量的溶剂(如乙醇)混合,置于超声波提取仪中进行提取,提取时间和温度根据实际情况确定。
3. 超临界流体提取法工艺(1)原料准备:将新鲜银杏叶洗净,晾干或烘干至水分含量低于10%。
(2)粉碎:将干燥的银杏叶粉碎成粉末。
(3)提取:将银杏叶粉末与超临界流体(如二氧化碳)混合,置于超临界流体提取仪中进行提取,提取时间和温度根据实际情况确定。
三、总结银杏叶黄酮是一种重要的天然药物成分,其提取工艺备受关注。
目前,溶剂提取法、超声波提取法和超临界流体提取法是常用的提取方法。
银杏叶提取黄酮及分离纯化

银杏叶提取黄酮及分离纯化组员:李佳辉、黄埔、赵超武一、实验目的1.掌握传统的溶剂提取法并对银杏中的黄酮进行提取2.掌握紫外分光光度计的应用,以及相关溶液的配置3.学会自主设计实验,培养团队合作精神二、实验原理⑴关于黄酮:银杏中最具药用价值的成分,有提高人体免疫力的作用;并且抗衰老、调节内分泌,还具有抗炎、抗真菌的作用;⑵实验需设置空白参比液,由文献资料可知芦丁标准液的最大波长大概为510nm;⑶本实验采用硝酸铝(氯化铝)法测定银杏叶总黄酮的质量浓度,因为黄酮类化合物可以与铝盐发生络合显色反应。
其主要原理为:在中性或弱碱性及亚硝酸钠存在的条件下,黄酮类化合物与铝盐发生螯合反应,加入氢氧化钠溶液后,溶液显橙红色,在510nm(左右)处有吸收峰,且符合定量分析的朗伯—比尔定律(即A=kbc)一般与芦丁标准溶液比较定量。
先用亚硝酸钠还原黄酮类化合物,再加铝盐络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成2-羟基查尔酮而显色。
显色原理发生在黄酮醇类邻位无取代的邻二酚羟基部位,不具有邻位无取代的邻二酚羟基的黄酮类成分加入上述试剂时是不显色的。
(如二氢黄酮类化合物就不发生该显色反应)目前银杏叶黄酮的提取方法主要有:溶剂提取法、超临界流体萃取法(SFE法)、高速逆流色谱技术提取法(HSCCC)微波提取法、超色波提取法、酶提取法、分子烙印技术。
因溶剂提取法操作简单,所需试剂廉价易得,故通常使用此法来进行大规模生产。
其工艺流程如下:银杏叶—→粉碎—→NaOH-60%乙醇回流提取—→离心—→过滤—→滤液收集—→二次醇提—→合并两次滤液—→树脂吸附—→脱吸—→浓缩—→干燥—→提取物由于银杏叶黄酮中的类黄酮主要为芦丁,故用芦丁为对照物绘制标准曲线,并采用分光光度法进行测定。
三.实验材料及器材1.材料酸银杏叶、芦丁、亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、磷酸氢二钠、磷二氢钠、D101大孔吸附树脂、盐酸2.相关溶液的配制和树脂预处理0.20mg/mL芦丁标准溶液(500mL)、5%NaNO2(500mL)、10%AI(NO3)3(500mL)、1mol/LNaOH 、0.4mol/LNaOH(500mL)、0.4mol /L HCl(500mL)、30%乙醇(500mL)30%乙醇(1)D101树脂预处理(500g):商品树脂均残留惰性溶剂,故使用前根据应用需要,必须进行不同深度的预处理,在提取器内,加入高于树脂层10-20厘米的乙醇浸泡3—4小时,然后放净洗涤液,为一次提取过程。
黄酮提取工艺设计思路

黄酮提取工艺设计思路黄酮提取工艺设计思路1、黄酮类化合物含量测定的原理在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与铝盐生成螯合物,加入氢氧化钠溶液后显红橙色。
黄酮类化合物能与金属离子络合产生有色反应,于波长510nm附近有吸收,可用分光光度法进行测定。
实验采用在碱性条件下,亚硝酸盐存在时,硝酸铝与黄酮形成红色络合物,在波长510nm附近有吸收可进行比色分析。
在中性或弱碱性及硝酸钠存在条件下,黄酮类化合物与铝盐生成鳌合物,加入氢氧化钠溶液后显红橙色,硝酸钠还原黄酮,加硝酸铝络合,加氢氧化钠使黄酮类化合物开环,生成2'-OH查耳酮而显色。
利用黄酮类化合物中的3-羟基、4-羟基、5-羟基、4-羰基或邻二位酚羟基,与Al3+进行络合反应,在碱性条件下生成红色络合物的原理测定其含量、测定波长的确定2取样品溶液和标准溶液2mL,加70 %的乙醇至5 mL, 然后加入5 %的NaNO2 溶液1 mL,室温放置6min, 再加入10 %的Al(NO3)3 1mL, 混匀, 室温放置6 min, 加入4%的NaOH10mL, 用水稀释至25 mL,混匀, 放置15 min, 在分光光度计上扫描波长从400 nm~600 nm之间的吸收度, 结果在510nm 波长处有最大吸收值。
配合物在Kmax= 354nm 及Kmax= 510nm有两个吸收峰, 经实验后得出Kmax= 112354nm波长处得到的工作曲线线性关系及精密度数据均不佳, 故本实验选取Kmax= 510 2nm为测定波长。
3、标准溶液的配制精确称取105℃干燥恒重芦丁对照品50mg, 加乙醇适量, 使之充分溶解, 用乙醇定容到100mL, 摇匀, 制得芦丁溶液。
精确量取芦丁溶液20mL, 置于50mL容量瓶中, 用水稀释至刻度, 摇匀, 即得对照品溶液。
每1mL溶液含芦丁对照品0.2mg。
或精密称取干燥至恒重的芦丁标准品10mg, 置50mL容量瓶中, 加无水乙醇20mL, 轻摇使充分溶解,定容, 摇匀, 得0. 2mg /mL芦丁标准液。
山楂中黄酮的提取研究技术PPT文档18页

4 讨论 在用浸渍法提取山楂中黄酮的研究里面,采用单因素
实验的方法,对比了提取时间、提取溶剂浓度、提取温度 这3个因素对黄酮提取的影响。得出最佳的浸渍提取条件 为4h、70%乙醇和40℃提取温度,黄酮含量为33.5mg/g。 在使用浸渍法时,随着提取乙醇的浓度的加大,提取的黄 酮含量下降,它的影响在于不同含量的乙醇极性的不同, 极性过大或过小会导致提取出的杂物较多,从而会影响黄 酮的溶出,70%的乙醇浓度对山楂中黄酮的溶解度最好。 随着提取时间的增加山楂中黄酮的提取量也随着增加,一 定时间后渐渐趋于稳定,这个时间出现在4h的时候,温度 升高,分子运动加快,黄酮提取率也随着增大。浸渍法需 要的时间较长。黄酮提取效率较低,而且加温会增加成本, 乙醇的回收也是一个大问题,因此并不适宜与工业生产。
山楂中黄酮的提取研究技 术
山楂中黄酮的提取研究技术
专业班级:生工08级2班 指导教师:张名爱
2.索氏提取法
根据浸渍法得出最佳乙醇提取浓度的水平, 对样品在提取温度(70℃、80℃、90℃),提取时间 (1.5h、3.Oh、6.Oh),乙醇浓度(60%、70%、 80%)进行提取比较。
3.超声波提取法
(3)时间极差 水平2比水平1的增加十分明显,然而水平3 只比水平2有一点的增加。提取时间一增长,黄酮提取量就慢 慢开始恒定。
这说明了各个实验因素与因素水平对山楂中黄酮提取量的 影响有一定的差异,由分析结果可以得出:因素B>A>C(注:A 、提取温度 B、提取时间 C、乙醇浓度)。
3.3 超声波提取法对山楂中黄酮提取的影响
根据浸渍法和索氏提取法的结果选择最佳浓度, 在超声时间(15min、30min、45min)、提取温度 (70℃、80℃、90℃)、乙醇浓度(60%、70%、 80%),条件下进行寻求最佳超声波提取的方法。
34532黄酮类化合物的分离

O
OCH3
>
OH O
OH O
橙皮查耳酮
橙皮素
OH OCH3
黄酮类化合物的提取分离
4)不同类型的黄酮类化合物,先后出柱顺序: 异黄酮>二氢黄酮醇>黄酮>黄酮醇
5)各种溶剂在聚酰胺柱上的洗脱能力由弱至强的顺序: 水<甲醇或乙醇<丙酮<稀氢氧化钠水溶液<甲酰胺<二甲基甲酰胺
聚酰胺色谱法总结
吸附规律:与酚羟基的数目、位置及溶剂介质有关。 与溶剂介质的关系: 吸附力:水﹥甲醇乙醇(浓度由低到高)﹥碱性溶剂 洗脱规律: 与吸附规律正好相反,即吸附力越强,越难洗脱
例:
HO
O
OH
HO
OH O
OH
OH OH O
OH OH O
山柰酚
桑色素
黄酮类化合物的提取分离
2)当分子中羟基数目相同时,吸附力与形成氢键的位置有关。 例:
HO
O
HO
O
OH O
A
OHOΒιβλιοθήκη OHBO H
O CH3
黄酮类化合物的提取分离
3)分子内芳香化程度越高,共轭双键越多,则吸附越强。
例:
OH
HO
OH
HO
1 pH梯度萃取法
总游离黄酮的乙醚液
依次以5%NaHCO3 、5%NaCO3、 0.2%NaOH、4%NaOH
5%NaHCO3 酸化
7,4`-二OH
5%NaCO3 酸化
7-或4`-OH
0.2%NaOH 酸化
一般酚OH
4%NaOH 酸化
5-OH
2 聚酰胺柱色谱(分离黄酮最理想的吸附剂)
分离原理:氢键吸附
黄酮类化合物的提取分离
二、 黄酮类化合物的分离
木蝴蝶总黄酮的提取纯化方法及其应用与设计方案
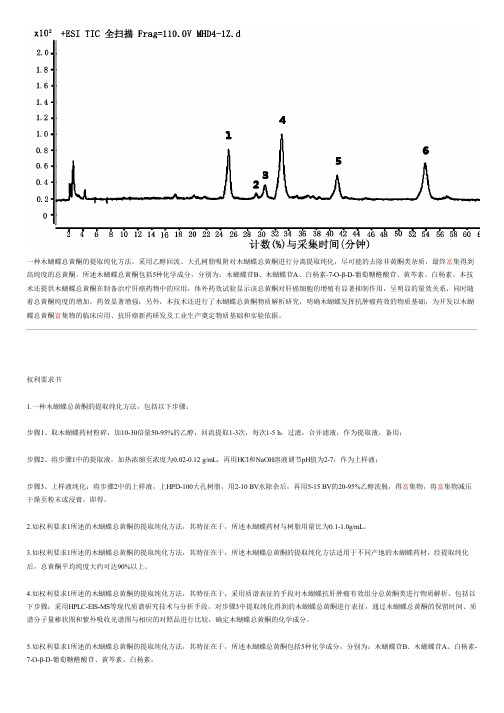
一种木蝴蝶总黄酮的提取纯化方法,采用乙醇回流、大孔树脂吸附对木蝴蝶总黄酮进行分离提取纯化,尽可能的去除非黄酮类杂质,最终富集得到高纯度的总黄酮。
所述木蝴蝶总黄酮包括5种化学成分,分别为:木蝴蝶苷B、木蝴蝶苷A、白杨素-7-O-β-D-葡萄糖醛酸苷、黄芩素、白杨素。
本技术还提供木蝴蝶总黄酮在制备治疗肝癌药物中的应用,体外药效试验显示该总黄酮对肝癌细胞的增殖有显著抑制作用,呈明显的量效关系,同时随着总黄酮纯度的增加,药效显著增强;另外,本技术还进行了木蝴蝶总黄酮物质解析研究,明确木蝴蝶发挥抗肿瘤药效的物质基础,为开发以木蝴蝶总黄酮富集物的临床应用、抗肝癌新药研发及工业生产奠定物质基础和实验依据。
权利要求书1.一种木蝴蝶总黄酮的提取纯化方法,包括以下步骤:步骤1、取木蝴蝶药材粉碎,加10-30倍量50-95%的乙醇,回流提取1-3次,每次1-5 h,过滤,合并滤液,作为提取液,备用;步骤2、将步骤1中的提取液,加热浓缩至浓度为0.02-0.12 g/mL,再用HCl和NaOH溶液调节pH值为2-7,作为上样液;步骤3、上样液纯化:将步骤2中的上样液,上HPD-100大孔树脂,用2-10 BV水除杂后,再用5-15 BV的20-95%乙醇洗脱,得富集物,将富集物减压干燥至粉末或浸膏,即得。
2.如权利要求1所述的木蝴蝶总黄酮的提取纯化方法,其特征在于,所述木蝴蝶药材与树脂用量比为0.1-1.0g/mL。
3.如权利要求1所述的木蝴蝶总黄酮的提取纯化方法,其特征在于,所述木蝴蝶总黄酮的提取纯化方法适用于不同产地的木蝴蝶药材,经提取纯化后,总黄酮平均纯度大约可达90%以上。
4.如权利要求1所述的木蝴蝶总黄酮的提取纯化方法,其特征在于,采用质谱表征的手段对木蝴蝶抗肝肿瘤有效组分总黄酮类进行物质解析,包括以下步骤:采用HPLC-EIS-MS等现代质谱研究技术与分析手段,对步骤3中提取纯化得到的木蝴蝶总黄酮进行表征,通过木蝴蝶总黄酮的保留时间、质谱分子量棒状图和紫外吸收光谱图与相应的对照品进行比较,确定木蝴蝶总黄酮的化学成分。
黄酮提取工艺.总结

黄酮提取⼯艺.总结黄酮提取⼯艺2-1 微波辅助提取⾦银花总黄酮⼯艺流程图3.实验⽅法3.1 标准曲线的制备3.1.1最⼤吸收波长的选择⽅法以亚硝酸钠、硝酸铝和氢氧化钠为显⾊剂,分别作各样品提取液以及芦丁标准品的吸收曲线,在510nm处均有1个强吸收峰,因此选择510nm为测定波长。
3.1.2对照品溶液的制备⽅法精密称取芦丁对照品10.2mg置50mL容量瓶中,加适量甲醇溶解,并稀释⾄刻度,摇匀备⽤。
3.1.3 标准曲线的制备精密量取对照品溶液0,1,2,3,4,5mL,分别置10mL容量瓶中,加⼊5%亚硝酸钠溶液0.3mL,振荡摇匀,放置6min;再加⼊10%硝酸铝0.3mL,振荡摇匀,放置6min;最后加⼊4%氢氧化钠试液4mL,加甲醇定容⾄刻度,摇匀,放置15min。
采⽤分光光度法,在510nm处测定吸光度,以对照品量(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
3.2 微波提取单因素实验⽅法分别考察不同的微波辐射功率,辐射时间,⼄醇浓度,固液⽐对提取效果的影响3.3 提取⼯艺正交试验设计⽅法系统考察微波提取法的⼯艺参数,根据已有的资料及实际情况,选⽤微波辐射功率(A),辐射时间(B),⼄醇浓度(C),固液⽐(D)作为考察因素,以测得的浸提取样品中总黄酮含量为考察指标,选⽤L9(34)正交表设计,得到供试液。
3.4微波辅助提取法与⼄醇回流法⽐较⽐较两种提取⽅法的处理时间和液固⽐对总黄酮提取量的影响。
传统⼄醇回流法提取总黄酮的所需时间⽐微波辅助提取法提取长得多,且⾦银花总黄酮提取量⽐较低;⽽微波辅助提取的总黄酮较⼄醇回流法⾼。
⽐较此两种⽅法在最佳条件下的总黄酮含量。
3.5总黄酮含量测定⽅法取0.5mL液,加⼊5%亚硝酸溶液0.3mL荡摇匀,放置6min加⼊10%硝酸铝0.3mL荡摇匀,放置6min⼊4%氢氧化钠试液4mL,30%(V/V)⼄醇定容⾄刻度,摇匀,放置15min分光光度法,在510nm定吸光度值由标准曲线计算得总黄酮含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黄酮提取工艺设计思路1、黄酮类化合物含量测定的原理在中性或弱碱性及亚硝酸钠存在条件下,黄酮类化合物与铝盐生成螯合物,加入氢氧化钠溶液后显红橙色。
黄酮类化合物能与金属离子络合产生有色反应,于波长510nm附近有吸收,可用分光光度法进行测定。
实验采用在碱性条件下,亚硝酸盐存在时,硝酸铝与黄酮形成红色络合物,在波长510nm附近有吸收可进行比色分析。
在中性或弱碱性及硝酸钠存在条件下,黄酮类化合物与铝盐生成鳌合物,加入氢氧化钠溶液后显红橙色,硝酸钠还原黄酮,加硝酸铝络合,加氢氧化钠使黄酮类化合物开环,生成2’-OH查耳酮而显色。
利用黄酮类化合物中的3-羟基、4-羟基、5-羟基、4-羰基或邻二位酚羟基,与Al3+进行络合反应,在碱性条件下生成红色络合物的原理测定其含量2、测定波长的确定取样品溶液和标准溶液2mL,加70 %的乙醇至5 mL, 然后加入5 %的NaNO2 溶液1 mL, 室温放置6min, 再加入10 %的Al(NO3)3 1mL, 混匀, 室温放置6 min, 加入4%的NaOH10mL, 用水稀释至25 mL,混匀, 放置15 min, 在分光光度计上扫描波长从400 nm~600 nm 之间的吸收度, 结果在510nm 波长处有最大吸收值。
配合物在Kmax1= 354nm 及Kmax2= 510nm有两个吸收峰, 经实验后得出Kmax1=354nm波长处得到的工作曲线线性关系及精密度数据均不佳, 故本实验选取Kmax2= 510 nm为测定波长。
3、标准溶液的配制精确称取105℃干燥恒重芦丁对照品50mg, 加乙醇适量, 使之充分溶解, 用乙醇定容到100mL, 摇匀, 制得芦丁溶液。
精确量取芦丁溶液20mL, 置于50mL容量瓶中, 用水稀释至刻度, 摇匀, 即得对照品溶液。
每1mL溶液含芦丁对照品0.2mg。
或精密称取干燥至恒重的芦丁标准品10mg, 置50mL容量瓶中, 加无水乙醇20mL, 轻摇使充分溶解,定容, 摇匀, 得0. 2mg /mL芦丁标准液。
精确称取芦丁标准品5mg,用70%乙醇溶解,于50 mL容量瓶中定容,即得每1mL溶液含芦丁对照品0.1mg芦丁标准品溶液。
称取约20mg芦丁标准品于称量瓶中置105℃烘箱下烘干至恒重,干燥器中冷却,精确称取10 mg芦丁标准品,用70%乙醇定容至100 ml为标准液。
4、样品溶液的测定方法4.1、标准曲线的绘制精确量取对照品溶液0.0、1.0、2.0、3.0、4.0、5.0、6.0mL, 分别置于25mL容量瓶中。
分别加水至6mL, 加5%亚硝酸钠溶液1.0mL, 混匀, 放置6min; 加10%硝酸铝溶液1.0mL, 摇匀, 放置6min; 加1% 氢氧化钠溶液10.0mL, 再加水至刻度, 摇匀, 放置15min。
用分光光度法在510nm波长处分别测定其吸光度。
以吸光度为纵坐标, 浓度为横坐标, 用最小二乘法对直线进行回归计算,令回归方程为:y=ax+b,绘制标准曲线, 得回归线方程: Y = 11. 321 43X + 0. 00343( r= 0.9998), 在8~40μg/mL的范围内,浓度与吸收度有良好的线性关系。
分别取0. 0、1. 0、2. 0、3. 0、4. 0、5. 0 mL的0. 1mg/mL芦丁标准溶液于6支比色管中,分别加入0. 3 mL 5%亚硝酸钠,放置6 min,加0. 3 mL 10%硝酸铝后放置6 min,,再加1. 0mol/L NaOH 4.0mL,加70%乙醇定容至10 mL,摇匀,放置12min得测定液。
以空白溶液作参比,在λ= 510nm处测吸光度,计算标准液浓度(C)与吸光度(D)的回归方程D = bC + k。
精确吸取芦丁标准液0、1. 0、2. 0、3. 0、4. 0、5. 0 ml分别置于6支具塞试管中,各补70%乙醇至5. 0ml,加5%亚硝酸钠溶液0. 3 ml,,摇匀,放置6 min后,加10%硝酸铝溶液0. 3ml,摇匀,放置6 min后,再加4%氢氧化钠溶液4. 0ml,加水0. 4ml,摇匀,放置15 min后,在510 nm处测吸光度-浓度值,所得吸光度-浓度曲线见图,回归方程如下: A =12. 721 0C - 0. 02903,相关系数r = 0. 9998。
4.2、样品处理取采回的新鲜芦蒿叶,洗净,参考相关文献,在105℃烘至约八成干,剪成约1 cm长度,用粉碎机粉碎,再在105℃烘至恒重。
采用Soxhlet提取法,以无水乙醚为脱脂剂,于43℃水浴中脱脂至充分除去样品中脂类和脂溶性色素。
取出样品滤纸包,先置通风处晾干,再将滤纸包置烘箱中130 ℃烘干,放入干燥器中冷却备用。
4.3、样品处理方法湿热法:将鲜叶置于高压反应釜加压蒸30min,另取鲜叶常压蒸30min。
将阴干叶置于高压反应釜加压蒸15min,另取阴干叶常压蒸15min。
氧化法:(1)H2O2法:将鲜叶、阴干叶分别用用2倍量H2O2浸泡10min(H2O2浓度1%、温度50℃)、10min(2%、40℃)、30min(0.5%、30℃)、30min(2%、50℃)、60min(0.5%、40℃)、60min(1%、30℃)。
(2)KMnO4法:将鲜叶、阴干叶分别用用2倍量KMnO4浸泡10min(KMnO4浓度1%、温度50℃)、10min(2%、40℃)、30min(0.5%、30℃)、30min(2%、50℃)、60min(0.5%、40℃)、60min(1%、30℃)。
4.3、样品溶液的测定4.3.1、分光光度法精确量取样品溶液5. 0 mL, 置于25 mL容量瓶中, 按照2.1中方法进行操作, 在510nm 波长处测定吸光度A1; 再精确量取样品溶液5.0mL, 置于25mL容量瓶中, 加水至刻度, 摇匀, 在510nm 波长处测定吸光度A2。
取2次吸光度的差值, 由回归线方程计算样品中黄酮类化合物的提取率。
4.3.2、HPLC 法取上述样品总黄酮提取液浓缩物,用甲醇溶解,进样前用0.45 μm 滤膜过滤。
高效液相色谱仪:LC- 9A(日本SHMADZU) ;色谱柱:Dima Technologies(C18 迪马公司),规格:250 mm×4.6 mm;柱温为室温;流速1 mL/min;检测器:SPD-10A;检测波长254 nm;进样量20 μL;流动相:80%甲醇。
在进柱之前,流动相要经过0.45μm 的有机膜过滤,并超声脱气30 min。
5、溶剂选择分别称取样品1g,以提取温度90℃,提取时间2 h ,分别利用甲醇、乙醇、丙酮、乙酸乙酯、氯仿、石油醚为溶剂,料液比1:50(g/mL)为提取条件进行常压回流提取,以此结果进行比较。
6、线性范围、回归方程和检出限总黄酮的线性范围在1.0~40μg/ml 之间,所得回归方程为y=0.0033x-0.0109,相关系数为0.9995,检出限为1.0μg/ml。
7、显色剂稳定性实验精确量取标准溶液和样品提取液1.0mL, 同标准曲线和样品测定的操作,分别于配制后每隔5min测定其吸光度考察反应体系的稳定性。
结果显示其RSD值为0. 5097% , 说明样品溶液在1h内稳定。
8、加标回收率实验取已测得黄酮类化合物提取率的样品溶液2.0mL, 加入0.2mg/mL的芦丁对照液1. 0mL, 按实验方法测定, 计算回收率。
加样回收率为99. 12%, RSD 值为2. 135%。
表明, 该方法对黄花菜中黄酮类化合物提取率测量的准确度较高。
回收率= (混合后测得的总黄酮含量-样品中总黄酮含量)/芦丁标准品加入量×100%。
分别取0.2g含总黄酮的样品于两支15ml具塞比色管中,各加入4ml乙醇,其中1管加入0.100mg芦丁标准品作为加标测定管,另1管作为本底管,再按最佳试验条件进行样品处理,用标准曲线法进行计算,重复试验3次,计算回收率。
由表8可知,该方法的回收率为95%~104%,证明该方法的准确度较好。
取5个10mL比色管,在已知黄酮含量的蓖麻叶和蓖麻花提取液中分别加入0.2mg/mL芦丁对照品溶液1.00mL、2.00mL、3.00mL、4.00mL、5.00mL样液,分别测定黄酮含量,根据所得的总黄酮含量减去加入的标量,再除以样品所含的总黄酮量即可计算出回收率。
回收率%= 样品加标准样测得总黄酮含量−样品中总黄酮含量/加入标准液总芦丁的含量×100%9、精密度实验取5份同一样品溶液各5.0mL, 置于25mL容量瓶中, 按实验方法测定,计算其平均含量和相对标准偏差。
其RSD 值平均为0.162%, 测定结果的相对标准偏差很小, 说明仪器的精密度较高, 实验数据可靠。
在正交试验得出的最佳条件下,样品用超声波提取后测定总黄酮提取量,重复试验5 次,计算保健食品总黄酮提取量为(5.370±0.092)mg,RSD 为1.717%,证明该方法的精密度较好。
按微波提取法同时制备5份试样液,按标准曲线方法对试样液中总黄酮含量进行平行测定。
精密称取车前草供试品3份,每份测试3次,结果见表2,相对标准偏差为3. 20 %(m =3)。
精密移取芦丁标准液1mL,共5 份,分别置于10mL试管中,按1.3.3.2 节操作,计算吸光度的相对标准偏差(RSD)。
10、重现性试验。
取同一批大白口蘑样品6份,在最佳条件下进行萃取,分别测定各自的总黄酮含量,结果表明,其相对标准偏差为1.24%。
在同一实验室、不同时间对样品叶中总黄酮含量进行5次重复测定。
11、金属离子的干扰实验银杏叶提取物作为生物活性物质, 许多金属离子对它的测定都有一定影响。
本实验选取常见的Zn2+ 、Fe3+ 进行实验。
实验表明Zn2+ 对反应无影响, 加入1 mL 100Lgöm L Fe3+ 溶液, 扫描发现在波长510 nm 无吸收峰, 由此可知Fe3+ 对实验测定影响很大。
本实验选择EDTA做掩蔽剂。
12、黄酮类化合物的定性检测12.1、三氯化铝反应取8支试管,分别加入少许经上述各提取方法所得的样品,用95%乙醇完全溶解,每只试管中再加1%三氯化铝乙醇溶液1~2 mL,观察颜色变化情况。
在三氯化铝反应中,原来的黄色加深,并有黄色或黄绿色荧光,原因是与铝离子产生了螯合物而呈现出鲜黄色。
滤纸上无明显颜色变化,紫外灯下显鲜黄色荧光,可能不含4’-羟基黄酮醇和7,4’-二羟基黄酮醇等黄酮类化合物。
黄色或黄绿色:有黄酮类化合物。
12.2、盐酸-镁粉还原反应将经上述各提取方法所得的样品分别溶于盛有95%乙醇的试管中,待完全溶解后加少许镁粉,再加数滴浓盐酸,观察颜色变化情况。
在盐酸- 镁粉还原反应中,溶液呈现出橙黄色或紫红色,这是由于黄酮类化合物被还原生成花色苷元及其二聚物。
