ADA缺乏症的基因治疗
分子医学综述

加样孔
电 泳 条 带
DNA分子的电泳检测
凝胶浓度与DNA片段大小 电压、电流与分辨率
电泳缓冲液、上样缓冲液
电泳的时间与环境温度 凝胶板的制备
法国VL凝胶成像系统
共轭双键:对260nm波长紫外光有较强吸收。
消 光 系 数
220 240 260 280 300 波长
核酸定量和纯度分析
BECKMAN DU 800 核酸蛋白检测仪
1973年,美国斯坦福大学教授S· 科恩和加州大学旧金山分校教授 H· 博耶将两个不同的质粒(一个是抗四环素质粒,另一个是抗链 W· 霉素质粒)拼接在一起,组成嵌合质粒,并将其导入大肠杆菌,当 该重组质粒进入大肠杆菌体内后,这些大肠杆菌能抵抗两种药物, 而且这种大肠杆菌的后代都具有双重抗药性。这表明“杂合质粒” 在大肠杆菌的细胞分裂时也能自我复制。
DNA鉴定技术是英国遗传学家A· 杰弗里斯(1950-)在1984 J· 年发明的。由于人体各部位的细胞都有相同的DNA,因此可以通 过检查血迹、毛发、唾液等判明身分。
DNA指纹
只要罪犯在案发现场留下任何 与身体有关的东西,例如血迹和毛 发,警方就可以根据这些蛛丝马迹 将其擒获,准确率非常高。DNA鉴定 技术在破获强奸和暴力犯罪时特别 有效,因为在此类案件中,罪犯很 容易留下包含DNA信息的罪证。 根据DNA指纹破案虽然准确率高, 但也有出错的可能,因为两个人的 DNA指纹在测试的区域内有完全吻合 的可能。因此在2000年英国将DNA指 纹测试扩展到10个区域,使偶然吻 合的危险几率降到十亿分之一。
分子医学常用技术
基因获取
基因标记
基因检测
基因探测
基因重组
具体的研究目的和实验条件选用 合适的方法。
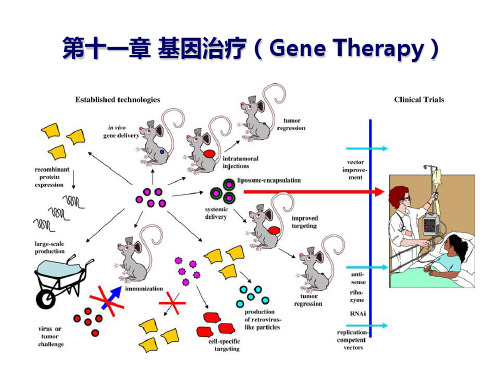
基因治疗

• 反义核酸药物 • 反义技术(antisense technology)是采用反 义核酸分子抑制、封闭或破坏靶基因的技术。 根据碱基互补原理结合并调节靶基因活性的核 酸分子称为反义核酸,其种类有反义脱氧核糖 寡核苷酸(oligodeoxynucleotide,ODN)、反义 RNA、核酶和三链形成寡核苷酸(triplexforming oligonucleotides,TFO)等。反义核 酸在抑制一些有害基因的表达和失控基因的过 度表达上发挥着重要作用,可用于肿瘤、病毒 感染性疾病、高血压等的治疗。
• (二) 基因调控治疗 • 1.药物调控 用药物使被抑制的基因重新表 达或抑制某些过度表达基因的表达。 • 2.反义核酸技术 利用反义核酸 (antisense nucleic acid) 在复制、转录、 转录后加工及翻译水平上抑制目的基因的表 达。 • 3.核酶技术 利用核酶(ribozyme)的催化 活性将mRNA特异地剪切,从而不能承担翻译 模板作用。
• 生长激素 • 生长激素( growth factor,GH)是垂体前叶合 成与分泌的一种蛋白质激素,其分泌受下丘脑 的生长激素释放激素及生长抑素的调节。。 • 重组人生长激素(recombinant human growth factor,rhGH)主要用于内源性生长激素缺乏 的儿童以及治疗烧伤、创伤、肌肉萎缩症等疾 病。
• 一、 基因治疗的类型 • (一) 基因矫正治疗 • 1.基因修正(gene correction) :此种方 法较困难,尚无体内成功的报道。 • 2.基因置换(gene replacement): 这是 最理想的基因治疗方法。但目前同源重组频 率太低而无法用于临床。 • 3.基因增补(gene augmentation) : 基 因增补较易实现,是目前基因治疗最常用的 方法。
ADA缺乏症的基因治疗

ADA缺乏症的基因治疗ADA缺乏症是SCID的主要病种,约占25%。
ADA缺乏症是人类基因治疗研究得较为成熟的一种常染色体隐性遗传性疾病。
由于ADA基因的克隆化早已完成,对其表达的调控认识得也比较清楚,ADA编码基因属于持家基因的范畴,因此人类历史上第一种以基因治疗的疾病就是:ADA缺乏症。
一、ADA缺乏症发病机制ADA有数种同功酶,在电泳上有二个带,分子量各带相异。
ADA广泛存在于各种组织与细胞中,在细胞中有三种同功酶,在组织中有四种同功酶。
除红细胞外,ADA在脾脏、皋丸、甲状腺、肺脏、肾脏次之;在心脏、肝脏、胃粘膜和肌肉中也存在。
其中以脾脏中的酶活性最高。
ADA在核酸代谢中具有重要作用。
它可催化腺苷变为次黄嘌呤核苷,后者再在嘌呤核苷磷酸化酶的作用下变为次黄嘌呤,又在黄嘌呤氧化酶作用下经黄嘌呤变为核酸代谢的最终产物一尿酸。
脾脏是重要的免疫器官,在人体免疫系统的发育中占有极为重要的地位。
当ADA缺乏时,细胞内腺苷及嘌呤核苷酸的水平增高,使乳清酸向乳清酸苷的转变被封闭,以致影响B淋巴细胞及免疫系统的发育,引起严重的体液、细胞免疫联合缺陷。
除此之外,ADA缺乏引起免疫缺陷的另一种可能的机制是存在一种抑制免疫的血清因子。
ADA基因异常时常可累及多种细胞,如红细胞等,但T、B淋巴细胞对腺苷及嘌呤核苷酸的敏感性远较其它种类的细胞敏感,因此这些核苷酸代谢产物的累积,对淋巴细胞的毒性和危害最大,因此导致T、B淋巴细胞的成熟过程及功能障碍,造成SCID的免疫病理状态。
二、ADA基因异常1983年人ADA的cDNA克隆化三家同时成功。
编码区有1089个核昔酸组成,编码的ADA 由363个氨基酸残基组成。
ADA基因组DNA的全长为3204个碱基对,由23个内含子和12个外显子序列组成。
ADA缺乏症是一种常染色体隐性遗传疾病,其基因的异常又分为纯合子型和杂合子型两种。
根据对多地区、多个ADA缺乏症ADA基因的序列的测定以及与正常人ADA序列的比较结果,目前认为ADA基因序列点突变至少发生在8个位点上。
遗传学--基因治疗
肿瘤基因治疗的靶点筛选
ERK1/2在肿瘤发生过程的作用
• ERK1/2及其通路成员在多数肿瘤中过表达或突变。 • ERK1/2参与细胞周期调控。 • ERK1/2参与细胞外基质MMP-9 的表达调控。 • ERK1/2参与肿瘤化疗耐药的作用。
RNAi是实现定点打击的理想方法
Andrew Z. Fire (Stanford University photo)
• Advantages
– Price – Shorter turn-around time
• Disadvantages
– More hands-on – Scalability – Purity – Lower specificity – If long transcripted RNA, cocktail SiRNA used
Chemically synthesized SiRNA
• Advantages
– No hands-on time – Purity of siRNA:>97% by PAGE or HPLC – Synthesis can be scaled up – Can be labeled – Potential therapeutic use
C. elegans
Antisense RNA dsRNA Mex-3 mRNA detection in embryos
by in situ hybridization
Nature 1998 391:806-811
Mechanism of RNAi
spreading
dsRNA
~22nt siRNAs
ATP ADP + ppi
DICER KINASE RdRP
遗传性疾病的基因治疗

遗传性疾病的基因治疗在医学领域,遗传性疾病一直是人类健康的重大挑战之一。
这些疾病由基因突变引起,往往会给患者及其家庭带来沉重的负担。
然而,随着基因治疗技术的不断发展,为遗传性疾病的治疗带来了新的希望。
什么是遗传性疾病呢?简单来说,就是由于生殖细胞或受精卵中的遗传物质发生改变而引起的疾病。
这些遗传物质的改变可以是单个基因突变,也可以是染色体异常。
常见的遗传性疾病包括血友病、囊性纤维化、镰状细胞贫血、苯丙酮尿症等等。
传统的治疗方法对于遗传性疾病往往只能缓解症状,无法从根本上解决问题。
比如,对于血友病患者,需要定期输注凝血因子来防止出血;对于囊性纤维化患者,需要进行物理治疗和药物治疗来缓解呼吸道症状。
但是,这些方法并不能修复患者体内受损的基因,疾病的根源依然存在。
基因治疗则是一种全新的治疗策略,旨在通过修复或替换患者体内有缺陷的基因,从而达到治疗疾病的目的。
其基本原理是将正常的基因导入患者的细胞中,使其能够产生正常的蛋白质,恢复细胞的功能。
基因治疗的方法主要有两种:一种是体外基因治疗,另一种是体内基因治疗。
体外基因治疗首先从患者体内取出一些细胞,比如造血干细胞,在体外将正常的基因导入这些细胞,然后再将经过基因修饰的细胞输回患者体内。
这种方法的优点是可以对细胞进行精确的基因修饰,但是操作比较复杂,而且存在细胞培养和移植过程中的风险。
体内基因治疗则是直接将携带正常基因的载体注入患者体内,让基因在体内的细胞中表达。
这种方法相对简单,但是基因导入的效率和靶向性可能不如体外基因治疗。
基因治疗的载体也有多种选择,常见的包括病毒载体和非病毒载体。
病毒载体如腺相关病毒、逆转录病毒等,具有较高的基因转导效率,但是可能会引起免疫反应和潜在的致癌风险。
非病毒载体如脂质体、纳米颗粒等,安全性相对较高,但是基因转导效率较低。
在基因治疗的过程中,还需要克服许多技术难题。
比如,如何将基因准确地导入到目标细胞中,如何保证基因的稳定表达,如何避免免疫反应和不良反应等等。
小儿腺苷脱氨酶缺乏的科普知识PPT

结论
结论
小儿腺苷脱氨酶缺乏是一种罕见的遗传 性疾病,临床表现复杂,治疗需要多学 科协作。通过科普知识,可以提高公众 对该疾病的认识和理解,促进患者的早 期诊断和及时治疗。
谢谢您的观赏聆听
小儿腺苷脱氨 酶缺乏的科普
知识PPT
目录 引言 病因与发病机制 临床症状和诊断 治疗和康复 预后与家族遗传咨询 结论
引言
引言
小儿腺苷脱氨酶缺乏简介:腺苷脱 氨酶(ADA)是一种重要的酶,负 责分解腺苷。小儿腺苷脱氨酶缺乏 是一种罕见的遗传性疾病。
病因与发病机 制
病因与发病机制
遗传模式:小儿腺苷脱氨酶缺乏通常是 由ADA基因突变引起的,遗传方式可以 是常染色体隐性遗传或X连锁遗传。 ADA缺乏的影响:ADA缺乏会导致腺苷在 体内积累,进而影响免疫系统的发育和 功能,引起一系列严重的症状。
免疫支持:对于患者来说,免疫支 持也是非常重要的,包括进行免疫 细胞移植等治疗手段。
治疗和康复
康复护理:小儿腺苷脱氨酶缺乏患者需 要长期康复护理,包括合理的饮食、健 康的生活方式等。
预后与家族遗 传咨询
预后与家族遗传咨询
预后:小儿腺苷脱氨酶缺乏的 预后与治疗的及时性和有效性 有关,及早诊断和治疗可以改 善预后。
临床症状和诊 断
临床症状和诊断
免疫系统异常:小儿腺苷脱氨 酶缺乏会导致免疫系统功能低 下,易患各种感染病。 神经系统受损:部分患者还可 能出现神经系统相关的症状, 如智力退化、运动障碍等。
临床症状和诊断
诊断方法:临床表现结合ADA酶活性检 测和基因检测可以疗:基因治疗是目前小儿腺 苷脱氨酶缺乏的主要治疗方法,可 以通过修复ADA基因来恢复酶活性 。
基因治疗成功的案例

基因治疗成功的案例
以下是一些基因治疗成功的案例示例:
1. ADA-SCID疗法:1999年,一名被诊断出患有严重联合免
疫缺陷症(ADA-SCID)的孩子接受了第一次成功的基因治疗。
这种治疗方法通过植入正常的ADA基因来恢复免疫系统功能,患者成功恢复了免疫系统的功能。
2. 脊髓性肌萎缩症(SMA)疗法:在2019年,一种名为Zolgensma的基因治疗药物获得批准,用于治疗脊髓性肌萎缩
症(SMA)。
这种疗法通过向患者体内注入正常的SMN1基
因来恢复脊髓肌肉神经元的功能。
该疗法被认为是迄今为止最昂贵的药物,但已经在救助许多儿童的生命中取得成功。
3. 猩红热基因治疗:2000年,一名5岁的女孩接受了基因治
疗来治疗严重的遗传性猩红热。
医生使用了一种名为"Targeted Endogenous Mutagensis"(TEM)的方法,使女孩体内的患病
基因发生突变,因此无法继续引发猩红热。
这种治疗被证明是成功的,女孩的症状得到了明显的改善。
这些案例提供了基因治疗在不同疾病中取得成功的证据。
然而,需要强调的是,基因治疗仍然是一个相对新的领域,仍有许多待解决的技术和伦理问题。
因此,更多的研究和临床试验仍然需要进行。
小儿腺苷脱氨酶缺乏护理

演讲人:
目录
Байду номын сангаас
1. 什么是小儿腺苷脱氨酶缺乏症? 2. 为什么需要特别护理? 3. 如何进行日常护理? 4. 治疗方案与支持 5. 护理人员的角色
什么是小儿腺苷脱氨酶缺乏症 ?
什么是小儿腺苷脱氨酶缺乏症?
定义
小儿腺苷脱氨酶缺乏症(ADA缺乏症)是一种遗 传性免疫缺陷病,导致体内腺苷脱氨酶酶活性不 足,影响免疫系统功能。
使用抗菌洗手液和消毒用品是有效的预防措施。
如何进行日常护理? 监测症状
观察患儿的健康状况,及时发现异常症状并就医 。
如高热、持续咳嗽等症状需立即咨询医生。
治疗方案与支持
治疗方案与支持 酶替代疗法
对部分患儿,酶替代疗法可以改善症状和生 活质量。
应在专业医师的指导下进行治疗。
治疗方案与支持 基因治疗
该病主要影响婴幼儿,可能导致严重的感染和早 期死亡。
什么是小儿腺苷脱氨酶缺乏症? 病因
该病是由ADA基因突变引起的,遗传模式为常隐 性遗传。
父母双方携带突变基因的风险会使孩子患病。
什么是小儿腺苷脱氨酶缺乏症? 临床表现
患儿常表现为反复感染、免疫缺陷、发育迟缓等 症状。
早期诊断和干预对改善预后至关重要。
长期疾病可能影响患儿及家庭的心理健康, 需要心理辅导和支持。
家长应关注儿童的情绪变化,必要时寻求专 业帮助。
如何进行日常护理?
如何进行日常护理? 定期体检
定期带患儿进行医学检查,监测免疫状态和健康 状况。
医生会根据病情调整护理方案和治疗措施。
如何进行日常护理? 维持清洁卫生
保持居住环境的清洁卫生,勤洗手,避免细菌传 播。
为什么需要特别护理?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ADA缺乏症的基因治疗ADA缺乏症是SCID的主要病种,约占25%。
ADA缺乏症是人类基因治疗研究得较为成熟的一种常染色体隐性遗传性疾病。
由于ADA基因的克隆化早已完成,对其表达的调控认识得也比较清楚,ADA编码基因属于持家基因的范畴,因此人类历史上第一种以基因治疗的疾病就是:ADA缺乏症。
一、ADA缺乏症发病机制ADA有数种同功酶,在电泳上有二个带,分子量各带相异。
ADA广泛存在于各种组织与细胞中,在细胞中有三种同功酶,在组织中有四种同功酶。
除红细胞外,ADA在脾脏、皋丸、甲状腺、肺脏、肾脏次之;在心脏、肝脏、胃粘膜和肌肉中也存在。
其中以脾脏中的酶活性最高。
ADA在核酸代谢中具有重要作用。
它可催化腺苷变为次黄嘌呤核苷,后者再在嘌呤核苷磷酸化酶的作用下变为次黄嘌呤,又在黄嘌呤氧化酶作用下经黄嘌呤变为核酸代谢的最终产物一尿酸。
脾脏是重要的免疫器官,在人体免疫系统的发育中占有极为重要的地位。
当ADA缺乏时,细胞内腺苷及嘌呤核苷酸的水平增高,使乳清酸向乳清酸苷的转变被封闭,以致影响B淋巴细胞及免疫系统的发育,引起严重的体液、细胞免疫联合缺陷。
除此之外,ADA缺乏引起免疫缺陷的另一种可能的机制是存在一种抑制免疫的血清因子。
ADA基因异常时常可累及多种细胞,如红细胞等,但T、B淋巴细胞对腺苷及嘌呤核苷酸的敏感性远较其它种类的细胞敏感,因此这些核苷酸代谢产物的累积,对淋巴细胞的毒性和危害最大,因此导致T、B淋巴细胞的成熟过程及功能障碍,造成SCID的免疫病理状态。
二、ADA基因异常1983年人ADA的cDNA克隆化三家同时成功。
编码区有1089个核昔酸组成,编码的ADA 由363个氨基酸残基组成。
ADA基因组DNA的全长为3204个碱基对,由23个内含子和12个外显子序列组成。
ADA缺乏症是一种常染色体隐性遗传疾病,其基因的异常又分为纯合子型和杂合子型两种。
根据对多地区、多个ADA缺乏症ADA基因的序列的测定以及与正常人ADA序列的比较结果,目前认为ADA基因序列点突变至少发生在8个位点上。
如表19一l表示。
碱基部位1.外显子1区2.IVS3一3,接合区3.外显子4(297)4.外显子4(302)5.外显子4(301)6.外显子7(632)·7.外显子10(911)8.外显子11(986)ADA基因上述8个位点上的突变中,2种情况下导致无ADAmRNA的产生,另外6种情况下,有3种是造成精氨酸残基(Arg)突变的结果。
说明ADA基因中有关Arg之密码子的突变较为常见。
三、ADA基因转移的靶.细胞正常情况下,ADA可由多种不同的组织细胞类型来表达。
说明ADA的表达其组织细胞的特异性不强。
为ADA缺乏症基因治疗靶细胞的选择提供了较广的范围。
到目前为止,以各种基因转移方法将ADA基因导入的细胞种类至少有7种。
包括淋巴细胞、血管内皮细胞、皮肤成纤维细胞、肝细胞、血管垂滑肌细胞、骨髓造血干细胞、二倍体皮肤成纤维细胞等。
外周血淋巴细胞是ADA缺乏症影响和危害最大的细胞,来源较为丰富,取出和回输较为容易,体外在重组白细胞介素的作用下可进行一定时间的培养,对逆转录病毒载体等的感染具有一定的敏感性,因此,淋巴细胞是ADA缺乏症基因治疗的靶细胞较为常用的种类。
但淋巴细胞的寿命一般较短,一个月到数个月不等。
随着转导淋巴细胞的死亡,ADA的表达量势必逐渐下降,到一定程度,ADA的分泌量不足以发挥其治疗作用,同样的基因治疗操作程序必须熏新进行。
因此,人们同时也想到了寿命较长的靶细胞种类。
最为常用的就是骨髓造血干细胞,在小鼠等动物和人体上,以逆转录病毒载体转导都有成功的报导。
只是骨髓干细胞在骨髓整个细胞群中都是难以分离培养,因为占的比例太少,不足0.05%。
虽然如此,骨髓干细胞依然是人价梦寐以求的靶细胞种类,希望通过骨髓干细胞的转导和回输,达到持久的基因治疗效果,起码是可以减少重复基因治疗的次数。
除了外周血淋巴细胞、骨髓干细胞作为ADA缺乏症基因治疗的靶细胞以外,血管内皮细胞和血管平滑肌细胞也由于其来源丰富,且易于操作,近邻血流等特点经常被选为靶细胞。
其次肝细胞,皮肤成纤维细胞也是ADA缺乏症基因治疗中靶细胞种类潜在的候选者。
四、ADA基因转移方法ADA缺乏症的基因治疗,首先是如何将正常人的ADA基因导入到体外培养的或在体的靶细胞中去,这是人DA缺乏症基因治疗的关键所在。
过去的十几年中,尽管人们相继建立了基因转移的物理法、化学法、融合法等,在基因工程和蛋白质工程研究中发挥了重要作用,但终因其基因转移的效率太低,仅达1/1,000一1/100,00。
,在基因治疗有限的操作时间内,难以取得治疗意义上所需足够数量的转导细胞,不能满足基因治疗对基因转移效率的要求,这也是早期的基因治疗研究难以取得成功的一个重要原因。
1983年,逆转录病毒载体基因转移技术的出现和不断发展,可以说是在基因治疗的基因转移技术中发生了革命性的变化。
逆转录病毒载体一包装细胞系基因转移系统,由于重组逆转录病毒载体在包装细胞中的大量复制而得到放大,借助病毒颗粒上包膜蛋白及其靶细胞膜上该蛋白的受体介导重组逆转录病毒载体包装成的假病毒颗粒对靶细胞的高度感染力,重组逆转录病毒载体本身表达的整合酶(integrase)催化重组逆转录病毒载体DNA与靶细胞染色体DNA的高效整合,因此,逆转录病毒载体一包装细胞系基因转移系统具有无与伦比的高效率和稳定表达获得的高比率,成为基因治疗中占有最重要地位的基因转移方法。
ADA 缺乏症基因治疗的ADA基因转移也广泛采用了逆转录病毒载体基因转移途径。
据不完全统计,自1985年以来,应用各种类型的逆转录病毒载体一包装细胞系进行了ADA基因转移的研究。
其中最为常用的逆转录病毒载体是pNZ及其衍生系列。
构建一株逆转录病毒载体必须考虑如下这些因素:.1.病毒载体可以在其包装细胞中大量复制,以产生高滴度的病毒颗粒,以满足感染靶细胞的需要。
2.病毒载体可以指导外源基因,包括目的基因和标记基因在靶细胞中的表达。
3.病毒载体在靶细胞中以整合方式存在,以便进行长期、稳定、高效表达。
目前应用的逆转录病毒载体都是由MoLV前病毒形成的DNA构建而成。
经过包装细胞,一般都能产生10℃Fu/毫升的假病毒滴度,完全可以满足ADA基因转移的要求。
五、ADA缺乏症基因治疗实验研究ADA缺乏症基因治疗实验研究包括体外培养的离体细胞ADA基因的转移,低等动物,如小鼠等淋巴细胞.ADA基因转移、回输,以及较高等的动物,如猴的淋巴细胞ADA基因转移、回输。
所有这些实验,一方面证明了人ADA基因转移技术纠正ADA缺乏症的有效性,另一方面也证明了实验系统中所应用的逆转录病毒载体一包装细胞系,以及靶细胞的转导与回输这一整套程序是切实可行的。
而且也是安全无害的。
为把基因治疗推向临床应用,提供了可靠而宝贵的实验资料。
Culver及其合作者(1991)应用逆转录病毒载体LASN,包装细胞系PA317系统,将ADA基因及SV4。
病毒序列中的启动子序列一起导入小鼠及人的体外培养的淋巴细胞中,.结果证明人及小鼠的淋巴细胞都能获得外源性的ADA基因稳定整合和高效表达,持续数月之久。
人ADA基因转入肿瘤浸润的淋巴细胞,也获得了表达。
证明逆转录病毒载体导入ADA基因,可以纠正体外培养的淋巴细胞的ADA表达缺陷。
Ferrari等(1991)应用双表达逆转录病毒载体PDC,以及包装细胞系PA317基因转移系统,将人ADA基因导入体外培养的小鼠外周血淋巴细胞(PBL)中,获得转导的细胞再回输入ADA缺陷小鼠的血流中,可使此免疫缺陷小鼠的免疫系统得以重建,血中出现免疫球蛋白及抗原特异性T淋巴细胞.这一ADA缺馅动物模型体外培养的外周血淋巴细胞,以逆转录病毒载体一包装细胞系基因转移系统将ADA基因导入,再回输到血循环中,转导的PBL表达ADA以纠正ADA缺陷引起的免疫缺陷基因治疗经典途径,为人ADA缺乏症基因治疗提供了丰富的体内实验依据。
在体外培养的细胞以及小鼠体内ADA基因转移与表达的实验都获得了令人满意的结果以后,Kantoff等应用较高等的动物一猴进行同样的实验,也得到了令人鼓舞的结果,他们应用逆转录病毒载体PS^x及包装细胞系基因转移方法,将人ADA基因导入了猴的骨髓造血干细胞,然后回输到致死剂量放射照射的供体猴内,所实验的猴都能重建自己的造血系流,并且有一定水平人ADA的基因表达,且存活期都在9个月以上。
在整个实验过程中,未发现逆转录病毒血症,骨髓功能抑制,造血干细胞瘤,实体瘤及其它病理改变。
六、ADA缺乏症基因治疗人体实验早在1987年,美国国立卫生研究院(NIH)的三位科学家就着手人类基因治疗方案的制订和论证。
由于当时基因治疗所涉及的技术问题以及可能带来的社会伦理问题,而迟达。
没有得到批准。
1989年1月19旧,美国NIH,重组DNA咨询委员会(RAC),食物与药物管理局FDA)等五家医政单位经过十余次的正式评审和论证,终于批准了一个由R6senberg 领导小组的基因转移人体实验计划,即以逆转录病毒载体,将一个野生型的细菌抗性基因,以逆转录病毒载体LNL6和包装细胞系基因转移方法,导入体外培养的黑色素瘤(melanoma)肿瘤浸润的淋巴细胞(TIL)中,在G418这种新霉素类似物的筛选作用下,得到成功转导的细胞,以重组白细胞介素一2刺激作用下进行扩增,再进行体内回输,以多聚酶链反应(PCR)等敏感的检测技术对ncoR基因进行超微量检测,以跟踪转导的TIL回输以后游走路径、·分布以及其寿命。
这是人类历史上第一次以逆转录病毒载体基因转移系统导入一种人体内不存在的基因的人体实验,获得了全部预期的结果。
对受试黑色素瘤病人进行了非常严密的监测和观察,未发现由于逆转录病毒载体或野生型基因的导入引起的不良反应.在这样的背景下,NIH等单位又批准了1990年的ADA缺乏症基因治疗人体实验方案,至此,人类基因治疗的临床研究宣告正式开始。
所以选择ADA缺乏症作为人类基因治疗临床试验的第一个病种,除了ADA缺乏症病因明确,病机清楚,以及研究人鼻对之有较为深而广的认识以外,主要还取决于ADA缺乏症的以下几个特点。
1.以骨髓移植可以治疗ADA缺乏症。
2.如不进行人淋巴细胞抗原配型,这种病便不能以骨髓移植方法治愈。
3.ADA缺乏是一种常染色体隐性遗传性疾病,而且酶的缺陷只限于单一基因的异常。
4.人ADA基因1983年就得到克隆化,而且已实现与逆转录病毒载体的重组。
5.ADA基因的表达不需要进行精确调控,ADA基因的表达水平即使低于正常人水平,也足以治愈;而且高于正常水平的表达也不至于给患者带来危害。
6.遗传缺陷得到纠正的淋巴细胞,在体内可以形成选择性生长优势。
