第十八章 已改杂环化合物
杂环化合物

第十八章杂环化合物教学要求1.了解杂环化合物的分类、命名。
2.掌握重要的五元、六元及稠环杂环化合物的结构和性质。
如:呋喃、噻吩、吡咯、喹啉(斯克奥浦合成)。
3.了解嘧啶及嘌呤的结构。
4.了解生物碱的一般概念。
杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N、O、S等)的环状化合物。
杂环化合物不包括极易开环的含杂原子的环状化合物,例如:本章我们只讨论芳香族杂环化合物。
杂环化合物是一大类有机物,占已知有机物的三分之一。
杂环化合物在自然界分布很广、功用很多。
例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。
第一节杂环化合物的分类和命名一、分类二、命名杂环的命名常用音译法,是按外文名词音译成带“口”字旁的同音汉字。
当环上有取代基时,取代基的位次从杂原子算起依次用1,2,3,… (或α,β,γ…)编号。
如杂环上不止一个杂原子时,则从O、S、N顺序依次编号。
编号时杂原子的位次数字之和应最小。
第二节五元杂环化合物含一个杂原子的典型五元杂环化合物是呋喃、噻吩和吡咯。
含两个杂原子的有噻唑、咪唑和吡唑。
本节重点讨论呋喃、噻吩和吡咯,简单介绍一下噻唑、咪唑和吡唑。
一、呋喃、噻吩、吡咯杂环的结构呋喃、噻吩、吡咯在结构上具有共同点,即构成环的五个原子都为sp2杂化,故成环的五个原子处在同一平面,杂原子上的孤对电子参与共轭形成共轭体系,其π电子数符合休克尔规则(π电子数 = 4n+2),所以,它们都具有芳香性。
二、呋喃、噻吩、吡咯的性质1、存在与物理性质2、光谱性质3、化学性质(1)亲电取代反应从结构上分析,五元杂环为∏56共轭体系,电荷密度比苯大,如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的有效电荷分布为:五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比要苯快得多。
有机化学(第四版)第十八章 杂环化合物
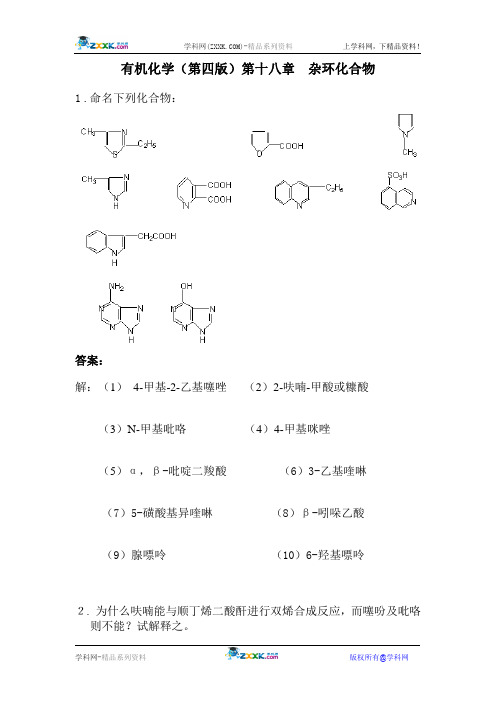
有机化学(第四版)第十八章杂环化合物1.命名下列化合物:答案:解:(1)4-甲基-2-乙基噻唑(2)2-呋喃-甲酸或糠酸(3)N-甲基吡咯(4)4-甲基咪唑(5)α,β-吡啶二羧酸(6)3-乙基喹啉(7)5-磺酸基异喹啉(8)β-吲哚乙酸(9)腺嘌呤(10)6-羟基嘌呤2.为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯则不能?试解释之。
答案:解:五元杂环的芳香性比较是:苯>噻吩>吡咯>呋喃。
由于杂原子的电负性不同,呋喃分子中氧原子的电负性(3,5)较大,π电子共扼减弱,而显现出共扼二烯的性质,易发生双烯合成反应,而噻吩和吡咯中由于硫和氮原子的电负性较小(分别为2.5和3),芳香性较强,是闭合共扼体系,难显现共扼二烯的性质,不能发生双烯合成反应。
3. 为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之。
答案:解:呋喃、噻吩和吡咯的环状结构,是闭合共扼体系,同时在杂原子的P轨道上有一对电子参加共扼,属富电子芳环,使整个环的π电子密度比苯大,因此,它们比苯容易进行亲电取代反应。
4. 吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式。
答案:解:5. 比较吡咯与吡啶两种杂环。
从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。
答案:解:吡咯与吡啶性质有所不同,与环上电荷密度差异有关。
它们与苯的相对密度比较如下:吡咯和吡啶的性质比较:6. 写出斯克劳普合成喹啉的反应。
如要合成6-甲氧基喹啉,需用哪些原料?答案:解:Skramp法合成喹啉的反应:7. 写出下列反应的主要产物:答案:.解:8. 解决下列问题:(1)区别吡啶和喹啉;(2)除去混在苯中的少量噻吩;(3)除去混在甲苯中的少量吡啶;(4)除去混在吡啶中的六氢吡啶。
答案:解;(1)吡啶溶于水,喹啉不溶。
(2)噻吩溶于浓H2SO4,苯不溶。
(3)水溶解吡啶,甲苯不溶。
(4)苯磺酰氯与六氢吡啶生成酰胺,蒸出吡啶。
18.杂环化合物解析
nC5H10O5
HCl / 脱水
HO HO CHO
O
CHO
戊糖
性质及用途: 无α-H的醛,不饱和的呋喃杂环,重要的工业原料。
a、催化加氢
O + H2 CHO
CuO , Cr2O3 150℃ 10 MPa
O
CH2OH
b、歧化反应
+ NaOH CHO + O
O
O
CH2 OH
COONa
c、安息香缩合
KCN
非芳香杂环:具有脂肪族类化合物相似性质。
杂环
O
N H
芳香杂环:环为平面型,电子数符合4n+2规则, 有一定程度芳香性的较稳定的杂环。
O
S
N H
N
命名:
β` 4 α` 5 3 β
O
1
2 α
S
N H
N
N
呋喃
噻吩
吡咯
N
吡啶
喹啉
N
N H
CH3
S
CH3O
O
吲哚
5-甲基噻唑
6-甲氧基苯并噁唑
编号 从杂原子编起(母体的编号是固定的); 若有不同杂原子时,从O、S、N顺序编号; 杂原子的位次遵循最低系列原则 例:
2-乙酰基噻吩
+ (CH3CO)2O O
BF 3
O O C CH3
+ (CH3 CO)2O N H
150~200℃
O N H C CH3
因呋喃、吡咯、噻吩很活泼,傅氏烷基化往往得到多烷基取代 混合物,甚至产生树脂状物质,因此用处不大。
e、吡咯的特殊反应 类似于苯胺、苯酚,可与重氮盐偶联,呋喃、 噻吩无此反应。
第十八章 杂环化合物

N H
(CH3CO)2O,-10℃
N H
NO2
噻吩对酸不那么敏感,可以用混酸硝化。
NO2
HNO3,H2SO4
S
S
+
S
NO2
呋喃比较特殊,先生成稳定的或不稳定的2,5-加成产物, 然后加热或用吡啶除去乙酸,得到硝化产物。
CH3COONO2 CH3COO-
O
-30~-5℃
O +
H NO2
了解生物碱;了解毒品的种类与危害。
呋喃、吡咯、噻吩的结构和性质; 吡啶、喹啉的结构和性质。
杂环化合物:环状化合物中构成环的原子除碳原子外,
还有其他原子的化合物。 常见的杂原子是O、N、S。 非芳香杂环:
O
芳香杂环:
O
O
S
习惯上把具有芳香结构的杂环,作为杂环化合物的母核, 而把各种氢化的杂环,看作杂环化合物的衍生物。
杂环化合物的内容非常丰富,无论在理论研究或实际应
用方面都很重要,本章只限于几类常见的杂环化合物。
1 杂环化合物的分类
按照环的多少可以分为单杂环和稠杂环两大类。 单杂环:常见的是五元杂环和六元杂环,环上的杂原子 有一个或两个。 五元杂环:
N
O
呋喃 furan
N N H
S
噻吩 thiophene
H2SO4
S
25℃
S
SO3H
常用这个反应除去苯中的噻吩,苯和噻吩的沸点接近, 不能用蒸馏的方法分离。
酰化:呋喃、噻吩的酰化反应在α-C上发生,呋喃要用较 温和的催化剂SnCl4、BF3等。
(CH3CO)2O BF3,-10℃
O
O
COCH3
噻吩的酰化反应可以用酸催化。
第十八章杂环化合物

5 6
4
3 CH3
7 8
H3C
N2
1
N HO
3,8-二甲基喹啉 8-羟基喹啉
如果环内含有不止一种杂原子时,编号的 先后顺序是 O、S、N、C。4-甲基-5-(-羟乙基)噻唑
第二节 五元杂环化合物
代表化合物:呋喃、噻吩、吡咯。
呋喃(furan) 吡咯(pyrrol)
苯噻吩吡咯呋喃
亲电取代反应(α-位取代): 硝化、磺化、卤化、F-C酰基化、F-C烷基化 活性次序:吡咯>呋喃>噻吩>苯
(1)溴代反应:
(2)硝化反应
(3)磺化反应
噻吩因很容易磺化而溶于 H2SO4,比苯 容易磺化,利用这一性质可以除去苯或 汽油中的噻吩.
(4)酰化反应
2、加成反应
3 吡咯的弱碱性和弱酸性(酸性较醇强较 酚弱)
吡啶能发生亲核取代反应,且主要发 生在 2-位。
+ NaNH2 N
N(CH3)2
NH2 N
2-氨基吡啶
4. 吡啶对氧化剂的稳定性 酸性氧化剂中比苯环稳定:
过氧化物氧化:
5. 还原反应 吡啶环对还原剂比苯环活泼:
嘧啶及其衍生物
嘧啶
有三种嘧啶的衍生物存在于核酸的碱基中, 它们是胞嘧啶、胸腺嘧啶、脲嘧啶
光谱数据
呋喃:δ:α-H 7.42 吡咯:δ:α-H 6.68 噻吩:δ:α-H 7.68 偶极矩:呋喃0.70D
噻吩0.51D 吡咯1.81D
β-H 6.37 β-H 6.22 β-H 7.10
三、五元杂环化合物的化学性质
能发生 SE 反应,且反应主要发生在-位。 其反应活性顺序:
吡咯呋喃噻吩苯 化合物的稳定性顺序:
噻吩(thiophene)
有机化学 第18章 杂环化合物

有机化学Organic Chemistry 第18章杂环化合物(3’)教材:李景宁主编高等教育出版社原则上,环状机化合物中,构成环的原子,除了碳原子外,还有其他原子的,都称为杂环化合物。
2. 杂环化合物的英文?杂环化合物,heterocyclic compound。
[hetərə'saɪklɪk]By the end of eighteen century,experimenters had well established that each pure substance had its own characteristic set of properties such as density, specific heat,melting point,and boiling point. Organic chemistry is a sub-discipline within chemistry involving the scientific study of the structure,properties,composition,reactions,and preparation(by synthesis or by other means)of carbon-based compounds,hydrocarbons,and their derivatives.一、分类ON S五元 杂环第一节杂环化合物的分类和命名H 六 元 杂环NN N 单杂环稠 杂环NN H1. 母体名称呋喃吡咯噻吩咪唑噻唑82. 编号•从杂原子编起(母体的编号是固定的);•若有不同杂原子时,从O 、S 、N 顺序编号;•杂原子的位次遵循最低系列原则•例:3-1-酸类化合物以酸为母体,杂环为取代基。
N CH3甲基吡咯(β-甲基吡咯)甲基吡咯(N -甲基吡咯)α-呋喃甲酸(2-呋喃甲酸)α-噻吩磺酸N第二节五元杂环化合物OSHfuran pyrrole thiophene 呋喃吡咯噻吩一、呋喃、噻吩、吡咯杂环的结构π电子数满足4n +2,分子是闭合的共轭体系,NMR 谱图δ值为7左右,具有芳香性。
曾昭琼《有机化学》(第4版)章节题库(杂环化合物)【圣才出品】

(2)
(3)
10 / 26
圣才电子书
十万种考研考证电子书、题库视频学习平 台
(4)
8.完成下列反应,写出主要有机产物。
11 / 26
圣才电子书
十万种考研考证电子书、题库视频学习平 台
答:
12 / 26
圣才电子书
5.为什么五元杂环的芳香性顺序是噻吩>吡咯>呋喃? 答:这三个化合物环上的杂原子电负性顺序为 O>N>S,与其相应的呋喃、吡咯、噻 吩分子中,O、N、S 的未共用电子对向芳环的给电子能力正好相反,S 最强,O 最差,因
8 / 26
圣才电子书
十万种考研考证电子书、题库视频学习平
9 / 26
圣才电子书
十万种考研考证电子书、题库视频学习平 台
7.分离和鉴别: (1)试用化学方法区别 2-氯丙酸和丙酰氯。 (2)试用化学方法区别丙酸乙酯和丙酰胺。 (3)用简单的化学方法分离丁醚和 2-庚酮。 (4)试用化学方法分离喹啉和 8-羟基喹啉。 答:(1)
8.不能用于从水相中萃取呋喃甲醇的试剂是( )。 A.乙醚 B.乙酸乙酯 C.乙醇 D.二氯甲烷 【答案】C
9.下列化合物中酸性最大的是( )。
3 / 26
圣才电子书
【答案】D
十万种考研考证电子书、题库视频学习平 台
二、填空题
1.将下列化合物按亲电取代反应活性高低排列成序:
6 / 26
圣才电子书
十万种考研考证电子书、题库视频学习平
台
4.(1)呋喃甲醛在浓 NaOH 作用下能发生歧化反应生成呋喃甲醇和呋喃甲酸,呋喃
甲醛在使用前需要减压蒸馏进行钝化,请画出减压蒸馏装置图。简述反应结束后,将采取
第十四章 杂环化合物(已修改)

7,没有固定名称的稠杂环命名(自学) ,没有固定名称的稠杂环命名(自学)
21
第二节 五元杂环化合物
Pentheterocycles
22
一,呋喃,噻吩,吡咯 呋喃,噻吩, ) (Furan, Thiophene and pyrrole)
(一) 结构
电子离域的结果使环上 各C原子的电子云密度增大 原子的电子云密度增大 ),这类杂环称 (6/5),这类杂环称"多π" ),这类杂环称" 芳杂环. 芳杂环.它们的亲电取代 比苯容易. 比苯容易.
H N 1H-吡咯 N 2H-吡咯 O O
2H-吡喃
4H-吡喃
15
4,若杂环不含有最多数目的非聚集双键, ,若杂环不含有最多数目的非聚集双键, 这样的饱和H称为"外加氢" 命名时, 这样的饱和 称为"外加氢".命名时, 称为 需标明外加氢的位置和数目, 需标明外加氢的位置和数目,全饱和的 可省略位置, 可省略位置,例:
5
本章着重讨论的杂环化合物, 本章着重讨论的杂环化合物,其环系较稳定并 具有一定程度的芳香性, 具有一定程度的芳香性,把它们统称为芳(香)杂环 其它不具有芳香性的杂环化合物, 化合物.其它不具有芳香性的杂环化合物,统称非 芳香杂环化合物(或称杂脂环化合物) 芳香杂环化合物(或称杂脂环化合物).
芳香性:平面环, 个电子, ※ 芳香性:平面环,4n+2个电子,难氧化 个电子 而易取代. 而易取代.
4
O
O
O
N H
O
杂环化合物种类繁多,数量庞大, 杂环化合物种类繁多,数量庞大,在自然界分 布极为广泛,大多数的生物碱为杂环化合物, 布极为广泛,大多数的生物碱为杂环化合物,植 物中的叶绿素,动物中的血红蛋白等,中心结构 物中的叶绿素,动物中的血红蛋白等, 都为杂环, 都为杂环,作为生命基础物质的核酸基本组成单 碱基也为杂环碱. 位—碱基也为杂环碱.在现代药物中,杂环化合 碱基也为杂环碱 在现代药物中, 物占了相当大的比重, 物占了相当大的比重,现在已成为一门独立的学 杂环有机化学. 科—杂环有机化学. 杂环有机化学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十八章杂环化合物
1、命名下列化合物:
解:(1) 4-甲基-2-乙基噻唑(2) 糠酸(α-呋喃甲酸)
(3) N-甲基吡咯(4) 4-甲基咪唑(5) α,β-吡啶二甲酸(2,3-吡啶二甲酸)(6)β-乙基喹啉(3-乙基喹啉)(7) 5-异喹啉磺酸(8) β-吲哚乙(3-吲哚乙酸)(9) 6-氨基嘌呤(10) 6-羟基嘌呤
2、为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯则不能?试解释之。
解:在呋喃、吡啶和噻吩中,杂原子分别是O、N和S。
电负性是O>N>>S ,提供电子对构成具有芳香性的芳环的能力与此电负性的关系相反。
因此芳香性:呋喃>吡啶>噻吩。
另一方面,反应出来的共轭二烯性:呋喃>吡啶>噻吩。
因此,呋喃易与顺—丁烯二酸酐发生环加成反应而吡啶、噻吩则需反应性更强的双烯体,如苯炔、丁炔二酸脂等。
3、为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之。
解:在呋喃、噻吩和吡咯中,具有五原子环六个π电子芳香共轭体系,符合[4n+2]休克尔规则,都具有芳香性。
因此芳香性大小是:呋喃>吡啶>噻吩。
这些芳环又是富电子的芳香共轭体系,易发生亲电取代。
4、吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式。
N
H C6H5N2 X
N
N N C6H5
2—吡咯偶氮苯
5、比较吡咯与吡啶两种杂环。
从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论。
解: 吡咯和吡啶分子中的氮原子都是sp2杂化的。
在吡啶中,有一对未共用电子对处在未参与共轭的sp2杂化轨道上,因此吡啶的碱性很强;另外吡啶氮上的未共用电子对能与水分子形成氢键,吡啶易溶于水,吡咯不具备与水形成氢键的结构特征,因此难溶于水。
在吡咯中,氮原子提供一对未参与杂化的p轨道上电子参与芳香体系的形成,因此其碱性很弱;氮原子上的氢电离后形成的负离子未破坏其芳香性,因此,吡啶的性质类似于硝基苯;为一缺电子芳香性分子,对氧化剂较不稳定,亲电取代反应活性也较高。
吡啶和强酸作用可生成盐,不破坏其芳香性;吡咯和酸作用时,氮原子提供一对p轨道上的电子和酸结合,破坏了其芳香性,生成聚合产物。
6、写出斯克劳普合成喹啉的反应。
如要合成6-甲氧基喹啉,需用哪些原料?
解:
HC OH CH2OH CH2OH 24CH
CH2
NO
2
CHO
N H
CH 2
CH 2CHO N H
CH 2
CH 2CHOH 烯醇化
2关环
NH
硝基苯
N
合成6-甲氧基喹啉所需的原料:
NH 2
H 3CO
;
CH
CH 2OH
2OH
OH
;
NO 2
CH 3
O
7、 写出下列反应的主要产物:
O (CH 3CO)2O
BF
3
O
C CH
3
CH 3COOH
(1)
S
H 2SO 4。
C
S
SO 3
H
(2)
(3)
O
Br 2
25。
C
O
Br
N
H
CH 3
MgI
N
H
CH 4
(4)
(5)
S
C C
O O
O AlCl 3
S
S O
HOOC
(6)
O
CHO
Cl 2
O
CHO
Cl
浓NaOH O
Cl
CH 2OH
O
Cl
COONa
8、 解决下列问题:
(1) 区别吡啶和喹啉;
(2) 除去混在苯中的少量噻吩;
(3) 除去混在甲苯中的少量吡啶;
(4) 除去混在吡啶中的六氢吡啶。
解:(1)吡啶溶于水,喹啉在水中的溶解度很小(这是由于多了一个疏水性苯基的结果。
)
(2)向混合物中加入浓硫酸,振摇,使生成的2-噻吩磺酸溶于下层的硫酸中得以分离。
(3)向混合物中加入水,振摇,吡啶溶于下层的水中得以分离。
(4)苯磺酰氯与六氢吡啶生成酰胺,蒸出吡啶。
或根据六氢吡啶的碱性比吡啶的碱性强得多,将混合物先溶于乙醚等有机溶剂,再向溶液中加入适量的酸,将六氢吡啶和酸生成的盐沉淀出来。
9、合成下列化合物:
(1) 由N CH3
合成N
O
(2) 由苯胺、吡啶为原料合成磺胺吡啶H2N S N
H
O
O N
(3) 由合成(1)
N CH3
H
4
N
AlCl3
N
O
该题不能将两边反过来设计,因为吡啶环不能发生傅-克反应。
(2)
NH 2
(CH 3CO)2O
NHCOCH 3
HOSO Cl 。
C
NHCOCH 3
S O
O N
NH 2
H 2N
S N H
O
O
N
(2)OH
O
S O
N H
N
H 3COCHN
(3)
CH
3
HNO 3N 2SO 4
CH 3
2
COOH
2Fe ,HCl
COOH
2
CH
OH
CH 2OH CH 2OH 浓H 2SO 4
N H
HOOC
N
HOOC
混酸
N
HOOC 2
10、 杂环化合物C 5H 4O 2经氧化后生成羧酸C 5H 4O 3,把此羧酸的钠盐与碱石灰作用,转变为C 4H 4O ,后者与钠不起反应,也不具有醛和酮的性质,原来的C 5H 4O 2是什么? 解:C 5H 4O 2 [O]
C 5H 4O 3
O
CHO [O]
O
COOH
O
COONa CaO,NaOH
O
11、 用浓硫酸将喹啉在220~230°C 时磺化,得喹啉磺酸(A ),把(A )与碱共熔,得喹啉的羟基衍生物(B )。
(B )与应用斯克劳普法从邻氨基苯酚制得的喹啉衍生物完全相同,(A )和(B )是什么?磺化时苯环活泼还是吡啶环活泼? 解:
喹啉磺酸(A )
N 3H
NaOH(s)
N (B)
NH 2
24
CH
CH 2OH
CH 2OH
N (B)
磺化时苯环比吡啶环更活泼。
12、 α、β-吡啶二甲酸脱羧生成β-吡啶甲酸(烟酸):
解:脱羧时涉及到碳—碳键异裂,吡啶环具有负电荷。
碳—碳键异裂时,负电荷处在α-位能被电负性大的氮原子所分散,负电荷处在β-位则不能被有效的分散。
因此脱羧在α-位。
(缺少一个图)
13、毒品有哪几类,它的危害是什么? 解:略,请参见教材229-232页。
