医院新药引进申请表
引进新药申请表

3、申请科室对申请量引起积压、过期失效负责。
XX市XX区人民医院引进新药申请表
商品名称
通用名称
规格
主要成分
药理分类
批Hale Waihona Puke 文号医保分类生产厂家
零售价
经销公司
申请理由(与同类比较的优点):
申请科室:医师:主任:日期:
现有同类品种
品名
规格
可否取缔
药剂科初步意见:
医务科初步意见:
药事委员会或分管院长意见:
院长意见:
说明:
1、新药是指我院未使用过的药品。已在用的品种,凡改变剂型的,亦属新药管理范围。
北京朝阳医院新药引进申请单

北京朝阳医院新药引进申请单
申请科室:联系电话:新药申请编号:□□□□□□□□□Part I拟引进新药基本信息(以下由临床科室填写)
药品通用名:规格及最小包装:
药品适应症:用法用量:
药品引进申请(包括但不限于:该药是否在治疗指南中被推荐使用?)
科室主任确认签名/日期:申请人确认签名/日期:
Part II拟引进新药补充信息(以下由药事部填写)
药品批准文号:商品名:药品性质:
□原研□仿制生产企业:联系人/电话:参考零售价:
北京市医保类别:
□甲类□乙类□自费是否中标产品:
□是□否
是否基本药物:
□是□否
□本院无同一通用名药品(本类新药需经过试用评价)
在用同类药品信息□本院有同一通用名,但规格、剂型、或生产厂家有所不同名称:规格及最小包装:
生产厂家:零售价:医保类别:
药事部形式审核意见:
药事部主任:年月日
新药评审专家组技术审核意见:(包括但不限于:该药是否在治疗指南中被推荐使用?对专科疾病治疗在疗效、价格、药物经济学等方面的价值,特别是与本院在用同类品种相比较的优势;能否替代在用的同类品种?)
新药评审专家组代表签名(至少需三人以上):
年月日
药事管理与药物治疗学委员会意见:
参会委员:共()名
评审结果:共收回选票()份,通过()票,不通过()票。
评审决议:□通过□不通过
药事管理与药物治疗学委员会(签章):
年月日
药事管理与药物治疗学委员会复审意见:(试用新药需填写此项)
复审结果:共收回选票()份,通过()票,不通过()票。
复审决议:□通过□不通过
药事管理与药物治疗学委员会(签章):
年月日。
渭南市中心医院新药申请表

渭南市中心医院新药申请表申请科室:受理时间:受理编号:
新药申请填表说明
1、新药系指经SFDA批准正式生产、试生产或正式进口但在我院尚未列入基本药品供应目录的药品。
新药申请应为临床医疗必需、适用于大多数患者、在医疗保险报销范围内的药品。
2、新药申请人可到医院网站下载或药剂科领取《渭南市中心医院新药申请表》,按要求填写,申请人应真实完整填写表格,请附药品说明书及彩页一份交药剂科分管副主任。
3、新药申请手续为:(1)由相关临床科室主任填写“新药申请单”;(2)新药申请单交药剂科进行药学审批;(3)医院药事管理与药物治疗学委员会(简称委员会)以无记名投票的方式审评;(4)委员会主任(主管院长)签字批准。
4、凡属招标范围的品种必须为中标药品,凡在最近一次招标中未中标的新药,则自动淘汰不予评审;
5、我院已有两个同化学名的相同剂型的药品不再接受申请,除非价格剂型等优势或本院使用药品脱标,并要提出淘汰的药品;
6、临床科室仅限申请本专科用药,跨科用药须经两个以上主要应用科室联合申请,跨科用药的药物替代也须经两个以上主要应用科室同意。
7、药剂科承担药品质量、价格等综合评价工作,并将结果提供委员会讨论。
8、新药经委员会审批通过后,按程序审批采购,采购员将按照工作流程通知有关部门,此过程不需要医药代表介入和督促。
9、凡我院基本药品供应目录中的药品,如果临床3个月不曾使用,则该药品自动进入委员会删除药品目录。
10、申请人务必认真填写,如表格填写不全、不规范或缺少材料,委员会将不予评审。
11、临床因抢救或上级医院会诊需要临时购药,可由临床科室主任填写《渭南市中
心医院一次性特殊用药申请表》,审批后由药剂科负责采购。
医学院新药申请表

医学院新药申请表申请人信息
- 申请人姓名:[姓名]
- 申请人职称:[职称]
- 申请人联系方式:[电话号码 / 邮箱地址]
新药信息
- 新药名称:[药物名称]
- 新药分类:[药物分类]
- 新药适应症:[适应症]
- 新药研发背景:[研发背景]
- 新药创新点:[创新点]
临床实验计划
- 临床实验目的:[实验目的]
- 临床实验范围:[实验范围]
- 临床实验设计:[实验设计]
- 临床实验时间计划:[时间计划]
安全性评价及监测
- 安全性评价方法:[评价方法] - 安全性监测计划:[监测计划] - 安全性评估指标:[评估指标]
申请材料
- 药物化学数据:[数据内容]
- 药理学数据:[数据内容]
- 毒理学数据:[数据内容]
- 临床试验方案:[方案内容]
知识产权
- 发明专利:[专利信息]
- 临床试验申请专利:[专利信息]
- 药物注册专利:[专利信息]
预计成果
- 预计市场价值:[市场价值]
- 预计营销策略:[营销策略]
- 预计利润回报:[利润回报]
以上为医学院新药申请表的内容,请申请人填写相应信息并提交申请。
XXX医院新药引进申请表

XXXX医院新药引进申请表医院新药、特药药学评估评估日期:年月日医院新药、特药审批一、药剂科主任意见二、药事管理委员会意见三、院长或主管副院长意见医院新药、特药临床使用观察医院新药、特药临床使用期药学评估药品名称:规格:单价:生产厂家:供货单位:1.疗效及安全性评估2.制剂稳定性评估3.评价人:评价日期:年月日医院特殊药品引进申请表医院药品安全性再评价药品名称:规格:生产厂家:供货单位:一、ADR核实及临床调查(预警编号:)二、安全性再评价与处理意见:评价日期:年月日医院新药、特药形式筛查1.合法经营:□营业执照□许可证□委托书□身份证□GMP(GSP)证2.报备文件合法:□新药证书□生产批件□批准文号□注册商标批件□包装□标签说明书□价格批准文件(□企业□国家零售价:实价:扣率%:)3.质量文件齐全:□《药品质量保证书》、□法定质量标准、□法定检验报告4.是否有失效的证书、批件等文件:□有□无;与年月日补其。
5.品种费别等:□自费、□甲类、□乙类、□()线抗菌药物、□招标品种6.查HIS系统同类品种名称与规格:结论:□符合要求□资料不齐全□不能提供有效资料签名:年月日优选品种:①医保品种;②质优价廉;③仿制药质量标准有提高;④优选国家批准的新药,“增加规格的品种”次选;⑤与医院有长期合作且未发生过任何不良事件的。
严控品种:①质量标准有缺项的。
②药名、外观与医院的同类品种极其相似,易混淆的;③辅助药品、同类品种多的。
④严格管理的二~三线抗菌药物。
不采用品种:①曾发生过严重质量事件的厂商生产的品种;②疗效不确切,作用机理不清楚的;③国家通报有严重不良反应;④外国禁用的;⑤厂家或供应商在我院有不良记录。
结论:□是优选品种第项;□是严控品种第项;□是不采用品种第项签名:年月日。
医院新药申请表格
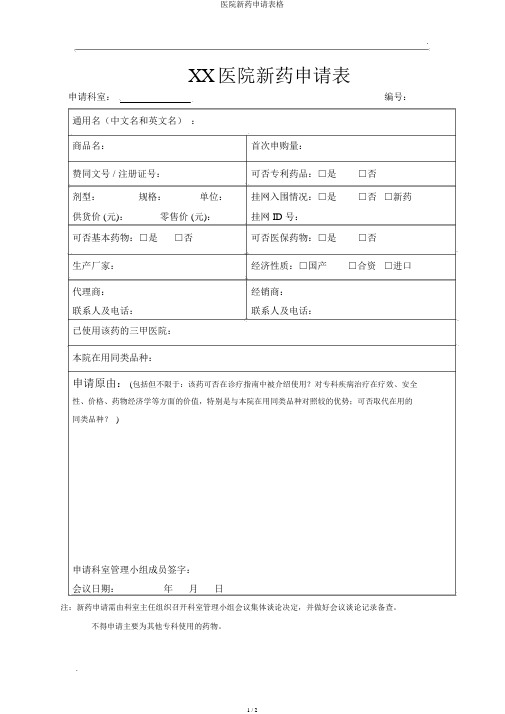
.XX医院新药申请表申请科室:编号:通用名(中文名和英文名):商品名:首次申购量:赞同文号 / 注册证号:可否专利药品:□是□否剂型:规格:单位:挂网入围情况:□是□否□新药供货价 (元):零售价 (元):挂网 ID 号:可否基本药物:□是□否可否医保药物:□是□否生产厂家:经济性质:□国产□合资□进口代理商:经销商:联系人及电话:联系人及电话:已使用该药的三甲医院:本院在用同类品种:申请原由: (包括但不限于:该药可否在诊疗指南中被介绍使用?对专科疾病治疗在疗效、安全性、价格、药物经济学等方面的价值,特别是与本院在用同类品种对照较的优势;可否取代在用的同类品种? )申请科室管理小组成员签字:会议日期:年月日注:新药申请需由科室主任组织召开科室管理小组会议集体谈论决定,并做好会议谈论记录备查。
不得申请主要为其他专科使用的药物。
.新药申请所需资料(一)必备资料:1、临床科室填写《新药申请表》,并供应本医疗机构中与申请新药治疗适应症相同的近似药品的品种情况、疗效差别、安全性、价格等信息,及新药的主要特点、临床凭据、治疗方案和申请进入医疗机构使用的原由等。
附科室谈论小组的集体签字及廉洁承诺书。
2、药学部门的新药评估报告。
附有同类药品比较,以简表的形式将所申请的药品与同类药( 包括治疗相同适应证的药物), 特别是与所申请进入的医疗机构已有的品种进行有效性、安全性、牢固性、可流通性及经济性等方面的比较。
所引用的数据需注明文件出处。
如无同类药品请注明。
( 二) 其他资料:1、新药生产及经营企业的“一证一照”及GMP、GSP证书。
2、新药证书及生产批件(或进口药品注册证)、注册商标证书。
新药使用说明书及其电子文档。
3、国家发改委或 XX省物价局有效价格批文,或企业自主定价的资料。
4、原研药品证明文件、专利药品证明文件。
5、XX省药品挂网采买中标入围的有关信息。
6、进入医保目录的证明文件。
7、质量标准及省市以上药检所出具的药品检验报告书。
新型疗法引进申请表(2023版)

新型疗法引进申请表(2023版)
一、申请人基本信息
1. 申请人姓名:
2. 申请人单位:
3. 申请人职务:
4. 联系
5. 电子邮箱:
6. 申请日期:
二、疗法信息
1. 疗法名称:
2. 疗法分类:
3. 疗法适应症:
4. 疗法机制:
5. 疗法研发进展情况:
- 研发起始日期:
- 目前进展情况:
- 预计研发完成日期:
6. 疗法相关专利情况:
- 专利名称:
- 专利号:
- 专利申请日期:
- 专利授权日期:
7. 疗法与现有治疗方式的比较:
三、疗法临床研究情况
1. 临床研究起始日期:
2. 临床研究地点:
3. 研究对象数量:
4. 研究设计:
5. 临床试验结果概述:
四、疗法安全性与有效性
1. 动物实验结果:
2. 人体临床试验结果:
3. 患者用药反应情况:
4. 疗法的安全性评估:
5. 疗法的有效性评估:
五、推广和应用计划
1. 疗法推广计划:
2. 疗法应用范围:
3. 预计上市日期:
4. 疗法成功案例:
- 案例描述:
- 成功指标:
- 案例来源:
六、附件清单
(请列明所附相关资料清单)
以上是新型疗法引进申请表(2023版)的主要内容,请详细填写相关信息并提交申请。
如有疑问,请联系申请人基本信息中的联系方式。
申请评审结果将及时通知申请人。
医院新药引进申请表

注:该药品在被多个指南/文献推荐时,以最新版本或最高级别的为主。
药事小组根据本专业诊疗需要,在所在党支部监督下,集体研究形成本科室药品引进申请意见。
医院新药引进申请表
申请日期:
申请科室:
编号:
通用名
剂型
规格
医保类别(打√)
医保报销备注
基药
(打√)
备注
甲
乙
丙
是
否
现目录情况
( )有同品种同规格____________ ( )有同品种不同规格_____________
( )有同类品种_______________________ ( )无同类品种
适应症
用法用量
注意事项
不良反应
申请理由
备案
资料
( )教科书推荐 教科书名称、版本及页码_____________________________________________
( )指南推荐 指南名称、版本及推荐级别
( )文献推荐 文献名称、年份______________________________________________________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年月日
主管副院长签字:
年月日
院长签字:
年月日
药事管理与药物治疗学委员会通过记录:
ห้องสมุดไป่ตู้年月日
******医院新药申请表
申请科室:药械科编号:
通用名:
商品名:
是否中标:□是□否网下采购
中标号:
剂型:规格:中位价(元):采购限价(元):拟采购价(元):
是否基本药物:□是□否
是否医保药物:□是□否
类型:□甲□乙□丙
医保药品代码:
生产厂家:
是否两票制:□是□否
本院在用同类品种
同类药品名称
规格
单价(元)
药品对比优点
申请理由:(包括但不限于:该药是否在治疗指南中被推荐使用?对专科疾病治疗在疗效、价格、药物经济学等方面的价值,特别是与本院在用同类品种相比较的优势;能否替代在用的同类品种等。)
申请科室主任签名:年月日
承诺:我保证,本申请表内容真实,由本人填写,我与申请产品的生产、经销企业无利益关系,我同意遵守医院廉政工作要求。
